摘要分享——巨噬細胞極化近期文獻
巨噬細胞是一種極具異質性和可塑性的細胞,不僅在生理條件下具有重要作用,而且在炎癥過程中也具有重要作用(包括引發炎癥和消除炎癥)。20 世紀 90 年代初,人們描述了巨噬細胞的兩種不同表型:一種稱為經典活化(或炎癥)巨噬細胞(M1),另一種稱為替代活化(或傷口愈合)巨噬細胞(M2)。目前已知,將巨噬細胞功能極化為兩類是對巨噬細胞異質性和可塑性的過度簡化描述;事實上,有必要考慮功能狀態的連續性。總之,現有數據表明,巨噬細胞極化是一個多因素過程,其中可能涉及大量因素,從而產生不同的活化情況。一旦巨噬細胞采用了一種表型,它仍有能力繼續變化以應對新的環境影響。極化的可逆性具有重要的治療價值,尤其是在M1/M2失衡起致病作用的疾病中。
最新相關文章摘要:
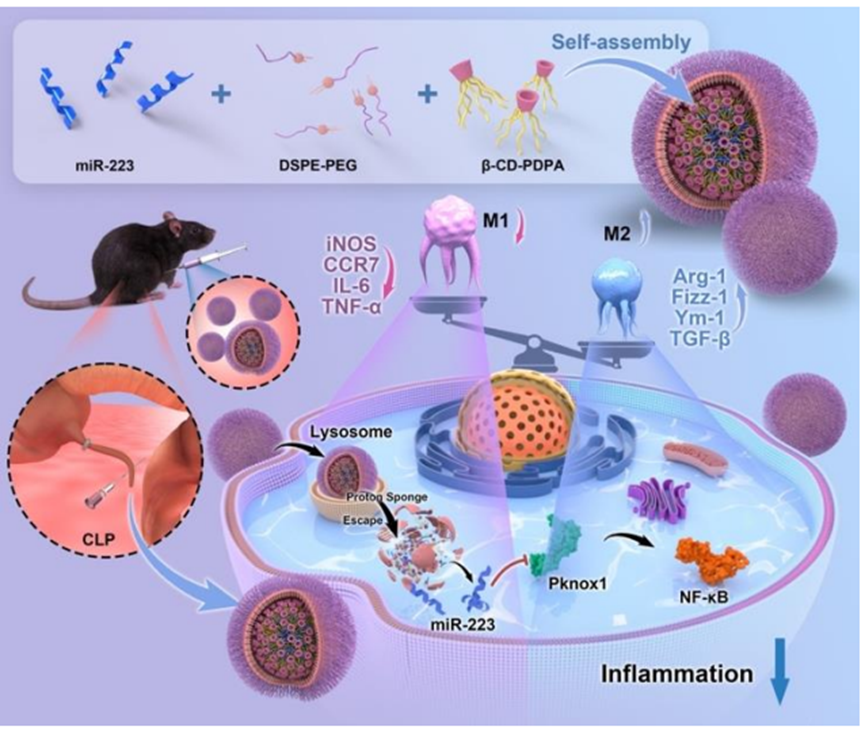
1. 一種基于環糊精的pH響應型micro RNA遞送平臺,以M1 到M2巨噬細胞極化為目標,用于敗血癥治療

盡管抗感染治療和輸液復蘇等對癥和支持療法在診斷和治療敗血癥方面有所改進,但敗血癥的死亡率仍然很高。基于核酸的藥物具有治療潛力,但其穩定性差和輸送效率低阻礙了其廣泛應用。本研究證實,miR-223能將促炎的 M1 巨噬細胞極化為抗炎的 M2 巨噬細胞。研究人員合成并開發了一種 pH 值敏感的納米給藥系統,該系統由 β-環糊精-聚(2-(二異丙基氨基)乙基甲基丙烯酸酯)/二硬脂酰磷脂酰乙醇胺-聚乙二醇(β-CD-PDPA/DSPE-PEG)組成,可靶向 M1 巨噬細胞,并將 miR-223 包封到納米顆粒(NPs)中用于敗血癥治療。NPs/miR-223 具有良好的生物安全性、穩定性和高輸送效率,體外 pH 值響應性良好。體內研究表明,NPs/miR-223 能優先在炎癥部位積聚和保留,從而減輕炎癥,提高敗血癥小鼠的存活率,同時表現出理想的生物安全性。在機制上,NPs/miR-223 通過靶向 Pknox1 和抑制 NF-κB 信號通路的激活來調節巨噬細胞的極化,從而達到抗炎效果。綜上所述,本文所述的 miRNA 遞送載體為敗血癥治療提供了一種新方法,并加速了核酸藥物的發展。
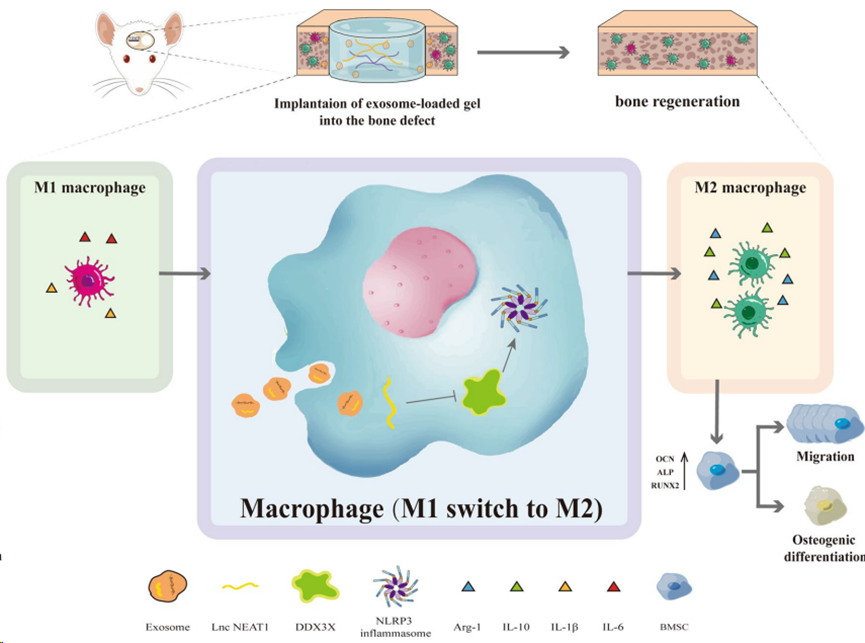
2. 內皮細胞外泌體Lnc NEAT1 通過DDX3X/NLRP3軸調節巨噬細胞極化,促進骨再生

背景:骨再生是一個復雜的過程,涉及骨生成和炎癥之間的相互作用。微環境中的巨噬細胞在骨代謝中起著重要作用。大量證據表明,外泌體傳遞的 lncRNA 是各種生物過程,尤其是骨生成過程中細胞相互作用的關鍵納米載體。然而,外泌體與巨噬細胞之間調控關系的內在機制尚待澄清。本研究旨在探討人臍靜脈內皮細胞(HUVECs)衍生的攜帶核富集轉錄本1(NEAT1)的外泌體在M2極化巨噬細胞介導的成骨過程中的作用,并闡明其潛在機制。
結果:我們證實,表達 NEAT1 的 HUVECs 衍生外泌體可顯著增強 M2 極化,并減輕脂多糖(LPS)在體外誘導的炎癥反應。此外,外泌體誘導的巨噬細胞條件培養基間接促進了骨髓間充質干細胞(BMSCs)的遷移和成骨分化。從機理上講,攜帶 NEAT1 的外泌體顯著降低死盒解旋酶 3X 鏈接(DDX3X)和類結核受體蛋白 3(NLRP3)的表達。RAW264.7細胞轉染 DDX3X 過表達質粒后,NLRP3 蛋白水平明顯升高。此外,外泌體中 NEAT1 的敲除在一定程度上抵消了 Exos 的上述作用。氣囊大鼠模型的結果表明,HUVECs衍生的外泌體在體內顯著增加了抗炎細胞因子(IL-10),降低了促炎細胞因子(IL-1β和IL-6),有助于改善LPS誘導的炎癥。在大鼠腓骨缺損模型中,包裹在海藻酸鹽/甲基丙烯酸明膠(Gelatin Methacrylate,GelMA)互穿聚合物網絡(IPN)水凝膠中的 HUVECs 衍生外泌體可以促進骨再生、促進血管生成、增加 M2 極化巨噬細胞的浸潤以及降低 NLRP3 的表達。
結論:HUVECs衍生的外泌體通過DDX3X/NLRP3調控軸誘導巨噬細胞M2極化,從而傳遞NEAT1緩解炎癥,最終在體內借助藻酸鹽/凝膠MA IPN水凝膠促進骨生成。因此,我們的研究為借助 HUVECs 衍生的外泌體包封復合水凝膠進行骨愈合提供了見解,在可預見的未來,這種水凝膠在骨組織工程中應用具有潛力。
3.FBXO38 調節巨噬細胞極化,控制癌癥和結腸炎的發展

巨噬細胞是一種可塑性很強的細胞,可對癌癥和自身免疫性疾病等多種病理情況進行不同的調節。為了應對各種刺激,巨噬細胞會激活不同的內在信號通路,并極化為不同的巨噬細胞亞群。我們的目標是找出可控制巨噬細胞極化并影響癌癥或結腸炎發展的關鍵新效應因子。經腫瘤細胞上清液處理后,巨噬細胞的 Fbxo38 表達出現上調。隨后,我們進一步發現,FBXO38在不影響m1型巨噬細胞極化的情況下,通過MAPK和IRF4信號通路上調m2型基因的表達,從而促進巨噬細胞的免疫抑制功能。研究發現,在巨噬細胞中缺失 Fbxo38 可阻止腫瘤發生,并防止 DSS 誘導的結腸炎。考慮到 FBXO38 在 T 細胞和巨噬細胞中對腫瘤發生的不同調控作用,我們認為全面了解 FBXO38 在不同細胞類型中的功能對其進一步轉化應用至關重要。
4. M2巨噬細胞衍生的sEV可調節促炎性CCR2+巨噬細胞亞群,促進急性心肌梗死后的心臟修復

組織駐留的心臟巨噬細胞亞群介導急性心肌梗死(AMI)后的心臟組織炎癥和修復。表達CC趨化因子受體2(CCR2)的巨噬細胞與M1極化巨噬細胞表型相似,具有促炎作用,并能將CCR2+循環單核細胞招募到梗死的心肌中。來自CCR2-巨噬細胞的細胞外小泡(sEV)表型類似于M2極化巨噬細胞,可促進抗炎活性和心臟修復。在本文中,作者從骨髓衍生的 M2 極化巨噬細胞中獲得了 M2 巨噬細胞衍生的 sEV(M2EV),用于心肌內注射和重現 sEV 在缺血再灌注(I/R)損傷心臟中介導的抗炎活性。大鼠和豬分別接受了假手術、未經治療的 I/R,或經過自體 M2EV 治療的 I/R。M2EV 挽救了心臟功能,減輕了損傷標志物、梗死面積和疤痕面積。M2EV抑制了CCR2+巨噬細胞的數量,減少了單核細胞衍生的CCR2+巨噬細胞向梗死部位的招募,誘導了M1到M2巨噬細胞的轉換,并促進了新生血管的形成。對M2EV micro RNA含量的分析發現了豐富的miR-181b-5p,它能調節巨噬細胞的葡萄糖攝取、糖酵解并減輕線粒體活性氧的生成。對 miR-181b-5p 進行功能性阻斷不利于 M2EV 發揮有益作用,并導致其無法抑制 CCR2+ 巨噬細胞的數量和梗死面積。綜上所述,這項研究表明,M2EV 可挽救心肌功能,改善心肌修復,并通過 miR-181b-5p 依賴性機制調節 CCR2+ 巨噬細胞,為無細胞療法治療 AMI 提供了一種選擇。
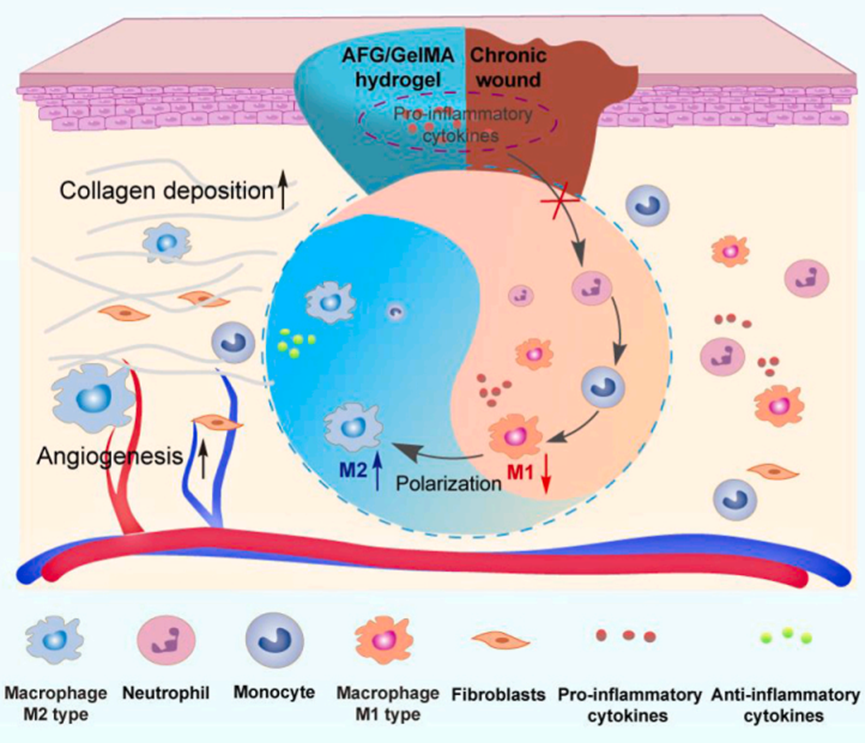
5. 蝸牛啟發的 AFG/GelMA 水凝膠通過炎癥細胞因子抑制和巨噬細胞極化加速糖尿病傷口愈合

糖尿病足潰瘍(DFUs)是一種嚴重且快速增長的糖尿病并發癥,但治療糖尿病足潰瘍仍是一項挑戰,因為現有的療法費用昂貴且反應不靈敏。最近,我們發現一種來自蝸牛粘液的天然粘合劑可以促進皮膚傷口愈合。其中,AFG 是蝸牛粘液中的主要生物活性成分,而 GelMA 則是模擬蝸牛粘液中蛋白質的支架。這種仿生物水凝膠具有很強的組織粘附性、強大的抗炎活性和良好的生物相容性。在 STZ 誘導的 1 型糖尿病大鼠和 db/db 小鼠模型(自發性Ⅱ型糖尿病小鼠)中,可生物降解的 AFG/GelMA 水凝膠在單次處理后可明顯促進慢性傷口愈合。進一步的機理研究表明,該水凝膠能吸附促炎細胞因子,顯著減輕炎癥反應,并通過抑制 NF-?B 信號通路下調促炎細胞因子的表達,促進巨噬細胞向 M2 表型極化。綜上所述,生物啟發水凝膠能有效促進慢性傷口從炎癥階段向增殖階段過渡。這些數據表明,AFG/GelMA 水凝膠是一種很有前景的治療慢性糖尿病傷口的生物材料。
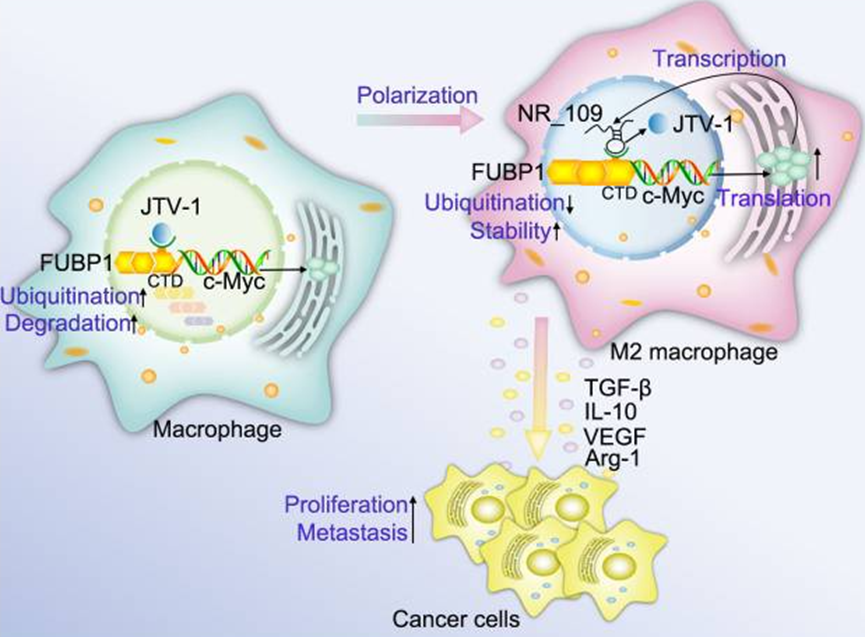
6. NR_109/FUBP1/c-Myc軸調控TAM極化并重塑腫瘤微環境以促進癌癥發展

背景:腫瘤相關巨噬細胞(TAMs)是腫瘤微環境(TME)的主要組成部分,在腫瘤進展中發揮著重要作用。由于 TAMs 的異質性和可塑性,調節 TAMs 的極化狀態被認為是一種潛在的腫瘤治療策略。長非編碼 RNA(lncRNA)與各種生理和病理過程都有關聯,但 lncRNA 如何操縱 TAMs 極化狀態的內在機制仍不清楚,有待進一步研究。
方法:微陣列分析用于描述參與THP-1誘導的M0、M1和M2樣巨噬細胞的lncRNA譜。在這些差異表達的lncRNA中,我們進一步研究了NR_109在M2樣巨噬細胞極化中的功能,以及NR_109介導的條件培養基或巨噬細胞在體外和體內對腫瘤增殖、轉移和TME重塑的影響。此外,我們還揭示了NR_109如何與遠上游元件結合蛋白1(FUBP1)相互作用,通過與JVT-1競爭性結合,阻礙泛素化修飾,從而調節蛋白的穩定性。最后,我們檢測了腫瘤患者的切片,探究了NR_109與相關蛋白表達的相關性,顯示了NR_109的臨床意義。
結果:我們發現lncRNA NR_109在M2樣巨噬細胞中高表達。敲除NR_109會阻礙IL-4誘導的M2樣巨噬細胞極化,并顯著降低M2樣巨噬細胞在體外和體內支持腫瘤細胞增殖和轉移的活性。從機理上講,NR_109與JVT-1競爭結合FUBP1的C端結構域,阻礙泛素介導的FUBP1降解,激活c-Myc轉錄,從而促進M2樣巨噬細胞極化。同時,作為一種轉錄因子,c-Myc 能與 NR_109 的啟動子結合,增強 NR_109 的轉錄。臨床上,在腫瘤組織的 CD163+ TAMs 中發現了 NR_109 的高表達,并且與胃癌和乳腺癌患者的臨床分期呈正相關。
結論:我們的研究首次發現,NR_109通過NR_109/FUBP1/c-Myc正反饋環路在調節M2樣巨噬細胞的表型重塑和功能方面發揮著關鍵作用。因此,NR_109在癌癥的診斷、預后和免疫治療方面具有巨大的轉化潛力。