由于WT1在小鼠顆粒細胞中積累,EPG5缺乏導致原發性卵巢功能不全
原發性卵巢功能不全(POI),也稱為卵巢早衰,是人類的一種卵巢缺陷,其特征是40歲之前卵巢卵泡過早耗竭。然而,POI背后的機制在很大程度上仍然未知。在這里,作者表明敲除EPG5(異位P顆粒自噬蛋白5同源物)導致雌性小鼠的生育能力低下,雌性小鼠表現出POI樣表型。單細胞RNA測序分析顯示,敲除EPG5影響顆粒細胞(GCs)的分化。進一步的研究表明,敲除EPG5阻斷巨自噬/自噬通量,導致WT1(WT1轉錄因子)的積累,WT1是GC的必需轉錄因子,表明WT1需要通過自噬途徑選擇性降解。作者發現,WT1在竇卵泡期的降解不足導致類固醇生成相關基因的表達減少,從而破壞GC分化。綜上所述,作者的研究表明,EPG5促進GC中WT1的降解,表明GC中EPG5的失調可以觸發POI發病機制。該研究于2022年7月發表于《Autophagy》上,題為“Epg5 deficiency leads to primary ovarian insufficiency due to WT1 accumulation in mouse granulosa cells”,影響因子13.3。
技術路線
研究思路
1. 敲除EPG5可導致小鼠卵巢早衰導致生育能力低下
與許多其他自噬相關基因不同,最近發現的自噬相關基因EPG5的敲除不會導致小鼠的嬰兒死亡,因此可以研究其在生育中的作用。作者初步檢測了EPG5在小鼠各種組織中的表達,發現它在卵巢中顯著表。蛋白水平上,經WB證實EPG5在GCs中高表達。卵巢免疫組織化學染色顯示,在原始、原發、繼發和竇卵泡的GCs中,EPG5信號強烈。這些結果提示EPG5可能參與了GC的某些功能。
為了進一步研究EPG5在生殖中的潛在功能,作者對EPG5基因敲除小鼠進行了實驗。首先通過卵巢樣本的免疫印跡證實了基因敲除效率(圖1a)。8周齡EPG5基因敲除小鼠的卵巢形態檢查顯示,與對照組小鼠相比,卵巢大小明顯減小(圖1b)。此外,作者發現EPG5基因敲除小鼠的卵巢重量:體重比也顯著降低(圖1c)。為了研究EPG5基因敲除對雌性生殖能力的影響,研究人員進行了一項育種試驗,將對照組或敲除EPG5的雌性小鼠與具有生育能力的雄性小鼠交配6個月。與對照組相比,EPG5基因敲除雌性小鼠的生育能力降低(圖1d)。EPG5基因敲除組每窩幼崽數量少于WT對照組;EPG5基因敲除小鼠的平均產仔數為2.1±0.59,而WT為7.6±1.41(圖1e)。最后,作者使用蘇木精和伊紅(H&E)染色對16周齡小鼠卵巢橫切面進行觀察,發現與對照組相比,敲除EPG5的卵巢有異常的卵泡發育(圖1f,g)。
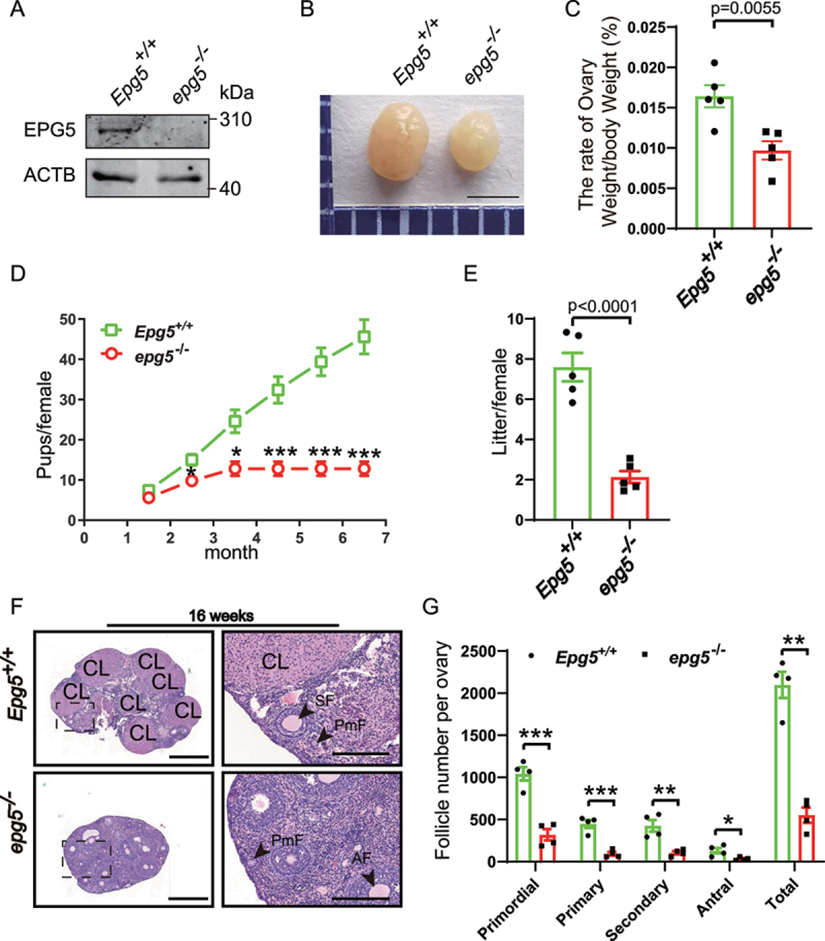
圖1 敲除EPG5的雌性小鼠不育
為了研究EPG5的缺失如何阻礙生育,作者比較了不同年齡的卵巢形態。作者發現EPG5基因敲除和3周大的對照卵巢沒有明顯的形態學差異:兩種基因型的卵巢都有相似數量的不同分期的卵泡,包括被扁平的顆粒前細胞包圍的小卵母細胞,以及含有增大卵母細胞的激活卵泡。然而,當作者檢測6周大的小鼠時,有明顯的差異,在EPG5基因敲除的卵巢中,原始卵泡、初級卵泡和竇卵泡的數量顯著減少。這些結果共同表明,EPG5基因缺失導致雌性卵巢卵泡發育功能障礙和生育能力低下。
2. 敲除EPG5對小鼠卵母細胞的發育能力無影響
在哺乳動物中,雌性的生殖能力是通過卵母細胞和卵泡的調節發育來維持的。鑒于作者已經在EPG5基因敲除小鼠中發現了與年齡相關的低生育能力和卵巢形態異常,作者探討了卵母細胞功能障礙是否有助于解釋作者的觀察結果。與對照組小鼠相比,EPG5基因敲除小鼠的MII卵母細胞數量減少(圖2a);然而,EPG5基因敲除組和對照組的極體-1(PB1)擠壓程度沒有差異(圖2b)。
為了評估EPG5缺失的卵母細胞的發育潛力,作者在體外培養了3周齡EPG5敲除小鼠和對照組的生發囊泡(GV)卵母細胞。與體內成熟結果相似,敲除EPG5的卵母細胞的MII率與對照卵母細胞沒有差異(圖2c,d)。免疫熒光和共聚焦顯微鏡也顯示,敲除EPG5的卵母細胞能夠成功擠出PB1(圖2e),并且敲除EPG5的卵母細胞與對照卵母細胞的異常MII比例沒有變化(圖2f)。為了進一步研究EPG5基因敲除小鼠卵母細胞的發育潛力,按照先前的描述進行了體外受精。作者發現,在EPG5基因敲除小鼠和對照組之間,雙細胞胚胎和囊胚的形成率沒有顯著差異。這些結果表明,EPG5基因敲除小鼠的低生育能力是由于卵泡發育和排卵缺陷造成的,而不是由于卵母細胞發育改變。
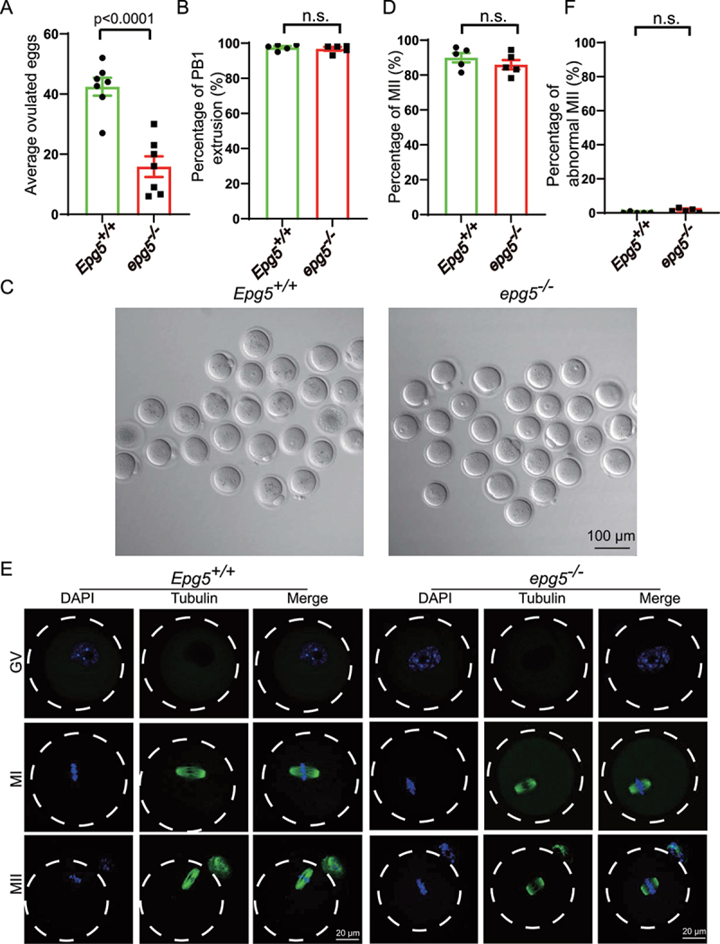
圖2 來自EPG5基因敲除小鼠的卵母細胞能夠完成減數分裂成熟。
3. 敲除EPG5可導致GCs老化和細胞死亡
GCs為卵母細胞提供必需的營養和類固醇,在卵泡發育中起著至關重要的作用。作者評估了GC功能失調是否可能是EPG5基因敲除小鼠poi樣表型的基礎。衰老相關GLB1/β-半乳糖苷酶(SAGLB1/β-gal)檢測顯示,與對照組相比,EPG5基因敲除的GCs中SAGLB1/β-gal活性顯著增加(圖3a,b)。作者還分別采用增殖細胞核抗原(PCNA)和末端脫氧核苷酸轉移酶(dUTP)缺口末端標記(TUNEL)染色法檢測了發育卵泡GCs的增殖率和細胞死亡率。6周齡EPG5基因敲除組卵巢中tunel陽性細胞明顯多于對照組(圖3c-g),EPG5基因敲除組卵巢細胞增殖明顯降低(圖3d-h)。同時,細胞死亡標志物cleavedCASP3(caspase3)的免疫染色信號在繼發性和竇性卵泡的GCs中非常強(圖3e-i)。此外,考慮到已知GCs在細胞死亡的后期階段表現出核變化(包括DNA斷裂),作者想知道EPG5的丟失是否會導致GCs中的DNA損傷。在EPG5基因敲除的GCs中,γ-H2AX水平顯著升高,表明DNA雙鏈斷裂積累(圖3f-j)。這些結果表明,EPG5的缺失減少了GC的增殖并誘導GC死亡,表明GC功能失調(即甾體生成)可能驅動了EPG5基因敲除卵巢中觀察到的卵泡發育缺陷。
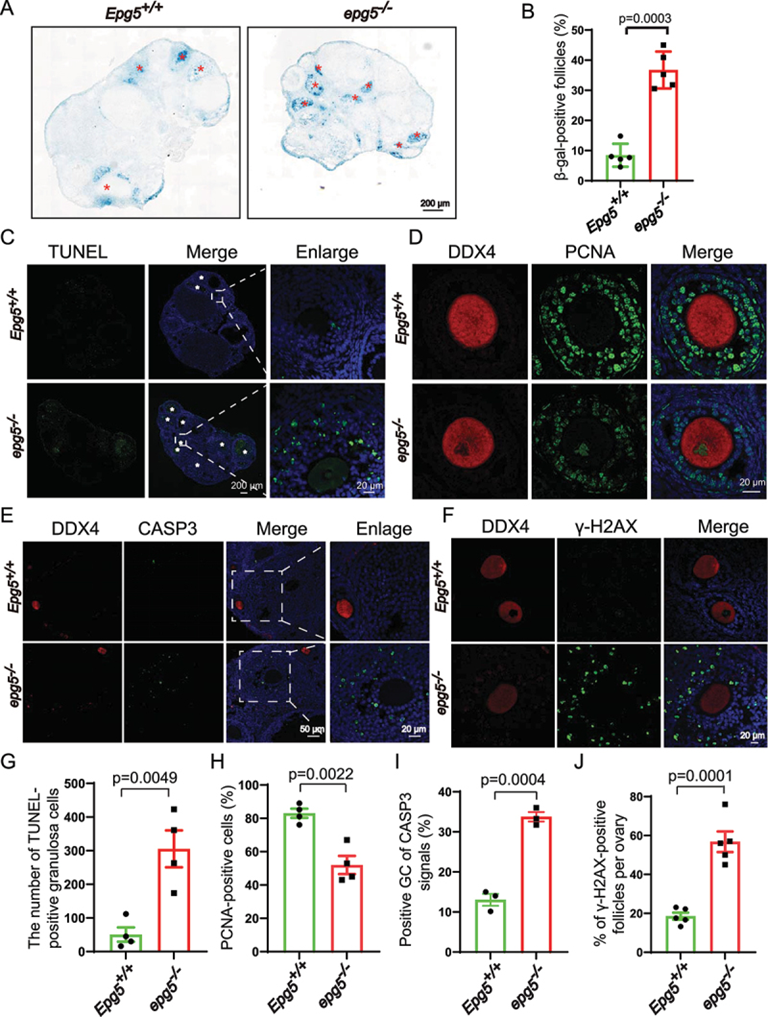
圖3 敲除EPG5可導致GCs老化和細胞死亡
4. 在EPG5敲除的GCs中,自噬通量被阻斷
EPG5通過與RAB7的直接相互作用以及與晚期內體/溶酶體上的VAMP7(囊泡相關膜蛋白7)-VAMP8復合物結合而被招募到自噬體中[41]。接下來,作者研究了EPG5是否對小鼠卵巢的基礎自噬活性至關重要。與EPG5敲除小鼠腦和肌肉細胞一致,6周齡卵巢免疫印跡顯示,與對照組相比,EPG5敲除卵巢中自噬標志物MAP1LC3/LC3-II和SQSTM1/p62水平顯著升高,表明自噬通量被阻斷(圖4a-c)。與免疫印跡結果一致,抗lc3b抗體免疫染色顯示,在6周齡EPG5基因敲除卵巢的所有卵泡期,lc3陽性GCs的數量均顯著增加(圖4d)。作者還在EPG5基因敲除的中央卵泡GCs中檢測到明顯的SQSTM1點信號積累,這在對照組中并不明顯(圖4e)。作者進一步研究了EPG5基因敲除卵巢的自噬通量受損是否導致了EPG5基因敲除GCs中LC3點數量的增加。6周齡卵巢分離GCs的免疫印跡顯示,與對照組相比,EPG5敲除GCs中LC3和SQSTM1水平顯著升高(圖4f-h)。為了進一步研究EPG5敲除對自噬通量的影響,作者通過延時顯微鏡監測了EPG5敲除的GC的自噬通量。作者發現自噬體在對照GCs中以LC3點的形式與溶酶體融合(圖4i,k,1),而LC3點在EPG5敲除的GCs中顯著積累,盡管離溶酶體很近(圖4i,k,1,j)。這些結果證實,在EPG5基因敲除的GCs中,自噬通量被阻斷。
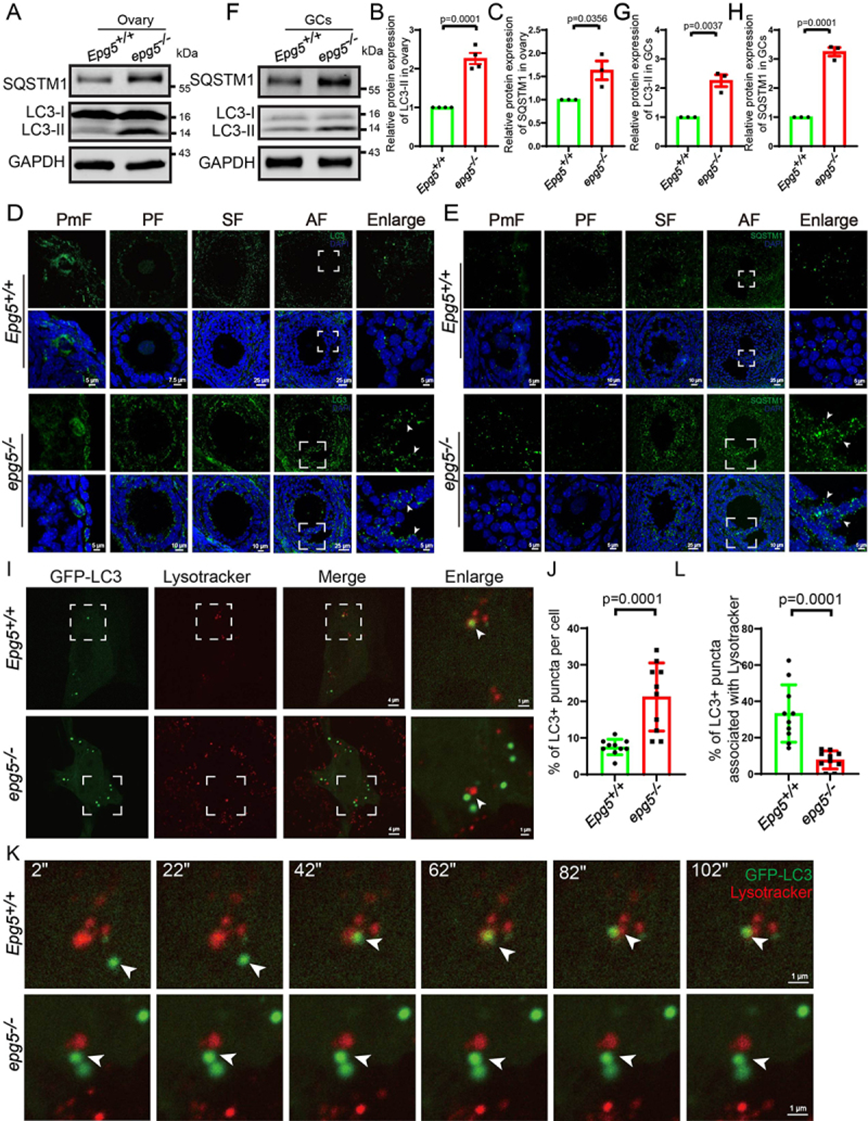
圖4 EPG5基因敲除小鼠卵巢中自噬制造因子LC3-II和SQSTM1聚集物的積累
5. 單細胞RNA測序分析顯示EPG5敲除GCs分化異常
為了研究EPG5在卵泡發生過程中的調控機制,作者對6周齡EPG5基因敲除小鼠和對照組小鼠全卵巢的游離細胞進行了單細胞RNA測序(scRNA-seq)分析(圖5a)。質量控制后,作者在對照組和EPG5敲除小鼠卵巢體細胞中分別獲得6328和4950個單細胞轉錄組。使用統一歧形近似和投影(UMAP)對10×基因組學數據進行無監督聚類分析,發現了7種主要的細胞類型,作者計算了每種細胞類型中排名前30位的差異表達基因(deg),過濾了平均loge變化>0.5的基因,按調整后的p值進行排序(Wilcoxon秩和檢驗)。為了可視化,作者為每個集群繪制了一個代表性的DEG。
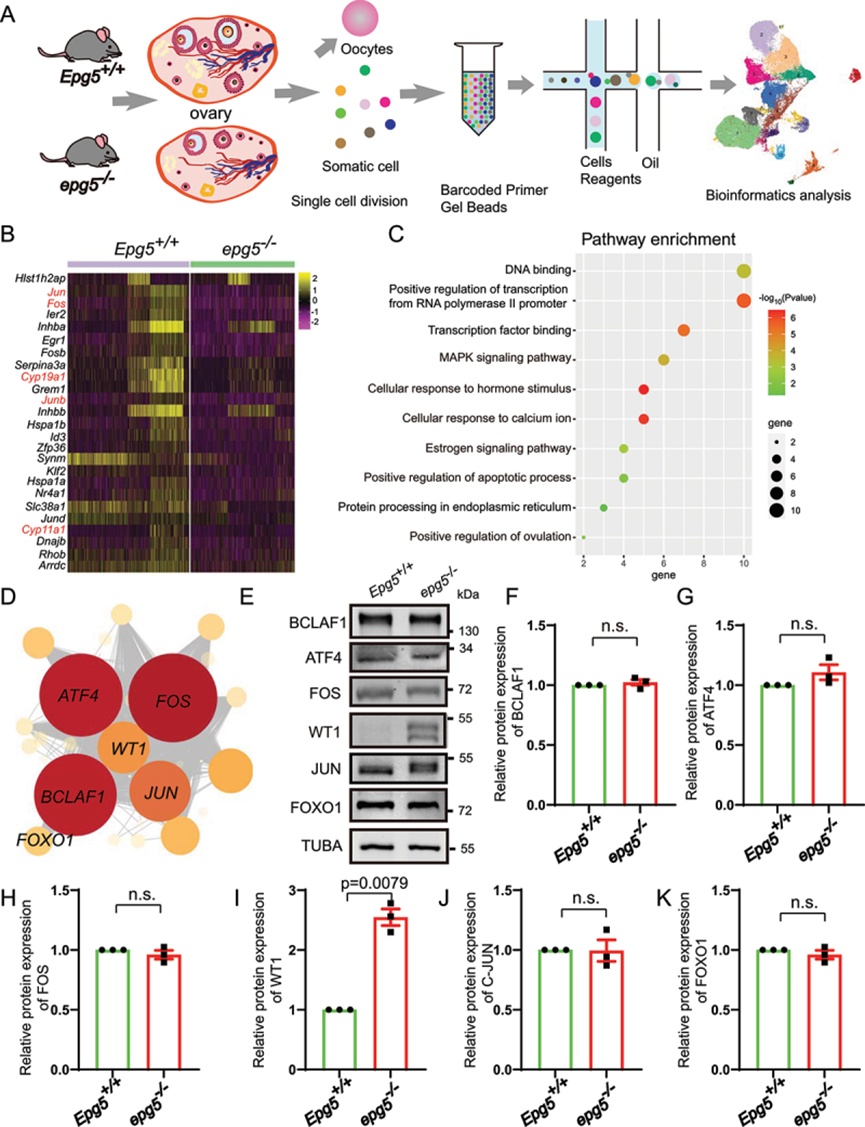
圖5 單細胞RNA-seq分析揭示了EPG5敲除GCs的功能改變
接下來,作者根據每簇50個最易表達的基因對數據進行聚類,并能夠區分五種主要的細胞類型:GC(四簇)、膜和基質細胞(六簇)、平滑肌細胞(一簇)、內皮細胞(一簇)、免疫細胞(三簇)和黃體細胞(一簇)。為了確認UMAP中這些細胞類型的身份,作者根據預期標記基因的表達水平對單個細胞進行了染色:Amh,Hsd3b1,Fshr,Wt1用于GCs;Pdgfrb,Lum為基質細胞;平滑肌細胞的Tagln和Rgs5;內皮細胞的Pecam1和Cdh5;Cd68和Ptprc用于免疫細胞;以及黃體細胞的Epdr1和Avpl1。
鑒于之前的結果,作者選擇GCs進行進一步分析,以進一步闡明EPG5丟失對卵巢細胞反應的影響。兩種基因型中GCs占總細胞百分比的相對比例顯示,EPG5敲除小鼠卵巢中GCs的比例從對照組的44.68%下降到33.07%。EPG5敲除小鼠的GCs中有25個差異表達基因(1個上調基因,24個下調基因),包括編碼性激素生物合成酶的Cyp11a1和Cyp19a1(圖5b)。基因本體(GO)分析顯示,下調基因富集了“轉錄正調控”、“轉錄因子結合細胞”、“激素刺激應答”、“雌激素信號通路”、“凋亡過程正調控”、“內質網蛋白加工”等功能注釋(圖5c)。為了確定GC中的主調控因子,作者通過單細胞調控網絡推斷和聚類(SCENIC)分析,構建了包含轉錄調控因子及其靶基因的轉錄調控網絡。將GCs集群中的deg輸入到SCENIC以建立監管網絡。作者確定了包含868個基因的20個重要調控(圖5d和表S3)。值得注意的是,調控網絡中的關鍵調控顯示高表達的調控包括Bclaf1、Atf4、Fos、Wt1、Jun和Foxo1調控,這些調控在維持GCs分化和卵泡閉鎖過程中都是明確的調控因子。而WB結果顯示,與對照組相比,BCLAF1、ATF4、FOS、JUN/c-JUN和FOXO1的蛋白水平沒有變化(圖5e、f、g、h、j、k)。其中,在敲除EPG5的卵巢中,WT1的蛋白水平顯著升高(圖5e、i)。總之,scRNA-seq分析顯示,敲除EPG5顯著干擾了GC分化基因的表達。
6. EPG5通過降解WT1調控GCs的分化
眾所周知,WT1作為多種類固醇基因的轉錄抑制因子,在卵泡發生過程中抑制GCs的分化。為了研究自噬缺陷如何影響GC分化,作者進一步通過免疫熒光檢測WT1蛋白水平,發現與對照組相比,6周齡EPG5基因敲除的GC中WT1明顯積累(圖6a)。此外,免疫印跡顯示,在EPG5基因敲除的GCs中,WT1的數量顯著增加(圖6b,c)。作者推測在EPG5基因敲除的GCs中觀察到的強WT1積累可能是由于WT1蛋白降解被破壞的結果。
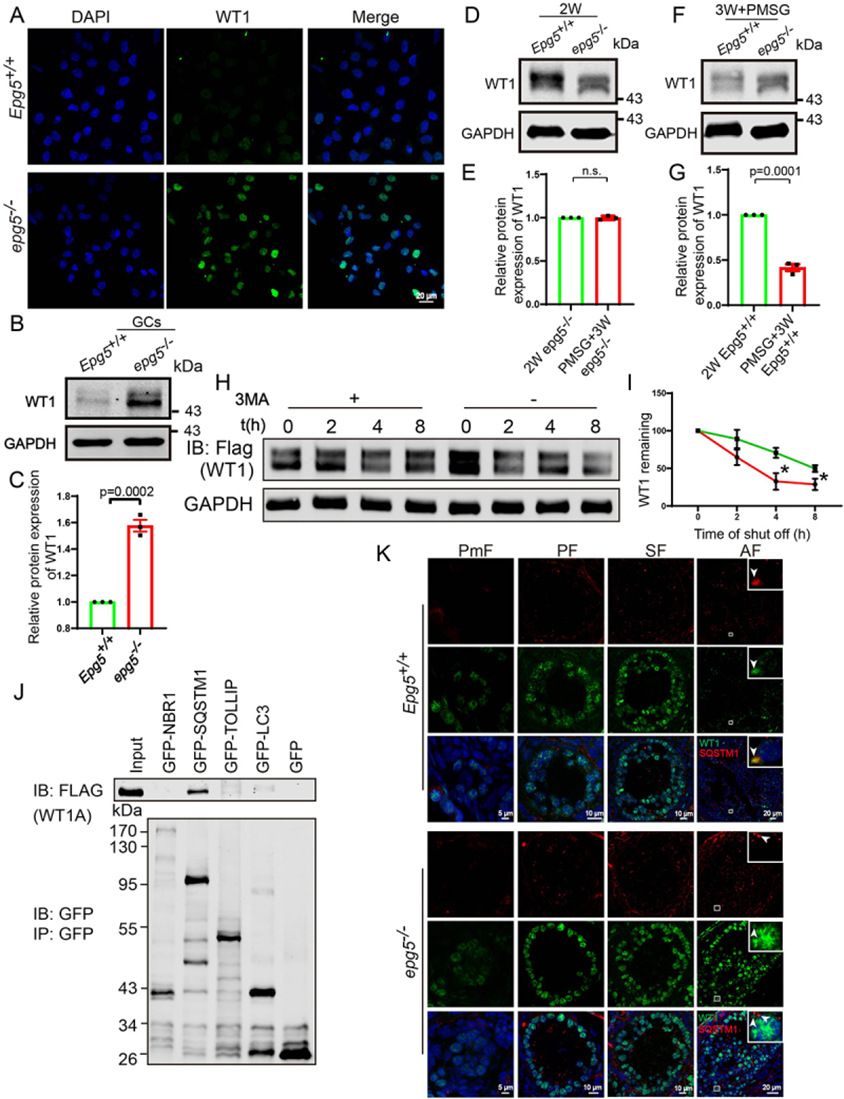
圖6 GCs中WT1的降解依賴于自噬
就其背景而言,2周齡小鼠卵巢中的大多數卵泡是原發性或繼發性的,其中WT1蛋白水平較高。隨后,WT1水平開始從原發卵泡向竇卵泡和排卵前卵泡逐漸降低。作者構建了一個卵泡同步模型來檢測敲除EPG5后WT1水平的變化。用馬絨毛膜促性腺激素(eCG)/妊娠母馬血清促性腺激素(PMSG)治療的3周齡雌性小鼠卵巢中出現了排卵前卵泡。在eCG/pmsg處理的3周齡EPG5基因敲除小鼠卵巢中觀察到WT1蛋白的積累,這與WT卵巢中觀察到的WT1水平急劇下降明顯不同(圖6d,e,f,g)。此外,作者觀察到EPG5基因敲除小鼠的心房卵泡中WT1沒有降解。這些結果表明,EPG5基因敲除小鼠的初級和次級卵泡具有正常的WT1積累,但WT1降解受損導致WT1在中央區和排卵期前的積累異常高。
考慮到研究結果顯示EPG5基因敲除GCs的自噬通量被阻斷,這一現象破壞了WT1蛋白在心房和排卵前卵泡中的降解,作者對HEK293T細胞進行了一系列體外實驗。將自噬/溶酶體抑制劑3-甲基腺嘌呤(3-MA)加入轉染Wt1表達質粒的HEK293T細胞培養基中。在環己亞胺(CHX)追逐實驗中,WT1的降解在3-MA處理后明顯延遲(圖6h,i)。此外,HEK293T細胞的共免疫沉淀實驗表明,WT1可以與SQSTM1物理相互作用,但不能與NBR1、LC3和TOLLIP(toll相互作用蛋白)相互作用(圖6j)。作者還發現,在對照小鼠中,WT1和SQSTM1在竇卵泡GC細胞細胞質中相對較大的點上相互共定位(圖6k)。而在EPG5基因敲除的GCs中,SQSTM1沒有與WT1共定位(圖6k),這表明在EPG5基因敲除的GCs中,WT1降解存在缺陷。總的來說,這些結果表明WT1是通過自噬-溶酶體途徑降解的。
7. 在敲除EPG5的GCs中,類固醇基因的表達可以通過敲除Wt1而部分恢復
WT1功能的喪失已被證明會導致顆粒前細胞向甾體生成細胞轉化,因此作者檢測了EPG5敲除GC中已知的甾體生成蛋白的水平。Gao等人(2014)證實Wt1抑制GCs中FSHR(卵泡刺激素受體)、hsd3b1/3β-羥基類固醇脫氫酶(羥基-δ-5-類固醇脫氫酶,3β-和類固醇δ異構酶1)、Cyp11a1和Cyp19a1等基因的表達。此外,Chen等人(2017)證明WT1通過直接結合Sf1啟動子區域抑制Sf1表達,并表明WT1失活導致Sf1上調,進而激活類固醇生成程序。作者的免疫印跡顯示,與eCG/pmsg處理的3周齡對照卵巢相比,eCG/pmsg處理的3周齡EPG5敲除卵巢中FSHR、HSD3B1、CYP11A1和CYP19A1水平降低(圖7a-e)。為了探討自噬對GC分化的影響,作者從5~6周齡的EPG5敲除小鼠和對照小鼠中分離培養GC。氯喹(Chloroquine,CQ)用于抑制GCs的自噬。cq處理的GCs免疫印跡顯示LC3-II和WT1水平顯著升高,與EPG5敲除的GCs相似(圖7f,g,h)。此外,作者觀察到EPG5敲除和cq處理的GCs中GC分化相關蛋白水平明顯降低(圖7f,i,j,k)。這些結果表明阻斷自噬顯著影響GC分化。為了驗證EPG5敲除GCs中類固醇基因的下調是否與WT1積累有關,作者使用siRNA下調了EPG5敲除GCs中WT1的表達(圖7l,m)。正如預測的那樣,WT1的下調部分挽救了GC分化相關基因的表達(圖7l,n,o,p,q),表明WT1是GC分化的主要自噬靶點。綜上所述,這些結果支持阻斷EPG5敲除GC的自噬導致WT1的異常積累,導致GC分化相關蛋白水平異常低。
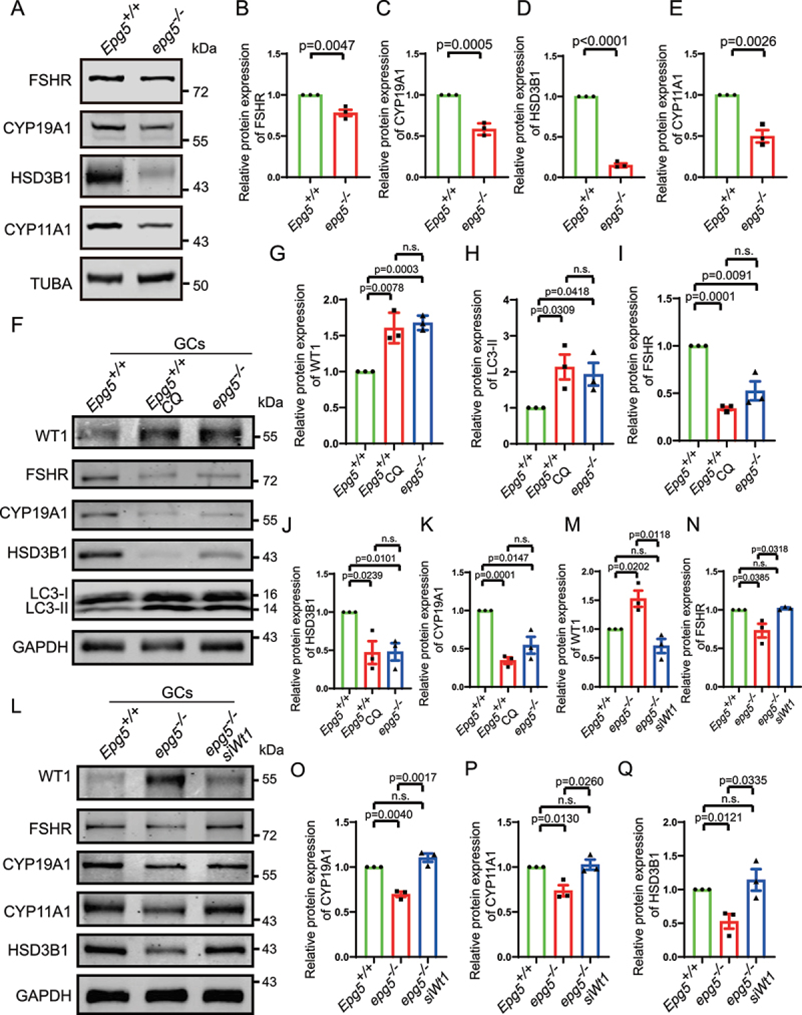
圖7 Wt1敲低部分恢復了EPG5敲除GCs中類固醇基因的表達
實驗方法
單細胞懸液制備、RNA測序和分析、超排卵和生育能力測試、組織采集和組織學分析、卵巢卵泡的定量、原代氣相色譜分離、培養、轉染和敲低、活細胞成像、免疫熒光染色、免疫組化染色、蛋白質印記分析、免疫沉淀、TUNEL檢測
參考文獻
Liu W, Chen M, Liu C, Wang L, Wei H, Zhang R, Ren Z, Chen Y, Luo M, Zhao J, Jiang H, Gao F, Li W. Epg5 deficiency leads to primary ovarian insufficiency due to WT1 accumulation in mouse granulosa cells. Autophagy. 2023 Feb;19(2):644-659.






