黑色素瘤腦轉移信號通路:HDAC8介導EP300 抑制驅動轉錄狀態
皮膚黑色素瘤是最致命的皮膚癌類型,有向多個器官轉移的傾向。黑色素瘤轉移發展的一個常見部位是大腦,如果不治療,黑色素瘤腦轉移(Melanoma Brain Metastases,MBMs)迅速進展,大多數患者在3個月內死亡。對MBM發展的分子驅動因素知之甚少。迄今為止,大多數研究都集中在PTEN丟失和AKT信號過度激活上,這限制了對于黑色素瘤異質性的調節。本研究確定應激誘導的HDAC8活性驅動了黑色素瘤腦轉移發展,通過ATAC-Seq和ChIP-Seq表明HDAC8活性增加是通過H3K27ac和c-Jun結合位點可及性的增強改變了染色質結構。HDAC8被鑒定為轉錄輔因子失活和染色質可及性的介質,驅動腦轉移。
該研究于2023年11月29日發表在《Nature Communications》,IF:16.6
技術路線
主要研究結果
1. 黑色素瘤細胞受到壓力后HDAC8活性增加
作者首先確定了HDAC8是否是黑色素瘤細胞狀態變化的表觀遺傳驅動因素。黑色素瘤細胞的WB分析表明,黑色素瘤細胞譜系轉錄因子MITF的高表達與較低的HDAC8表達相關,并降低由HDAC8調節的信號分子水平,包括SMC3乙酰化、EGFR磷酸化和c-Jun磷酸化(圖1a)。根據細胞對BRAF抑制劑(BRAFi)vemurafenib的基線敏感性對其進行排名,并證明高MITF表達、低HDAC8表達和高BRAFi敏感性之間的聯系(圖1a)。同樣, HDAC8低表達的黑色素瘤細胞中過表達HDAC8后磷酸化Jun和EGFR水平增加(圖1b)。由于轉錄轉換可能是對外源性應激的反應,作者接下來探討了HDAC8的過表達是否會增加不同微環境條件下黑色素細胞的存活。HDAC8表達的增加導致暴露于缺氧、紫外線照射和BRAF-MEKi治療后的黑色素瘤細胞存活增加(圖1c-e)。為了確定這是否與黑色素細胞和黑色素瘤細胞間的保守反應有關,用紫外線照射處理了2個原代人類黑色素細胞系(FOM173和NHEM),并發現HDAC8和磷酸化c-Jun表達增加(圖1f)。人類黑色素細胞系(HERMES1和HERMES3)中HDAC8表達升高導致MITF表達下降,磷酸化c-Jun水平增加(圖1g),并在細胞受到缺氧或紫外線照射時提高了存活率(圖1h&i)。
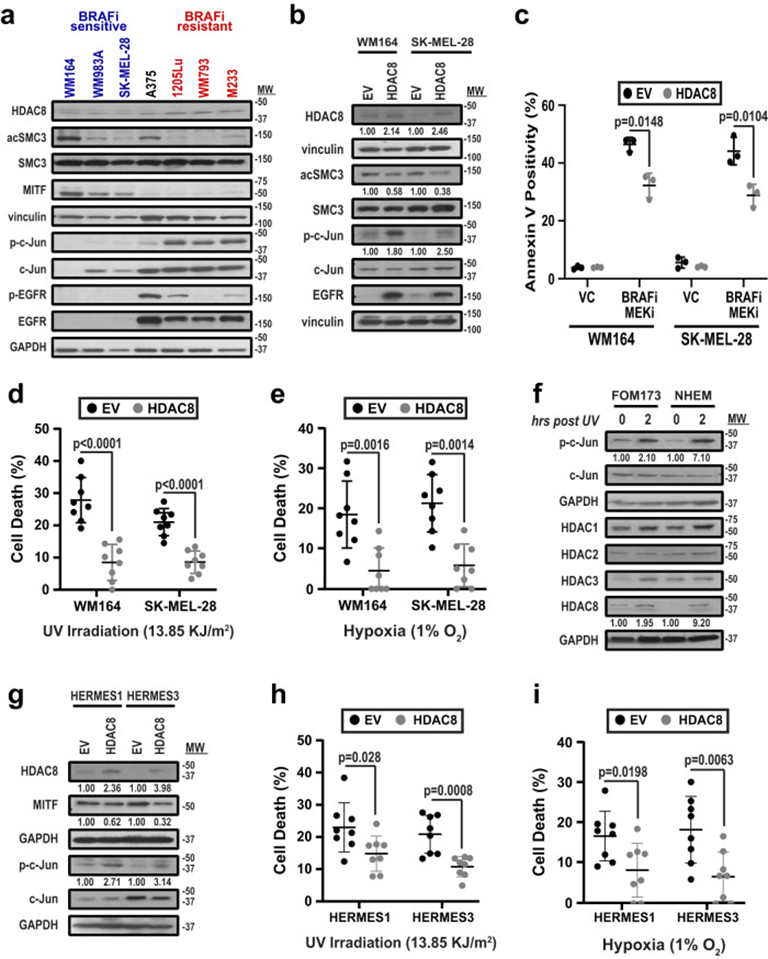
圖1:HDAC8表達賦予黑色素細胞和黑色素瘤抗逆性
2. HDAC8驅動黑色素瘤細胞中的轉錄開關
對兩個黑色素瘤細胞系(WM164和SK-MEL-28)進行RNA-seq分析,以確定HDAC8的上調如何重塑轉錄格局,發現隨著HDAC8的表達升高,204個常見基因顯著增加,163個常見基因顯著減少(圖2a)。KEGG分析顯示,HDAC8高表達導致了黑色素瘤轉移等途徑的富集,包括PI3K-AKT信號、局灶粘附、ECM-受體相互作用、肌動蛋白細胞骨架調節、MAPK信號和RAP1信號(圖2b),同時減少了一些代謝途徑如谷胱甘肽和嘌呤代謝的富集(圖2c)。這些數據表明HDAC8驅動的轉錄程序與侵襲性、轉移性表型相關,接下來確定HDAC8表達增加是否與黑色素瘤轉錄狀態相關。最近對黑色素瘤異質性的分析確定了幾種不同的細胞狀態,包括未分化胚胎干細胞(ESC)狀態、神經嵴干細胞(NCSC)樣狀態和分化黑色素細胞狀態等。對數據集的分析表明,HDAC8高表達富集了 WM164細胞中的NCSC和未分化狀態相關的基因(圖2d&e)。通過分析WM164和1205Lu細胞中NCSC基因啟動子區域的H3K27ac 的ChIP-Seq數據,驗證了NCSC基因轉錄活性的增加。與NCSC狀態相關的基因,包括AXL、FAM83G、FOSL1和SOX2,增加了HDAC8過表達細胞中的H3K27ac乙酰化(圖2f);而與黑色素細胞狀態相關的基因,包括MLANA、DCT、TYR和PMEL,減少了HDAC8過表達細胞中的H3K27ac乙酰化(圖2g)。
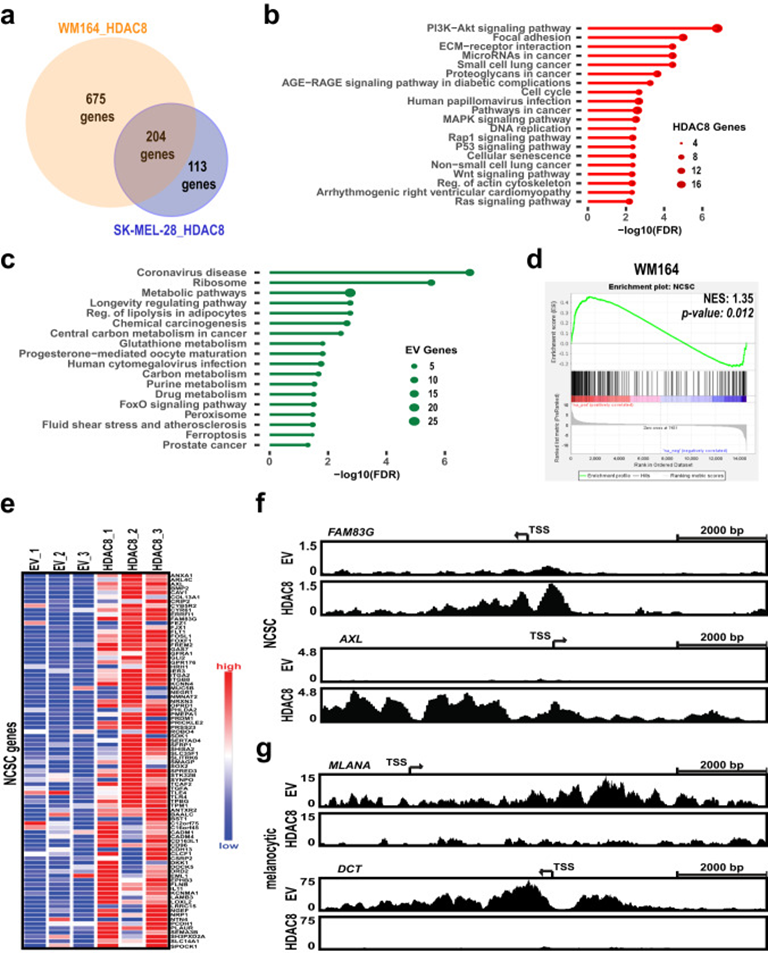
圖2: HDAC8驅動黑色素瘤細胞中的轉錄開關
3. HDAC8驅動的轉錄狀態導致侵襲性變形蟲表型
轉移到大腦的細胞必須克服多種障礙,包括通過血腦屏障外滲、在循環系統的高剪應力條件和腦實質富含蛋白酶的環境中生長。由于在RNA-seq和ChIP-Seq分析中上調的許多基因與侵襲增加有關,所以進行了3D球形膠原蛋白侵襲和基質膠侵襲檢測,發現WM164和SK-MEL-28細胞在HDAC8過表達后細胞侵襲增強(圖3a-d)。接下來觀察HDAC8是否通過使用模擬一般循環中經歷的剪切水平的流動室系統來增加黑色素瘤細胞對剪切應力的彈性。WM164和SK-MEL-28細胞暴露于高水平的流體剪切應力24h后,對照細胞高水平死亡(圖3e&f)。HDAC8上調的許多基因參與細胞骨架重排,包括與變形蟲表型相關的SOX2和PROM1。WM164和SK-MEL-28細胞表達HDAC8后被鍍在膠原蛋白上時采用了圓形變形蟲表型(圖3g)。由于變形蟲表型可以允許細胞擠過狹窄的空間,例如離開血管和穿過血腦屏障相關的空間,進行跨內皮細胞遷移檢測,發現HDAC8過表達導致黑色素瘤細胞通過匯合內皮細胞層,轉移性增加了十倍(圖3h&i)。總的來說,這些發現表明HDAC8驅動的轉錄程序可以增加體內黑色素瘤細胞的侵襲。
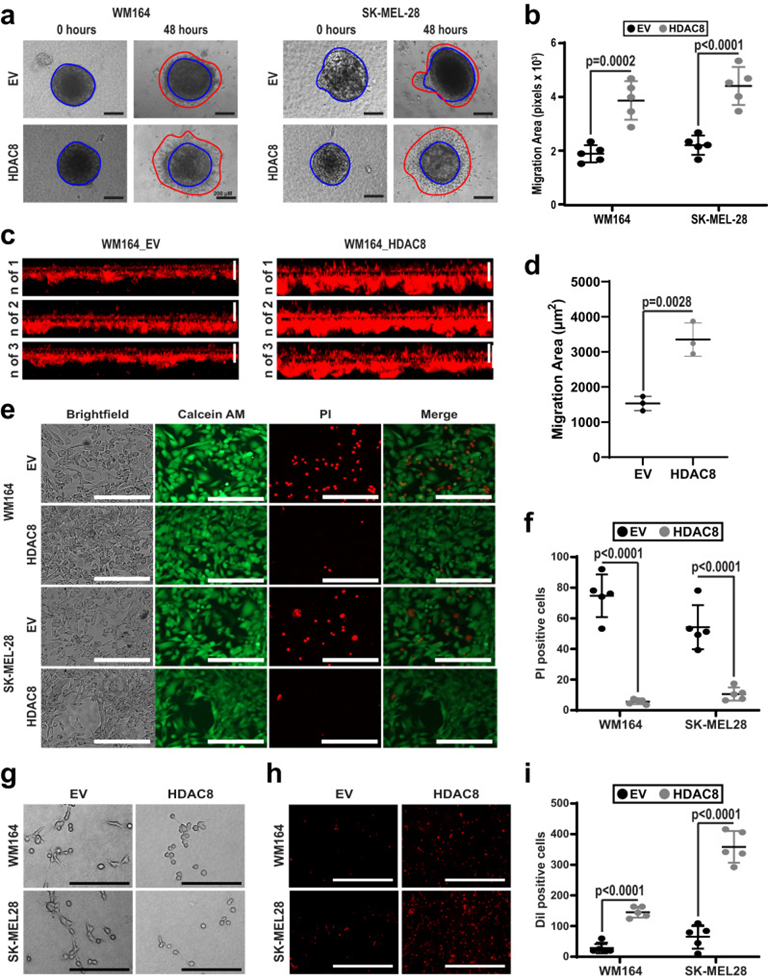
圖3: HDAC8增加黑色素瘤細胞的侵襲和變形蟲樣狀態
4. HDAC8增加小鼠腦轉移的發展
接下來,作者檢測HDAC8驅動的轉錄狀態是否改變了體內轉移播種的模式。對照組或表達HDAC8的WM164被注射到小鼠心臟左心室和每隔5天收集的器官中,以確定潛在的轉移位點。過表達HDAC8和EV組之間肝臟或肺轉移的總發生率差異不大(圖4a)。與第5天的EV細胞相比,HDAC8表達后肝轉移數量顯著增加,但在之后的時間點不再顯著(圖4b)。對肺的分析顯示,隨著時間的推移,HDAC8表達組和EV對照組之間的轉移發展動態相似(圖4c)。作者接下來關注高表達HDAC8的黑色素瘤細胞形成黑色素瘤腦轉移的傾向。在心內注射后, SK-MEL-28、WM164和1205Lu的高表達HDAC8黑色素瘤細胞與對照相比,出現更多的腦轉移(圖4d-f)。神經病理學檢查確定腫瘤累及側腦室顳角的室管膜表面,已經侵犯到腦實質,腫瘤邊界侵犯血管周圍。為了解決發現的臨床相關性,作者對臨床黑色素瘤樣本進行單細胞RNA-seq分析。這些分析顯示,人類黑色素瘤細胞中HDAC8表達與NCSC樣基因表達譜之間存在顯著相關性(圖4g&h)。根據轉移部位進行的更詳細的細分顯示,LMD和腦轉移樣本中HDAC8表達與NCSC樣狀態之間存在顯著相關性,但與皮膚轉移樣本無關。然而,這可能是由于皮膚轉移樣本中腫瘤細胞數量較少。黑色素瘤腦轉移通常富含OXPHOS代謝基因。
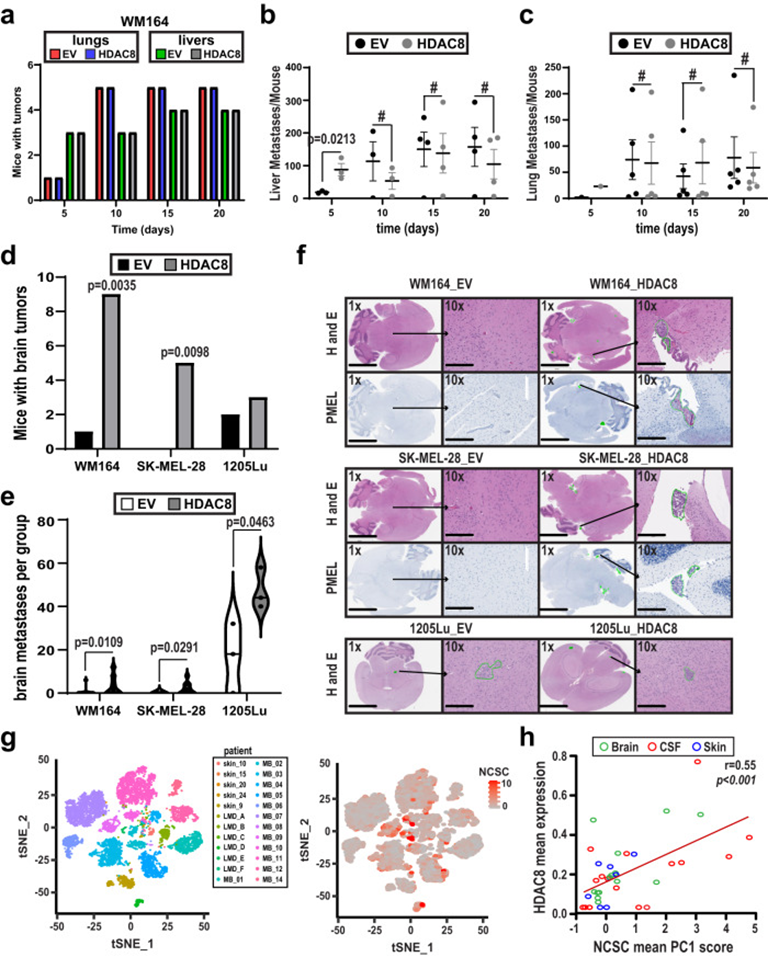
圖4: HDAC8增加黑色素瘤腦轉移的建立
5. HDAC8增加了Jun靶向基因的染色質可及性和H3K27ac
作者接下來使用ATAC-Seq和ChIP-Seq來確定HDAC8如何調節轉錄重編程。ChIP-Seq數據的整體分析顯示HDAC8表達對H3K27ac在啟動子或增強子區域幾乎沒有整體影響(圖5a&b),總乙酰-H3組蛋白水平也幾乎沒有變化(圖5c)。H3K27ac ChIP-Seq數據的HOMER分析顯示,過表達HDAC8時,Jun位點的H3K27乙酰化增加,而對照細胞在對細胞周期進展重要的轉錄因子(包括B-myb和A-myb)上表現出H3K27乙酰化增加(圖5d)。基因峰數/長度的ATAC-seq分析顯示,在HDAC8過表達和EV細胞中,DNA片段大小相似(圖5e)。雖然整個基因組的總體可及性相似,但在HDAC8表達細胞中,啟動子的可及性增加(圖5f),而在非啟動子位點幾乎沒有差異(圖5g)。對HDAC8表達時可及性增加的基序的分析包括多個AP-1轉錄因子(Fra1,ATF3,Jun)和TEADs(圖5h,補充圖10a,b)。多個基序在HDAC8引入時也顯示下調,包括CTCF、多個SOX轉錄因子和黑色素細胞譜系轉錄因子MITF(圖5h)。
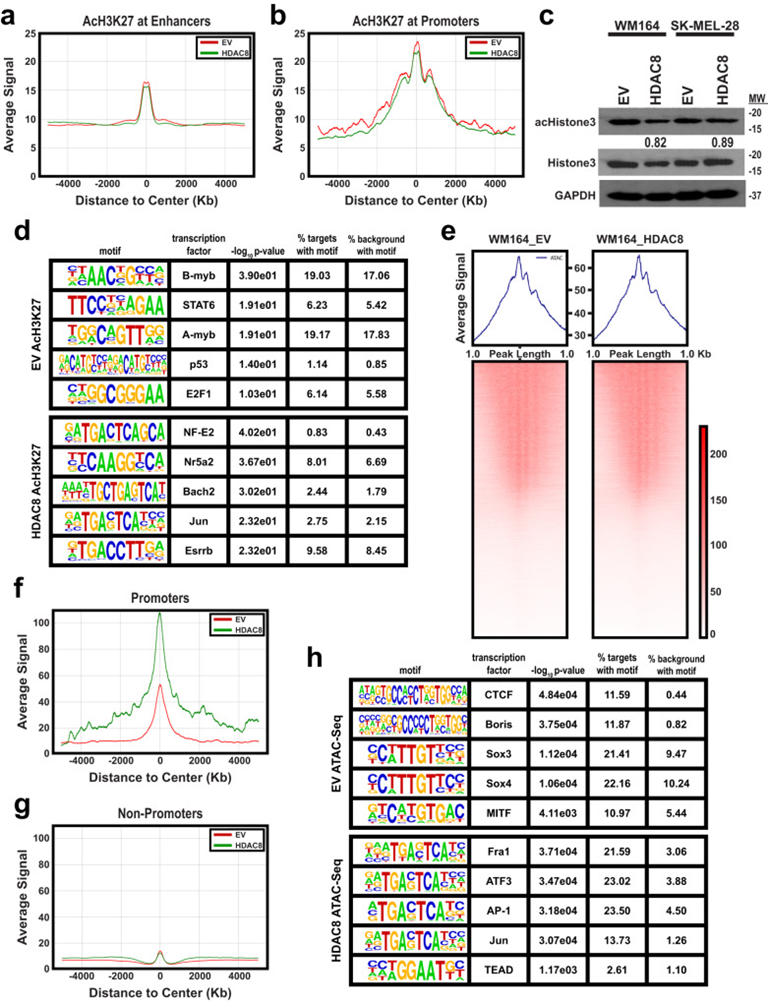
圖5:HDAC8激活誘導Jun和MITF靶向基因的染色質可及性的變化
6. EP300失活導致Jun轉錄活性增加
ATAC-Seq和ChIP-Seq數據的生物信息學整合表明HDAC8表達增強細胞外基質組裝、細胞分化相關的基因通路中的可及性/轉錄激活(圖6a)。盡管ATAC-Seq和ChIP-Seq數據顯示HDAC8介導的H3K27ac或染色質可及性的總體變化很少,但在WM164和1205Lu細胞系中都注意到離散Jun和MITF位點的變化。許多與NCSC表型有關的基因,如SOX2,由c-Jun調節,并在HDAC8過表達細胞中表現出可及性/H3K27乙酰化增加(圖6b),而MITF調節的基因,如MLANA的可及性降低(圖6c)。作者注意到HDAC8的表達導致多個Serpins(如Serpin E1,E2和A1)的基因表達,H3K27ac和染色質可及性增加,這些蛋白酶抑制劑有助于腦轉移的建立。這些結果表明HDAC8的過表達導致從MITF驅動的轉錄程序到c-Jun調節的轉錄程序的轉變。
由于HDAC8對全局染色質可及性的影響相對較小,接下來探究了HDAC8是否通過調節非組蛋白靶點發揮作用。進行蛋白質組學分析以確定HDAC8如何影響黑色素瘤細胞的“乙酰化”。 STRING分析發現參與脂質代謝調節的顯著去乙酰化蛋白質(圖6d),確定的中心樞紐之一是組蛋白乙酰轉移酶(HAT)EP300/CREBBP。已知EP300可以乙酰化多種蛋白質,包括MITF和c-Jun。 EP300結構分析確定了它的HAT結構域中的4個賴氨酸殘基(賴氨酸的1542、1546、1549和1550),它們在HDAC8過表達時被脫乙酰化(圖6e)。HDAC8對EP300的脫乙酰化能力通過免疫沉淀和總蛋白乙酰化的免疫印跡(圖6f)得到證實。在兩個獨立的黑色素瘤細胞系中,EP300的脫乙酰化與其HAT活性的降低(通過組蛋白H4的乙酰化測量)相關(圖6g)。NCSC和黑色素細胞表型相關基因的單位點ChIP檢測顯示,HDAC8表達的增加與EP300與AXL的Jun啟動子的結合增加以及EP300與MLANA的MITF啟動子的結合減少有關(圖6h)。這些結果表明HDAC8通過抑制其HAT活性將其從MITF啟動子位點轉換為Jun啟動子位點來調節EP300功能。
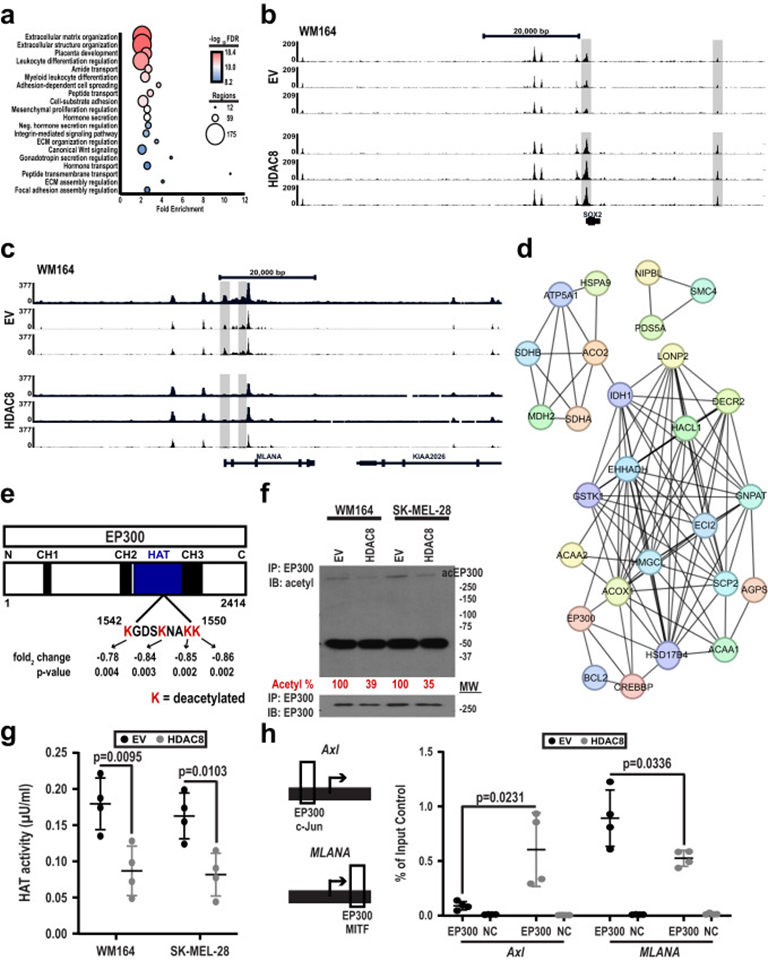
圖6: HDAC8去乙酰化失活EP300,導致JUN轉錄活性增加
7. 抑制EP300驅動黑色素瘤腦轉移的發展
由于EP300是HDAC8的直接靶點,作者接下來探索了EP300在驅動抗應激、侵襲表型中的作用。首先確定了對BRAFi治療敏感或耐藥的黑色素瘤細胞系中EP300和CREBBP的表達水平,并發現對抑制劑治療敏感的細胞系EP300水平增加(圖7a)。對TCGA黑色素瘤數據庫的研究強調了與EP300/HDAC8水平不變的患者相比, EP300水平降低和HDAC8水平升高與總體生存率降低之間的相關性。然后進行功能研究以確定抑制EP300(通過HDAC8模仿其去乙酰化)是否會改變黑色素瘤細胞對BRAFi治療的敏感性。BRAF突變黑色素瘤細胞系與EP300/CREBBP抑制劑I-CBP112聯合治療降低了黑色素瘤細胞對BRAFi的敏感性,增加了形成的菌落數量(圖7b&c)。通過特異性siRNA沉默EP300也有類似的效果,并被發現BRAFI-MEKi治療誘導的細胞凋亡水平降低(圖7d)。這種影響與c-Jun活性的增加有關,發現抑制EP300可以增加轉錄活性的磷酸化c-Jun水平(圖7e)。進一步的研究表明,通過shRNA敲低沉默EP300也保護WM164和SK-MEL-28黑色素瘤細胞免受紫外線照射和缺氧損傷(圖7f&g)。由于表達HDAC8的細胞具有高度侵襲性,接下來研究調節EP300的表達是否會改變黑色素瘤細胞的侵襲能力。通過shRNA敲除沉默EP300增加了黑色素瘤細胞對3D膠原基質的侵襲(圖7h-j)。因此,與shRNA對照組相比,心內注射EP300沉默的SK-MEL-28細胞增加了腦轉移小鼠的數量(圖7k&l)。綜上表明HDAC8介導的EP300去乙酰化導致HAT活性降低,轉錄活性JUN增加,以及從黑色素細胞轉換為NCSC樣。
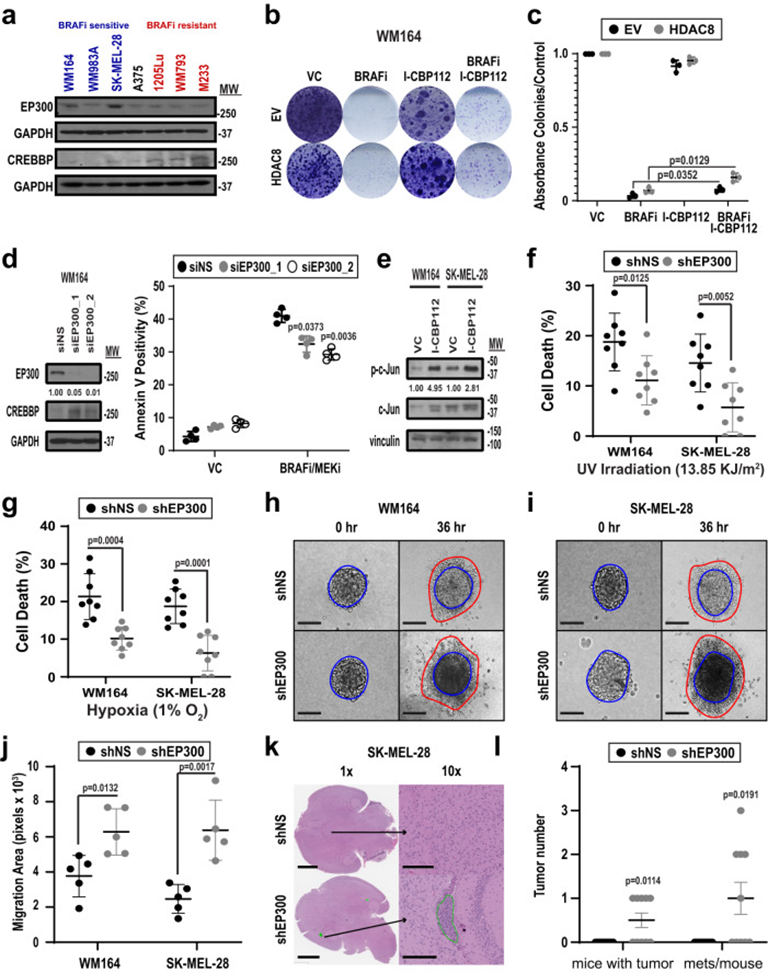
圖7: EP300的抑制作用驅動了黑色素瘤細胞中的抗壓侵襲性表型
結論
本研究證明在黑色素瘤細胞中,HDAC8介導的去乙酰化導致從MITF到Jun驅動的轉錄程序的轉換,從而導致采用NCSC狀態特征的轉錄狀態。Jun蛋白的去乙酰化增加了其磷酸化和轉錄活性,導致Jun/AP-1驅動類似NCSC的轉錄程序的啟動。與此同時,HDAC8介導的EP300去乙酰化抑制其HAT功能,降低MITF啟動子位點的可及性,并改變H3K27在關鍵黑色素細胞基因中的分布。HDAC8誘導的轉錄程序導致黑色素瘤細胞采用高度彈性的變形蟲表型,從而在剪切應力條件下和腦實質中驅動侵襲和存活。這種HDAC8驅動的程序也在暴露于紫外線照射的黑色素細胞中觀察到,提供了保守的黑色素細胞存活程序和黑色素瘤細胞侵襲性轉移行為之間的聯系。
實驗方法
細胞培養,質粒的生成和轉染,免疫印跡,免疫沉淀,細胞活力測定,附著力/遷移分析,HAT活性測定,RNA測序和數據分析,ChIP測序和數據分析,ATAC測序和數據分析,scRNA-Seq數據分析,乙酰組學,小鼠體內試驗,HE染色,免疫組織化學分析
參考文獻
Emmons Michael F, Bennett Richard L, Riva Alberto et al. HDAC8-mediated inhibition of EP300 drives a transcriptional state that increases melanoma brain metastasis. [J] .Nat Commun, 2023, 14: 7759.






