三陰性乳腺癌中的鐵死亡異質性揭示了一種創新的免疫治療聯合策略
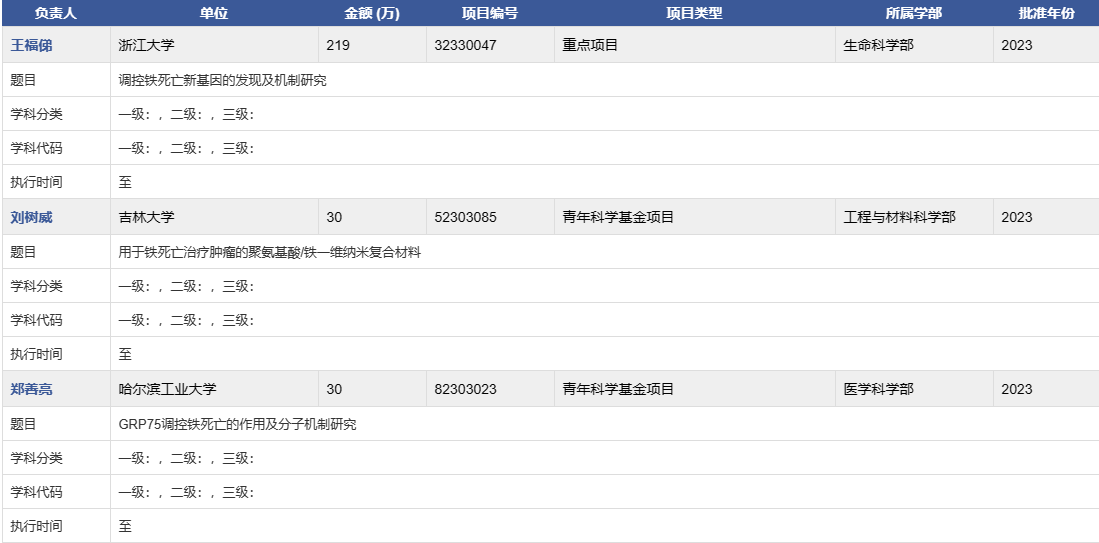
鐵死亡(Ferroptosis)最早由哥倫比亞大學Dr. Brent R.Stockwell在2012年提出,是一種鐵依賴性的,區別于細胞凋亡、細胞壞死、細胞自噬的新型的細胞程序性死亡方式。鐵死亡的的本質是谷胱甘肽的耗竭,谷胱甘肽過氧化物酶(GPX4)活性下降,脂質氧化物不能通過GPX4催化的谷胱甘肽還原酶反應代謝,之后二價的鐵離子氧化脂質產生活性氧,從而促使鐵死亡的發生。下圖為2023年鐵死亡中標項目:
三陰性乳腺癌(Triple-negative breast cancer, TNBC)是一種生物學和臨床異質性疾病,約占已診斷乳腺癌的 15%,仍然是最難治療的乳腺癌亞型。作者之前的工作描述了中國人群中 TNBCs在分子特征、代謝重編程和腫瘤微環境方面的異質性。基于這些發現,作者提出了一個穩健的 TNBC分型系統,包括四種亞型:間充質樣(MES)、管腔雄激素受體(LAR)、免疫調節(IM)和基底樣和免疫抑制(BLIS)亞型。因為 TNBC是一種富含鐵和脂質的腫瘤,誘導鐵死亡是一種可探索的治療策略。重要的是,干預脂質代謝或氧化還原平衡可誘導多種癌癥的鐵死亡。然而,最近乳腺癌背景下的鐵死亡研究主要集中在探索調節鐵死亡的新分子和新型納米顆粒的開發上。鑒于鐵死亡是一個逐步的過程,并受多種代謝途徑的調控,而 TNBC 中鐵死亡的清晰圖譜仍不清楚,因此在 TNBC 中利用鐵死亡進行精準治療仍有諸多阻礙。2023年3月發表在《Cell Metabolism》,IF:29。
技術路線:

研究結果:
1.TNBC亞型中鐵死亡相關特征的異質性
作者使用了多組學 TNBC數據集(n = 465),該數據集包括360個轉錄組數據的樣本、279個全外顯子組測序(WES)結果的樣本、401個體細胞拷貝數改變(SCNA)數據的樣本和330個代謝組數據的樣本(圖1A和B),劃分出MES、LAR、IM和BLIS四個亞型,以評估鐵死亡特征。TNBC 在鐵死亡相關代謝產物和代謝途徑中具有高度異質表型,LAR亞型中誘導過氧化脂質形成等正調控鐵死亡的通路富集評分均較高,主要包括脂肪酸代謝通路、ROS代謝通路,脂肪酸過氧化酶(LOXs)相關通路(圖1C和D)。HAMP是鐵穩態的負調節因子,在MES亞型中HAMP在mRNA水平分度較低(圖1E和F)。此外,通過鐵檢測試劑盒分析,在TNBC細胞系中驗證了MES亞型鐵代謝失調(圖1G)同時,促進鐵死亡的代謝通路也在LAR亞型中顯著上調。與其他亞型相比,LAR腫瘤的OxPE和OxPE/PE-PUFA比值較高(圖1D和H)。此外,棕櫚油酸和油酸促進細胞鐵死亡,在LAR腫瘤中表達較高。LAR亞型的脂質過氧化水平升高也在TNBC細胞系中得到驗證(圖1I)。多組學分析和實驗均證實,LAR 亞型是TNBC 中鐵死亡活躍性最高的亞型。
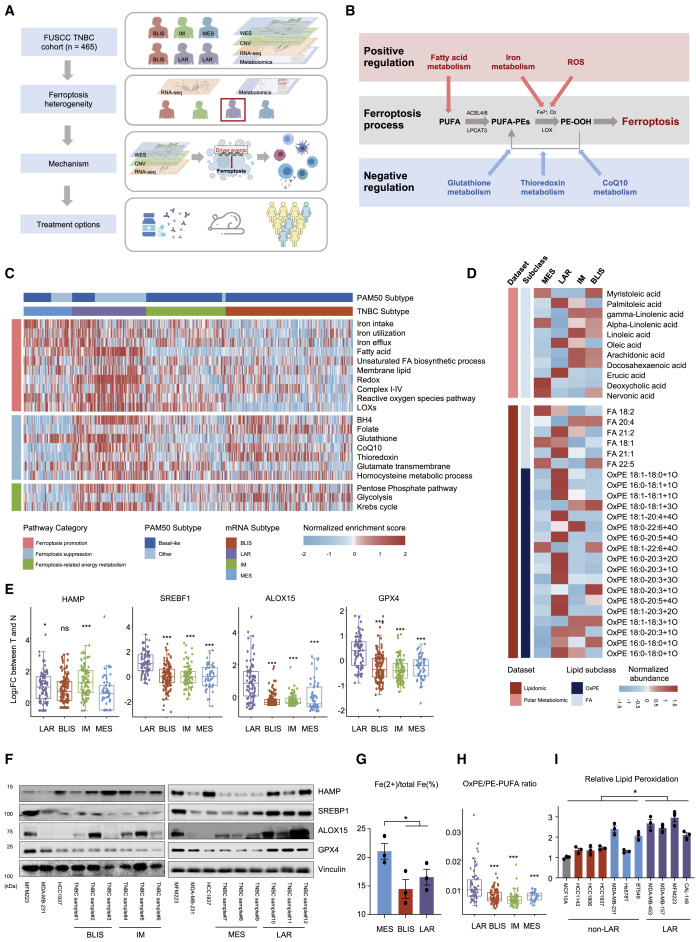
圖1. TNBC亞型中鐵死亡相關特征的異質性
2.谷胱甘肽代謝對于抑制 LAR 腫瘤的鐵死亡至關重要
作者利用代謝組學和轉錄組學數據探索了LAR腫瘤中抑制鐵死亡的最主要途徑。在代謝組學方面,GSH代謝被確定為LAR腫瘤中最顯著的鐵死亡抑制和可靶向的特征(圖2A和B)。GSH是癌細胞中主要的小分子抗氧化劑,由半胱氨酸、谷氨酸和甘氨酸組成(圖2C)。通過比較GSH循環核心代謝物的豐度,作者發現GSH相關代謝物如甘氨酸和半胱氨酸在LAR腫瘤中顯著富集并且在TNBC細胞系中也證實了LAR亞型中GSH與氧化GSH (GSSG)的較高比例(圖2D、E、F)。在轉錄組學中比較 LAR和非 LAR腫瘤之間的鐵死亡抑制通路。結果表明,GSH代謝是LAR亞型鐵死亡抑制的基本途徑(圖2G)。在GSH通路的所有代謝基因中,GPX4 將LAR腫瘤與非LAR腫瘤區分開來(圖2H和I)。這些數據表明,GPX4 是 GSH代謝抑制LAR腫瘤鐵死亡的潛在決定因素。
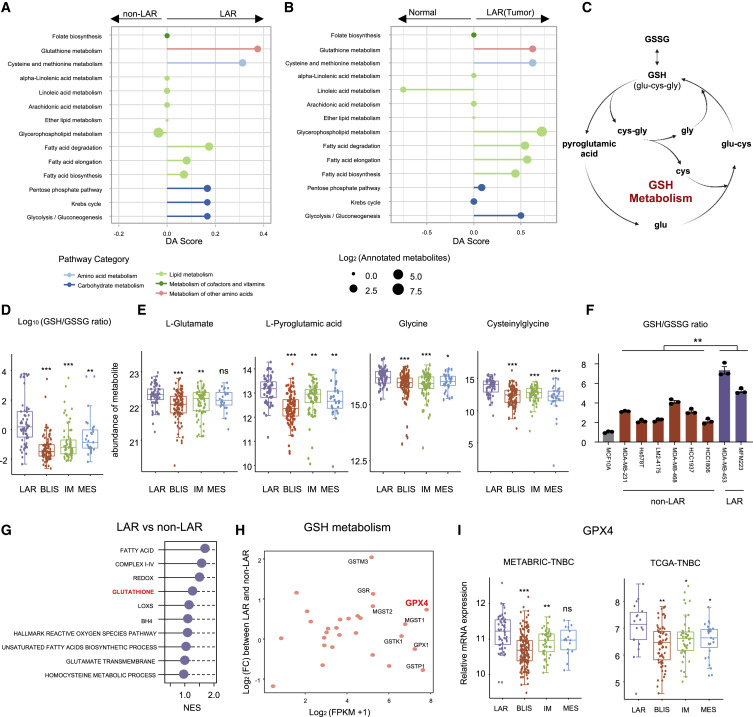
圖2. 谷胱甘肽代謝對于抑制 LAR 腫瘤的鐵死亡至關重要
3.GPX4對多種鐵死亡誘導因子的敏感性突顯其在 LAR腫瘤中的重要性
作者組裝了包括erastin、PX-12、FIN-56、RSL3 和ML162 在內的一系列鐵死亡誘誘劑(圖3A和B),以評估每種化合物在LAR、非LAR和非TNBC細胞系中啟動鐵死亡的效果結果與之前的轉錄組和代謝組學分析一致(圖3C和D),并強調了GPX4 在LAR腫瘤鐵死亡穩態中的重要性,并強調了GPX4 是LAR腫瘤的代謝靶點。
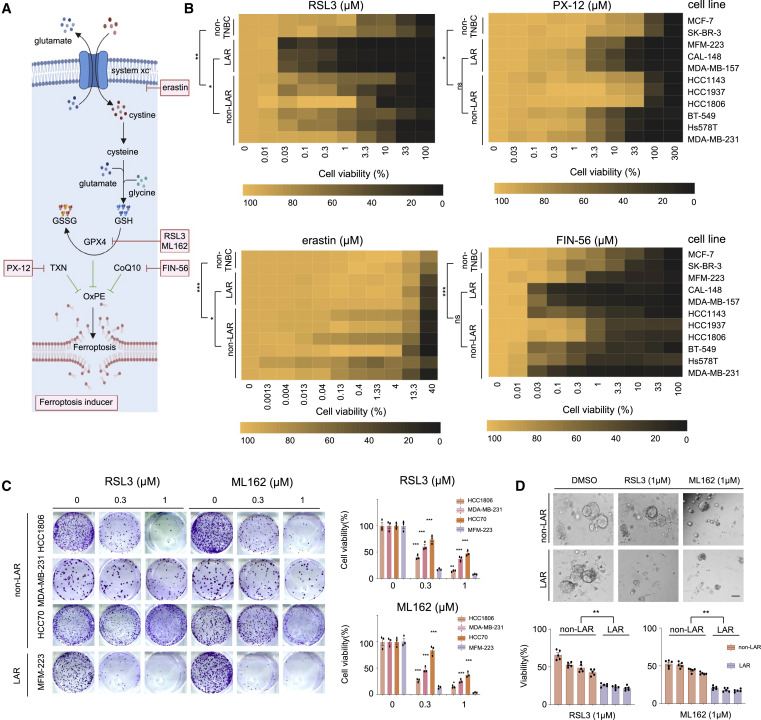
圖3. GPX4對多種鐵死亡誘導因子的敏感性突顯其在 LAR腫瘤中的重要性
4.AR 與 GPX4 啟動子結合并驅動其表達,是 LAR腫瘤中 GPX4 表達的關鍵調節因子
作者進行了整合基因組和轉錄組分析,并確定LAR特異性改變與GPX4表達之間的相關性(圖4A)。在LAR腫瘤中,GSEA證明了標志基因集中的幾種途徑的激活,如FA代謝、雄激素反應和過氧化物酶體途徑(圖4B)。基因組分析顯示,在LAR腫瘤中,磷脂酰肌醇-4,5-二磷酸3激酶(PI3K)信號通路、受體酪氨酸激酶(RTK)信號通路和絲裂原活化蛋白激酶(MAPK)通路的突變以及缺失9p21.3、9p24.2和18q11.2得到富集(圖4C)。Spearman相關分析顯示,FA代謝、膽汁酸代謝、雄激素反應、脂肪生成、膽固醇穩態、PI3K信號突變、MAPK信號突變、溶質載體家族1成員1 (SLC1A1)表達與GPX4表達呈正相關(圖4E)。
接下來,我們進行了實驗來驗證這些轉錄組和基因組改變對GPX4的影響。鑒于膽汁酸代謝、FA代謝、脂肪生成和膽固醇代謝密切與AR信號通路密切相關。測試了bicalutamide(一種AR抑制劑)、tamoxifen(一種雌激素受體調節劑)、apitolisb(一種PI3K抑制劑)、ulixertinib(一種MAPK抑制劑)和RSL3在蛋白水平上對GPX4表達的影響。在所有抑制劑中,只有AR抑制劑比卡魯胺和GPX4抑制劑RSL3明顯降低GPX4蛋白(圖4F)。此外,我們證實了AR在HEK293T細胞中的過表達導致GPX4 mRNA和蛋白水平表達降低,MDA-MB-453和MFM223在細胞中,抑制AR表達導致GPX4 mRNA和蛋白水平表達降低(圖4G和H)。接下來,我們探討了AR調控GPX4的機制。首先使用包含GPX4轉錄起始位點上游五個區域的瞬時轉染報告基因構建體進行轉錄分析Flag-AR共轉染后,只有2500至2000-bp區域上調熒光素酶信號(圖4I)。對該區域的AR結合位點進行掃描,確定了四個基序(圖4J)。這些基序的突變(ABS1/2/3/4-Del和all-ABSs-Del)阻斷了AR誘導的轉錄上調(圖4 K)。
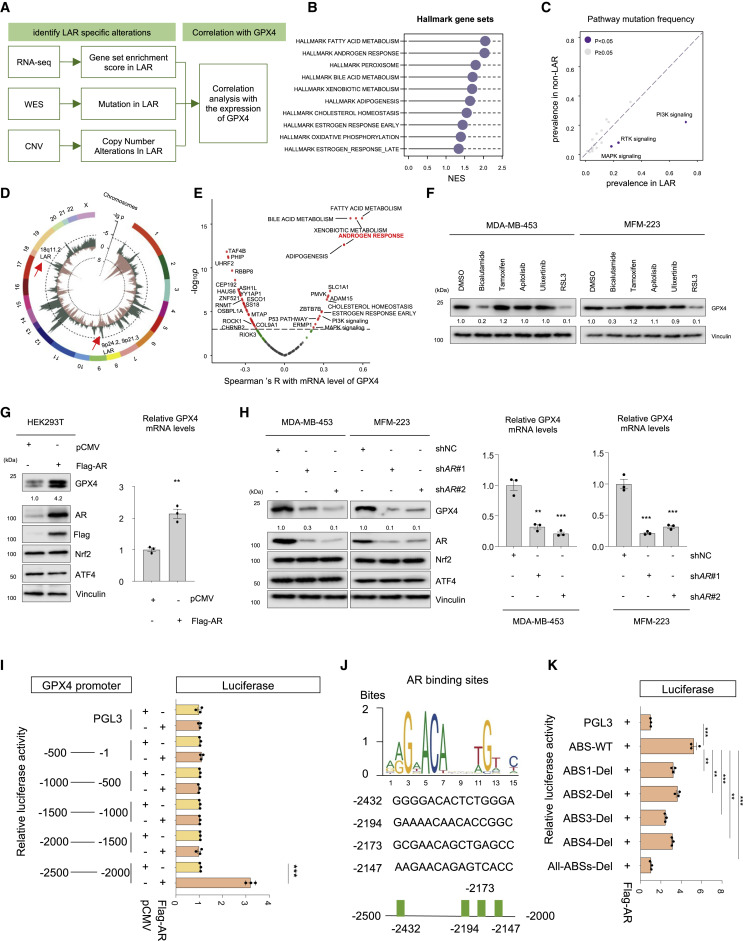
圖4. AR 與 GPX4 啟動子結合并驅動其表達,是 LAR腫瘤中 GPX4 表達的關鍵調節因子
5.對于 LAR患者,靶向 GPX4 是比靶向 AR 更好的策略
考慮到GPX4是LAR腫瘤鐵死亡的潛在抑制因子,AR驅動GPX4的表達,我們想知道AR抑制劑是否促進鐵死亡并作為LAR腫瘤患者的最佳治療方法。然而,AR抑制劑單藥治療或與PI3K抑制劑和CDK4/6抑制劑聯合使用在幾項臨床試驗中顯示出次優效果,包括MDV3100-11、TBCRC032和FUTURE試驗
這些數據表明,LAR腫瘤中的未知機制使它們在AR抑制后能夠逃避鐵死亡。接下來,作者確定了AR在LAR腫瘤細胞系鐵死亡中的作用。用比卡魯胺(靶向細胞核中的雄激素相關元件)、達魯胺(靶向 AR 核易位)、恩雜魯胺(靶向 AR 核易位)處理 MFM-223和MDA-MB-453細胞后,通過免疫印跡、脂質過氧化測定和 BODIPY 581/591 C11 染色分析了鐵死亡。(圖5A和5B)所示,GPX4抑制劑而不是AR抑制劑擴大了脂質過氧化水平并促進了鐵死亡。我們進一步探討了AR抑制劑在促進鐵死亡方面無效的可能機制。既往研究表明,AR可以通過下調2,4-二烯酰輔酶A還原酶(DECR1)來促進FA代謝,尤其是PUFA的積累,DECR1是一種直接雄激素抑制的基因,我們還驗證了 LAR 腫瘤中 DECR1和OxPE 1之間的負相關關系,以及通過在 LAR 細胞系中使用 AR 抑制劑來上調DECR1(圖5C和5D)。此外,我們驗證了MDA(脂質過氧化的生物標志物)在暴露于GPX4抑制劑而非AR抑制劑后上調(圖5C)。這些數據證明了AR在鐵死亡中的多重作用。一方面,AR可能促進PUFA生物合成,支持鐵死亡。另一方面,AR 可能上調 GPX4 的表達以清除鐵死亡過程中的脂質過氧化(圖 5E)。因此,GPX4 抑制(而非 AR 抑制)是刺激 LAR 腫瘤患者鐵死亡的最佳方法。
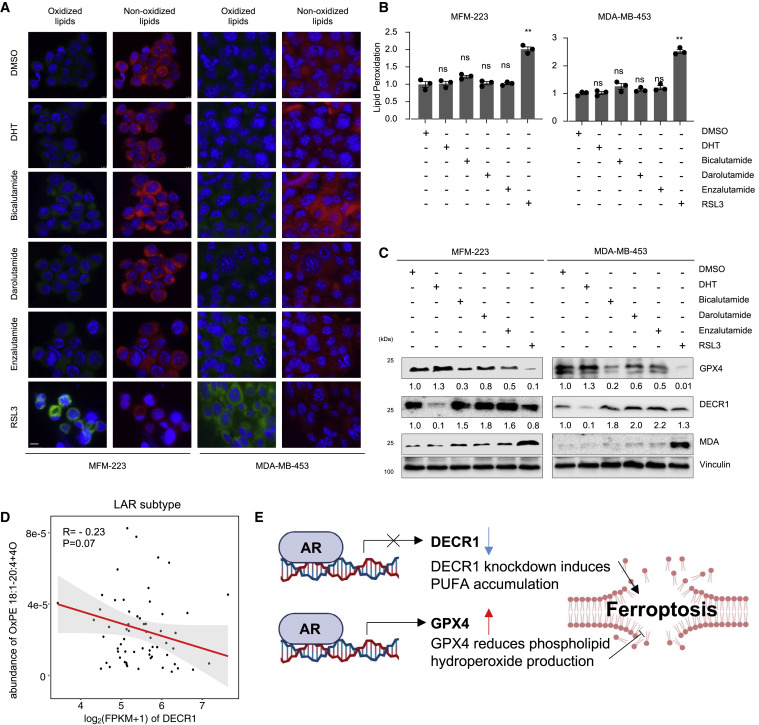
圖5. 對于 LAR患者,靶向 GPX4 是比靶向 AR 更好的策略
6.GPX4 抑制劑抑制腫瘤生長,并在體內重編程腫瘤微環境
接下來,我們進行了體內實驗,以探索基于亞型特異性鐵死亡活性的LAR腫瘤患者的治療策略。首先,在體內評估GPX4抑制劑在表達AR的TNBC腫瘤中的抗癌作用。我們選擇了小鼠 LAR 腫瘤細胞系 TS/A,因為該細胞系富含鐵死亡相關通路,并在我們最近的研究中被確定為 LAR 亞型( 圖6A). 我們在 TS/A 細胞中穩定表達 shGpx4 或 shNC,并通過注射建立原位模型5細胞進入小鼠(圖S5A)。注射有shNC細胞系的兩組小鼠用兩種不同的GPX4抑制劑處理,而其他組用DMSO作為對照處理(圖6B)。如圖 6C、6D、S5B 和 S5C 所示,敲低 Gpx4 表達或添加 GPX4 抑制劑顯著誘導腫瘤鐵死亡,但不誘導細胞凋亡。最近的研究表明,鐵死亡誘導的納米顆粒抑制腫瘤生長并增強抗癌免疫力。因此,作者研究了Gpx4 敲低或利用 GPX4 抑制劑對腫瘤微環境的影響。如圖 6D 所示,IHC 染色表明 GPX4 抑制有效導致藥物誘導的鐵死亡生物標志物 PTGS2、MDA 和 4-HNE 升高并募集CD3e細胞、CD4細胞、CD8細胞和CD86細胞,并減少CD206細胞的數量。相關性分析表明,GSH代謝與CD8 T細胞和M1巨噬細胞的比例呈負相關,但與M2巨噬細胞和靜息肥大細胞的比例呈正相關(圖6E)。CD3e T細胞是抗癌免疫中最重要的效應因子,包含 CD4 T 細胞和 CD8 T 細胞亞群。巨噬細胞是腫瘤微環境中的關鍵細胞,表現出殺瘤 M1 型和再生 M2 型表型。我們通過流式細胞術分析進一步評估了免疫反應。GPX4的抑制顯著增加了CD45細胞中CD3e細胞的比例、CD45 T細胞中CD4細胞的比例、CD45 T細胞中CD8細胞的比例、CD45細胞中CD11b F4/80細胞的比例以及CD45 CD11bF4/80細胞中CD86細胞的比例,同時降低了CD45CD11bF4/80細胞中CD206細胞的比例(圖6F)。我們還使用4T1細胞衍生的異種移植模型驗證了 GPX4 抑制劑對腫瘤微環境的影響,因為4T1被稱為免疫冷腫瘤模型。這些數據表明,抑制LAR腫瘤中GPX4的表達可顯著促進鐵死亡,減緩腫瘤生長,并觸發腫瘤微環境獲得炎癥表型。
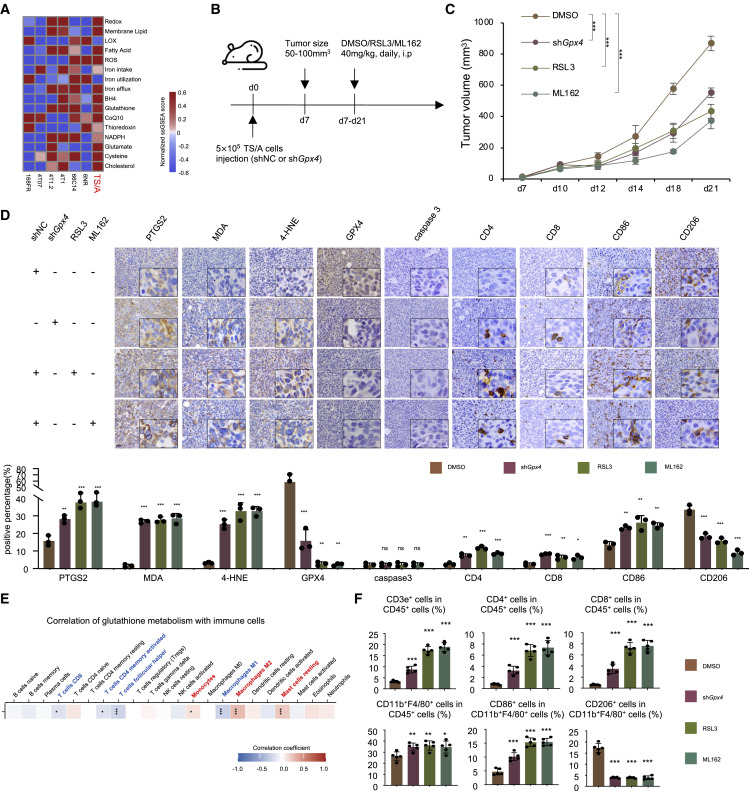
7.GPX4 抑制劑聯合 ICB 有效治療類似 LAR 的腫瘤
為了測試GPX4抑制劑和免疫療法是否發揮協同作用,我們通過注射5×10來建立TS / A異種移植腫瘤5將TS / A小鼠乳腺癌細胞系放入每只小鼠中,并用GPX4抑制劑或DMSO加阻斷PD-1處理小鼠(圖7A)。與單藥治療相比,GPX4抑制劑和抗PD-1抗體聯合治療可顯著抑制腫瘤生長(圖7B)。此外,我們利用流式細胞術分析了治療后腫瘤的免疫反應。與單藥治療相比,聯合治療不會導致額外的免疫細胞浸潤。然而,流式細胞術的結果表明,聯合療法誘導了明顯的免疫反應,增加了PRF1CD8 T細胞和GZMBCD8 T細胞的比例(圖7C)。
接下來,作者研究了兩個隊列中LAR亞型對GSH代謝的抑制作用是否與ICB的臨床反應相關。在 I-SPY2 隊列中,21例 TNBC患者接受了新輔助免疫治療,并進行了轉錄組學分析具有較高AR表達的TNBC顯示出增強的鐵代謝,不飽和FA代謝和GSH代謝活性(圖7E)。我們驗證了GSH代謝與腫瘤炎癥特征、STAT1特征、IFN-γ特征、PD-1表達、PD-L1表達和M1型巨噬細胞比例呈負相關,但與AR高TNBC腫瘤中M2型巨噬細胞比例呈正相關(圖7F)。此外,GSH代謝的增加與AR高亞組缺乏病理完全緩解(pCR)有關(圖7G)。在TNBC小鼠模型中的另一組抗PD1和抗CTLA-4聯合治療中,我們注意到類似的結果。具有較高AR表達的腫瘤也顯示出與LAR腫瘤相似的生物學特征(圖7H和7I)。在第一個隊列中,GSH代謝與AR高亞組中的免疫相關生物標志物呈負相關(圖7J)。通過將 GPX4 表達與單個小鼠細胞系對免疫治療的反應進行比較,我們發現 ICB 耐藥組表達 GPX4 的水平更高(圖7K)。總之,我們的研究表明,GPX4抑制劑與ICB的聯合治療在生物學特征上類似于LAR的腫瘤是最佳療法。
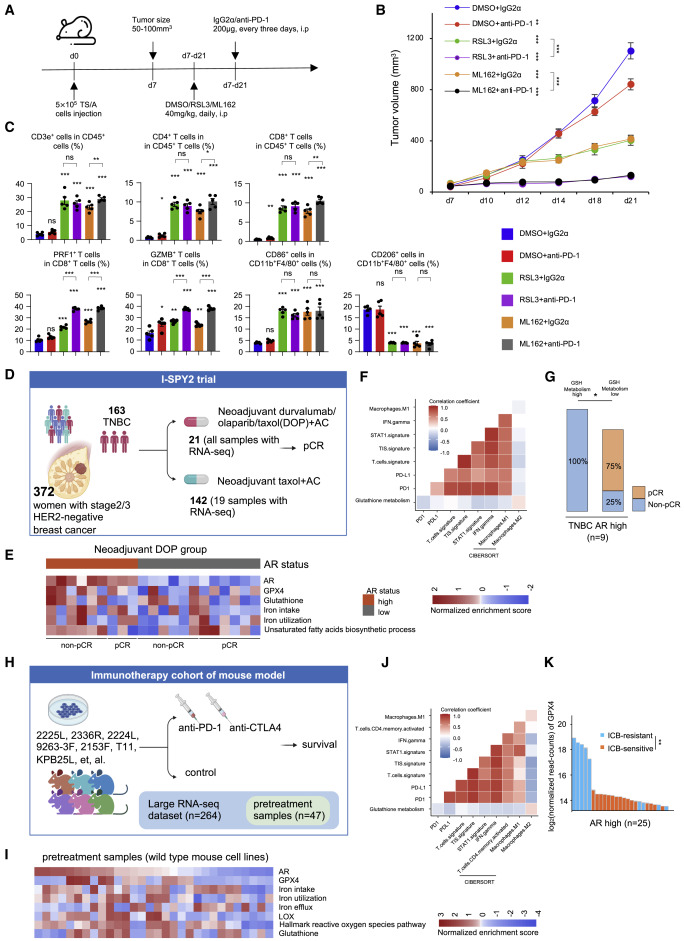
圖7.GPX4 抑制劑聯合 ICB 有效治療類似 LAR 的腫瘤
結論:
總之,該研究展示了TNBC的鐵死亡的高度異質性,并揭示了難治性LAR腫瘤的一種新型免疫治療聯合策略,將有望給LAR型TNBC患者帶來新希望。該研究提出通過多組學融合分析全面揭示鐵死亡特征和鑒定關鍵調控因子的思路,是研究腫瘤鐵死亡的新模式,在腫瘤鐵死亡研究和TNBC臨床治療領域均具有重要意義。
實驗方法:
異種移植模型、類器官培養、基因集富集分析(GSEA)、載體構建、轉染、免疫印跡分析、實時熒光定量PCR(qPCR)和ChIP–qPCR、脂質過氧化試驗、GSH/GSSG比值測定、鐵測定、熒光素酶檢測、流式細胞術分析、免疫組化染色和H&E染色。
參考文獻:
Yang F, Xiao Y, Ding JH, et al. Ferroptosis heterogeneity in triple-negative breast cancer reveals an innovative immunotherapy combination strategy. Cell Metab. 2023;35(1):84-100.e8.






