hsa_circ_0007919增強(qiáng)胰腺導(dǎo)管腺癌DNA損傷應(yīng)答,促進(jìn)吉西他濱耐藥
circRNAs在癌癥和化療耐藥的發(fā)生和發(fā)展中發(fā)揮著重要作用。DNA損傷修復(fù)有助于癌細(xì)胞的增殖和對(duì)化療誘導(dǎo)的細(xì)胞凋亡的抵抗。然而,circRNA在DNA損傷修復(fù)調(diào)控中的作用需要澄清。我們?cè)谀?span>GEM的PDAC組織和細(xì)胞中發(fā)現(xiàn)了高表達(dá)的circRNA hsa_circ_0007919。hsa_circ_0007919的高表達(dá)與PDAC患者較差的總生存期(OS)和無(wú)病生存期(DFS)相關(guān)。Hsa_circ_0007919以依賴LIG1的方式抑制GEM誘導(dǎo)的DNA損傷、DNA斷裂積累和細(xì)胞凋亡,維持細(xì)胞存活。機(jī)制上,hsa_circ_0007919招募FOXA1和TET1降低LIG1啟動(dòng)子的甲基化并增加其轉(zhuǎn)錄,進(jìn)一步促進(jìn)堿基切除修復(fù)、錯(cuò)配修復(fù)和核苷酸切除修復(fù)。最后,我們發(fā)現(xiàn)GEM增強(qiáng)了QKI與hsa_circ_0007919 pre-mRNA內(nèi)含子的結(jié)合以及該pre-mRNA的剪接和環(huán)狀化,從而生成hsa_circ_0007919。Hsa_circ_0007919通過(guò)以依賴LIG1的方式增強(qiáng)DNA損傷修復(fù)以維持細(xì)胞存活,從而促進(jìn)GEM耐藥。靶向hsa_circ_0007919和DNA損傷修復(fù)途徑可能是PDAC的治療策略。本文于2023年12月發(fā)表于“Molecular Cancer”(IF=37.3)上。
技術(shù)路線

結(jié)果:
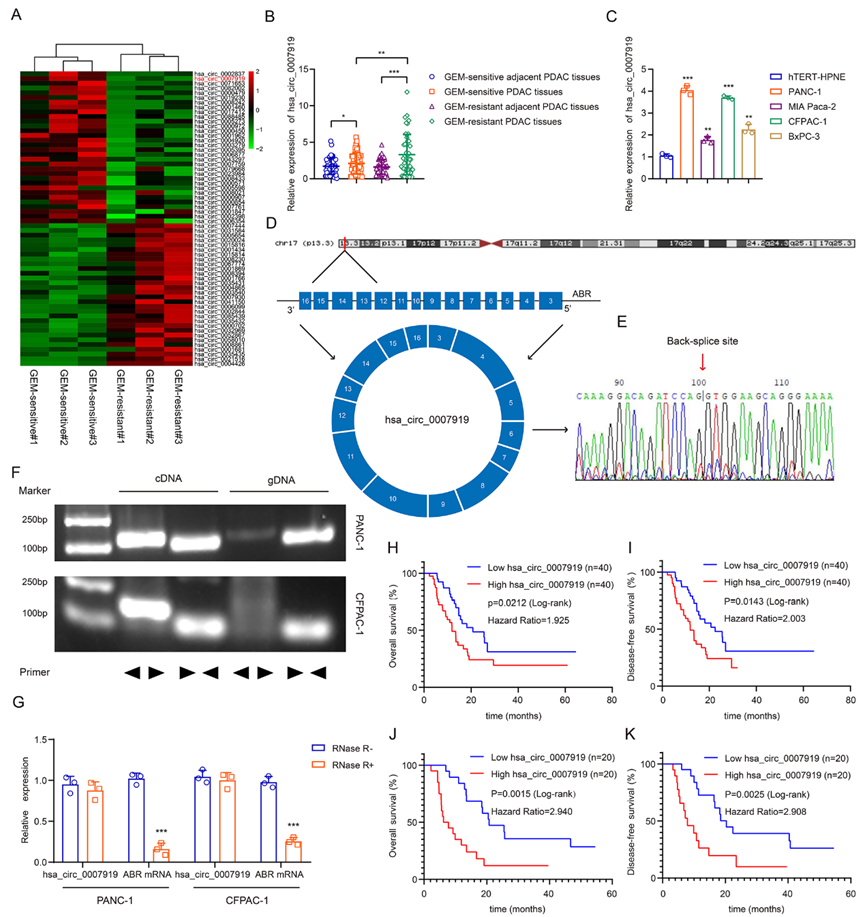
1)hsa_circ_0007919在GEM耐藥PDAC中表達(dá)上調(diào),預(yù)測(cè)預(yù)后不良
我們進(jìn)行了下一代測(cè)序,以鑒定導(dǎo)致GEM耐藥的環(huán)狀RNA。共有62個(gè)circRNA差異表達(dá),與GEM敏感組織相比,hsa_circ_0007919在GEM耐藥PDAC組織中顯著上調(diào)(圖1A)。然后,我們測(cè)量了50對(duì)非GEM耐藥PDAC組織及鄰近組織和45對(duì)GEM耐藥PDAC組織及相關(guān)鄰近組織中hsa_circ_0007919的表達(dá)。結(jié)果顯示,與GEM敏感的PDAC組織相比,hsa_circ_0007919在GEM耐藥PDAC組織中的表達(dá)明顯上調(diào)(圖1B)。hsa_circ_0007919在PDAC細(xì)胞中表達(dá)增加,包括PANC-1、CFPAC-1、BxPC-3和MIA-Paca2,其表達(dá)水平在PANC-1和CFPAC-1細(xì)胞中相對(duì)較高(圖1C)。接下來(lái),我們?cè)u(píng)估了hsa_circ_0007919的結(jié)構(gòu),該結(jié)構(gòu)來(lái)源于ABR基因的外顯子3-16,并通過(guò)Sanger-seq驗(yàn)證了hsa_circ_0007919的環(huán)狀位點(diǎn)(圖1D-1E)。我們還設(shè)計(jì)了發(fā)散型和收斂型引物來(lái)檢測(cè)hsa_circ_0007919在cDNA和gDNA中的表達(dá)。結(jié)果表明,hsa_circ_0007919可以從cDNA中擴(kuò)增出來(lái),但不能從gDNA中擴(kuò)增出來(lái)(圖1F), hsa_circ_0007919對(duì)RNase R外切酶酶切的抗性證實(shí)了它確實(shí)是環(huán)狀的(圖1G)。最后,我們利用臨床組織樣本數(shù)據(jù)分析hsa_circ_0007919表達(dá)與臨床病理特征的相關(guān)性。我們分析hsa_circ_0007919表達(dá)與GEM耐藥患者總生存期(OS)和無(wú)病生存期(DFS)的關(guān)系顯示,hsa_circ_0007919高表達(dá)預(yù)示較差的OS和DFS (圖1H-1I)。此外,我們將40例GEM治療的PDAC患者分為hsa_circ_0007919高表達(dá)和低表達(dá)兩組,發(fā)現(xiàn)hsa_circ_0007919高表達(dá)同樣預(yù)測(cè)較差的OS和DFS(圖1J-1K)。
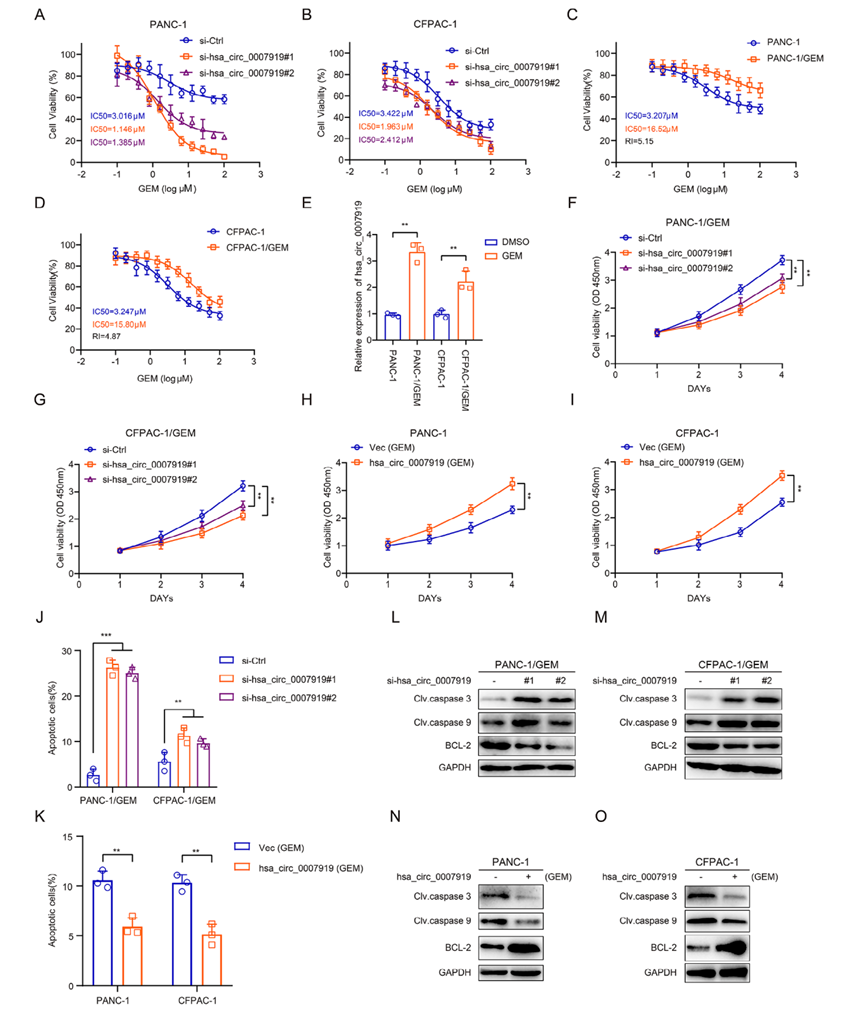
2)hsa_circ_0007919抑制DNA損傷和吉西他濱敏感性
由于hsa_circ_0007919在GEM耐藥PDAC組織中表達(dá)上調(diào),我們研究了它在GEM耐藥細(xì)胞中的功能。首先,我們?cè)?span>PDAC細(xì)胞中沉默了hsa_circ_0007919,發(fā)現(xiàn)抑制hsa_circ_0007919增加了GEM的敏感性(圖2A-2B)。然后,我們構(gòu)建了GEM耐藥PDAC細(xì)胞系PANC-1/GEM和CFPAC-1/GEM(圖2C-2D),發(fā)現(xiàn)hsa_circ_0007919在這些GEM耐藥細(xì)胞中高表達(dá)(圖2E)。我們?cè)俅卧谶@兩種GEM耐藥細(xì)胞系中沉默hsa_circ_0007919,并在GEM處理的正常PANC-1和CFPAC-1細(xì)胞中過(guò)表達(dá)hsa_circ_0007919 (圖2C-2D)。CCK-8實(shí)驗(yàn)、FCM實(shí)驗(yàn)和DNA Ladder實(shí)驗(yàn)結(jié)果表明,沉默hsa_circ_0007919可降低細(xì)胞增殖,增加細(xì)胞凋亡,而過(guò)表達(dá)hsa_circ_0007919則相反(圖2F-2K)。與凋亡實(shí)驗(yàn)結(jié)果一致,hsa_circ_0007919沉默增加了cleaved caspase 3和cleaved caspase 9的水平,降低了BCL2的表達(dá),而hsa_circ_0007919過(guò)表達(dá)降低了cleaved caspase 3 and cleaved caspase 9的水平,增加了BCL2水平(圖2L-2O)。GEM作為一種嘧啶類抗代謝藥物,可誘導(dǎo)單基損傷并導(dǎo)致DNA斷裂,因此我們?cè)u(píng)估了hsa_circ_0007919對(duì)DNA損傷的影響,發(fā)現(xiàn)hsa_circ_0007919沉默增加了單細(xì)胞凝膠電泳尾部和細(xì)胞核中γ-H2AX的積累,而hsa_circ_0007919過(guò)表達(dá)降低了這些參數(shù)(圖3A, 3B)。最后,我們?cè)诼闶笊砩辖惙N移植模型,發(fā)現(xiàn)沉默hsa_circ_0007919的PANC-1/GEM和PANC-1/GEM細(xì)胞形成的腫瘤體積和重量比對(duì)照細(xì)胞形成的腫瘤體積和重量都減少(圖3C-3G)。IHC、TUNEL和qPCR結(jié)果顯示,沉默hsa_circ_0007919可降低Ki-67的表達(dá),增加caspase3和γ-H2AX的表達(dá)和細(xì)胞凋亡(圖3H-3J)。這些結(jié)果表明,hsa_circ_0007919通過(guò)減少DNA損傷促進(jìn)PDAC細(xì)胞增殖和減少細(xì)胞凋亡,從而增強(qiáng)PDAC細(xì)胞的GEM耐藥性。
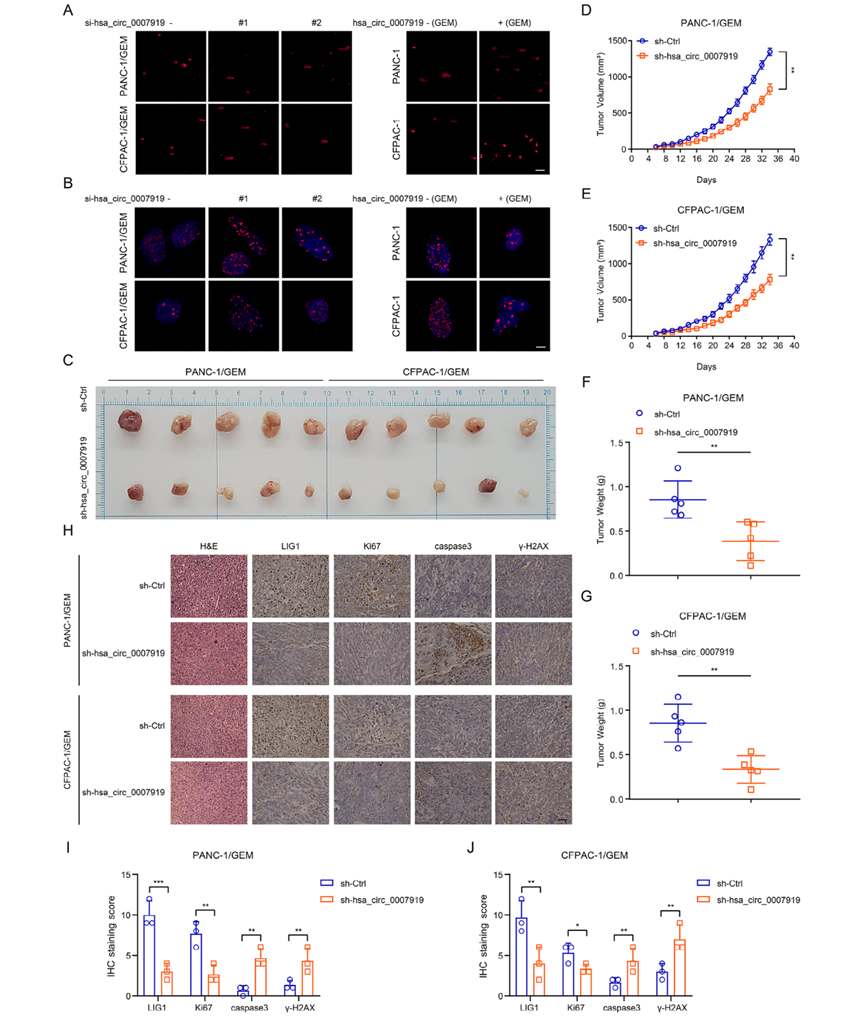
3)hsa_circ_0007919通過(guò)LIG1介導(dǎo)的修復(fù)途徑抑制DNA損傷
為了證實(shí)hsa_circ_0007919如何抑制DNA損傷并影響GEM敏感性,我們通過(guò)RNA-seq鑒定了hsa_circ_0007919沉默的PANC-1/GEM細(xì)胞與對(duì)照細(xì)胞的差異表達(dá)基因。有520個(gè)上調(diào)基因和219個(gè)下調(diào)基因(圖4A), KEGG分析和GSEA顯示,這些基因在多種DNA損傷修復(fù)途徑中富集,包括堿基切除修復(fù)、錯(cuò)配修復(fù)和核苷酸切除修復(fù)(圖4B-4E)。LIG1是所有這些通路中共有的下調(diào)幅度最大的基因(圖4F)。LIG1是DNA連接酶家族的一員,據(jù)報(bào)道,在幾乎所有DNA損傷修復(fù)途徑中,LIG1都在DNA重組中發(fā)揮重要作用。因此,我們測(cè)量了LIG1的表達(dá),發(fā)現(xiàn)與正常PDAC組織相比,LIG1在GEM耐藥PDAC組織中也高表達(dá),并且與hsa_ circ_0007919在PDAC組織中的表達(dá)呈正相關(guān)(圖4G–4I)。在hsa_circ_0007919沉默后,LIG1的mRNA和蛋白表達(dá)水平降低,而當(dāng)hsa_circ_0007919過(guò)表達(dá)時(shí),LIG1的mRNA和蛋白表達(dá)水平升高(圖4J-4M)。這些結(jié)果表明,hsa_circ_0007919誘導(dǎo)LIG1表達(dá)激活DNA損傷修復(fù)途徑,增強(qiáng)PDAC細(xì)胞對(duì)GEM的抗性。
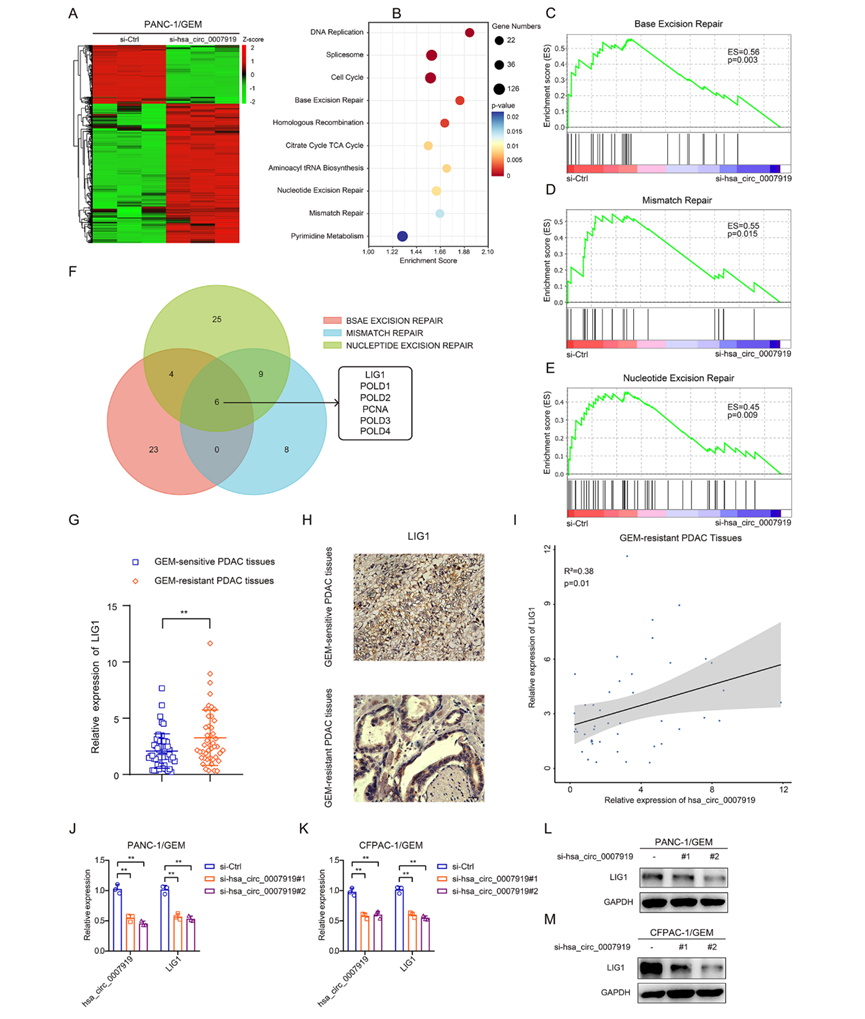
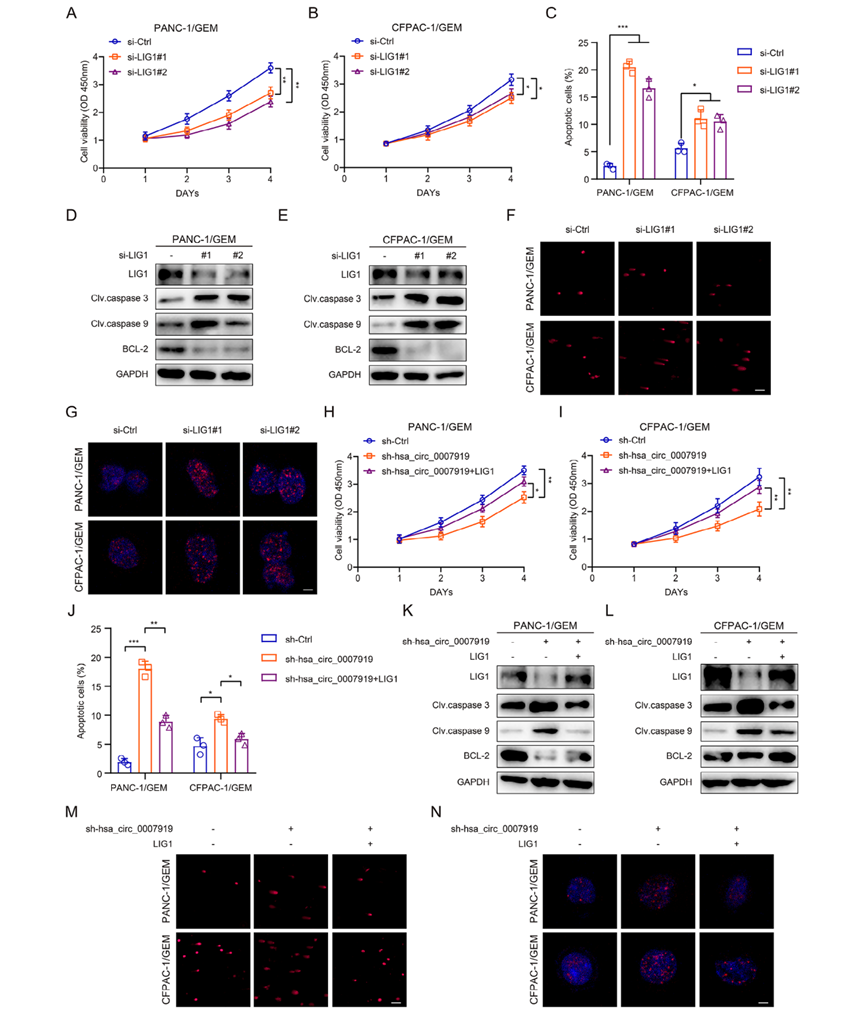
4)LIG1逆轉(zhuǎn)了hsa_circ_0007919對(duì)細(xì)胞增殖、凋亡和DNA損傷的影響
為了證實(shí)LIG1是hsa_circ_0007919的下游靶點(diǎn),我們研究了LIG1在GEM耐藥PDAC細(xì)胞中的作用,發(fā)現(xiàn)沉默LIG1導(dǎo)致增殖減少,細(xì)胞凋亡和DNA損傷增加(圖5A-5G)。此外,我們進(jìn)一步在hsa_circ_0007919沉默穩(wěn)定的PANC-1/GEM和PANC-1/GEM細(xì)胞中過(guò)表達(dá)LIG1,發(fā)現(xiàn)LIG1過(guò)表達(dá)逆轉(zhuǎn)了hsa_circ_0007919沉默影響的細(xì)胞增殖、凋亡和DNA損傷(圖5H-5N)。這些結(jié)果表明,hsa_circ_0007919通過(guò)增加LIG1的表達(dá),促進(jìn)細(xì)胞增殖,減少細(xì)胞凋亡和DNA損傷。
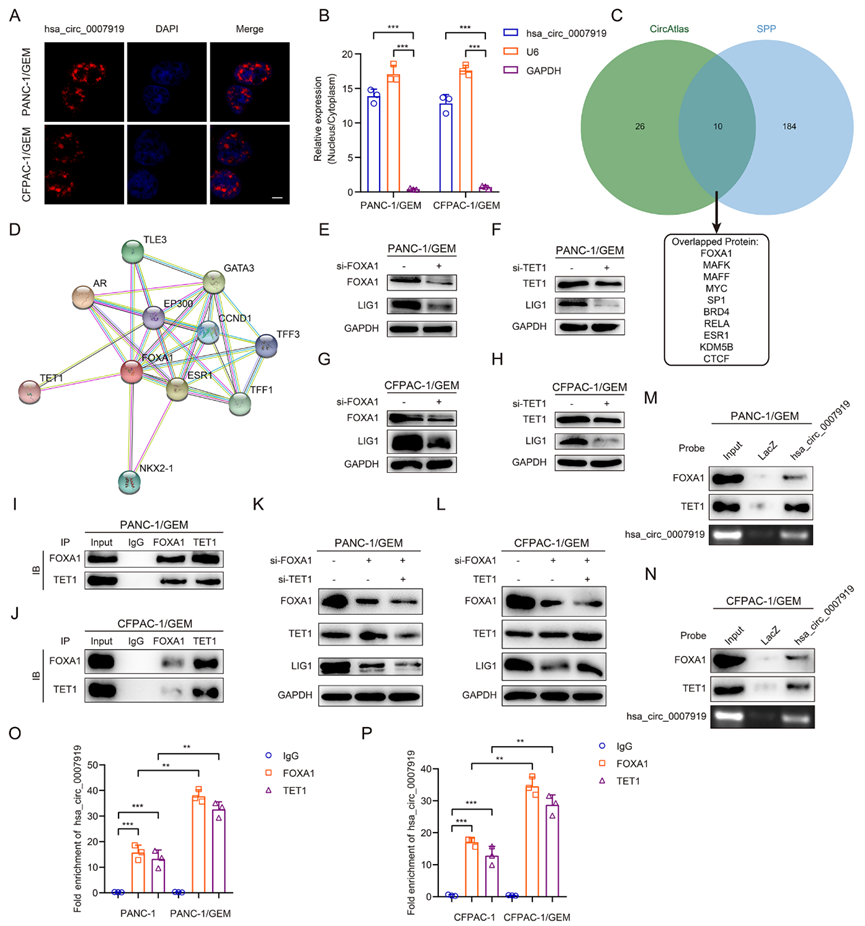
5)hsa_circ_0007919結(jié)合FOXA1和TET1促進(jìn)LIG1轉(zhuǎn)錄
為了研究hsa_circ_0007919如何增加LIG1的表達(dá),我們進(jìn)行了FISH和核細(xì)胞質(zhì)RNA分離實(shí)驗(yàn),結(jié)果顯示hsa_circ_0007919主要分布在細(xì)胞核中(圖6A-6B)。我們使用circAtlas 2.0和ENCORI數(shù)據(jù)庫(kù)確定了與hsa_circ_0007919結(jié)合的蛋白和與LIG1 mRNA結(jié)合的蛋白之間的重疊,但無(wú)法識(shí)別任何重疊蛋白。然后,我們使用circAtlas 2.0和SPP數(shù)據(jù)庫(kù)確定了與hsa_circ_0007919結(jié)合的蛋白質(zhì)和與LIG1啟動(dòng)子結(jié)合的蛋白質(zhì)之間的重疊,FOXA1被確認(rèn)為蛋白質(zhì)最重要的重疊(圖6C)。我們進(jìn)一步預(yù)測(cè),可能還有其他蛋白質(zhì)與FOXA1一起起作用,并鑒定出與FOXA1結(jié)合的TET1 (圖6D)。由于FOXA1在多種癌癥中作為轉(zhuǎn)錄啟動(dòng)子,而TET1作為DNA甲基化酶降低各種基因啟動(dòng)子的甲基化水平并增強(qiáng)其轉(zhuǎn)錄,我們預(yù)測(cè)hsa_circ_0007919結(jié)合FOXA1和TET1促進(jìn)LIG1的轉(zhuǎn)錄。我們首先沉默FOXA1和TET1,發(fā)現(xiàn)LIG1的表達(dá)降低(圖6E-6H),co-IP實(shí)驗(yàn)的結(jié)果證實(shí)了FOXA1和TET1在GEM耐藥細(xì)胞中的相互作用(圖6I-6J)。同時(shí),我們?cè)?span>FOXA1沉默的GEM耐藥細(xì)胞中沉默TET1,發(fā)現(xiàn)TET1可以增強(qiáng)FOXA1沉默對(duì)LIG1的抑制能力,而過(guò)表達(dá)TET1可以部分逆轉(zhuǎn)FOXA1沉默對(duì)LIG1的抑制能力,這表明FOXA1和TET1在調(diào)節(jié)LIG1中發(fā)揮協(xié)同作用(圖6K-6L)。然后,我們進(jìn)行了ChIRP分析,發(fā)現(xiàn)hsa_ circ_0007919可以結(jié)合FOXA1和TET1(圖6M, 6N)。此外,我們使用RIP實(shí)驗(yàn)證實(shí)FOXA1和TET1可以與hsa_circ_0007919相互作用,且這種相互作用在GEM耐藥細(xì)胞中得到增強(qiáng)(圖6O-6P)。
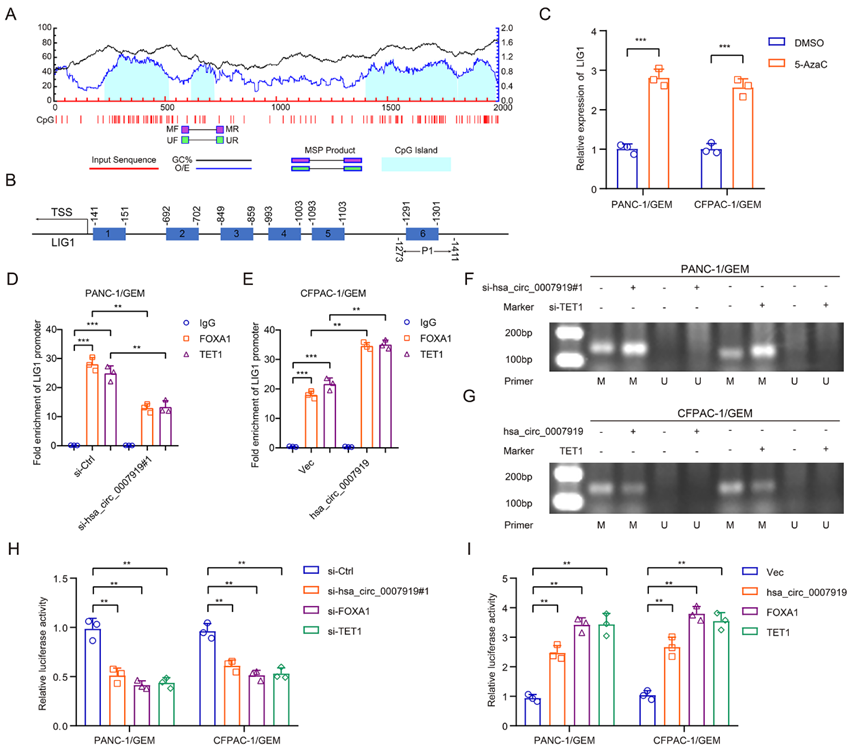
為了研究FOXA1、TET1與LIG1啟動(dòng)子之間的相互作用,我們使用JASPAR數(shù)據(jù)庫(kù)分析了FOXA1與LIG1啟動(dòng)子之間的結(jié)合位點(diǎn),并使用MethPrimer 2.0數(shù)據(jù)庫(kù)預(yù)測(cè)了LIG1啟動(dòng)子中的CpG島。在JASPAR鑒定的6個(gè)位點(diǎn)和4個(gè)預(yù)測(cè)的CpG島中,我們發(fā)現(xiàn)LIG1啟動(dòng)子的位點(diǎn)6富集程度最高,因此我們選擇了- 1411至-1273區(qū)域(P1)進(jìn)行進(jìn)一步研究(圖7A-7B),我們發(fā)現(xiàn)5-AzaC處理增加了GEM耐藥細(xì)胞中LIG1的表達(dá)(圖7C)。ChIP實(shí)驗(yàn)結(jié)果顯示FOXA1和TET1結(jié)合到LIG1啟動(dòng)子區(qū)域P1。抑制hsa_circ_0007919降低了這種結(jié)合能力(圖7D)。MS-PCR檢測(cè)結(jié)果顯示,沉默hsa_circ_0007919或TET1會(huì)增加LIG1啟動(dòng)子中的DNA甲基化水平(圖7F),而過(guò)表達(dá)hsa_circ_0007919或TET1具有相反的效果(圖7E和7G)。此外,我們建立了一個(gè)熒光素酶報(bào)告基因?qū)嶒?yàn),發(fā)現(xiàn)沉默hsa_circ_0007919、FOXA1或TET1會(huì)降低LIG1啟動(dòng)子的轉(zhuǎn)錄活性,而過(guò)表達(dá)hsa_circ_0007919、FOXA1或TET1會(huì)增強(qiáng)LIG1的轉(zhuǎn)錄活性(圖7H -7I)。這些結(jié)果表明hsa_circ_0007919通過(guò)結(jié)合FOXA1和TET1增強(qiáng)了LIG1的轉(zhuǎn)錄。
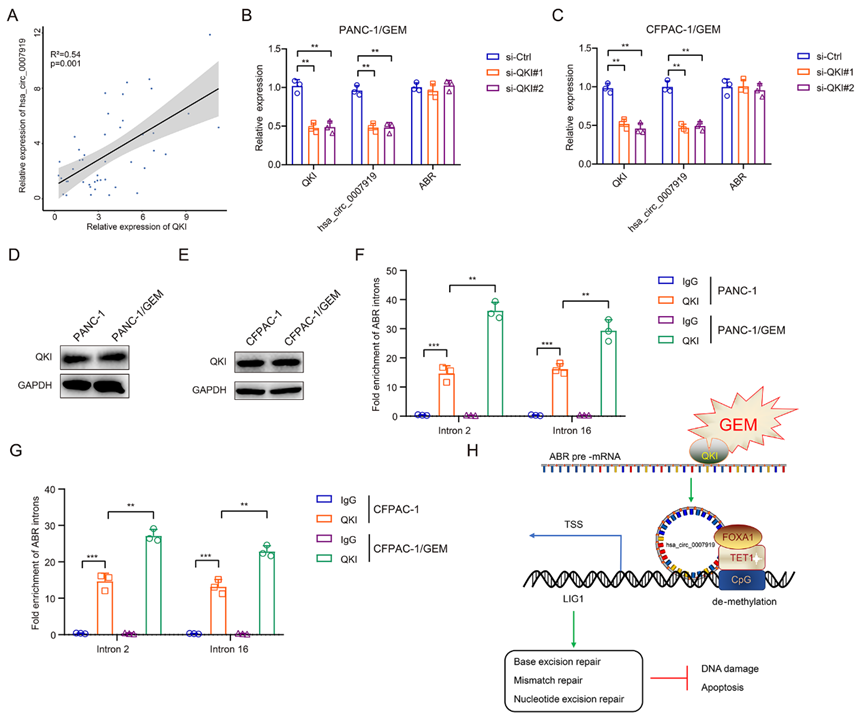
6)吉西他濱通過(guò)增強(qiáng)QKI介導(dǎo)的反向剪接誘導(dǎo)hsa_circ_0007919表達(dá)
研究表明,在circRNA合成過(guò)程中,有多種蛋白質(zhì)參與了反向剪接過(guò)程。在幾個(gè)公認(rèn)的調(diào)控因子中,有報(bào)道稱QKI和FUS可以促進(jìn)環(huán)狀RNA的形成,而ADAR1則起到相反的作用。為了探究hsa_circ_0007919高表達(dá)的原因,我們分析了上述蛋白與hsa_circ_0007919在耐藥PDAC組織中的表達(dá)相關(guān)性,發(fā)現(xiàn)QKI與hsa_circ_0007919表達(dá)呈正相關(guān),FUS與hsa_circ_0007919表達(dá)相關(guān)性較低,ADAR1與hsa_circ_0007919表達(dá)呈負(fù)相關(guān)(圖8A)。因此,我們預(yù)測(cè)QKI可以促進(jìn)hsa_circ_0007919的形成。我們?cè)?span>GEM耐藥PDAC細(xì)胞中沉默QKI,發(fā)現(xiàn)hsa_circ_0007919的表達(dá)下調(diào),但hsa_circ_0007919宿主基因ABR的表達(dá)不受影響(圖8B-8C);此外,QKI的表達(dá)在正常PDAC細(xì)胞和抗GEM PDAC細(xì)胞之間沒(méi)有差異(圖8D-E8)。據(jù)報(bào)道,QKI在其pre-mRNA中與環(huán)狀RNA外顯子側(cè)翼的內(nèi)含子相互作用。我們?cè)O(shè)計(jì)了ABR內(nèi)含子2和16的引物,發(fā)現(xiàn)QKI可以在PDAC細(xì)胞中與這兩個(gè)內(nèi)含子結(jié)合,并且這種相互作用在耐GEM的PDAC細(xì)胞中得到增強(qiáng)(圖8F-8G)。綜上所述,本研究表明GEM增強(qiáng)QKI介導(dǎo)的hsa_circ_0007919剪接和循環(huán)化,以及hsa_circ_0007919招募FOXA1和TET1來(lái)調(diào)節(jié)LIG1轉(zhuǎn)錄和DNA損傷修復(fù)途徑,從而有助于抵抗GEM誘導(dǎo)的PDAC細(xì)胞DNA損傷和凋亡(圖8H)。
結(jié)論:我們的研究結(jié)果表明hsa_circ_0007919可以促進(jìn)DNA損傷修復(fù)以對(duì)抗GEM治療。機(jī)制上,hsa_circ_0007919招募FOXA1和TET1促進(jìn)LIG1轉(zhuǎn)錄,激活堿基切除修復(fù)、錯(cuò)配修復(fù)和核苷酸切除修復(fù)途徑,改善DNA損傷,抑制GEM誘導(dǎo)的細(xì)胞凋亡。此外,GEM處理增強(qiáng)了QKI和ABR pre-mRNA之間的相互作用,以反向剪接依賴的方式導(dǎo)致hsa_circ_0007919增加生物發(fā)生。我們的發(fā)現(xiàn)可能有助于了解GEM耐藥的機(jī)制,并制定化療耐藥PDAC的治療策略。
實(shí)驗(yàn)方法:qRT-PCR,CCK-8,流式,WB,免疫熒光,IHC,動(dòng)物實(shí)驗(yàn),TUNEL,GSEA,FISH,ChIRP,Co-IP,RIP,ChIP,MS-PCR,熒光素酶報(bào)告試驗(yàn)。
參考文獻(xiàn):Xu L, Ma X, Zhang X, Zhang C, Zhang Y, Gong S, Wu N, Zhang P, Feng X, Guo J, Zhao M, Ren Z, Zhang P. hsa_circ_0007919 induces LIG1 transcription by binding to FOXA1/TET1 to enhance the DNA damage response and promote gemcitabine resistance in pancreatic ductal adenocarcinoma. Mol Cancer. 2023 Dec 4;22(1):195. doi: 10.1186/s12943-023-01887-8.






