外泌體lncAKR1C2編碼的微蛋白通過調節脂肪酸代謝促進胃癌淋巴結轉移
淋巴結轉移(Lymph node metastasis, LNM)是胃癌傳播的重要途徑,常導致腫瘤進展,胃癌預后較差。盡管外泌體lncRNAs已被報道參與腫瘤的發展,但分泌的lncRNAs是否可以在受體細胞中編碼肽仍然未知。在這里,我們發現了一個外泌體lncRNA (lncAKR1C2),它在臨床上以不依賴于VEGF的方式與胃癌的淋巴結轉移相關。胃癌細胞分泌的Exo-lncAKR1C2在體內可促進淋巴內皮細胞的管狀形成和遷移,促進淋巴管生成和淋巴轉移。通過比較LN轉移灶與原發病灶的代謝特點,我們發現胃癌LN轉移灶具有較高的脂質代謝活性。此外,外泌體lncAKR1C2在淋巴內皮細胞中編碼一種微蛋白(pep-AKR1C2),并通過調節YAP磷酸化促進CPT1A的表達,從而增強脂肪酸氧化(FAO)和ATP的產生。這些發現強調了LNM的新機制,并提示外泌體lncAKR1C2編碼的微蛋白可作為晚期胃癌的治療靶點。本文于2023年10月發表于“Cell Death and Disease”(IF=9.0)上。
技術路線

結果
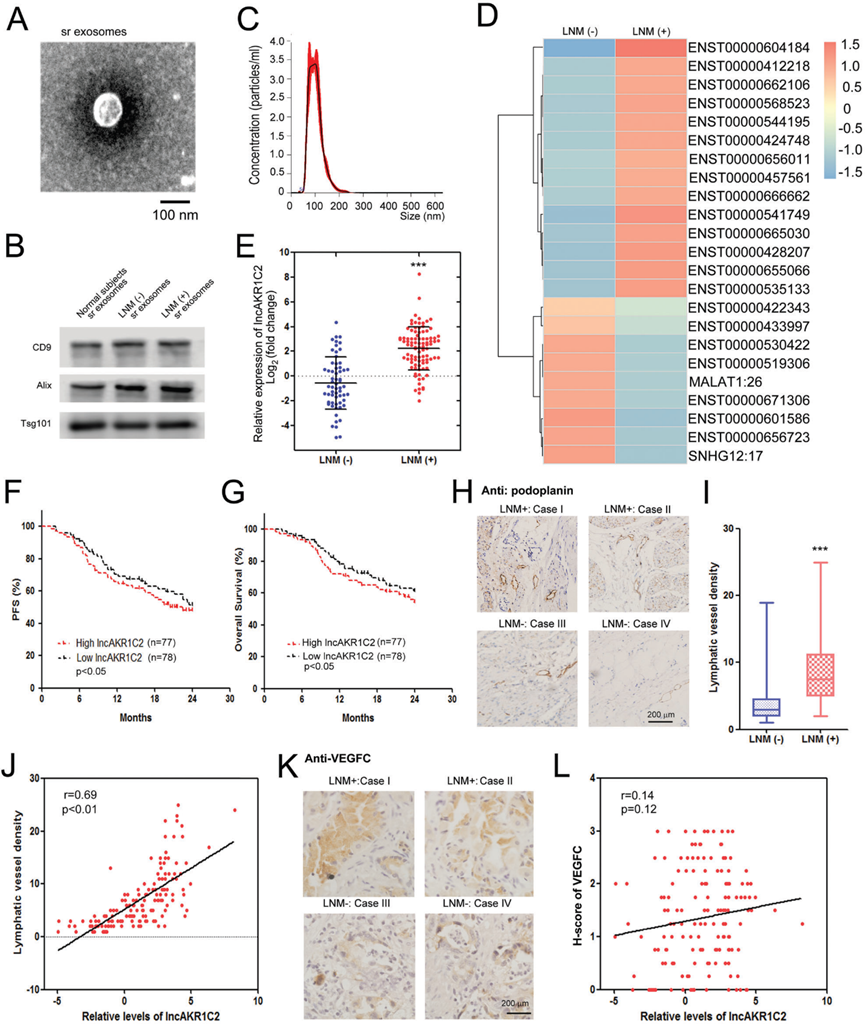
1)外泌體lncAKR1C2與胃癌淋巴結轉移呈正相關
為了確定與LNM相關的外泌體lncRNA,我們在手術前分離II/III期GC患者的血清外泌體,并進行lncRNA-seq。通過透射電鏡觀察LNM-組和LNM+組的外泌體(圖1A),并通過WB分析檢測外泌體標志物CD9、Tsg101和Alix(圖1 B)。外泌體的大小通過納米跟蹤分析確定,這些血清外泌體的直徑約為30-150 nm(圖1C)。高通量測序結果顯示,與沒有LNM的患者相比,LNM+組的一系列外泌體lncRNAs發生了顯著變化。lncRNA ENST00000604184 (lncAKR1C2)的表達量最高(圖1D)。擴大樣本的進一步檢測結果證實,與LNM-組相比,LNM+組的exo-lncAKR1C2表達量上調了8倍以上(圖1E)。Kaplan-Meier分析顯示,高水平的lncAKR1C2可預測較短的無進展生存期(PFS)(圖1F)和總生存期(OS)(圖1G)。使用anti-podoplanin抗體的免疫組化分析表明,LNM患者的淋巴管密度要高得多(圖1H, 1I),lncAKR1C2水平與淋巴管密度呈正相關(圖1 G)。盡管在胃癌合并LNM患者中VEGFC也上調(圖1K),但VEGFC與lncAKR1C2之間沒有顯著相關性(圖1L)。這些結果表明外泌體lncAKR1C2與胃癌中LNM相關,該過程可能不依賴于VEGFC。
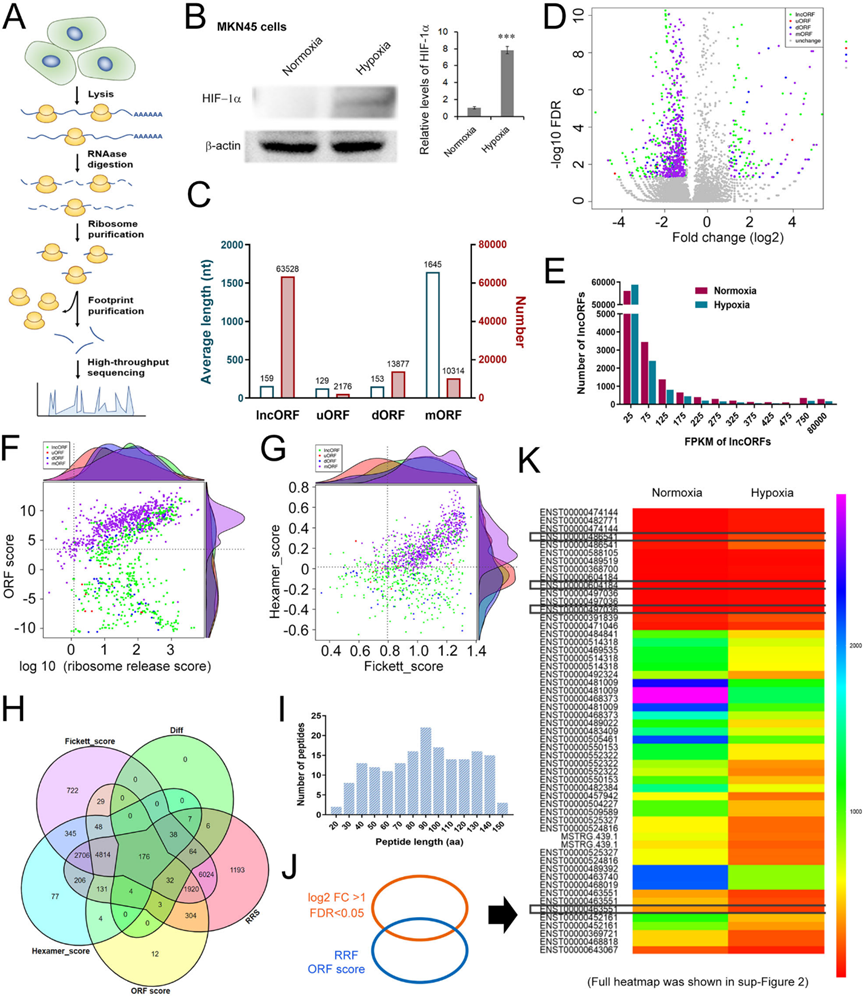
2)lncAKR1C2具有編碼微蛋白的潛力
接下來,我們使用翻譯組學分析了lncAKR1C2的特征。Rio-seq的流程圖如圖2A所示。由于缺氧是實體腫瘤的共同特征之一,我們比較了低氧和常氧條件下胃癌細胞lncRNA翻譯組學的差異。缺氧誘導因子-1α (HIF-1α)在缺氧處理下的MKN45細胞中顯著上調(圖2B)。除了主要的蛋白質編碼ORF (mORF)外,還鑒定了一些來自傳統上被認為不能編碼蛋白質的RNA的小于300個核苷酸(nt)的sORF,包括來自lncRNAs的lncORF、來自mRNA上游區域的uORF和來自mRNA下游區域的dORF。不出所料,lncORF、uORF和dORF的長度比mORF短得多,而lncORF的數量是mORF的6倍多(圖2C)。這些ORF的折疊變化和錯誤發現率(FDR)如圖2D所示,其中一組lncORF明顯增加。所有鑒定的lncORF大部分小于125 FPKM(圖2E),肽長度在30-140 aa之間(圖2I)。ORF評分和RRS評分(核糖體釋放評分)如圖2F所示。Fickett評分和Hexamer評分如圖2G所示。綜合多個評分系統共篩選出176個 lncORFs (圖2H)。圖2J和圖2K所示為這176個lncRNA表達的熱圖主體部分。綜上,這些結果提示lncAKR1C2具有編碼微蛋白的潛力。
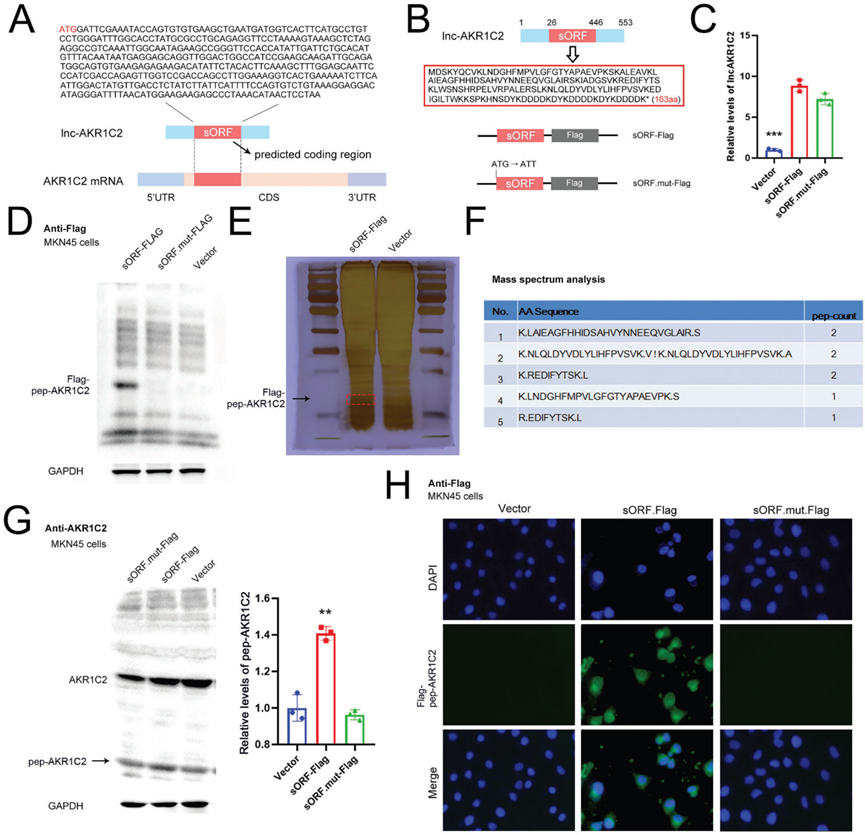
3)lncAKR1C2編碼微蛋白在胃癌細胞中的檢測
根據Ribo-Seq分析,選擇了四個具有編碼短肽潛力的lncRNA進行后續驗證。為了檢測lncRNA編碼肽的表達,我們構建了包含4個lncRNA全序列的質粒。使用抗flag抗體進行WB分析,證實ENST00000486541和ENST00000604184 (lncAKR1C2)具有編碼短肽的能力(補充圖)。lncAKR1C2和AKR1C2 mRNA的預測編碼區(sORF)如圖3A所示,AKR1C2 mRNA的CDS區覆蓋了sORF的全長。RNA-seq數據表明,lncAKR1C2具有編碼163-aa短微蛋白的潛力(稱為pep- AKR1C2),因此構建了具有突變初始密碼子(ATG→ATT)的lncAKR1C2過表達質粒(圖3B)。野生型(sORF-Flag)和突變型lncAKR1C2 (sORF.mutt-Flag)均導致lncAKR1C2 RNA水平升高(圖3C)。但flag標記的pep-AKR1C2僅在sORF-Flag組中檢測到(圖3D)。我們使用銀染色結合質譜(MS)對pep-AKR1C2進行分析,MS檢測到的片段氨基酸序列與Ribo-Seq預測一致(圖3E, 3F)。由于pep-AKR1C2是宿主基因(AKR1C2)的一部分,使用抗AKR1C2抗體也可以檢測到pep-AKR1C2的表達(圖3G)。最后,通過免疫熒光(IF)測定pep-AKR1C2的分布,pep-AKR1C2主要存在于細胞質中(圖3H)。綜上所述,這些結果表明lncAKR1C2在胃癌細胞中編碼163-aa微蛋白。
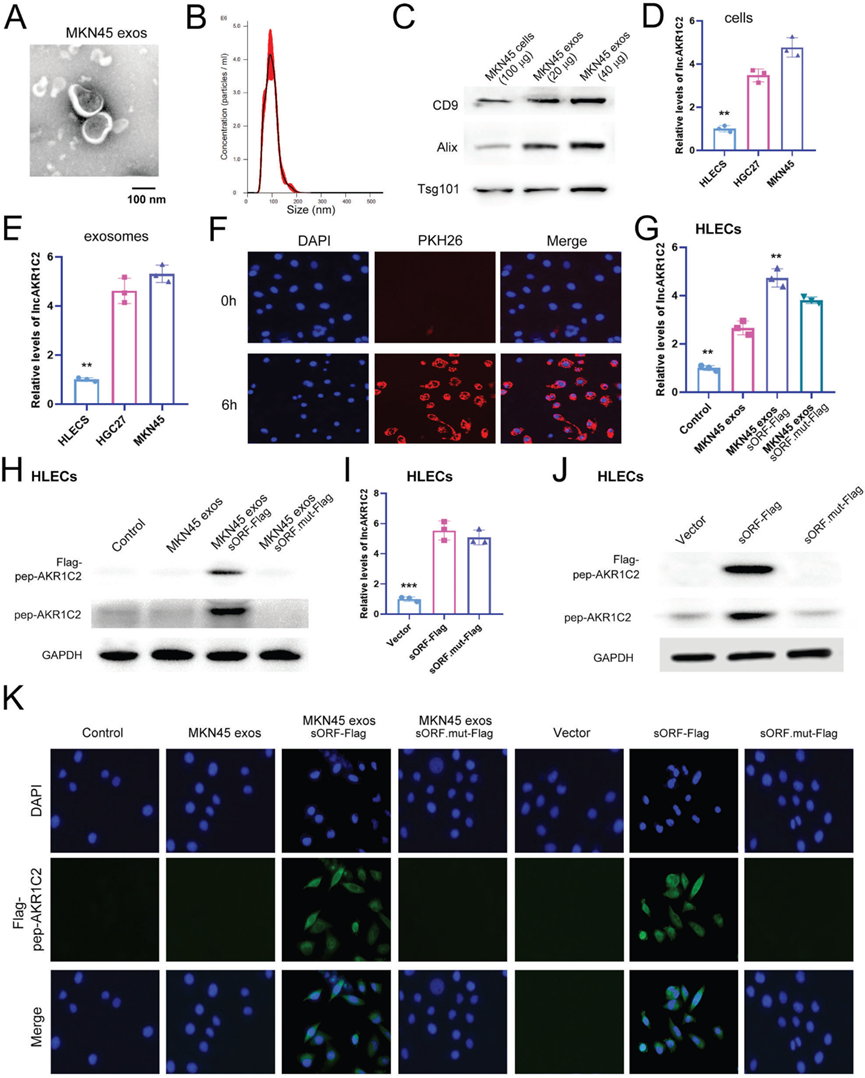
4)外泌體傳遞的lncAKR1C2編碼淋巴內皮細胞中的一種微蛋白
臨床分析數據表明外泌體lncAKR1C2與淋巴管生成和LNM有關,我們接下來檢測了lncAKR1C2編碼的pep-AKR1C2在人淋巴內皮細胞(HLECS)中的表達。通過透射電鏡、NTA和WB分析觀察MKN45細胞外泌體,大多數外泌體直徑約為100 nm(圖4A-4C)。通過比較lncAKR1C2在GC細胞和HLECS中的水平,我們發現lncAKR1C2在GC細胞和GC外泌體中都明顯過表達(圖4D, 4E)。MKN45細胞分別過表達野生型lncAKR1C2或突變型lncAKR1C2,并收集外泌體。這些外泌體用PKH26標記并與HLECS共培養,在6小時內觀察到MKN45外泌體與HLECS融合(圖4F),導致HLECS中lncAKR1C2顯著上調(圖4G)。如圖4H所示,Flag-pep-AKR1C2僅在含有野生型sORF-Flag的MKN45外泌體處理的HLECS細胞中檢測到,并且pep-AKR1C2在MKN45外泌體sORF-Flag組中增加,這表明外泌體lncAKR1C2可以在HLECS細胞中編碼微蛋白。為了提供淋巴內皮細胞中pep-AKR1C2存在的直接證據,我們用野生型lncAKR1C2、突變型lncAKR1C2或空白載體轉染HLECS。WB分析結果顯示與外泌體處理組的效果相同(圖41、4J)。此外,IF分析也表明pep-AKR1C2主要存在于HLECS細胞的細胞質中(圖4K)。因此,這些數據表明GC分泌的exo-lnAKR1C2可以在淋巴內皮細胞中編碼微蛋白,而pep-AKR1C2可能在細胞質中起作用。
5)淋巴管生成需要依賴外泌體lncAKR1C2的代謝向FAO轉移
我們通過GC足墊植入模型和代謝組學分析來確定GC淋巴結轉移的代謝特征(圖5A, 5B)。圖5C顯示了原發性GC腫瘤(植入足墊)和LN代謝腫瘤的代謝組譜比較,LN轉移中觀察到更高水平的脂質代謝。正如預期的那樣,用GC外泌體或lncAKR1C2處理的淋巴內皮細胞顯示出更高的OCR和最大呼吸能力的增加(圖5D, 5E)。然而,突變的lncAKR1C2對HLECS的OCR影響很小。為了評估外泌體lncAKR1C2在脂肪酸代謝中的作用,將HLECS細胞用油酸(OA)處理24小時,然后在低糖培養基中再培養48小時,以充分利用脂肪酸。MKN45外泌體和lncAKR1C2顯著促進了HLECS細胞對OA和ATP的利用,特別是在過表達野生型lncAKR1C2的MKN45外泌體中(圖5F, 5G)。在MKN45外泌體組中,HLECS細胞形成的環的數量和遷移細胞的數量都有所增加,并且在使用野生型lncAKR1C2過表達的MKN45外泌體處理時,數量最多。轉染lncAKR1C2也顯示出類似的效果(圖5H)。這些結果表明GC分泌的lncAKR1C2促進淋巴管內皮細胞的形成和遷移。
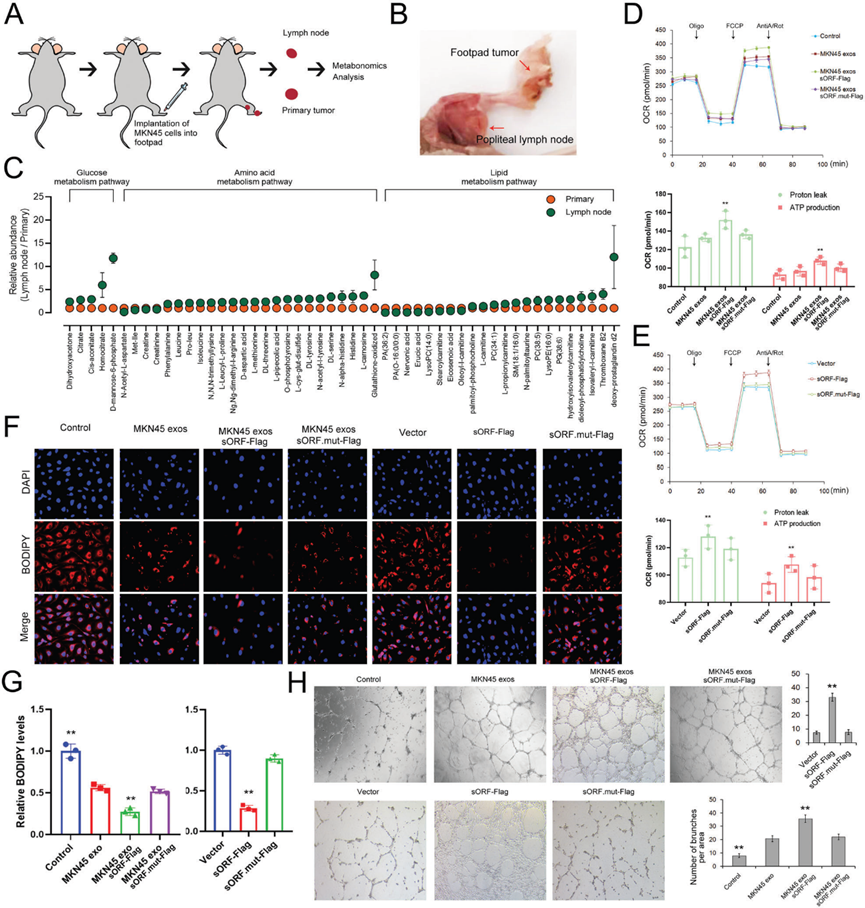
6)LncAKR1C2編碼的微蛋白通過YAP途徑促進淋巴內皮細胞中CPT1A的表達
為了探索pep-AKR1C2介導脂肪酸代謝和淋巴管生成的潛在機制,我們采用co-IP結合LC-MS/MS對與pep-AKR1C2相互作用的蛋白進行鑒定。質譜法檢測到的63種蛋白,其中包括Hippo通路核心蛋白之一YAP (yesassociated protein)(圖6A)。MKN45外泌體和lncAKR1C2對YAP總表達(t-YAP)影響不大,但顯著降低了磷酸化的YAP水平(p127-YAP)(圖6B),這反過來促進了YAP進入細胞核(圖6C)。隨后,通過免疫熒光共定位分析也驗證了YAP與pep-AKR1C2之間的直接相互作用(圖6D)。考慮到近年來已有研究報道了YAP與CPT1A之間的關系,我們也檢測了CPT1A在HLECS細胞中的表達。GC分泌的外泌體lncAKR1C2顯著上調了CPT1A mRNA和蛋白水平(圖6E, 6F)。此外,lncAKR1C2對脂肪酸利用和ATP產生的影響被證明依賴于CPT1A(圖6G, 6H)。這些數據表明,外泌體lncAKR1C2編碼的pep-AKR1C2通過降低YAP磷酸化來促進與FAO相關的CPT1A表達。
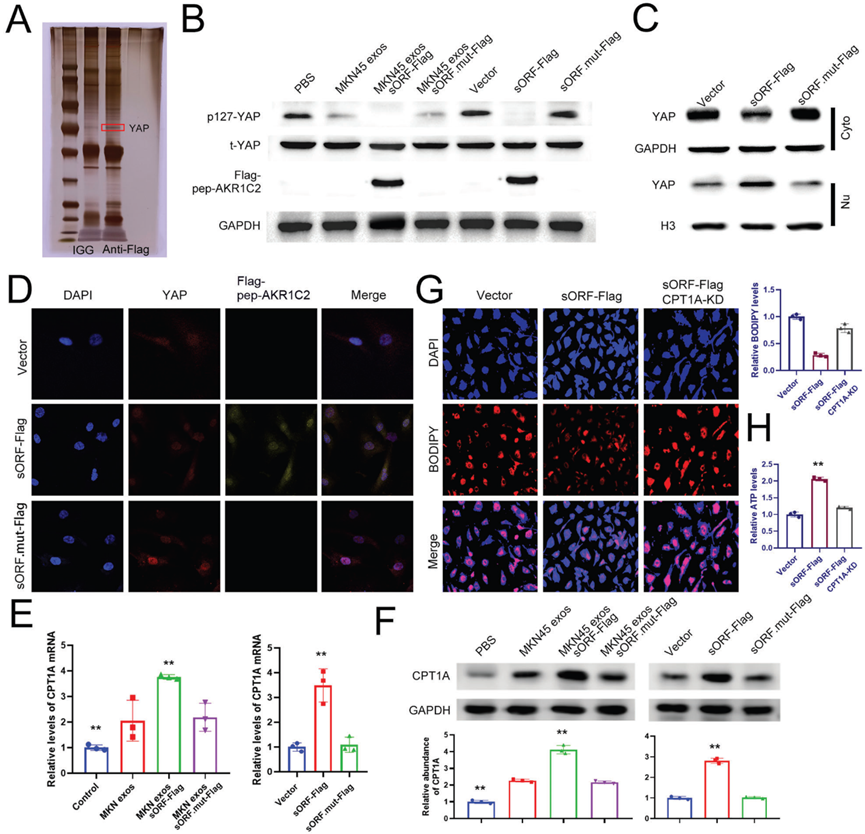
7)外泌體lncAKR1C2促進體內淋巴轉移
為了進一步研究外泌體lncAKR1C2對淋巴結轉移的影響,我們建立了腘窩淋巴轉移模型。將上述處理過的MKN45細胞植入裸鼠足墊,第40天切除腫瘤和腘窩淋巴結(圖7A)。in Vivo Imaging System顯示,lncAKR1C2過表達可顯著促進淋巴結轉移,lncAKR1C2下調可顯著抑制淋巴結轉移和原發腫瘤生長(圖7B,7C)。lncAKR1C2野生型組的淋巴結體積和重量也最高(圖7D,7E)。透射電鏡檢測小鼠血清外泌體,如圖7F所示。與體外實驗一致,野生型lncAKR1C2,而非突變型lncAKR1C2,增強了胃癌的腫瘤發生和淋巴管生成(圖7G, 7H)。從機制上看,上調外泌體lncAKR1C2通過編碼微蛋白促進淋巴結中CPT1A的表達(圖7I-K)。因此,這些結果提供了GC-exo-lncAKR1C2編碼微蛋白促進淋巴轉移的體內證據。
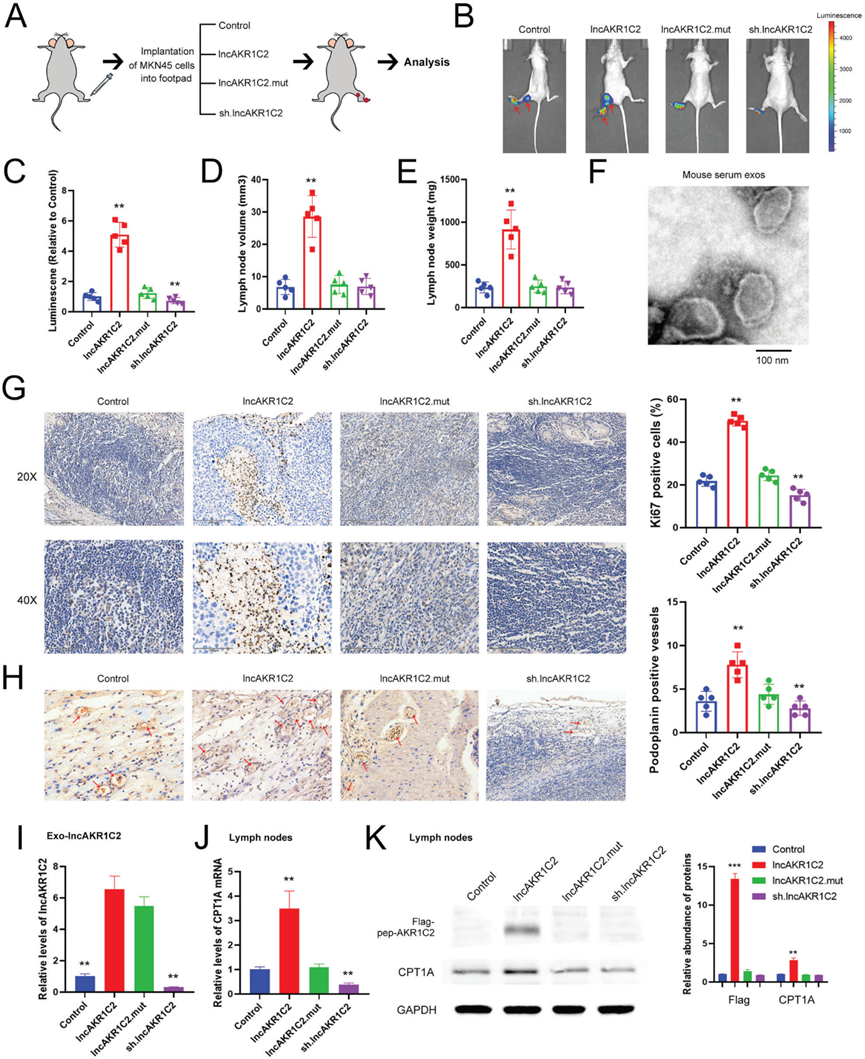
8)lncAKR1C2在腫瘤發生中的體內作用
我們通過皮下異種移植模型研究了lncAKR1C2在體內的作用。用慢病毒感染MKN45細胞,使其過表達野生型或突變型lncAKR1C2,或敲低lncAKR1C2,然后將這些細胞用于小鼠腫瘤植入(圖8A)。結果表明,野生型lncAKR1C2而非突變型lncAKR1C2增強了腫瘤生長,而下調lncAKR1C2抑制了小鼠模型中的腫瘤發生(圖8B, 8C)。lncAKR1C2組的腫瘤直徑、體積和重量也更大(圖8D-8F)。在WT lncAKR1C2組中也觀察到更高水平的增殖標志物Ki67,而lncAKR1C2的敲低導致Ki67水平急劇下降,突變組和對照組之間沒有顯著差異(圖8G)。最后,我們提供了一個示意圖來展示GC分泌的lncAKR1C2編碼的微蛋白在促進淋巴內皮細胞脂質代謝和淋巴轉移中的生物學作用(圖8H)。

結論:
GC來源的exo-lncAKR1C2編碼的微蛋白通過調節YAP磷酸化和CPT1A表達促進淋巴管生成和LN轉移,這依賴于淋巴內皮細胞向脂肪酸氧化的代謝轉變。我們的研究結果為研究外泌體遞送的非編碼RNA提供了見解,并強調了靶向lncAKR1C2在胃癌中的診斷和治療潛力。
實驗方法:
外泌體分離,TEM,NTA,PKH26染色,質譜,FA定量,ATP定量,WB,qRT-PCR,核糖體測序,RNA測序,免疫沉淀,免疫熒光,IHC,動物實驗。
參考文獻:
Zhu KG, Yang J, Zhu Y, Zhu Q, Pan W, Deng S, He Y, Zuo D, Wang P, Han Y, Zhang HY. The microprotein encoded by exosomal lncAKR1C2 promotes gastric cancer lymph node metastasis by regulating fatty acid metabolism. Cell Death Dis. 2023 Oct 30;14(10):708. doi: 10.1038/s41419-023-06220-1.






