骨髓間充質干細胞衍生的含Dermcidin的遷移體增強肺巨噬細胞與LC3相關的吞噬功能,并預防中風后肺炎
肺炎是急性缺血性卒中(AIS)患者的主要死亡原因之一。抗生素雖然抑制感染,但由于對免疫系統的不良影響,未能改善卒中后肺炎患者的預后。目前的研究報道骨髓間充質干細胞(BM-MSC)下調卒中小鼠模型肺部的細菌負荷。對BM-MSC治療的卒中模型進行的肺RNA測序表明,腦缺血后BM-MSC調節肺巨噬細胞的活性。機制上,BM-MSC通過釋放遷移體促進肺巨噬細胞對細菌的吞噬作用。研究結果表明,BM-MSC具有抗感染和免疫調節的雙重功能,是治療卒中后肺炎的有效藥物。該研究于2023年8月發表在《Advanced Science》,IF:15.1。
技術路線:
主要研究結果:
1. 骨髓間充質干細胞移植預防急性缺血性卒中和預防卒中后肺炎
成功分離人BM-MSC。為比較對AIS和卒中后肺炎的治療效果,野生型(WT)雄性C57/Bl6小鼠接受60分鐘短暫大腦中動脈閉塞(tMCAO),然后在再灌注后2小時接受BM-MS或廣譜抗生素恩諾沙星(每日腹腔注射20 mg / kg)治療(圖1A)。與之前的報道一致,BM-MSC移植提高卒中后1 ~ 14日的生存率(圖1B)。BM-MSC受者的神經功能缺損評分降低(圖1C),梗死體積減小(圖1D)。通過BM-MSC移植,神經元存活在兩個3d(短期,圖1E)和14d(長期,圖1F)。此外,在tMCAO模型的紋狀體(STR)和皮質(CTX)的MBP染色顯示,BM-MSC保護白質的完整性(圖1G,H)。因此,BM-MSC治療的卒中模型顯示,在tMCAO后3-14 d,通過滾筒試驗(圖1I)、粘連清除試驗(圖1J)和足部故障試驗(圖1K)評估的感覺運動功能改善。然而,與PBS處理的對照相比,抗生素治療小鼠的卒中結局未顯示顯著改善(圖1B-K)。為分析卒中小鼠的細菌感染情況,在tMCAO后3d分離支氣管肺泡灌洗液(BALF)并進行細菌培養(圖1L)。tMCAO后小鼠肺部感染普遍存在。預防性抗生素治療限制了肺組織中的細菌生長(圖1L)。同時,非特異性檢測細菌存在的肺組織16S rRNA定量(圖1M)和BALF中脂多糖(LPS)水平(圖1N)表明,在抗生素治療的小鼠中,細菌載量下降(圖1L-N)。有趣的是,BM-MSC受體與抗生素治療的小鼠在細菌感染方面表現出相似的局限性(圖1L-N)。然而,盡管抗生素具有抗菌作用,但HE染色顯示,恩諾沙星處理的小鼠出現了嚴重的肺部炎癥,這與PBS處理的對照組相似(圖1O)。需要注意的是,BM-MSC移植組的肺組織顯示出有限的免疫細胞浸潤和保留肺組織完整性(圖1O)。結果表明,BMMSC對卒中后肺炎具有雙重保護作用,即抑制細菌生長和促進肺部炎癥消退。
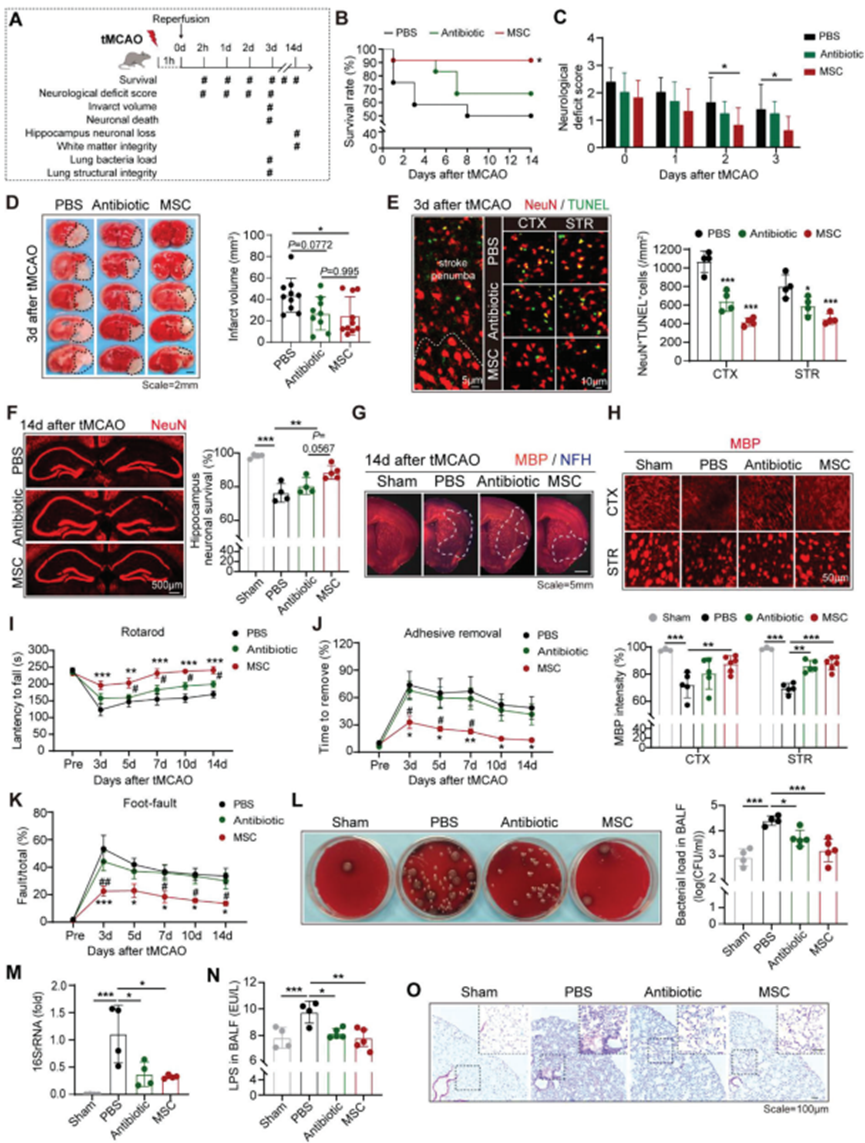
圖1. BM-MSC移植可預防AIS并預防卒中后肺炎
2. BM-MSC轉移通過巨噬細胞依賴的方式預防卒中后肺炎
在tMCAO后3d分離腦卒中模型小鼠的肺組織并進行大批量RNA測序(RNA-seq)。分析了PBS、抗生素和BM -MSC治療的卒中小鼠之間的差異表達基因(DEGs)(圖2A)。為探索BM -MSC轉移的治療機制,選擇BM-MSC和PBS處理小鼠中上調的DEGs(圖2Aa),抗生素和PBS處理小鼠中下調的DEGs(圖2Ab),以及BM-MSC和抗生素治療小鼠中上調的DEGs(圖2Ac)的交集(圖2B)。在交集的DEGs中發現巨噬細胞的特征基因,包括Ccr2(圖2C)。通過Reactome通路分析進一步分析交集的DEGs。結果顯示,在BM -MSC治療的小鼠的肺中,多個抗原呈遞相關通路上調(圖2D)。免疫組織化學染色(Iba1,綠色)和熒光原位雜交(FISH)技術(EUB338,紅色)對tMCAO模型的肺組織進行巨噬細胞標記。發現,BM-MSC治療增強巨噬細胞對細菌的清除,因為細菌大部分保留在Iba1+細胞內(圖2E)。相比之下,在接受抗生素治療的小鼠中,盡管細菌負荷減少,但殘留細菌仍未被巨噬細胞吞噬,這表明巨噬細胞的抗菌功能受到抗生素治療的影響(圖2E)。進一步耗盡循環單核細胞(圖2F)和肺駐留巨噬細胞(圖2F)聯合氯磷酸二鈉脂質體(75 mg kg - 1,腹腔注射,tMCAO前3d)(圖2F)。值得注意的是,在單核細胞/巨噬細胞清除的小鼠中,BM-MSC未能對腦缺血提供進一步保護(圖2G)。此外,BM-MSC的抗菌作用被逆轉(圖2H,I)。這些數據表明,巨噬細胞的功能在BM-MSC移植對AIS和卒中后肺炎的保護中是必不可少的。
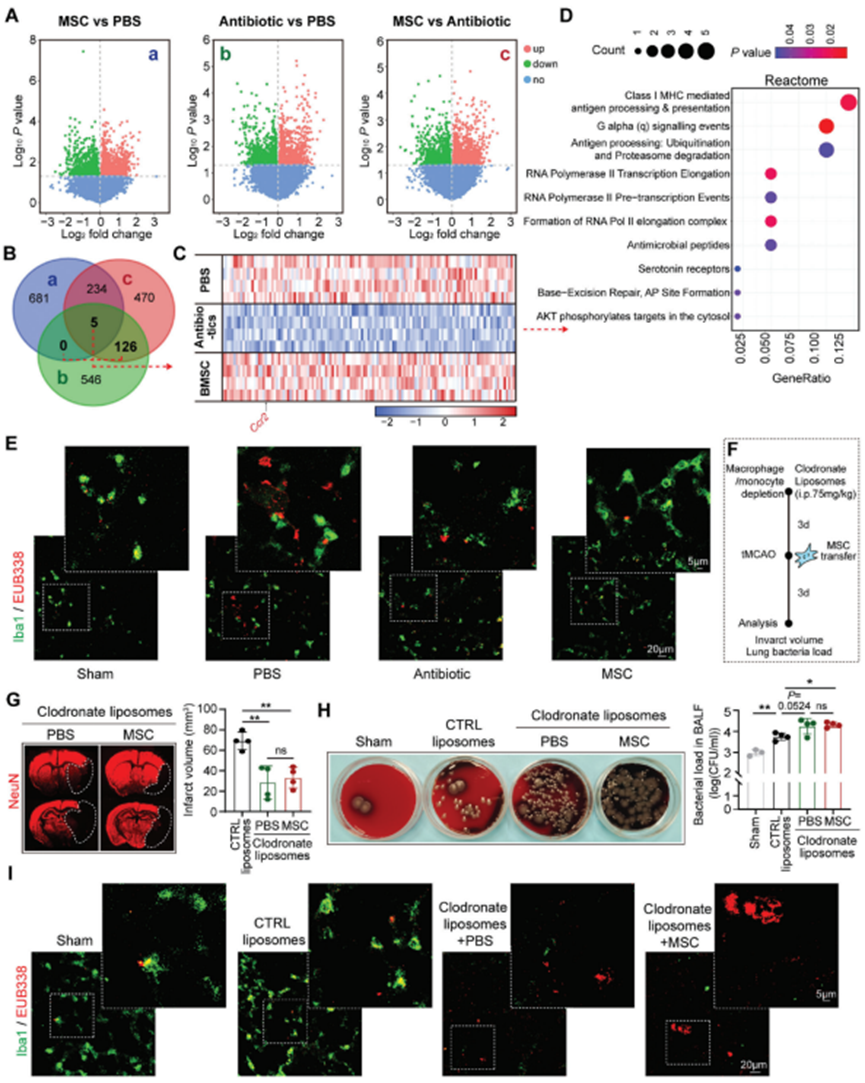
圖2. 骨髓間充質干細胞轉移促進巨噬細胞的細菌清除
3. BM-MSC通過增強LC3相關的吞噬作用促進巨噬細胞的細菌清除
評估BM-MSC處理后巨噬細胞的功能變化。如細菌16s rRNA的FISH所示,在BM-MSC轉移小鼠中,細菌吞噬肺巨噬細胞的效率提高(圖2E)。入侵的細菌被巨噬細胞通過LC3相關吞噬作用(LAP)識別和處理通過免疫染色,RUBCN (RUN結構域和含半胱氨酸豐富結構域的Beclin 1相互作用蛋白),LAP的特異性標志物,在BM-MSC受體的肺巨噬細胞中上調(圖3A)。相應地,通過trans-well將骨髓來源的巨噬細胞(BMDM)與BM-MSC共培養(圖3B)提高了它們對大腸桿菌的清除,而大腸桿菌是導致卒中后肺炎的主要病原體之一(圖3C,D)。通過western blot發現BM-MSC共培養上調BMDM中的RUBCN表達,并促進下游與LC3相關的大腸桿菌的消化(圖3D)。此外,當用大腸桿菌(e.c oli-BM-MSC)刺激BM-MSC來封閉卒中后肺炎的微環境時,BM-MSC吞噬BMDM的促進作用進一步增強(圖3B-D)。在與E. Coli-BM-MSC共培養的小鼠BMDM和人巨噬細胞中,RUBCN顯示出與BECN1的活躍組裝,表明LAP進展(圖3E-G)。敲低Rubcn抑制BMDM的LAP,E. Coli-BM-MSC對BMDM細菌清除的促進作用被消除(圖3H,I),說明BM-MSC通過促進LAP增強巨噬細胞的殺菌功能。值得注意的是,恩諾沙星下調BMDM的細菌清除及其RUBCN的表達(圖3C-E),這進一步證明與抗生素相比,恩諾沙星對BM-MSC的卒中后肺炎具有更好的保護作用。
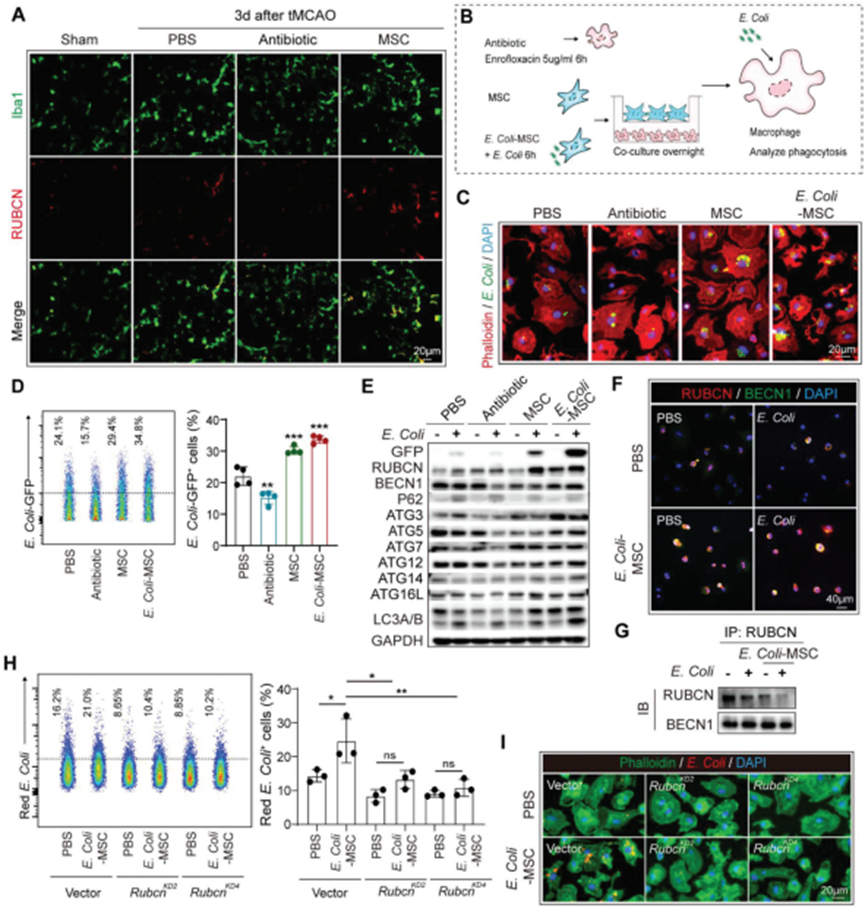
圖3. BM-MSC通過增強LC3相關吞噬作用(LAP)促進巨噬細胞的細菌清除
4. BM-MSC通過釋放遷移體促進巨噬細胞清除細菌
在共培養系統中,通過插入物將BMMSC與BMDM分離,但不影響它們的非接觸交流(圖3B)。BM-MSC的條件培養基(CM)或經大腸桿菌預處理的條件培養基(CM)均可增強BMDM對大腸桿菌 (GFP+)的吞噬作用(圖4A),表明BM-MSC衍生的分泌因子促進BMDM對細菌的吞噬作用。BM-MSC衍生的CM被進一步分離為可溶性部分和細胞外囊泡(EVs),特別是由大腸桿菌預處理的BM-MSC產生的EVs,增強BMDM對細菌的吞噬(圖4B,C)。在體內,BM-MSC注射后僅在肺內短暫停留約24小時(圖4C)。BM-MSC在2天內從肺內回縮,而BM-MSC移植的抗菌作用至少在3天內仍然明顯(圖1I-K)。因此,作者推斷是BM-MSC衍生的EVs對巨噬細胞發揮促吞噬作用。在BM-MSC受者的肺中發現了直徑為500 ~ 3000 nm的EV富集,這與報告的新發現的遷移體EV的大小一致(圖4E,F)。對從BMMSC CM和BM-MSC轉移的卒中模型中分離的EVs進行的透射電子顯微鏡(TEM)分析顯示,典型的偏小體形態為結合回縮纖維的大囊泡,并包含小囊泡(圖4G,H)。此外,與BPS處理對照相比,BMMSC轉移的卒中小鼠(tMCAO后3d)的肺組織的蛋白質印跡分析顯示,C3ORF64、PIGK和PGCP的遷移體標志物表達增加,而外泌體標志物包括HSP70和HSP90的水平穩定(圖4H)。免疫染色一致地顯示,注射后0-3d, tMCAO受體肺內保留BM-MSC (WGA預染色,紅色)來源的遷移體 (TSPAN4+,白色)(圖4I)。
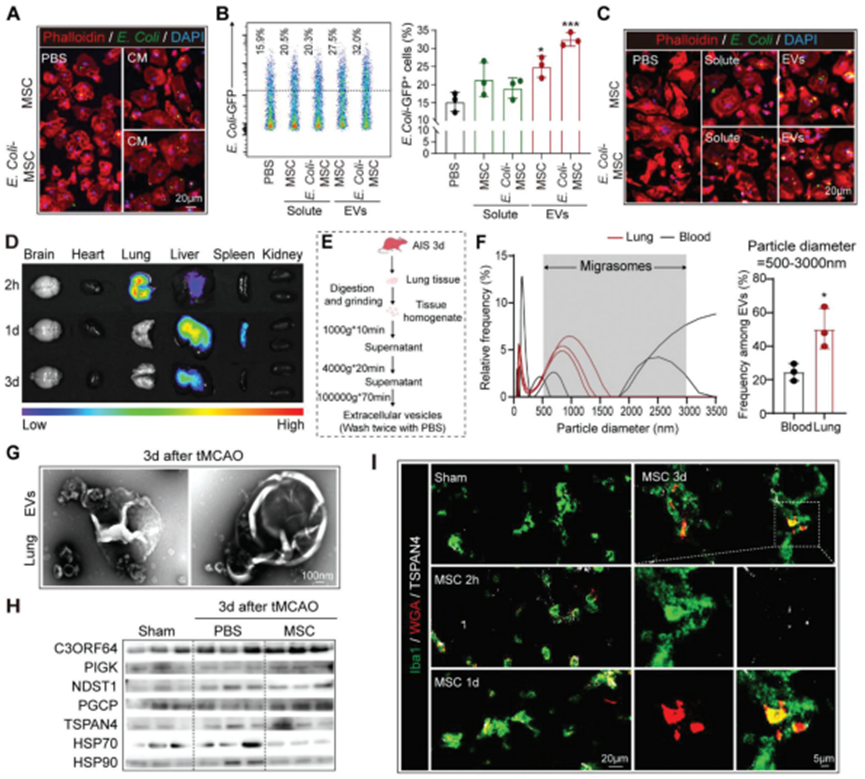
圖4. BM-MSC轉移通過釋放遷移體預防卒中后肺炎
通過流式細胞術(圖5A)和免疫染色(圖5B)評估發現PBS-M和E. Coli-M均上調BMDM對GFP+ E. Coli的吞噬。為探索遷移體在BM-MSC提供的BMDM細菌清除增強中的必要性,將細胞松弛素D(CytD)應用于BM-MSC以抑制細胞遷移(圖5C)。將不含遷移體的CytD處理的BM-MSC (CytD-EV)來源的EVs處理為BMDM。發現,CytD-EV既不能增強BMDM對GFP+大腸桿菌的吞噬作用(圖5D-F),也不能上調其RUBCN的表達(圖5F)。另一方面,BM-MSC衍生的遷移體的促吞噬作用與BM-MSC衍生的EVs相當(圖5A,B)。在本研究中發現,接受遷移體處理的巨噬細胞在細菌清除方面的改善與接受含有遷移體的總EVs處理的巨噬細胞相似(圖5A,B),而接受不含遷移體的EVs處理的巨噬細胞的吞噬增強較弱(圖5G-I)。在動物實驗中,無論是偏側體還是偏側體排除的EVs均有效縮小了梗死體積(圖5J)。然而,在腦卒中后肺部感染的體內分析中發現,通過遷移體轉移的tMCAO模型肺組織中的細菌生長(圖5K)、肺組織16S rRNA濃度(圖5L)、BALF中的LPS水平(圖5M)和肺部炎癥(圖5N)減少,這與接受BM-MSC治療的模型相似(圖1L - O),并優于通過排除遷移體的EVs轉移的模型(圖5K - n)。因此,得出結論,BM-MSC通過釋放遷移體促進巨噬細胞清除細菌,同時發揮殺菌作用。
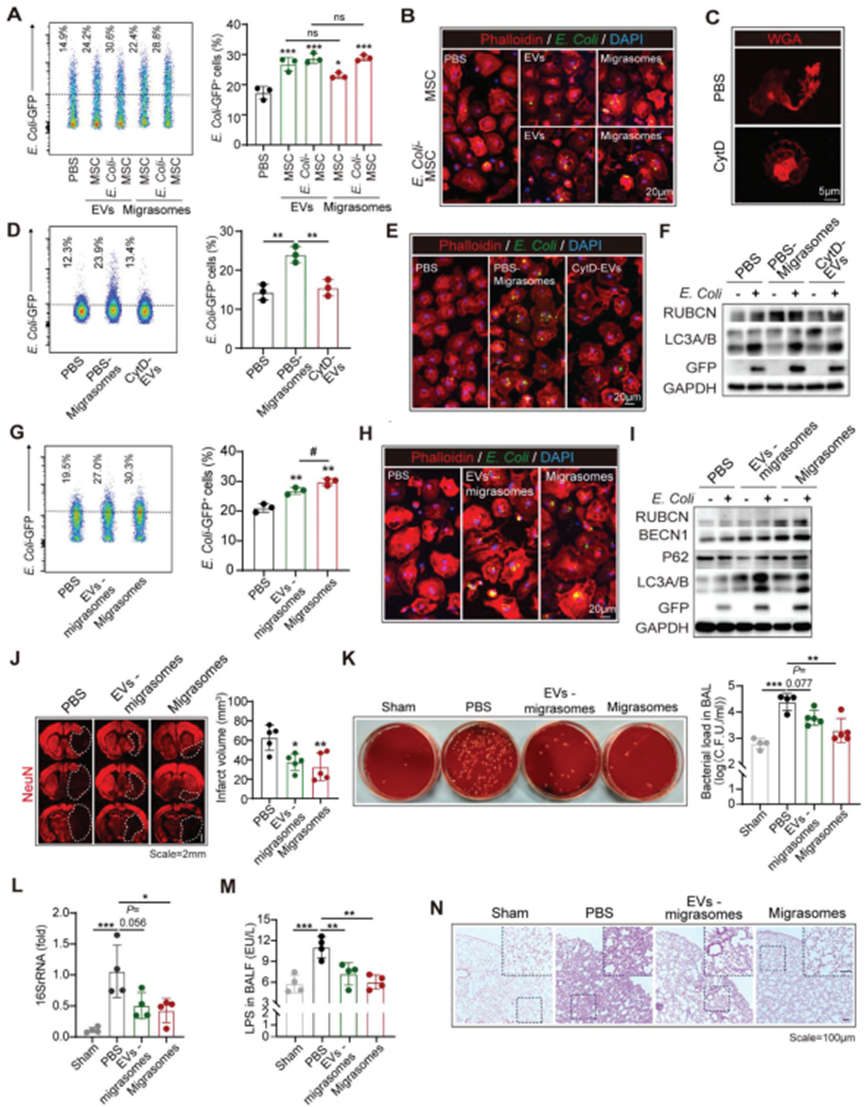
圖5. BM-MSC通過釋放遷移體促進巨噬細胞清除細菌
5. 皮離蛋白(DCD)被包裝在BM-MSC衍生的遷移體中并改善巨噬細胞的細菌清除
分離培養骨髓間充質干細胞(BM-MSC)來源的遷移體,采用液相色譜串聯質譜(LCMS/MS)分析遷移體的抗菌分子。在鑒定的成分中,抗菌蛋白皮離蛋白(DCD)值得關注(圖6A)。通過免疫染色(圖6B)和ELISA(圖6C),驗證DCD集中于BM-MSC衍生的遷移體。DCD在BM-MSC胞體中的濃度較低(圖6B,C)。此外,通過ELISA(圖6C)和QPCR(圖6D)評估,發現大腸桿菌刺激上調BM-MSC中的DCD表達,這解釋了大腸桿菌預處理的BM-MSC共培養和E. Coli對巨噬細胞的超活性作用。用DCD預處理BMDM,進行細菌清除實驗。免疫染色表明DCD啟動以劑量依賴性方式改善BMDM對大腸桿菌的吞噬或髓鞘碎片的清除(圖6E,F),揭示DCD的促清除功能。同時,DCD促進E. Coli吞噬巨噬細胞后的LAP(圖6G)。免疫染色評估發現RUBCN和BECN1、GFP+ E. Coli或和LC3A/B的共定位在DCD預處理的BMDM中上調(圖6H)。需要注意的是,DCDKD 的BM-MSC來源的遷移體的pro-LAP功能被取消,這表明DCD在BM-MSC來源的遷移體的抗菌作用中不可或缺的作用(圖6I,J)。
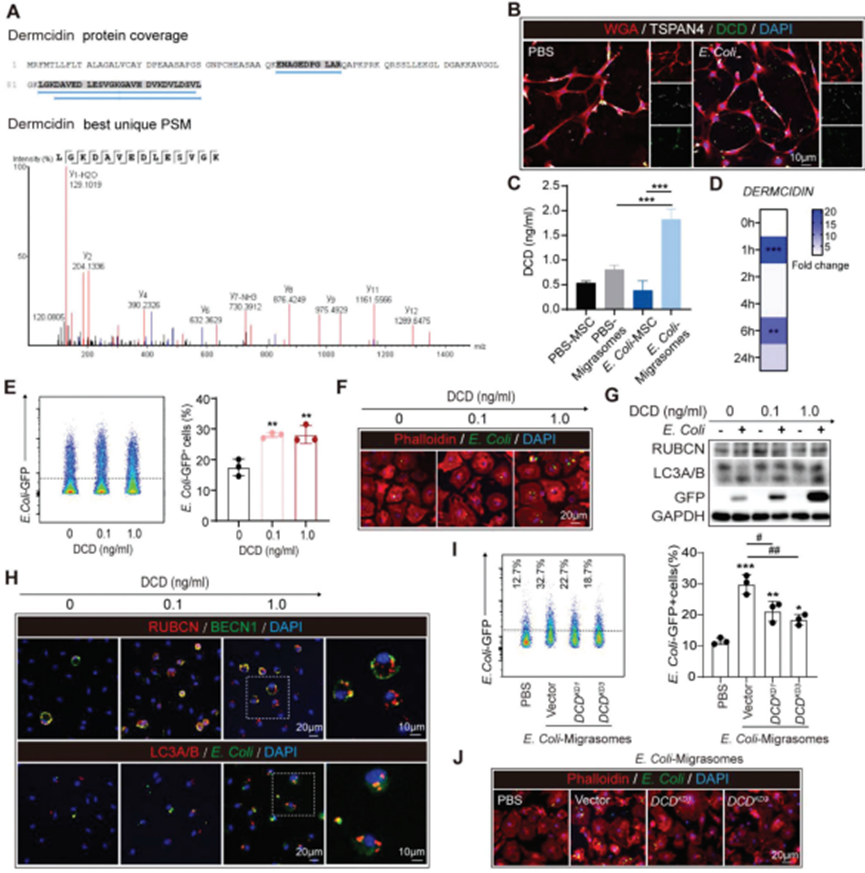
圖6. BM-MSC衍生的遷移體含有皮離蛋白(dermcidin, DCD),可提高巨噬細胞的細菌清除
進一步研究DCD和含有DCD的BM-MSC衍生的遷移體的治療潛力。我們發現,與年齡和性別匹配的健康對照(HC)相比,AIS患者(急性期,發病后0-3d)外周血中的DCD濃度上調(圖7A)。有趣的是,外周血DCD水平與患者的梗死體積呈負相關(圖7B - d),與δ NIHSS (7d-1d)呈正相關(圖7B,E) 說明DCD有利于AIS的恢復。血漿DCD濃度高的AIS患者比DCD水平低的患者有更明顯的肺炎發生率(圖7F,G)。考慮到DCD和含DCD的巨噬細胞來源的遷移體的抗菌作用(圖7H-J),推斷DCD對肺炎的抗菌反應至關重要。使用BMDM、DCD和含DCD處理時BM-MSC衍生的遷移體均被BMDM吞噬(圖7H)。通過流式細胞術分析(圖7I)和免疫染色(圖7J),發現與使用DCD蛋白處理的BMDM相比,使用BM-MSC來源的遷移體處理的BMDM顯示出更強的細菌清除能力。因此,含有DCD的BM-MSC衍生的遷移體是一種治療卒中后肺炎的有效療法,其療效優于之前所關注的DCD蛋白。
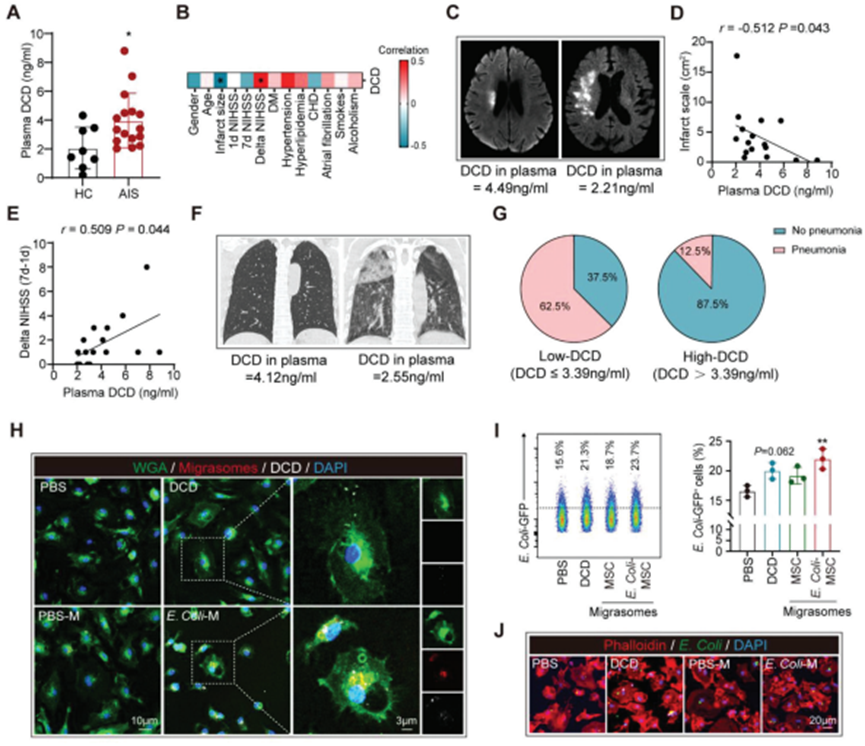
圖7. DCD有利于AIS的恢復,含DCD的BM-MSC來源的遷移體可有效促進巨噬細胞的吞噬功能
結論
綜上所述,本研究發現BM-MSC移植通過釋放含DCD的遷移體,增強肺巨噬細胞的LAP,從而保護卒中后肺炎。BM-MSC不僅具有有效的神經保護作用,還具有抗菌和免疫調節功能,是治療AIS和卒中后肺炎的潛在治療方法,遠超抗生素。
實驗方法
人骨髓間充質干細胞(BM-MSC)的分離鑒定,骨髓間充質干細胞的成骨和成脂分化,急性缺血性腦卒中的小鼠模型,小鼠的BM-MSC移植和藥物給藥,神經功能評分,行為實驗,梗死體積分析,支氣管肺泡灌洗液(BALF)收集,原代小鼠骨髓源巨噬細胞(BMDMs)培養,人單核細胞富集和巨噬細胞分化,巨噬細胞耗竭,批量RNA測序和數據分析,組織學分析,FISH,BM-MSC的細胞外囊泡(EVs)和遷移體的分離和鑒定,液相色譜串聯質譜(LC-MS/MS)分析,TEM分析,吞噬作用分析,體內MSC示蹤實驗,慢病毒感染BMDM和BM-MSC,免疫熒光染色,RT-PCR,免疫沉淀,WB,流式細胞分析,ELISA
參考文獻
Li T, Su X, Lu P, Kang X, Hu M, Li C, Wang S, Lu D, Shen S, Huang H, Liu Y, Deng X, Cai W, Wei L, Lu Z. Bone Marrow Mesenchymal Stem Cell-Derived Dermcidin-Containing Migrasomes enhance LC3-Associated Phagocytosis of Pulmonary Macrophages and Protect against Post-Stroke Pneumonia. Adv Sci (Weinh). 2023 Aug;10(22): e2206432. doi: 10.1002/advs.202206432. Epub 2023 May 28. PMID: 37246283; PMCID: PMC10401184.






