鐵死亡(Ferroptosis)摘要分享
鐵死亡(Ferroptosis)是一種鐵依賴性的,區別于細胞凋亡、細胞壞死、細胞自噬的新型的細胞程序性死亡方式。鐵死亡的主要機制是,在二價鐵或酯氧合酶的作用下,催化細胞膜上高表達的不飽和脂肪酸,發生脂質過氧化,從而誘導細胞死亡;此外,還表現為抗氧化體系(谷胱甘肽系統)的調控核心酶GPX4的降低。
越來越多的證據表明,鐵死亡在腫瘤抑制和免疫中的潛在生理作用。此外,鐵死亡的病理生理學相關性,特別是作為癌癥和缺血性器官損傷的治療方式,已得到令人信服的證實。盡管如此,在許多方面,鐵死亡領域仍處于萌芽階段,僅在最近幾年才從氨基酸和脂質代謝,鐵穩態,氧化還原和硒生物學以及細胞死亡等鄰近領域合并而來。
最近相關文章摘要
1、CDKN2A缺失重塑了脂質代謝從而導致膠質母細胞瘤鐵死亡
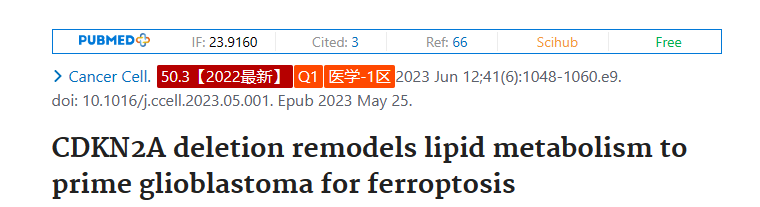
惡性腫瘤表現出異質的代謝重編程,阻礙了代謝靶向治療的可翻譯漏洞的識別。腫瘤中的分子改變如何促進代謝多樣性和不同的靶向依賴性仍然不明確。在這里,我們創建了一個資源庫,其中包含來自156個分子多樣化的膠質母細胞瘤(GBM)腫瘤和衍生模型的脂質組學、轉錄組學和基因組數據。通過對GBM脂質組與分子數據集的綜合分析,我們發現CDKN2A缺失重塑了GBM脂質組,特別是將可氧化的多不飽和脂肪酸重新分配到不同的脂質區室中。因此,CDKN2A缺失的GBM顯示出更高的脂質過氧化,選擇性地引發腫瘤鐵死亡。總之,這項研究提供了臨床和臨床前GBM標本的分子和脂質組學資源,我們利用這些資源來檢測GBM中復發性分子病變與脂質代謝改變之間的治療上可利用的聯系。
2、FSP1的相分離促進鐵死亡

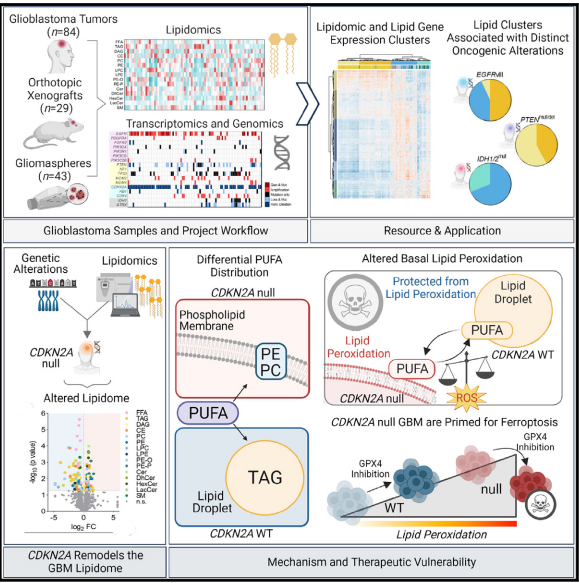
鐵死亡正在發展成為一種非常有前途的方法來對抗難以治療的腫瘤實體,包括難治性癌癥和去分化癌癥。最近,鐵死亡抑制蛋白-1 (FSP1) 與線粒體外泛醌或外源維生素K和NAD(P)H/H+作為電子供體一起,已被確定為第二個鐵死亡抑制系統,可有效防止脂質過氧化,并獨立于半胱氨酸-谷胱甘肽(GSH)-谷胱甘肽過氧化物酶4(GPX4)軸。為了開發FSP1抑制劑作為下一代治療性鐵死亡誘導劑,我們進行了小分子庫篩選,并鑒定了3-苯基喹唑啉酮類化合物(以icFSP1為代表)作為有效的FSP1抑制劑。我們發現,與第一個描述的靶向FSP1抑制劑iFSP1不同,icFSP1不會競爭性抑制FSP1酶活性,而是與GPX4抑制協同作用,在鐵死亡誘導之前觸發FSP1在膜的亞細胞重新定位和FSP1凝結。icFSP1誘導的FSP1凝聚體表現出與相分離一致的液滴狀特性,相分離是一種新出現的、廣泛存在的調節生物活性的機制。FSP1中的N端肉豆蔻酰化、獨特的氨基酸殘基和本質上無序的低復雜性區域被認為對于細胞內和體外的FSP1依賴性相分離至關重要。我們進一步證明icFSP1會損害腫瘤生長并在體內誘導腫瘤中的FSP1凝聚。因此,我們的結果表明,icFSP1表現出獨特的作用機制,并與鐵死亡誘導劑協同作用,增強鐵死亡細胞死亡反應,從而為將FSP1依賴性相分離作為有效的抗癌療法提供了理論基礎。
3、CDK7-YAP-LDHD軸促進D-乳酸消除和鐵死亡防御,以支持癌癥干細胞樣特性
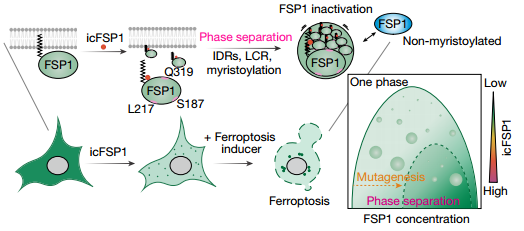
重新編程的細胞代謝是維持腫瘤干細胞(CSCs)狀態的關鍵。在此,我們報告了線粒體D-乳酸分解代謝是食管鱗癌(ESCC)發生過程中一個必要的致癌事件。我們發現細胞周期蛋白依賴性激酶7(CDK7)在S127和S397位點使核Yes關聯蛋白1(YAP)磷酸化并增強其轉錄功能,從而促進D-乳酸脫氫酶(LDHD)蛋白表達。此外,LDHD在ESCC-CSC中顯著富集,而不是在分化的腫瘤細胞中,并且高LDHD狀態與ESCC患者的不良預后有關。從機制上講,CDK7-YAP-LDHD 軸幫助ESCC-CSC逃避D-乳酸誘導的鐵死亡,并產生丙酮酸以滿足其自我更新潛力提高的能量需求。因此,我們認為食道CSCs通過依賴CDK7-YAP-LDHD軸的D-乳酸清除和丙酮酸積聚的方式,驅動了ESCC-CSCs的干性相關特征。合理地說,以代謝檢查點為靶點可能是ESCC治療的有效策略。

腫瘤干細胞是腫瘤中具有自我更新能力并能產生異質性腫瘤細胞的細胞。CDK7抑制劑THZ1在小分子篩選中顯示出強大的抗腫瘤干細胞特性。
4、伊美司他介導的脂肪酸代謝改變誘導鐵死亡作為急性髓系白血病的治療策略
端粒酶能夠在大多數癌癥中實現復制永生,包括急性髓系白血病(AML)。伊美司他是一種端粒酶抑制劑,對骨髓纖維化和骨髓增生異常綜合征具有臨床療效。在這里,我們開發了AML患者來源的異種移植資源,并結合功能遺傳學進行綜合基因組學、轉錄組學和脂質組學分析,以確定伊美司他療效的關鍵介質。在患者來源的異種移植物的隨機II期臨床前試驗中,伊美司他有效地減輕了AML負擔,并優先靶向含有突變體NRAS和氧化應激相關基因表達特征的亞群。無偏倚的全基因組CRISPR/Cas9編輯將鐵死亡調節因子確定為伊美司他功效的關鍵調節因子。伊美司他促進含磷脂的多不飽和脂肪酸的形成,導致過度的脂質過氧化和氧化應激。鐵死亡的藥理學抑制會降低伊美司他的療效。我們利用這些機制見解來開發優化的治療策略,使用氧化應激誘導化療使患者樣本對伊美司他敏感,從而AML 的疾病得到實質性控制。
5、中性粒細胞通過烏頭酸脫羧酶1抵抗鐵死亡并促進乳腺癌轉移
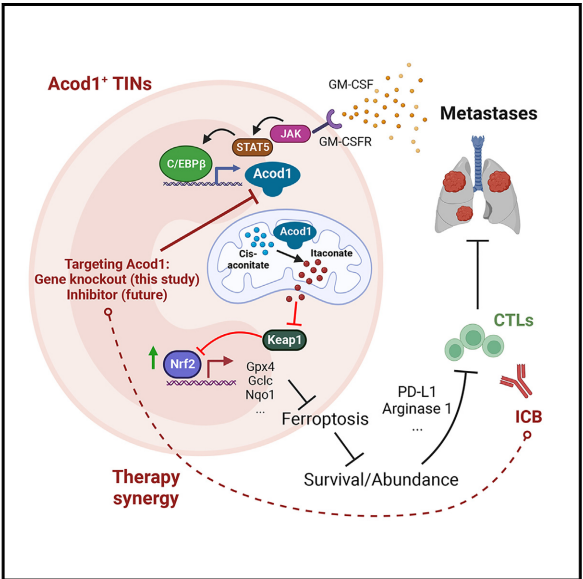
轉移會導致乳腺癌相關死亡。腫瘤浸潤性中性粒細胞(TIN)會造成免疫抑制并促進轉移。對TINs的治療性削弱可能會增強免疫治療,然而鑒定在TINs中高表達和功能上必需但在腫瘤外中性粒細胞中低表達的治療靶點仍然是一個挑戰。在這里,使用單細胞RNA測序來比較小鼠乳腺腫瘤模型中的TIN和循環中性粒細胞,我們鑒定出烏頭酸脫羧酶1(Acod1)是小鼠TIN中最上調的代謝酶,并驗證了Acod1在人類TIN中的高表達。Acod1通過GM-CSF-JAK/STAT5-C/EBPB途徑激活,產生衣康酸(itaconate),介導Nrf2依賴的對鐵死亡的防御,并維持TINS的持久性。Acod1消融可減少TIN浸潤,限制轉移(但不限制原發腫瘤),增強抗腫瘤T細胞免疫,并增強免疫檢查點阻斷的功效。我們的研究結果揭示了TIN如何通過Acod1依賴性免疫代謝開關逃避鐵死亡,并將Acod1作為抵消免疫抑制和改善抗轉移免疫治療的靶點。
參考文獻
1. Minami JK, Morrow D, Bayley NA, Fernandez EG, Salinas JJ, Tse C, et al. CDKN2A deletion remodels lipid metabolism to prime glioblastoma for ferroptosis. Cancer Cell. 2023;41(6):1048-60.e9. doi: 10.1016/j.ccell.2023.05.001.
2. Nakamura T, Hipp C, Santos Dias Mour?o A, Borggr?fe J, Aldrovandi M, Henkelmann B, et al. Phase separation of FSP1 promotes ferroptosis. Nature. 2023;619(7969):371-7. doi: 10.1038/s41586-023-06255-6.
3. Lv M, Gong Y, Liu X, Wang Y, Wu Q, Chen J, et al. CDK7-YAP-LDHD axis promotes D-lactate elimination and ferroptosis defense to support cancer stem cell-like properties. Signal Transduction and Targeted Therapy. 2023;8(1). doi: 10.1038/s41392-023-01555-9.
4. Bruedigam C, Porter AH, Song A, Vroeg in de Wei G, Stoll T, Straube J, et al. Imetelstat-mediated alterations in fatty acid metabolism to induce ferroptosis as a therapeutic strategy for acute myeloid leukemia. Nature Cancer. 2023. doi: 10.1038/s43018-023-00653-5.
5. Zhao Y, Liu Z, Liu G, Zhang Y, Liu S, Gan D, et al. Neutrophils resist ferroptosis and promote breast cancer metastasis through aconitate decarboxylase 1. Cell Metabolism. 2023;35(10):1688-703.e10. doi: 10.1016/j.cmet.2023.09.004.






