調節(jié)性T細胞(Tregs)摘要分享
Tregs是一種獨特的細胞群,可以調節(jié)和抑制免疫系統(tǒng)中的其他細胞,促進對自身和外來抗原的免疫耐受。它們是在幾十年前被發(fā)現的,已知在維持免疫穩(wěn)態(tài)中具有戰(zhàn)略作用。它們的功能與多種病理的發(fā)展密切相關,包括自身免疫和癌癥。越來越多的證據表明,消除Tregs可以增強抗腫瘤免疫反應。然而,Treg細胞的系統(tǒng)性消耗可同時引起有害的自身免疫。
Tregs的活性是研究最廣泛的調節(jié)免疫反應的機制。Tregs可以控制與感染相關的炎癥,也可以控制不適當的針對組織或細胞的炎癥。活化的T調節(jié)性細胞產生抑制性細胞因子。Tregs抑制免疫系統(tǒng)的能力可能是由于與其他細胞的直接相互作用,但也可能通過分泌抑制化合物以旁分泌的方式。盡管效應T細胞的代謝過程是眾所周知的,但對Tregs機制的理解尚未完全闡明。
最近相關文章摘要
1、腫瘤微環(huán)境中調節(jié)性T細胞的保守轉錄連通性為新的聯(lián)合癌癥治療策略提供了信息

雖然調節(jié)性T細胞(Treg)傳統(tǒng)上被認為是自身免疫和癌癥中抗原提呈細胞和效應T細胞的專業(yè)抑制因子,但最近關于Treg細胞在組織維持中的獨特功能的發(fā)現表明,它們的調節(jié)范圍擴展到更廣泛的細胞范圍,并且比以前認為的更廣泛。為了闡明腫瘤Treg細胞與多種支持腫瘤的輔助細胞類型的“連通性”,我們探索了實驗性肺癌和損傷性炎癥中Treg細胞準時耗竭時單細胞轉錄組的即時早期變化。在任何顯著的T細胞激活和炎癥之前,成纖維細胞、內皮細胞和髓細胞在癌癥和損傷環(huán)境中都表現出明顯的基因表達變化。因子分析揭示了共同的Treg細胞依賴基因程序,最重要的是,在任何一種情況下,VEGF和CCR2信號相關基因在Treg細胞剝奪以及Treg細胞貧乏與Treg細胞豐富的人肺腺癌中都有顯著的上調。因此,與相應的單藥治療相比,準時Treg細胞消耗聯(lián)合短期VEGF阻斷顯著改善了小鼠PD-1阻斷耐藥肺腺癌進展的控制,突出了一種有希望的基于因子的查詢方法來闡明新的合理的實體器官癌聯(lián)合治療。
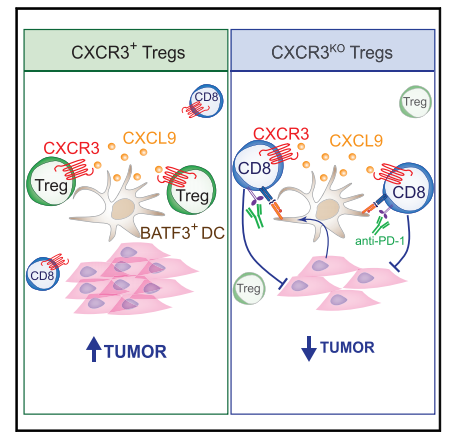
2、CXCR3在調節(jié)性T細胞中的表達驅動與腫瘤中I型樹突狀細胞的相互作用,從而限制CD8+ T細胞抗腫瘤免疫

調節(jié)性T細胞(Treg)是一種CD4+ T細胞的免疫抑制群體,浸潤到實體癌癥中代表了癌癥免疫治療的障礙。趨化因子受體是炎癥組織(包括癌癥)中Treg細胞募集和細胞間相互作用的關鍵,因此是理想的治療靶點。在這里,我們在多種癌癥模型中發(fā)現,與淋巴組織相比,CXCR3+ Treg細胞在腫瘤中增加,表現出活化的表型,并優(yōu)先與產生CXCL9的BATF3+樹突狀細胞(DC)相互作用。Treg細胞中CXCR3的基因消融破壞了DC1-Treg細胞的相互作用,同時增加了DC-CD8+ T細胞的相互作用。機制上,Treg細胞中CXCR3消融增加了DC1s的腫瘤抗原特異性交叉呈遞,增加了腫瘤中CD8+ T細胞的啟動和再激活。這最終會損害腫瘤進展,特別是與抗PD -1檢查點阻斷免疫療法聯(lián)合使用。總的來說,CXCR3被證明是腫瘤中Treg細胞積累和免疫抑制的關鍵趨化因子受體。
3、雙免疫檢查點阻斷在功能失調的CD8+ T細胞和活化的Treg細胞室中誘導相似的改變

為了探討新輔助PD-1和CTLA4阻斷對治療- 初始頭頸部鱗狀細胞癌瘤內T細胞的影響,我們分析了應答和無應答患者的原發(fā)腫瘤免疫浸潤。在基線時,活性(4-1BB/OX-40+)和非活性調節(jié)性CD4+ T細胞之間的比例較高與免疫治療應答相關。此外,在治療后,這些活躍的Treg群體顯示出應答患者的顯著減少。在一個類似的過程中,腫瘤內功能失調的CD8+ T細胞在有反應的患者中表現出活性和功能失調相關基因的表達降低,而在臨床無反應的NK細胞在治療早期表現出增加的細胞毒性譜。這些數據揭示了對PD-1/CTLA4雙重阻斷的免疫變化,包括應答患者中假定的腫瘤反應性Treg和CD8+ T細胞區(qū)室的平行重塑,并表明在基線時激活Treg的存在可能與應答有關。
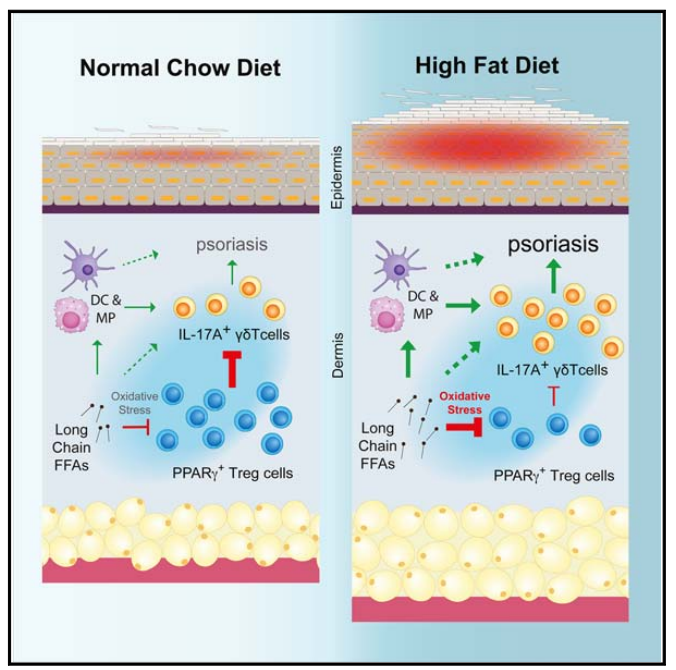
4、肥胖引起的皮膚PPARγ+ Treg細胞失調促進IL - 17A介導的銀屑病炎癥

肥胖是銀屑病的主要危險因素,但肥胖如何破壞控制皮膚炎癥的調節(jié)機制尚不清楚。在這里,我們發(fā)現皮膚富含獨特的CD4+ Foxp3+表達核受體過氧化物酶體增殖激活受體γ (PPARγ)的調節(jié)性T (Treg)細胞群。PPARγ驅動了IL-17A+ γδ T細胞介導的銀屑病炎癥的獨特轉錄程序和功能抑制。然而,飲食誘導的肥胖導致PPARγ+皮膚Treg細胞減少,并相應失去對IL-17A+ γδ T細胞介導的炎癥的控制。在機制上,肥胖小鼠的PPARγ+皮膚Treg細胞優(yōu)先吸收高水平的長鏈游離脂肪酸,從而導致細胞脂毒性、氧化應激和線粒體功能障礙。利用這些PPARγ+皮膚Treg細胞的抗炎特性可能具有治療肥胖相關炎癥性皮膚病的潛力。
5、肥胖引起的皮膚PPARγ+ Treg細胞失調促進IL - 17A介導的銀屑病炎癥

白細胞介素-2 (IL-2)是一種多效性細胞因子,通過調節(jié)性T細胞(Tregs)和效應細胞協(xié)調雙向免疫反應,導致矛盾的后果。在這里,我們報告了一種策略,利用遺傳密碼擴展引導將潛在的生物反應性人工氨基酸氟硫酸鹽- L -酪氨酸(FSY)結合到IL-2中,與IL-2Rα進行接近性共價結合,以選擇性地促進Treg激活。我們發(fā)現,攜帶FSY的IL-2變體,如L72-FSY,在接近時通過硫氟交換與IL-2Rα共價結合,導致IL-2的持續(xù)循環(huán),并選擇性地促進Tregs細胞的擴增,而不是效應細胞。對L72-FSY擴增Tregs的進一步評估表明,L72-FSY將Tregs維持在中樞記憶表型,而不會驅動終末分化,這可以通過淋巴細胞活化基因3 (LAG-3)的表達減弱和程序性細胞死亡蛋白1 (PD-1)的表達增強來證明。與野生型IL-2治療相比,皮下給藥L72-FSY對普利坦誘導的狼瘡和移植物抗宿主病(GvHD)小鼠模型的治療效果增強且持續(xù)。通過N端聚乙二醇修飾,L72-FSY的療效進一步提高,從而增加了其循環(huán)保留,從而獲得優(yōu)先和持續(xù)的效果。這種接近共價結合策略可能會加速多效細胞因子作為一類新的免疫調節(jié)療法的發(fā)展。
6、自身免疫性腎臟疾病和移植中的調節(jié)性T細胞

表達轉錄因子叉頭盒蛋白P3 (FOXP3)的調節(jié)性T (Treg)細胞天然存在于免疫系統(tǒng)中,并在維持免疫自身耐受和免疫系統(tǒng)和組織穩(wěn)態(tài)中發(fā)揮作用。Treg細胞通過多種機制,特別是通過控制抗原提呈細胞的功能,抑制T細胞的活化、擴增和效應功能。它們還可以通過抑制炎癥和促進組織再生來促進組織修復,例如,通過產生生長因子和促進干細胞分化和增殖。Treg細胞的單基因異常和Treg細胞功能分子的遺傳變異可導致或使患者易患自身免疫性疾病和其他炎癥性疾病,包括腎臟疾病。Treg細胞可以潛在地利用或靶向治療免疫疾病并建立移植耐受性,例如,通過使用IL-2或小分子在體內擴增天然Treg細胞,或通過在體外擴增它們以進行過繼性Treg細胞治療。目前正在努力將抗原特異性的傳統(tǒng)T細胞轉化為Treg細胞,并從天然Treg細胞中產生嵌合抗原受體Treg細胞,用于過繼性Treg細胞治療,目的是在臨床中實現抗原特異性免疫抑制和耐受。
參考文獻
1. Glasner A, Rose SA, Sharma R, Gudjonson H, Chu T, Green JA, Rampersaud S, Valdez IK, Andretta ES, Dhillon BS, Schizas M, Dikiy S, Mendoza A, Hu W, Wang ZM, Chaudhary O, Xu T, Mazutis L, Rizzuto G, Quintanal-Villalonga A, Manoj P, de Stanchina E, Rudin CM, Pe'er D, Rudensky AY. Conserved transcriptional connectivity of regulatory T cells in the tumor microenvironment informs new combination cancer therapy strategies. Nat Immunol. 2023 Jun;24(6):1020-1035. doi: 10.1038/s41590-023-01504-2. Epub 2023 May 1. PMID: 37127830; PMCID: PMC10232368.
2. Moreno Ayala MA, Campbell TF, Zhang C, Dahan N, Bockman A, Prakash V, Feng L, Sher T, DuPage M. CXCR3 expression in regulatory T cells drives interactions with type I dendritic cells in tumors to restrict CD8+ T cell antitumor immunity. Immunity. 2023 Jul 11;56(7):1613-1630.e5. doi: 10.1016/j.immuni.2023.06.003. Epub 2023 Jun 30. PMID: 37392735.
3. van der Leun AM, Traets JJH, Vos JL, Elbers JBW, Patiwael S, Qiao X, Machuca-Ostos M, Thommen DS, Haanen JBAG, Schumacher TNM, Zuur CL. Dual Immune Checkpoint Blockade Induces Analogous Alterations in the Dysfunctional CD8+ T-cell and Activated Treg Compartment. Cancer Discov. 2023 Oct 5;13(10):2212-2227. doi: 10.1158/2159-8290.CD-22-0851. PMID: 37548431; PMCID: PMC10551666.
4. Sivasami P, Elkins C, Diaz-Saldana PP, Goss K, Peng A, Hamersky M 4th, Bae J, Xu M, Pollack BP, Horwitz EM, Scharer CD, Seldin L, Li C. Obesity-induced dysregulation of skin-resident PPARγ+ Treg cells promotes IL-17A-mediated psoriatic inflammation. Immunity. 2023 Aug 8;56(8):1844-1861.e6. doi: 10.1016/j.immuni.2023.06.021. Epub 2023 Jul 20. PMID: 37478855; PMCID: PMC10527179.
5. Zhang B, Sun J, Yuan Y, Ji D, Sun Y, Liu Y, Li S, Zhu X, Wu X, Hu J, Xie Q, Wu L, Liu L, Cheng B, Zhang Y, Jiang L, Zhao L, Yu F, Song W, Wang M, Xu Y, Ma S, Fei Y, Zhang L, Zhou D, Zhang X. Proximity-enabled covalent binding of IL-2 to IL-2Rα selectively activates regulatory T cells and suppresses autoimmunity. Signal Transduct Target Ther. 2023 Jan 23;8(1):28. doi: 10.1038/s41392-022-01208-3. PMID: 36690610; PMCID: PMC9871032.
6. Mikami N, Sakaguchi S. Regulatory T cells in autoimmune kidney diseases and transplantation. Nat Rev Nephrol. 2023 Sep;19(9):544-557. doi: 10.1038/s41581-023-00733-w. Epub 2023 Jul 3. Erratum in: Nat Rev Nephrol. 2023 Nov;19(11):747. PMID: 37400628.






