TREM2巨噬細胞是乳腺癌肺轉移邊界的調節因子
乳腺癌仍然是婦女癌癥相關死亡的主要原因之一。乳腺癌的死亡幾乎都是腫瘤轉移導致的。肺部是乳腺癌最常見的轉移部位之一,診斷后中位生存時間不到兩年。為解開乳腺癌轉移的秘密,作者對免疫微環境的綜合分析揭示了轉移級聯過程中免疫細胞分子狀態的關鍵改變,并闡明了乳腺癌轉移不同空間,不同免疫亞群的景觀。本文于2023年9月發布在《Cancer Discovery》,IF=28.2。
技術路線
主要研究結果
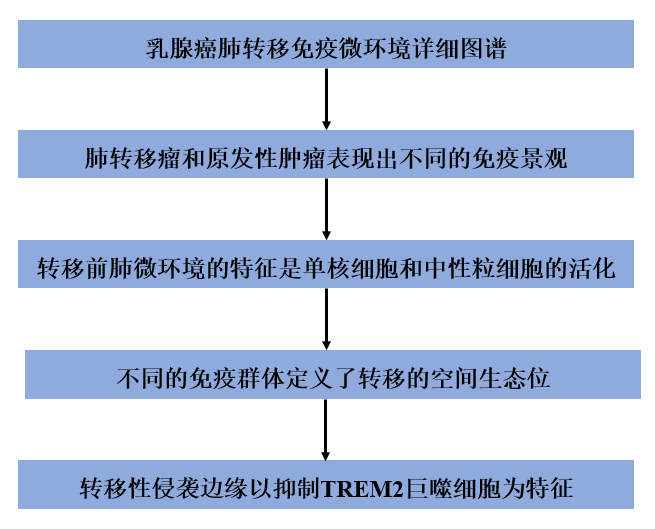
1、乳腺癌肺轉移免疫微環境詳細圖譜
最近的研究利用scRNA-seq鑒定了原發性乳腺腫瘤的免疫微環境。然而,大多數研究忽視了對轉移灶免疫微環境的綜合分析。為了確定轉移微環境以及轉移前生態位的異質性和可塑性的原理,作者開始在時間和空間上解剖轉移相關免疫細胞在轉移進展過程中的功能亞群。為此,作者利用小鼠自發性肺轉移模型,將tdTomato-EO771乳腺癌細胞原位注射到乳腺(圖1A)。為了模擬臨床環境,手術切除原發腫瘤,隨后發生自發性肺轉移。作者分離并分析了不同階段和空間區域的免疫細胞。作者收集了原發乳腺腫瘤切除前小鼠轉移前生態位(pre-MET)和明顯轉移灶小鼠的細胞。然后,在原發腫瘤切除后,每周使用CT監測小鼠的轉移情況,并在首次CT檢測到轉移后不久收集樣本。使用tdTomato標記和顯微鏡檢查,作者能夠區分含有轉移灶的肺組織和遠端正常組織。還從未發生轉移的小鼠身上收集細胞,歸類為無復發。為了解剖和比較不同空間區域的免疫微環境,作者利用光激活GFP (PA-GFP)小鼠作為乳腺腫瘤和自發性轉移的受體,從而通過應用NICHE-seq技術進行空間分析。最后,作者從對照PA-GFP小鼠的肺中分離出免疫細胞,并將來自EO771-tdTomato原發腫瘤的免疫細胞納入圖譜。對27只小鼠的63份樣本進行scRNA測序。作者鑒定了9個T細胞和NK細胞群(圖1B和C),包括na?ve CD4和CD8細胞(CD4 Lel1和CD8 Dapl1),活化CD4 (CD4 S100a4)和CD8 (CD8 Gzmk和CD8 Gzma)細胞,功能失調的CD8 (CD8 Lag3)和Treg (Foxp3)細胞。NKs分為NK Ncr1和NK Xcl1兩個種群。骨髓細胞包括樹突狀細胞(DC)、單核細胞、巨噬細胞和中性粒細胞(圖1D)。樹突狀細胞分為cDC1 (Naaa)、cDC2 (CD209a)、遷移DC (migDC、Ccr7)和類漿細胞(Siglech)。單核細胞被分離成經典單核細胞(Mon Ace)和表達纖維連接蛋白(Mon Fn1)或血栓反應蛋白(Mon Thbs1)的單核細胞亞群。巨噬細胞分為肺泡巨噬細胞(Mac Cd9)、腫瘤相關巨噬細胞(Mac Cd81和Mac is20)和巨噬細胞群,作者之前鑒定為巨噬細胞調節細胞(Mregs),它們獨特地表達Trem2、Gpnmb和Cd63等基因。通過S100a8表達鑒定的中性粒細胞,通過Ptgs2(編碼前列腺素-內過氧化物合成酶,或COX2)、Ifit3、Lcn2和Camp的表達將其分為亞群。
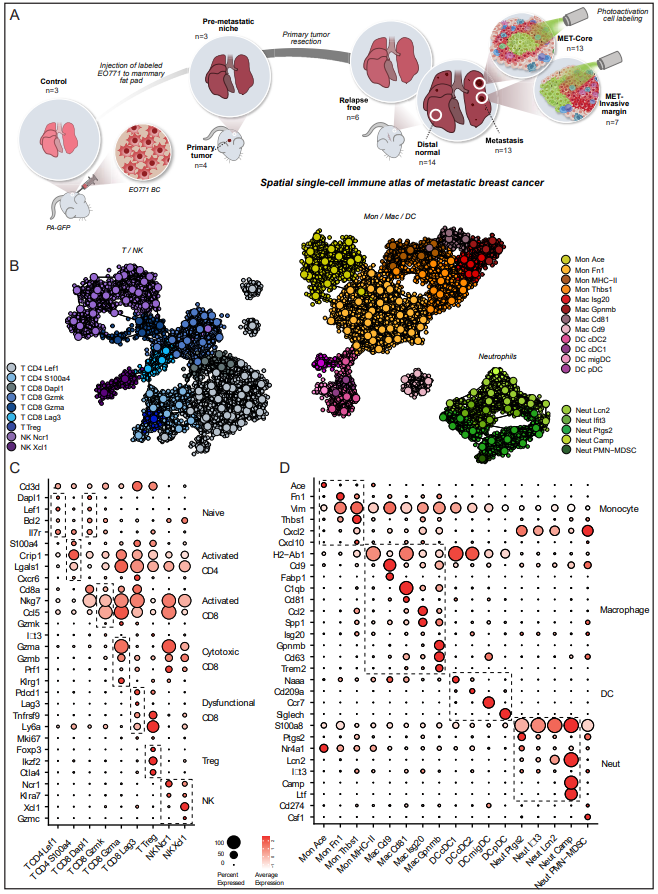
圖1. 乳腺癌肺轉移免疫微環境詳細圖譜
2、肺轉移瘤和原發性腫瘤表現出不同的免疫景觀
作者使用NICHE-Seq標記自發性轉移模型中的特異性轉移駐留細胞(圖2A),比較來自原發乳腺腫瘤和肺轉移核心的免疫細胞,而不是平均整個肺組織。為了確保肺組織的光激活不會引起捕獲細胞的偏差,作者對對照小鼠肺組織進行了光激活,并對GFP陽性或陰性的CD31CD45+細胞進行了分類。作者在細胞類型和亞群水平上比較了轉移瘤和原發腫瘤(PT)的整體免疫組成,發現原發腫瘤和轉移核心的免疫景觀高度不同(圖2B和C)。基于細胞類型和亞群頻率的主成分分析顯示,這兩個位置之間存在明顯的差異(圖2D),表明原發腫瘤的免疫景觀與轉移瘤的免疫景觀截然不同。具體來說,通過檢查主要免疫譜系的差異,作者發現與原發腫瘤相比,NK細胞增加,而B細胞和DC細胞在轉移中減少(圖2E)。雖然原發腫瘤與Tregs水平升高有關,但轉移時活化的CD8 Gzmk細胞、CD8 Gzma、功能失調的CD8 Lag3 T細胞水平升高,活化/na?ve T細胞比例總體增加(圖2F和G),表明一組不同的信號塑造了轉移性微環境。轉移瘤和原發瘤的主要單核細胞群都是Mon Thbs1,然而,轉移瘤增加了Mon Fn1的比例,減少了抗原呈遞Mon MHC-II(圖2H和I)。此外,雖然轉移瘤被Mac is20和Mregs浸潤,但原發瘤中的巨噬細胞主要是Mac Cd81群(圖2J),表達補體系統基因(C1qa/b/c, Fcna), MHC-II (H2-Ab1, Cd74, Cd81),Ccl8已被證明在乳腺癌腫瘤相關巨噬細胞(tam)中富集,并支持癌細胞傳播(圖2K和L)。因此,轉移性免疫微環境由不同的細胞亞群、途徑和檢查點組成,在設計臨床前藥物開發研究時應仔細考慮這些差異。
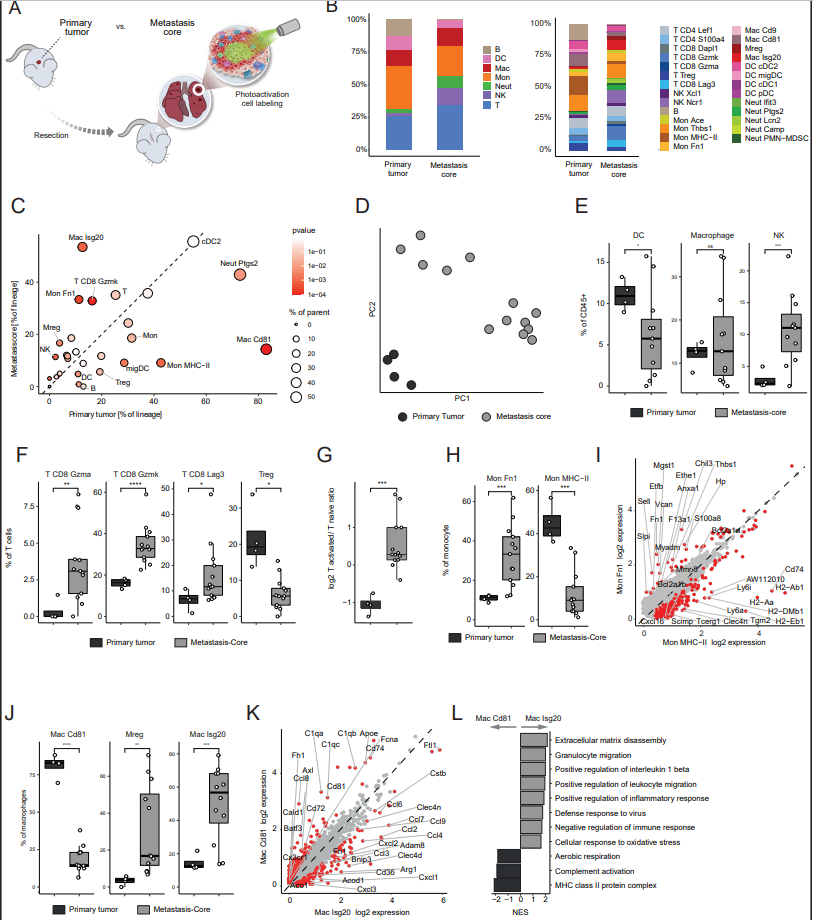
圖2. 肺轉移瘤和原發性腫瘤表現出不同的免疫景觀
3、轉移前肺微環境的特征是單核細胞和中性粒細胞的活化
為了研究轉移發生前肺部免疫環境的變化,作者比較了在原發腫瘤切除前注射EO771-tdTomato細胞系第20天正常肺和荷瘤小鼠肺的免疫環境(圖3)。作者發現荷瘤小鼠在這個轉移前階段就已經有了肺免疫環境的顯著改變(圖3B)。具體來說,巨噬細胞、B、NK和T細胞減少,而PreMET生態位中的中性粒細胞和單核細胞增加(圖3C)。有趣的是,在Pre-MET微環境中,常駐(肺泡)巨噬細胞的比例急劇減少(圖3C)。這些發現與先前報道的單核細胞和中性粒細胞在肺轉移前轉移階段的擴增一致。為了確保作者的發現不具有模型特異性或小鼠品系特異性,作者在另外一種三陰性乳腺癌小鼠模型中進行了類似的實驗。作者向WT (Balb/c)小鼠原位注射4T1-tdTomato細胞系,3周后手術切除原發腫瘤,每周進行CT監測,隨訪自發性肺轉移性復發。值得注意的是,在注射4T1乳腺癌模型的小鼠的Pre-MET肺中,中性粒細胞的增加和T細胞的減少也很明顯,這表明這種機制在肺轉移生態位的形成中通常很重要。NLR在臨床上被用作幾種癌癥適應癥的預后生物標志物,高血液NLR與不良預后相關。作者的研究結果表明,這些變化是在轉移級聯的早期引起的,并且在轉移前階段已經起作用。除了淋巴細胞的整體減少外,作者還觀察到活化的CD8 Gzmk和細胞毒性CD8 Gzma T細胞,表達顆粒酶(Gzma, Gzmb, Gzmk),Ccl4, Ccl5和Klrc1, Klrc2的減少(圖3D和E)。這些發現與先前報道的轉移前肺中T細胞功能障礙增加的研究一致。這些早期的免疫改變,可能是由原發腫瘤的系統信號引起的,暗示了免疫抑制在轉移前生態位的形成中,可能使到達生態位的播散性癌細胞免疫逃避。Pre-MET肺中最豐富的免疫細胞是單核細胞,與對照組相比,單核細胞的增加也最高(圖3B和C)。這種明顯的變化與單核細胞組成的轉變相吻合,其中Pre-MET中經典單核細胞(Mon Ace)被Mon Fn1群體所取代(圖3F)。monfn1細胞群的特點是炎癥特征,包括趨化因子受體Ccr2和Ccr1的表達增加,促進細胞募集、免疫抑制和腫瘤促進因子,如凝集素(Lgals3/9)和NLRP3炎性小體抑制劑Tmem176b(圖3G)。此外,與健康肺部的經典單核細胞Mon Ace相比,Mon Fn1細胞富含細胞外基質相關因子,如Mmp8、Vcan和纖維連接蛋白(Fn1),以及細胞間粘附和脂質代謝過程(如低密度脂蛋白受體Ldlr)。這些分子譜可能表明,ECM重塑和代謝改變先于轉移發生(圖3H)。與單核細胞類似,在轉移前的肺生態位中,中性粒細胞組成從高前列腺素表達的成熟細胞(Neut Ptgs2)轉變為促炎細胞(Neut Ifit3和Neut Lcn2)(圖3I)。炎癥中性粒細胞上調IFN-I信號、中性粒細胞次級顆粒因子(Ngp)和中性粒細胞胞外陷阱(NET)形成所需的Padi4的表達(圖3J)。基因集富集分析(GSEA)顯示,與正常肺中發現的Neut Ptgs2相比,Pre-MET富集的Neut Lcn2在趨化途徑、IL-1β產生和IFN-I中含量較高(圖3K)。這些發現表明,中性粒細胞在轉移前生態位介導炎癥微環境,促進轉移進展。為了評估不同免疫群體之間的相互作用,作者接下來使用CellChat算法分析了Pre-MET和對照肺免疫區間的細胞間相互作用。作者發現,除了單核細胞-中性粒細胞相互作用和單核細胞自分泌相互作用外,Pre-Met肺內相互作用強度總體降低(圖3L)。具體來說,在轉移前肺中上調的相互作用包括Ccl6(單核細胞)-Ccr2(中性粒細胞)信號軸(圖3L)。因此,作者假設這些分泌因子可能參與單核細胞和中性粒細胞向轉移前肺的募集。為了驗證這一點,作者進行了transwell試驗。收集對照組和轉移前小鼠的肺組織,將其加工成單細胞懸液,并將肺勻漿的非細胞部分用作骨髓源性細胞的化學吸引介質(圖3M)。流式細胞術分析骨髓細胞的遷移情況。作者發現,與正常肺的分泌因子相比,來自Pre-met肺的分泌因子顯著增強了單核細胞(CD45+ Ly6C+)和粒細胞(CD45+ Ly6G+)的遷移(圖3N)。此外,在Pre-MET肺勻漿中,CCL6的功能性抑制顯著減少了單核細胞的募集(圖3N),這表明該信號軸在免疫轉移生態位的形成中具有功能性作用。總之,這些數據表明,在原發性乳腺癌腫瘤存在時,肺免疫環境經歷了巨大的重塑,包括單核細胞和中性粒細胞特異性炎癥群的涌入,而肺泡巨噬細胞、活化的T細胞和NK細胞群則減少。這些系統性的變化可能有助于形成一個適宜的微環境,有利于播散性癌細胞的播種和擴張。
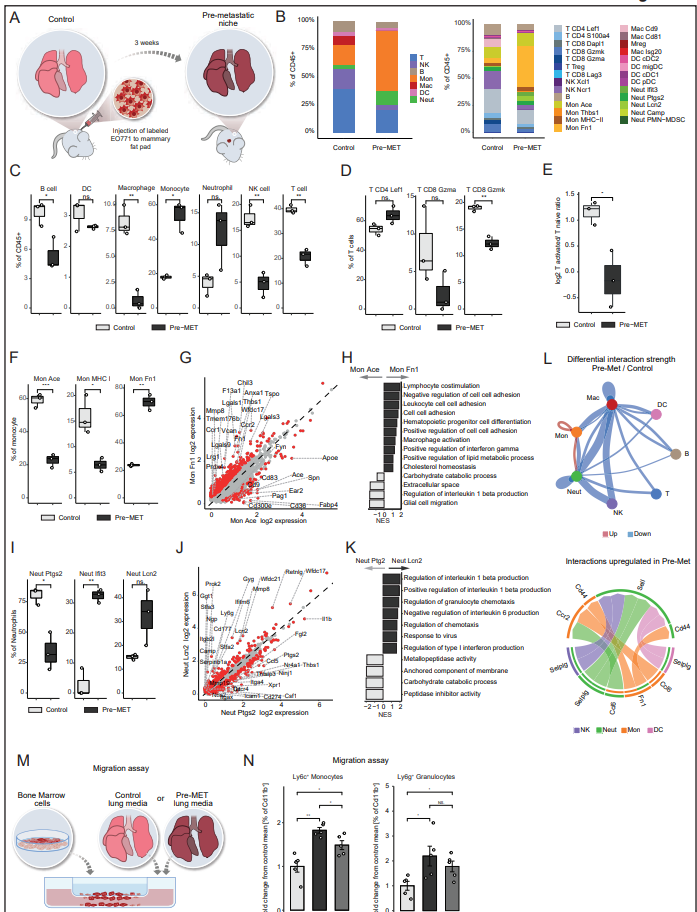
圖3. 轉移前肺微環境的特征是單核細胞和中性粒細胞的活化
4、不同的免疫群體定義了轉移的空間生態位
為了更好地了解轉移生態位的組成,作者接下來對免疫mTME生態位本身進行了表征,并分析了來自肺轉移病變的細胞與同一肺遠端正常組織的比較,并與對照小鼠進行了比較(圖4A)。與作者在Pre-met肺中發現的免疫重塑類似,遠端正常和轉移組織均表現出單核細胞和中性粒細胞的富集,相反,與對照組相比,B細胞、淋巴細胞和nk的豐度較低,這代表了Pre-met表型的持久性(圖4B)。有趣的是,從未發生肺轉移(無復發)的小鼠肺中的免疫微環境與對照小鼠相似(圖4B),進一步表明免疫mTME的重塑對于轉移進展至關重要。對轉移瘤和遠端正常組織主要免疫譜系差異的分析顯示,巨噬細胞的富集是最顯著的變化(圖4B)。為了更好地表征肺轉移空間生態位之間的差異,作者比較了免疫亞群頻率,并對不同空間區域的細胞組成進行了PCA,確定了三種組織原型(圖4C)。一種由來自非腫瘤/轉移小鼠的組織組成,即對照樣本和無復發部位,富含淋巴細胞和NK細胞(藍色)。第二組由Pre-met和遠端正常組織組成,富含中性粒細胞和單核細胞,特別是Mon Fn1(橙色)。第三種原型由轉移組織組成,富含表達IFN-I的單核細胞、巨噬細胞和抑制性Mregs(紅色)。為了進一步鑒定分離轉移和遠端正常組織的細胞模塊,作者將不同樣本的組織組成進行了關聯(圖4D)。共識層次聚類揭示了四個單元模塊。具體來說,作者確定了一個抑制性細胞模塊,由功能失調的CD8 Lag3、Tregs、PMN-MDSCs、Mregs和表達Mon Thbs1和Mac is20亞群的IFN-I組成。該細胞模塊僅在轉移中發現(圖4E)。單核細胞是遠端正常組織和轉移組織中最豐富的細胞類型(如PreMET),與對照組相比增加最多(圖4B)。這種浸潤由特定的單核細胞亞群組成。遠端正常組織和轉移組織都相對缺乏經典的循環單核細胞表型(Mon Ace),取而代之的是Mon Fn1群(Pre-met肺的主要成分)。轉移組織也被Mon Thbs1群體高度浸潤,遠端正常浸潤程度較小(圖4F)。這種基因表達譜可能表明,轉移特異性單核細胞支持初始轉移灶中的炎癥和血管形成過程。轉移中的巨噬細胞有兩個特定的轉移相關巨噬細胞群,Mac is20和Mreg(圖4G)。作者通過流式細胞術從對照組、Pre-MET或轉移性肺中分離巨噬細胞(CD45+ F4/80+),并將其與T細胞(從na?ve小鼠中分離)共培養。對T細胞增殖能力的分析顯示,與從對照組或Pre-MET組織分離的巨噬細胞相比,從轉移性肺組織分離的巨噬細胞能減弱T細胞的增殖(圖4J)。總之,與對照肺組織相比,轉移性免疫微環境的戲劇性重編程表明轉移性復發影響整個器官。此外,這一過程的特點是特定區域的改變,以及在轉移性肺組織中促進免疫抑制的微生態位的發展。
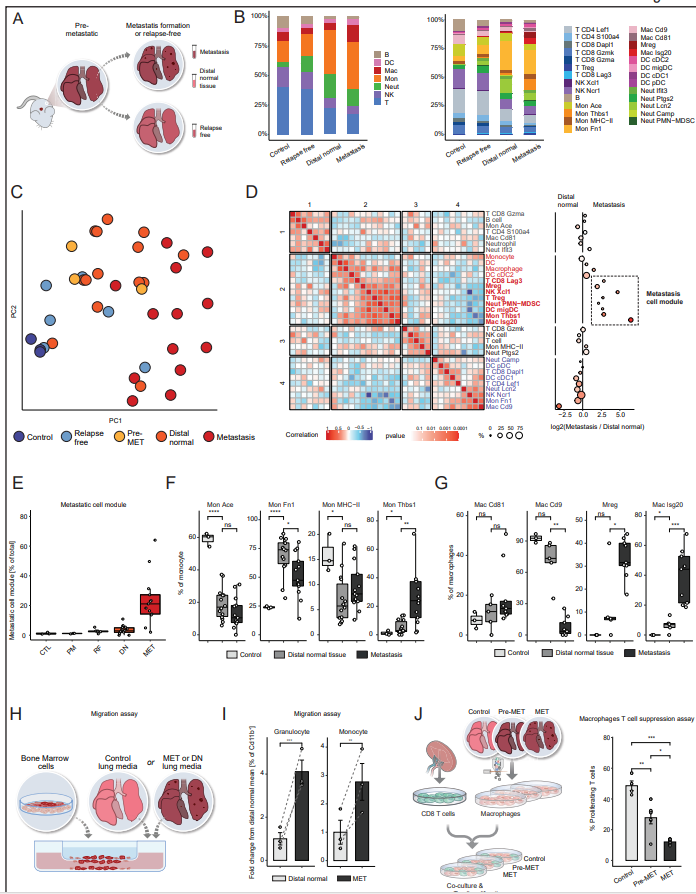
圖4. 肺轉移的進展與非常規免疫細胞亞型的浸潤有關
5、轉移性侵襲邊緣以抑制TREM2巨噬細胞為特征
在幾種癌癥類型和小鼠模型中,腫瘤浸潤邊緣具有不同于腫瘤核心的特定細胞群。因此,作者接下來要問的是,在轉移性病變中是否也存在類似的差異。作者的自發轉移模型使作者不僅能夠標記位于轉移灶核心的細胞,還能夠標記位于浸潤邊緣的細胞- tdtomato標記的轉移灶周圍的區域(圖5A和B)。作者發現轉移的核心和浸潤邊緣是不同的生態位,顯示不同的免疫組成(圖5C和D)。與遠端正常組織相比,在轉移組織中富集的Tregs和PMN-MDSCs實際上幾乎只存在于轉移核心,而不存在于浸潤邊緣,這表明在這些不同的轉移壁位中存在獨特的信號傳導(圖5E)。在單核細胞內,monthbs1群體高度集中在轉移核心,而monfn1在轉移灶浸潤邊緣占主導地位(圖5F)。巨噬細胞亞群在轉移核心和邊緣之間也存在差異,Mac Isg20群體主導核心,而Mregs群體主導邊緣(圖5g)。Mac is20的特征是中性粒細胞趨化劑Cxcl1/Cxcl2/Cxcl3的表達,之前與轉移形成有關,c型凝集素結構域家族成員Clec4d和Clec4n, Il1b和IFN-I信號基因的表達。作者的分析顯示,Mreg巨噬細胞表達強有力的抑制性免疫檢查點,包括Trem2、Gpnmb和Cd63(圖5H)。與葡萄糖分解代謝導向的Mac is20相比,Mregs偏向于脂質分解代謝,并且在腫瘤相關巨噬細胞中表達組織蛋白酶B、D、K和S的水平升高(圖5I)。具體而言,轉移核心的單核細胞和巨噬細胞Ccl2、Ccl7和Ccl12的表達增加,與Ccr2表達增加相一致。單核細胞、巨噬細胞和中性粒細胞之間的Ccl6/9/-Ccr1信號軸在轉移核中也上調。該軸也可以直接作用于表達Ccr1受體的癌細胞,促進它們在肺部的滯留。為了更好地闡明轉移核心和浸潤邊緣組成的差異,作者進行了細胞模塊分析,其中作者將轉移核心和浸潤邊緣細胞的細胞群頻率聯系起來,揭示了四種細胞模塊。模塊1由浸潤邊緣富集cDC1、Mon Fn1、Mac Cd9和Mreg組成。模塊2由核心富集的Treg、cDC2、Mon Thbs1和Mac is20組成。IFN-I信號傳導對TME中的不同細胞有一系列影響,可以增加抗腫瘤免疫,也可以在信號傳導持續的情況下導致免疫功能障礙。值得注意的是,核心富集的細胞模塊都具有IFN-I信號基因的上調,這表明這是轉移核心的一個主要特征。為了確定肺轉移壁龕中空間上不同的細胞群,作者進行了一項分析,比較了轉移性組織與遠端正常組織的富集,以及核心與浸潤邊緣的富集。有趣的是,除了Mregs外,細胞群的動態是相關的。換句話說,除了Mregs外,所有轉移富集的群體也在轉移核心中富集。這一發現表明,Mreg巨噬細胞群位于轉移灶周圍,而非轉移灶核心,是轉移灶肺組織的標志(圖5J)。有趣的是,最近也觀察到Mreg人群對免疫治療不良反應具有高度預測性。接下來,作者研究了轉移性肺組織中巨噬細胞群體的特定空間域是否與它們調節T細胞激活的不同功能有關。因此,作者結合流式細胞術分析蛋白表達和scRNA-seq,使用指數排序來定義一個有效的小組,用于從轉移性肺組織中分離Mreg和功能分析。作者發現從轉移性肺組織中分離的Mregs顯示特異性標志物的共表達,包括CD9、PDPN、TREM2、GPNMB、SPP1和IL7R。相比之下,Mac Isg20細胞沒有表現出這種共表達模式(圖5K)。為了進一步驗證Mreg巨噬細胞在轉移中的空間分布,作者使用GPNMB作為Mreg群體的標記物,對EO771乳腺癌肺轉移進行了免疫熒光成像(圖5M)。事實上,GPNMB+細胞主要在轉移灶浸潤邊緣檢測到。進一步驗證作者的發現,在距離轉移邊界一定距離的間隔內定量GPNMB+細胞的百分比,證實Mregs在轉移浸潤邊緣高度富集(圖5N)。這些結果與作者之前的研究一致,表明脂肪組織或疾病相關小膠質細胞(DAM)中的TREM2+巨噬細胞存在于病理組織周圍,使其免受進一步的免疫損傷。CD9+ TREM2+巨噬細胞表達GPNMB、SPP1、FABP5和CD63,在小鼠和人肺纖維化中被報道,在疤痕邊緣富集。綜上所述,這些結果強調骨髓間室是區分轉移核心和侵襲前沿的免疫環境的主要特征,表明骨髓間室在轉移浸潤邊緣的免疫抑制和ECM重塑中起作用,從而掩蓋了轉移灶抗腫瘤免疫的作用,促進了轉移擴張。最后,作者想知道作者在乳腺癌肺轉移模型浸潤邊緣富集TREM2+ Mregs的發現是否也適用于人類肺轉移。為此,作者對包括乳腺癌、黑色素瘤和軟組織肉瘤在內的多種癌癥轉移患者的肺組織切片進行了免疫熒光成像。Mreg染色分析表明,與作者在小鼠肺轉移中的發現類似,TREM2+細胞在人肺轉移的侵襲邊緣積聚(圖6A),這表明巨噬細胞亞群的特定生態位空間分布在人免疫轉移生態位的形成中也起著關鍵作用。
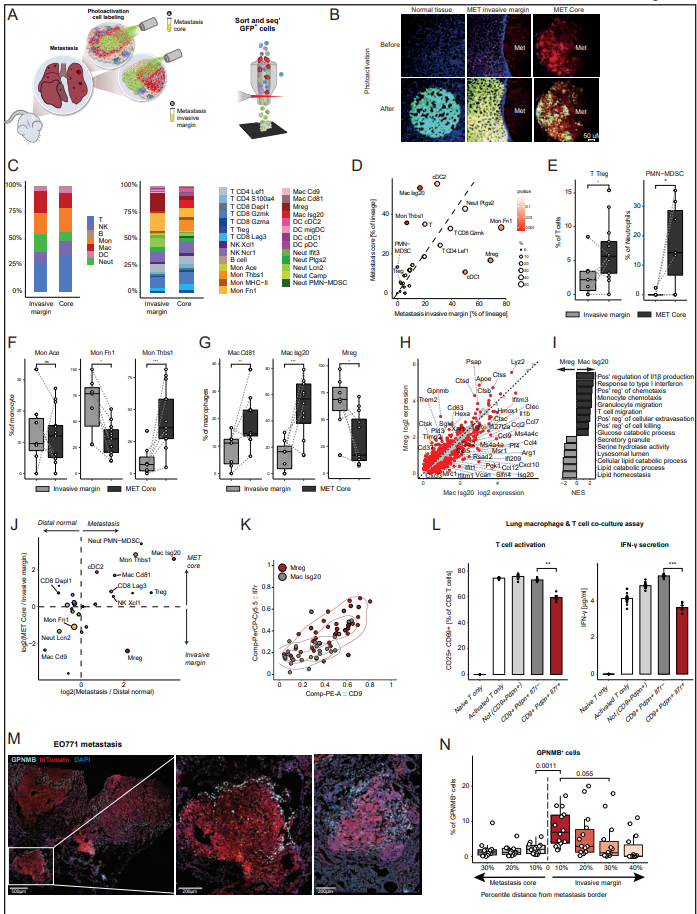
圖5. 轉移性浸潤邊緣由抑制性TREM2巨噬細胞填充
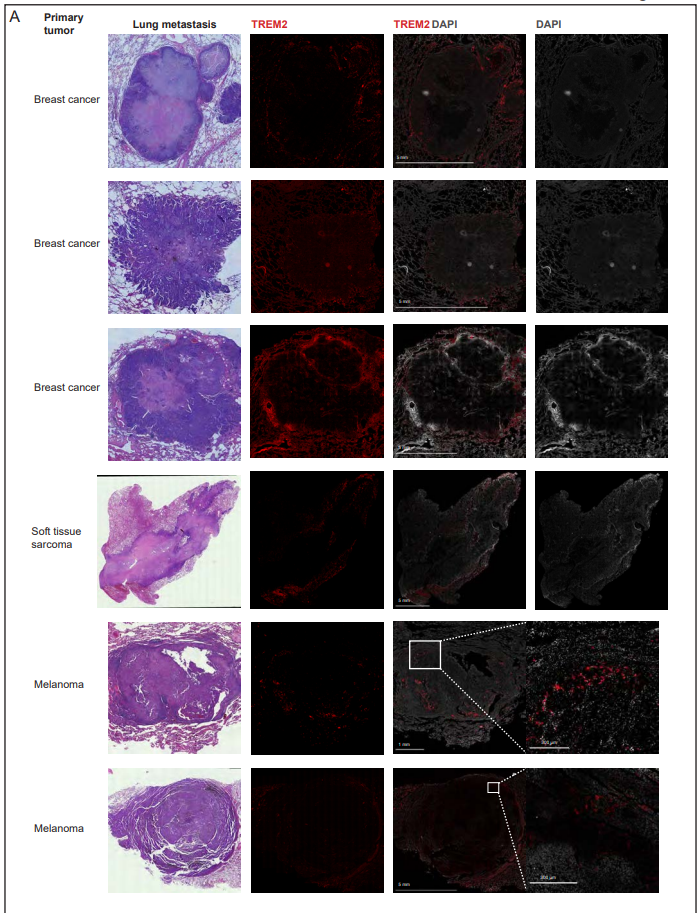
圖6. Mregs積聚在人肺轉移灶的浸潤邊緣
結論
總的來說,本研究的結果提供了對轉移性肺免疫微環境的更深入了解,并強調了巨噬細胞在促進或抑制腫瘤生長和進展中的重要性。這些發現可能對開發針對轉移生態位中特定巨噬細胞群體的新治療策略具有啟示意義。作者的研究結果強調了更好地了解器官特異性免疫變化的重要性,這有助于開發更準確、更有效的免疫療法來抑制轉移性復發。
實驗方法
原位腫瘤移植、single-cell RNA-seq、SPID-seq、遷移實驗、共培養實驗、免疫熒光、生信分析
參考文獻
Yofe I, Shami T, Cohen N, Landsberger T, Sheban F, Stoler-Barak L, Yalin A, Phan TS, Li B, Monteran L, Scharff Y, Giladi A, Elbaz M, David E, Gurevich-Shapiro A, Gur C, Shulman Z, Erez N, Amit I. Spatial and temporal mapping of breast cancer lung metastases identify TREM2 macrophages as regulators of the metastatic boundary. Cancer Discov. 2023 Sep 27. doi: 10.1158/2159-8290.CD-23-0299. Epub ahead of print. PMID: 37756565






