USP1通過去泛素化PARP1來阻止其蛋白酶體降解,從而促進(jìn)膽管癌的發(fā)展
盡管去泛素酶USP1(泛素特異性蛋白酶1)參與了多種癌癥的治療,但它在膽管癌(CCA)中的功能尚未得到研究。在本研究中,作者提供了USP1通過穩(wěn)定聚(ADP-核糖)聚合酶1(PARP1)促進(jìn)CCA進(jìn)展的證據(jù),這與USP1和PARP1在人類 CCA中均上調(diào)的觀察結(jié)果一致。對表達(dá)USP1的CCA細(xì)胞進(jìn)行的蛋白質(zhì)組學(xué)和泛素組分析發(fā)現(xiàn),PARP1是USP1的主要底物。事實上,通過一系列免疫熒光、共免疫沉淀(CO-IP)和GST牽引試驗驗證了它們的直接相互作用,并利用缺失突變體確定了它們的相互作用區(qū)域。從機(jī)理上講,USP1清除了PARP1 K197 處的泛素鏈,阻止了其蛋白酶體降解,從而使PARP1趨于穩(wěn)定,這是促進(jìn)CCA體外和體內(nèi)生長和轉(zhuǎn)移的必要條件和充分條件。此外,作者還發(fā)現(xiàn)乙酰轉(zhuǎn)移酶GCN5可在K130處對USP1進(jìn)行乙酰化,從而增強(qiáng)USP1和PARP1之間的親和力,進(jìn)一步提高PARP1蛋白的穩(wěn)定性。最后,USP1和PARP1都與CCA患者的不良生存率密切相關(guān)。這些研究結(jié)果表明,PARP1是USP1的新型去泛素化靶點,也是CCA的潛在治療靶點。本文于2023年10月發(fā)表于《cell death & disease》,IF=9。
技術(shù)路線
主要實驗結(jié)果
1. PARP1是CCA中USP1去泛素化酶活性的主要靶標(biāo)
為了闡明USP1可能參與了CCA的發(fā)生和發(fā)展,作者首先發(fā)現(xiàn)與TCGA數(shù)據(jù)庫中的鄰近組織相比,USP1在CCA組織中顯著上調(diào)(圖1A)。接下來,作者建立了過表達(dá)USP1的穩(wěn)定RBE細(xì)胞系,并進(jìn)行了基于質(zhì)譜儀的總蛋白質(zhì)組學(xué)分析和泛素化特異性蛋白質(zhì)組學(xué)分析(圖1B)。結(jié)合質(zhì)譜結(jié)果,作者選出了前10個候選蛋白,并用 IP 檢測法對它們進(jìn)行了單獨檢測。其中,只有PARP1(圖1C)驗證了與USP1的相互作用。PARP1是一種眾所周知的癌癥相關(guān)蛋白,在許多癌癥類型中都會發(fā)生PTM(翻譯后修飾),因此作者將其作為后續(xù)機(jī)理研究的重點。
為了進(jìn)一步驗證觀察到的USP1-PARP1相互作用,作者在CCA細(xì)胞系HuCC-T1、HCCC-9810、RBE和HEK-293T中進(jìn)行了確證CO-IP試驗(圖1D-H)。免疫熒光染色證實它們主要共定位在細(xì)胞核內(nèi),一小部分分布在HuCC-T1、HCCC-9810和RBE 細(xì)胞的細(xì)胞質(zhì)中(圖1I)。為了獲得更高的特異性和靈敏度,作者還使用靶向USP1 和內(nèi)源性PARP1的一抗以及用特異性檢測寡核苷酸標(biāo)記的二抗進(jìn)行了近距離連接試驗(PLA)。作者在細(xì)胞核和細(xì)胞質(zhì)中都觀察到了主要的PLA信號(圖1J),進(jìn)一步支持了USP1-PARP1的直接相互作用。使用重組蛋白GST-USP1或無催化活性的突變體GST-USP1 C90S進(jìn)行的體外GST牽引實驗表明,兩種純化蛋白都能與Myc-PARP1結(jié)合,而GST本身在無細(xì)胞條件下不能與Myc-PARP1結(jié)合(圖1K),這表明它們的直接相互作用與USP1的酶活性無關(guān)。
為了研究USP1和PARP1之間相互作用的特定區(qū)域,作者生成了這兩種蛋白的截短突變片段(圖1L、M),以確定結(jié)合位點。作者在HEK-293T細(xì)胞中進(jìn)行的轉(zhuǎn)染實驗表明,缺失USP1的201-785和401-785氨基酸會削弱其與PARP1結(jié)合的能力,而缺失1-200或1-400氨基酸則沒有影響(圖1N、O),這表明PARP1結(jié)合的關(guān)鍵區(qū)域在USP1的401-785氨基酸之間。對PARP1而言,缺失203-1014氨基酸就會失去與USP1的結(jié)合,而缺失1-203氨基酸或一系列C端截斷則會保留結(jié)合,包括缺失476-1014氨基酸;這些措施一起將與USP1結(jié)合的關(guān)鍵區(qū)域縮小到了PARP1的203-476氨基酸(圖1P),該區(qū)域包含已知的介導(dǎo)蛋白-蛋白相互作用的BRCT結(jié)構(gòu)域。這些實驗劃定了每種蛋白質(zhì)的關(guān)鍵相互結(jié)合區(qū)域。

圖 1:USP1與PARP1相互作用
2. USP1阻止PARP1蛋白降解
為了驗證USP1通過阻止PARP1降解直接穩(wěn)定PARP1的假設(shè),作者首先在HEK-293T細(xì)胞中以兩種劑量水平過表達(dá)USP1,并觀察到PARP1蛋白水平出現(xiàn)了相應(yīng)的梯度增加(圖2A)。在CCA細(xì)胞系中,敲除USP1導(dǎo)致PARP1蛋白水平下降,而 USP1過表達(dá)則產(chǎn)生相反的效果。接著,作者發(fā)現(xiàn)蛋白酶體抑制劑MG132逆轉(zhuǎn)了USP1 敲除導(dǎo)致的PARP1蛋白水平的降低,但沒有逆轉(zhuǎn)USP1過表達(dá)導(dǎo)致的PARP1蛋白水平的升高(圖2B-D)。相比之下,自噬體途徑抑制劑CQ未能逆轉(zhuǎn)USP1敲除對PARP1 的影響(圖2B)。通過qRT-PCR分析,作者觀察到USP1敲除或過表達(dá)對PARP1的 mRNA水平?jīng)]有任何顯著影響(圖2E、F)
接著,作者發(fā)現(xiàn)USP1敲除介導(dǎo)的PARP1蛋白減少在過表達(dá)USP1后幾乎完全恢復(fù),但催化活性不高的突變體USP1 C90S則不能(圖2G-I)。最后,作者給過表達(dá) USP1或USP1 C90S的RBE細(xì)胞施用蛋白質(zhì)合成抑制劑CHX。只有過表達(dá)野生型 USP1才能阻止PARP1蛋白降解(圖2J-K)。此外,在HuCC-T1和HCCC-9810細(xì)胞中,CHX 處理同樣會降低PARP1蛋白水平,而敲除USP1會進(jìn)一步加劇這種情況(圖2L-O)。綜上所述,這些結(jié)果表明USP1通過防止蛋白體降解對PARP1進(jìn)行翻譯后調(diào)控,而這需要USP1的催化活性。
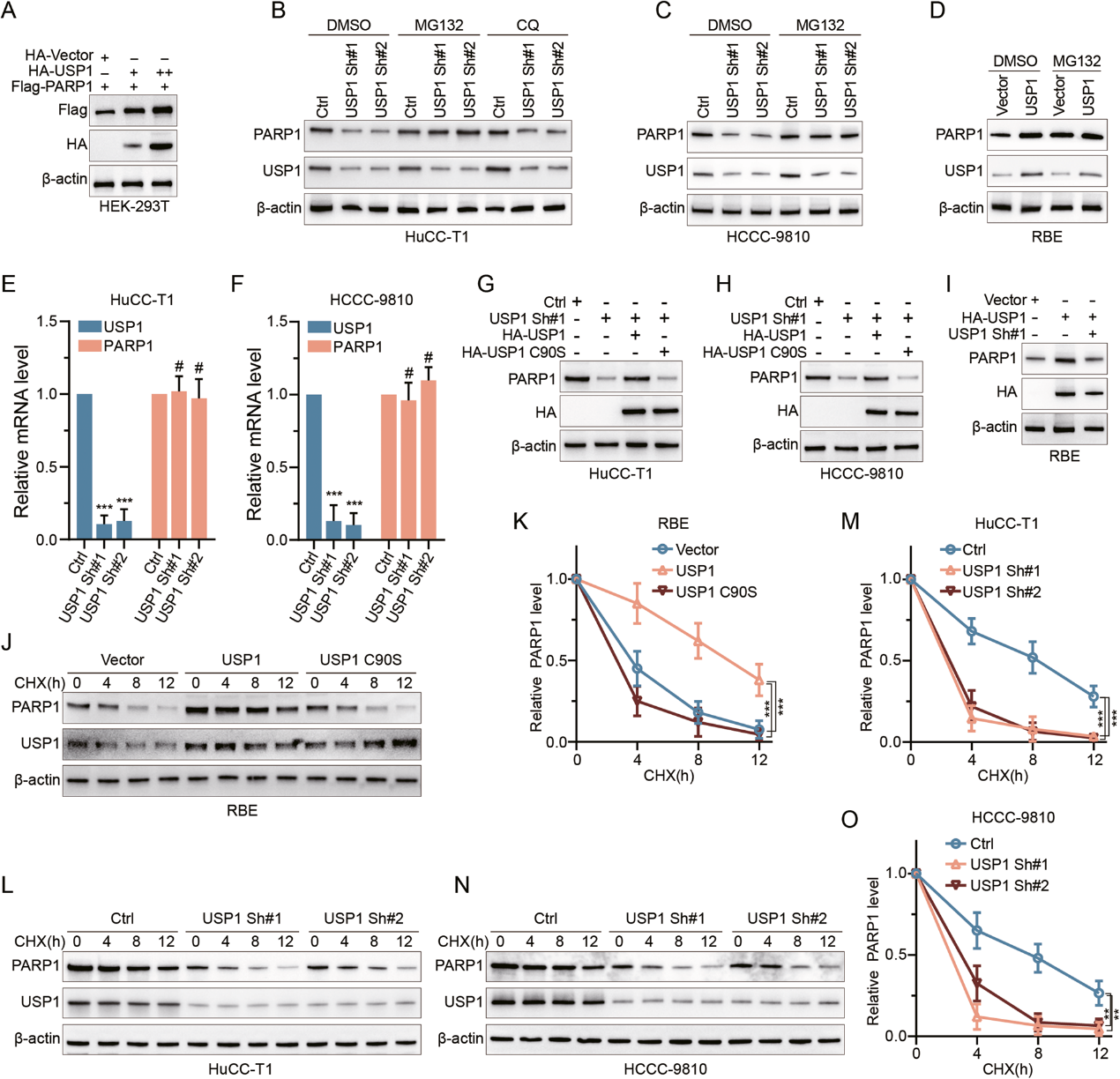
圖 2:USP1可增強(qiáng)PARP1的穩(wěn)定性。
3. USP1 通過去泛素化防止PARP1降解
作者觀察到,在HuCC-T1和HCCC-9810細(xì)胞中敲除USP1后,PARP1的內(nèi)源性泛素化水平增加(圖3A),這與USP1在CCA中直接去泛素化PARP1的情況一致。相反,轉(zhuǎn)染HA-USP1而非HA-USP1 C90S會導(dǎo)致HEK-293T和RBE細(xì)胞中外源性 PARP1泛素化水平下降(圖3B)。此外,隨著USP1用量的增加,PARP1的泛素化水平同樣進(jìn)一步下降(圖3C)。為了確定PARP1是否是USP1直接去泛素化的底物,作者在無細(xì)胞條件下將多泛素化的PARP1與純化的HA-USP1或HA-USP1 C90S共同結(jié)合。HA-USP1而不是HA-USP1 C90S 能特異性地去除PARP1的多泛素化鏈(圖 3D)。這些結(jié)果共同證實了USP1可直接去泛素 PARP1。
為了確定USP1靶向的PARP1賴氨酸位點,作者對泛素化特異性質(zhì)譜數(shù)據(jù)進(jìn)行了全面分析,觀察到Lys-197可能是USP1對PARP1進(jìn)行去泛素化的重要位點(圖3E)。作者還發(fā)現(xiàn),USP1并沒有對PARP1-K197R進(jìn)行泛素化(圖3F)。這表明K197 位點是控制PARP1降解的主要USP1泛素化靶點。
通過使用特定的泛素突變體,作者確定USP1能有效地裂解與lys48鏈接的 PARP1多泛素化,但不能裂解與lys63鏈接的PARP1多泛素化(圖3G)。此外,USP1對與 lys6、lys11、lys27、lys29 和 lys33 連接的PARP1的泛素化影響不大(圖3H)。在以泛素鏈為底物的體內(nèi)二泛素化形成實驗中,作者觀察到USP1能夠裂解K48鏈接的二泛素(圖3I)。總之,這些研究結(jié)果表明,USP1可作為一種針對PARP1上K197的去泛素化酶發(fā)揮作用。
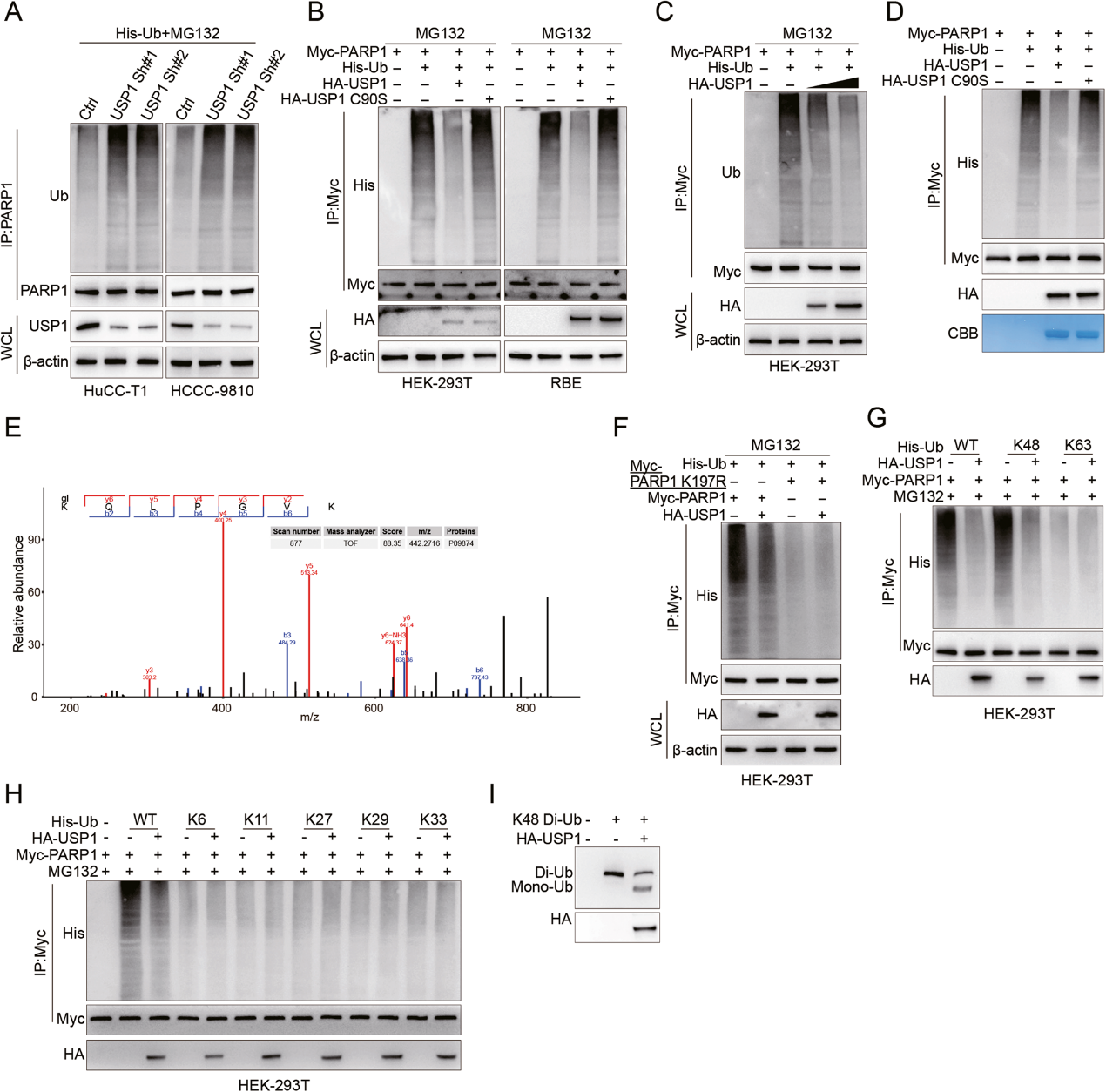
圖 3:USP1清除PARP1的K197上與K48鏈接的泛素鏈
4. USP1通過穩(wěn)定PARP1促進(jìn)CCA的增殖、侵襲和轉(zhuǎn)移
為了評估USP1介導(dǎo)的PARP1調(diào)節(jié)對CCA表型的功能影響,作者首先在HuCC-T1和HCCC-9810細(xì)胞中沉默USP1,結(jié)果體外細(xì)胞增殖受到抑制。相反,上調(diào)USP1 會增加RBE細(xì)胞的增殖。重要的是,這兩種效應(yīng)可分別通過過表達(dá)或敲除PARP1而逆轉(zhuǎn)(圖4A-C)。此外,抑制USP1會阻礙HCCC-9810和HuCC-T1的侵襲,而上調(diào) USP1會促進(jìn)RBE細(xì)胞系的侵襲。同樣,通過調(diào)節(jié) PARP1 的表達(dá)也可以逆轉(zhuǎn)這些情況(圖4D-G)。
接下來,作者發(fā)現(xiàn)敲除USP1會阻礙HuCC-T1異種移植物的體內(nèi)生長,而USP1 的過表達(dá)則會促進(jìn)RBE異種移植物的生長。與體外實驗類似,這兩種結(jié)果也可分別通過過表達(dá)或敲除PARP1而逆轉(zhuǎn)(圖4H-M)。此外,使用實驗性尾靜脈肺轉(zhuǎn)移方案,USP1 基因敲除導(dǎo)致轉(zhuǎn)移數(shù)量減少,而USP1基因過表達(dá)導(dǎo)致轉(zhuǎn)移數(shù)量增加,這同樣分別取決于PARP1基因過表達(dá)或基因敲除(圖4N,Q)。總之,這些發(fā)現(xiàn)表明 USP1 主要通過PARP1在體外和體內(nèi)促進(jìn)CCA的增殖和轉(zhuǎn)移。
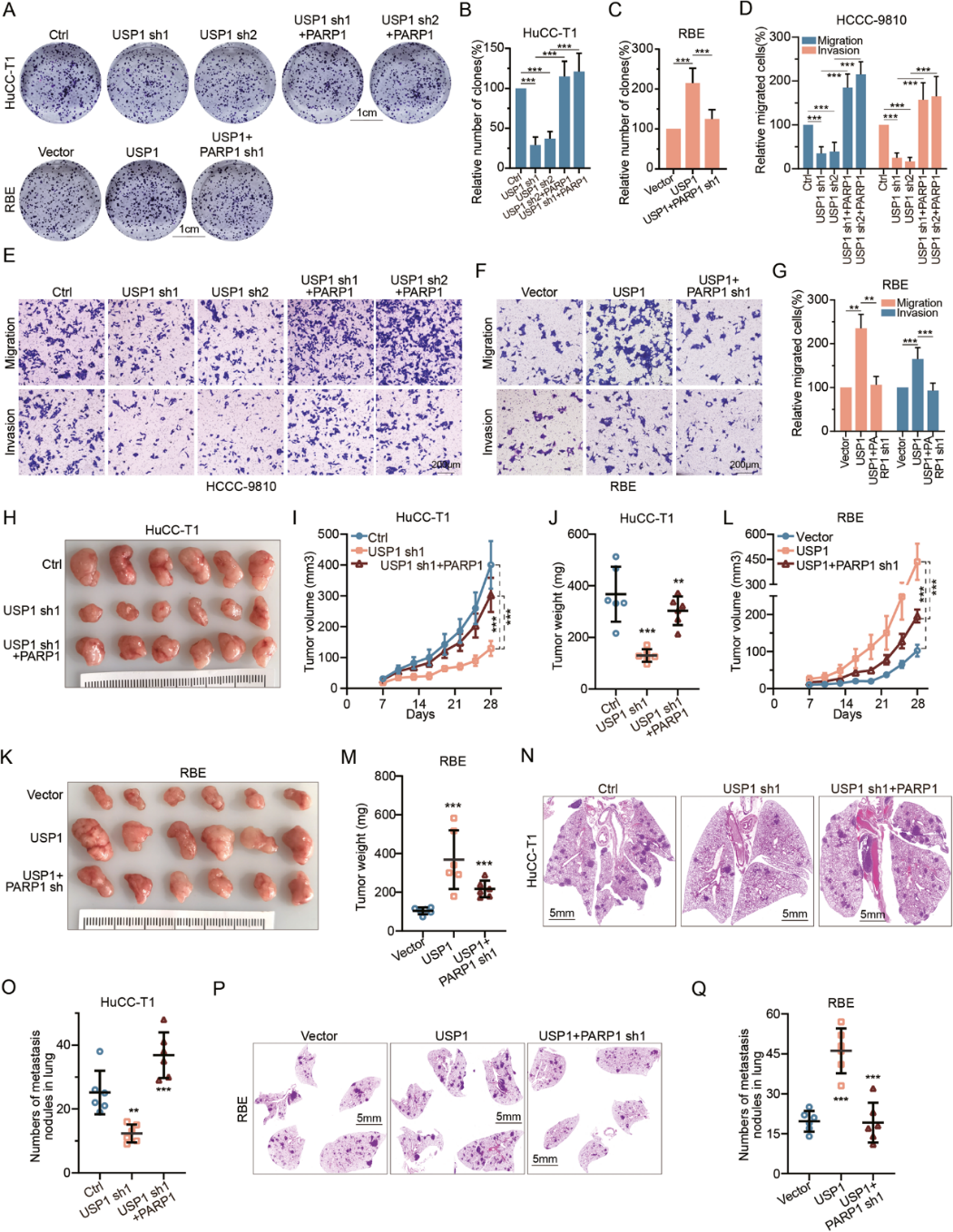
圖 4:USP1通過PARP1促進(jìn)CCA增殖、侵襲和轉(zhuǎn)移
5. GCN5可誘導(dǎo)USP1發(fā)生乙酰化,從而增強(qiáng)PARP1的穩(wěn)定性
作者接下來詢問USP1本身是否受PTM調(diào)節(jié)。在研究了蛋白質(zhì)組數(shù)據(jù)庫 PhosphoSitePlus 之后,作者發(fā)現(xiàn)USP1具有多個乙酰化位點,包括在不同物種中高度保守的K130(圖5A)。用去乙酰化酶抑制劑(TSA/NAM)處理后,IP分析顯示在 HuCC-T1和HCCC-9810中USP1的乙酰化顯著增加(圖5B)。一般來說,包括 P300、GCN5、PCAF、CBP和Tip60在內(nèi)的五種乙酰轉(zhuǎn)移酶介導(dǎo)了真核生物中約90%的蛋白質(zhì)乙酰化。使用所有5種乙酰轉(zhuǎn)移酶進(jìn)行的系統(tǒng)IP實驗發(fā)現(xiàn),GCN5是HEK-293T細(xì)胞中與USP1僅有的相互作用者(圖5C)。這種直接相互作用在CCA細(xì)胞中通過IP 和免疫熒光共定位實驗得到了證實(圖5D、E)。
接下來,作者在HEK-293T細(xì)胞中過表達(dá)GCN5,觀察到USP1乙酰化增加,而用GCN5抑制劑MB-3處理則會減少USP1乙酰化(圖5F)。作者通過創(chuàng)建不可乙酰化的USP1-K130R突變體,進(jìn)一步關(guān)注USP1上的K130位點。值得注意的是,在過表達(dá)GCN5時,HEK-293T細(xì)胞中USP1-K130R突變體的整體乙酰化水平并沒有增加(圖5G)。與此相一致的是,在HEK-293T和RBE細(xì)胞系中過表達(dá)乙酰基擬態(tài) K130Q USP1時,與野生型USP1相比,USP1 K130Q與PARP1之間的親和力更強(qiáng),PARP1 蛋白水平的增加也更明顯(圖5H,I),這表明K130乙酰化對USP1的功能有正向調(diào)節(jié)作用。然后作者發(fā)現(xiàn),與野生型USP1相比,USP1 K130R的過表達(dá)導(dǎo)致PARP1泛素化的增加(圖5J)。反之亦然,過表達(dá)USP1 K130Q會導(dǎo)致PARP1泛素化程度降低(圖5K)。此外,在HEK-293T和RBE細(xì)胞中,GCN5的共重表達(dá)增強(qiáng)了USP1 過表達(dá)對PARP1去泛素化的影響(圖5L)。最后,利用CHX蛋白合成抑制試驗,作者發(fā)現(xiàn)與野生型USP1相比,在RBE中過表達(dá)USP1 K130Q能顯著提高內(nèi)源性 PARP1蛋白水平的穩(wěn)定性(圖5M,N)。同樣,GCN5與USP1共重表達(dá)也增強(qiáng)了PARP1蛋白水平的穩(wěn)定性(圖5O,P)。總之,作者的研究結(jié)果確定了GCN5是主要的USP1乙酰化酶,其作用是將PARP1和USP1結(jié)合在一起。
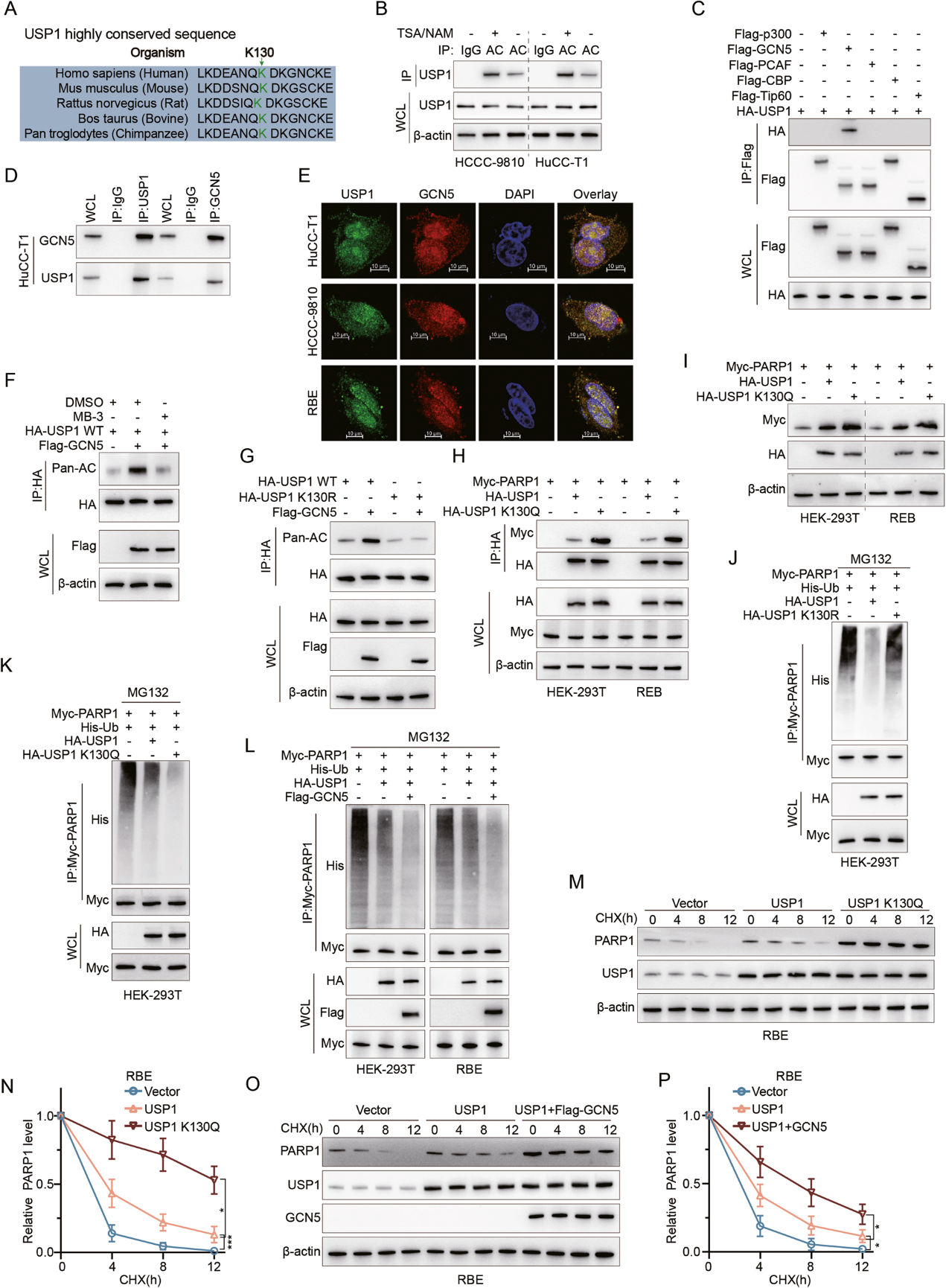
圖 5:GCN5誘導(dǎo)USP1乙酰化以加強(qiáng)PARP1的穩(wěn)定性
6. USP1與PARP1在CCA患者中的表達(dá)相關(guān)
為了評估USP1-PARP1軸在CCA中的臨床意義,作者首先研究了人類CCA樣本中USP1和PARP1蛋白表達(dá)之間的關(guān)系。通過免疫印跡分析,作者觀察到CCA樣本中USP1和PARP1蛋白水平呈正相關(guān)(n = 28,P < 0.0001,Pearson r = 0.3118)(圖 6A、B)。隨后,對CCA樣本(n = 65)進(jìn)行了USP1和PARP1的IHC染色。圖6C 和D展示了USP1和PARP1染色的代表性圖像,這兩種蛋白之間存在顯著的正相關(guān)性(Pearson r = 0.0002,P = 0.1987)。Kaplan-Meier 生存分析(n = 65)表明,USP1 或PARP1表達(dá)上調(diào)與總生存期縮短之間存在顯著相關(guān)性(圖6E、F)。這些發(fā)現(xiàn)共同表明,USP1在CCA患者中調(diào)控 PARP1,而兩者都與不利的預(yù)后顯著相關(guān)。圖 6G 顯示了本研究的總體設(shè)計,它表明GCN5在K130處乙酰化USP1,增強(qiáng)了USP1和 PARP1之間的親和力,進(jìn)一步提高了PARP1蛋白的穩(wěn)定性。

圖 6:USP1在CCA組織中富集,其表達(dá)與患者的存活率呈負(fù)相關(guān)
結(jié)論
總之,作者的研究結(jié)果表明,USP1作為一種去泛素化酶,通過對抗PARP1泛素化介導(dǎo)的降解來調(diào)節(jié)CCA的生長和轉(zhuǎn)移。此外,作者還證明這一調(diào)控機(jī)制受GCN5 對USP1乙酰化狀態(tài)的影響。GCN5-USP1-PARP1軸為乙酰轉(zhuǎn)移酶和去泛素化酶在 CCA發(fā)病機(jī)制中的作用提供了新的見解,并可能為開發(fā)針對這種致命疾病的更好的靶向療法鋪平道路。
常規(guī)分子實驗
免疫印跡、qRT-PCR、免疫組織化學(xué)、免疫熒光、免疫共沉淀、GST下拉試驗、體內(nèi)和體外去泛素化測定、質(zhì)譜
細(xì)胞實驗
質(zhì)粒轉(zhuǎn)染和慢病毒感染、 跨孔檢測、細(xì)胞克隆檢測、細(xì)胞凋亡測定、
動物模型及病理實驗
鄰位連接試驗、動物實驗
參考文獻(xiàn)
Zhang, D.Y., Zhu, Y., Wu, Q. et al. USP1 promotes cholangiocarcinoma progression by deubiquitinating PARP1 to prevent its proteasomal degradation. Cell Death Dis 14, 669 (2023). https://doi.org/10.1038/s41419-023-06172-6






