膀胱癌中TRMT6 / 61A依賴(lài)的堿基甲基化調(diào)控基因沉默活性和未折疊蛋白反應(yīng)
RNA修飾是RNA功能的重要調(diào)控元件。然而,大多數(shù)RNA修飾的全基因組圖譜都集中在信使RNA和轉(zhuǎn)移RNA上,但缺乏小RNA的此類(lèi)數(shù)據(jù)集。在這里,作者繪制了細(xì)胞小RNA空間中的N1 -甲基腺苷(m1 A)。以合成的m1 - A RNA為基準(zhǔn),作者的工作流程確定了含有m1 - A的小RNA的特定組,否則不成比例地代表性不足。特別是,22個(gè)核苷酸長(zhǎng)的3 ' tRNA片段高度富集于位于種子區(qū)的trmt6 / 61a依賴(lài)性m1 A。TRMT6/ 61a依賴(lài)性m1 - A負(fù)性影響trf -3的基因沉默。在TRMT6/61A過(guò)表達(dá)的膀胱尿路上皮癌中,檢測(cè)到tRF上較高的m1 A修飾,與tRF靶組失調(diào)相關(guān)。最后,TRMT6/61A調(diào)節(jié)參與未折疊蛋白反應(yīng)的tRF-3靶點(diǎn)。總之,作者的研究結(jié)果揭示了通過(guò)小RNA的堿基修飾調(diào)節(jié)基因表達(dá)的機(jī)制。這篇文章于2022年4月發(fā)表于《Nature Communication》IF:16.6。
技術(shù)路線

技術(shù)路線圖
主要研究結(jié)果
1. 小RNA空間中m1A位點(diǎn)的系統(tǒng)制圖
已知m1A會(huì)中斷常規(guī)的沃森-克里克A:U堿基配對(duì)(圖1a),并在為HTS準(zhǔn)備文庫(kù)時(shí)導(dǎo)致逆轉(zhuǎn)錄酶(RT)停滯。該特性可用于通過(guò)m1A位置的錯(cuò)配(錯(cuò)誤結(jié)合)來(lái)繪制m1A位點(diǎn)。為了系統(tǒng)地繪制小RNA(<50個(gè)核苷酸長(zhǎng))中潛在的m1A位點(diǎn),作者結(jié)合了兩種獨(dú)立的方法(圖1b): m1A抗體富集,然后進(jìn)行小RNA測(cè)序(m1A- rip -seq)和m1A誘導(dǎo)的錯(cuò)配測(cè)序。為了首先確定用于標(biāo)準(zhǔn)小RNA測(cè)序的m1A兼容RT,使用具有單個(gè)m1A位點(diǎn)的合成小RNA測(cè)試了三種候選RT (protoscriptii -一種常用的M-MuLV RT,tgir -模板切換組II逆轉(zhuǎn)錄酶和工程HIV RT-1306)。選擇TGIRT和RT-1306進(jìn)行測(cè)試是基于它們之前在測(cè)序含有m1a的mRNA和tRNA方面的成功。實(shí)驗(yàn)流程(圖1c,左下)如下:小RNA先與3′端接頭連接,然后與5′端接頭連接,然后引物啟動(dòng)RT反應(yīng)生成cDNA,然后用覆蓋兩個(gè)接頭序列的引物進(jìn)行PCR擴(kuò)增。作者的策略確保只有可讀取的產(chǎn)品將被克隆并用于下游的錯(cuò)配分析,以進(jìn)行m1A修改估計(jì)。通過(guò)在RT步驟之前包括5 '接頭連接,作者消除了由于與PCR擴(kuò)增的5 '引物缺乏互補(bǔ)性而導(dǎo)致任何RT延遲產(chǎn)物被克隆為截?cái)喈a(chǎn)物的可能性。這種方法對(duì)于小RNA是首先考慮的,因?yàn)樗鼈兺ǔV挥袔讉€(gè)堿基不同,特別是對(duì)于trf。例如,18-nt tRF-3和22-nt tRF-3已被證明通過(guò)不同的機(jī)制調(diào)節(jié)LTR功能。使用這一工作流程,合成m1A位點(diǎn)的錯(cuò)配指數(shù)(由A到T/G/C突變計(jì)算)對(duì)于TGIRT和RT-1306來(lái)說(shuō),在不同的m1A化學(xué)計(jì)量中都顯示出很高的靈敏度和動(dòng)態(tài)范圍(圖1c)。然而,當(dāng)m1A存在于<=60%的合成短RNA中時(shí),通常用于短RNA測(cè)序的逆轉(zhuǎn)錄酶ProtoScriptII產(chǎn)生的錯(cuò)配率低于5%(圖1c)。與TGIRT和RT-1306相比,克隆頻率較低,當(dāng)100%的RNA具有m1A時(shí)可以看出(圖1d)。最后,當(dāng)與m1A抗體富集(m1A- rip)結(jié)合使用時(shí),TGIRT和ProtoScriptII都能夠檢測(cè)到插入細(xì)胞小RNA的合成m1A RNA的富集(圖1e)。基于上述分析,作者選擇了TGIRT來(lái)進(jìn)一步鑒定內(nèi)源性m1A小RNA。
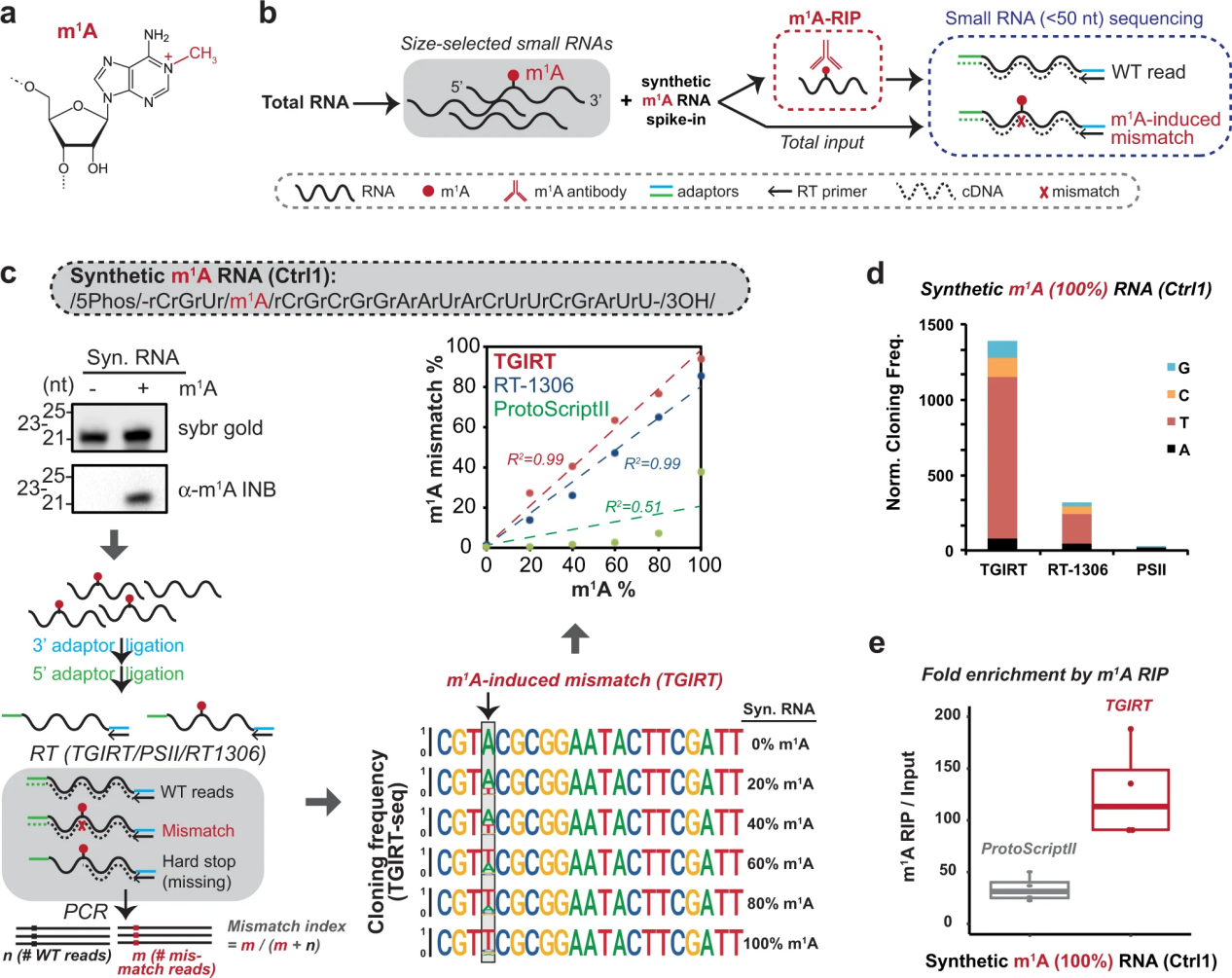
圖1小RNA空間中m1A位點(diǎn)的系統(tǒng)制圖
2. 特異性tRNA衍生片段高度富集于m1A
為了鑒定內(nèi)源性含有m1A的小RNA,將m1A RIP應(yīng)用于細(xì)胞中純化的短RNA。HEK293T細(xì)胞中m1A修飾的tRNA通過(guò)m1A RIP富集并洗脫成功(圖2a)。對(duì)于有一個(gè)堿基錯(cuò)配的tRF reads, m1A RIP的富集更為突出,可能是在m1A修飾的位點(diǎn)(圖2b)。在microRNAs或其他小RNA中,m1A RIP未觀察到這種錯(cuò)配相關(guān)的富集(圖2b)。在m1A RIP后,大多數(shù)含有錯(cuò)配的tRF讀取具有A到C/G/T不匹配(細(xì)胞質(zhì)tRF為90%,線粒體tRF為95%)(圖2b),表明修飾的(容易錯(cuò)配的)腺苷特異性富集,最有可能是m1A。
根據(jù)起始和結(jié)束位置,tRNA片段可以分為三組(圖2c)22,30,34:(1)映射到成熟tRNA的極端3 ' CCA端的tRF-3s,(2)映射到成熟tRNA的極端5 '端的tRF-5s,以及(3)包含前體tRNA的尾鏈序列(通常以poly-U結(jié)尾)的tRF-1s。成熟tRNA的3′端trf優(yōu)先被m1A抗體富集,而5′端trf相對(duì)microRNA輕度富集,tRF-1s不富集(圖2d, e)。此外,與18-nt tRF-3a相比,22-nt tRF-3b被m1A抗體特異性富集(圖2f),這表明只有22-nt而不是18-nt tRF-3s含有m1A。值得注意的是,tRF-3b(圖2f)的富集程度與峰值控制的m1A RNA(圖1e)相似。輸入樣品的TGIRT誤摻入特征也得到了m1A在特定trf -3上的位置和化學(xué)計(jì)量。在所有22 nt的tRF-3b的第四個(gè)位置(A4)觀察到最高的錯(cuò)配率(圖3b, c)。這種高錯(cuò)配率具有高度特異性:在tRF-3b的其他位置(圖3c)或18 nt的tRF-3a上沒(méi)有觀察到。有趣的是,一些microRNA被m1A RIP顯著富集(圖2d),但未能顯示位點(diǎn)特異性錯(cuò)配模式,因此作者在本報(bào)告中沒(méi)有將它們報(bào)道為真正的含有m1A的小RNA(在Discussion中進(jìn)一步討論)。這些都表明tRF-3b是含有m1a的小RNA。
由于確定的大多數(shù)m1A位點(diǎn)都處于高化學(xué)計(jì)量,因此作者跳過(guò)了m1A RIP,僅使用TGIRT錯(cuò)配特征來(lái)量化特定位點(diǎn)的m1A,以便進(jìn)行以下分析。

圖2特異性tRNA衍生片段高度富集于m1A
3. 22個(gè)核苷酸3 ' tRNA片段上的m1A依賴(lài)于TRMT6/61A
22-nt tRF-3b上的A4位置與成熟tRNA上的A58位置相對(duì)應(yīng)(圖3a)。胞質(zhì)tRNAs上的m1A58由異源二聚體酶復(fù)合物TRMT6/TRMT61A(或酵母中的GCD10/GCD14)催化。為了測(cè)試tRF-3b上的m1A是否由TRMT6/61A引入的修飾(可能在親本tRNA上),在TRMT6/61A敲低后評(píng)估了錯(cuò)誤合并特征(圖3b-e)。當(dāng)TRMT6/61A被敲除(圖3d)時(shí),除了tRNAiMet中的trf -3外,m1a依賴(lài)的trf -3錯(cuò)結(jié)合在全球范圍內(nèi)減少(圖3b, c)。在HeLa和U251細(xì)胞中也觀察到siTRMT6/61A或單獨(dú)使用siTRMT61A的較低的tRF-3b A4錯(cuò)摻率(圖3f)。盡管TRMT6/61A敲除后,攜帶ProtoScriptII的tRF-3b的克隆頻率顯著增加,但Northern blots未檢測(cè)到tRF-3b和tRNA的穩(wěn)態(tài)水平有任何變化(圖3g)。這證實(shí)了攜帶m1a的小RNA在這種常用的ProtoScriptII RT中代表性不足。
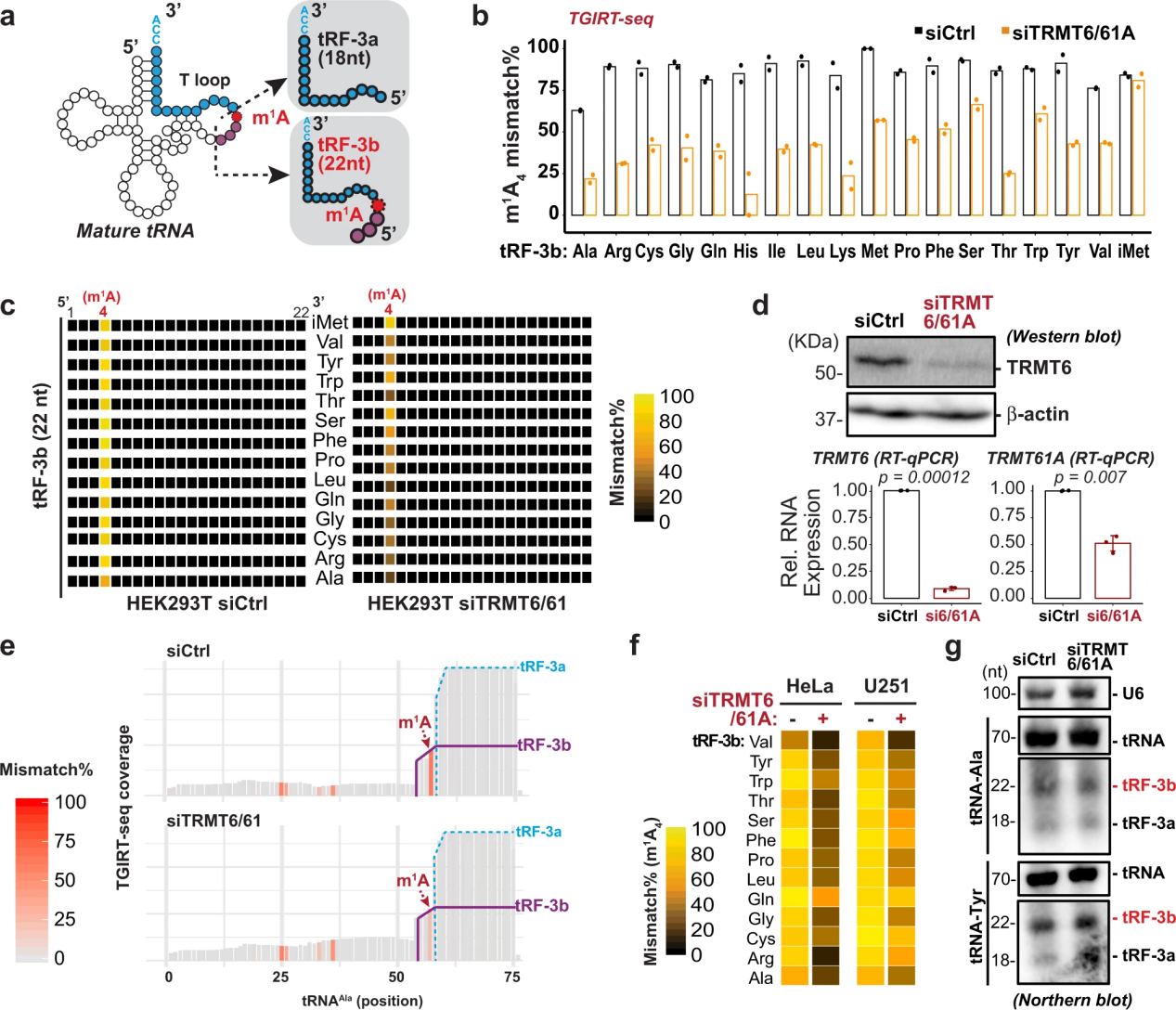
圖3 22個(gè)核苷酸3 ' tRNA片段上的m1A依賴(lài)于TRMT6/61A
4. m1A減弱了trf -3的基因沉默
m1A在tRF-3上特定位置的存在提出了一種有趣的可能性,即它可能調(diào)節(jié)tRF-3的功能,特別是如果它涉及堿基配對(duì)或蛋白質(zhì)結(jié)合。已經(jīng)在多種生物學(xué)途徑中發(fā)現(xiàn)了trf -3,特別是依賴(lài)于引導(dǎo)小RNA(trf -3)與靶RNA之間堿基配對(duì)的基因沉默途徑(圖4a)。這些依賴(lài)ago的基因沉默機(jī)制可能受到tRF-3s 4位m1A的影響,該位置位于與目標(biāo)RNAs25,45堿基配對(duì)所必需的種子區(qū)。
為了直接測(cè)試m1A對(duì)tRF-3b基因沉默活性的影響,作者生成了雙熒光素酶報(bào)告基因,在Renilla熒光素酶基因的3 ' UTR中有tRF-3靶位,可以歸一化為螢火蟲(chóng)熒光素酶信號(hào)(圖4b)。只有未經(jīng)a4修飾的tRF-3b觸發(fā)了基因沉默,而m1a4修飾的tRF-3b則消除了這種基因沉默(圖4c-f)。對(duì)來(lái)自不同氨基酸群的四個(gè)不同的tRF-3b序列(tRNALeu的tRF-3009b, tRNAAla的tRF-3021b, tRNATyr的tRF-3030b和tRNAGln的tRF-3004b)觀察到這種效應(yīng)。
為了確保tRF的抑制不是過(guò)度表達(dá)的產(chǎn)物,作者還通過(guò)LNA(鎖定的核酸)敲低了內(nèi)源性tRF-3。抗tRF-3021特異性地抑制了tRF-3021報(bào)告因子的活性(圖4)。同樣,tRF-3009、tRF-3030和tRF-3004報(bào)告基因活性被相應(yīng)的LNAs去抑制(圖4h-j)。
總的來(lái)說(shuō),這表明由于種子退火到靶mRNA的問(wèn)題,m1A減弱了tRF-3b的基因沉默。
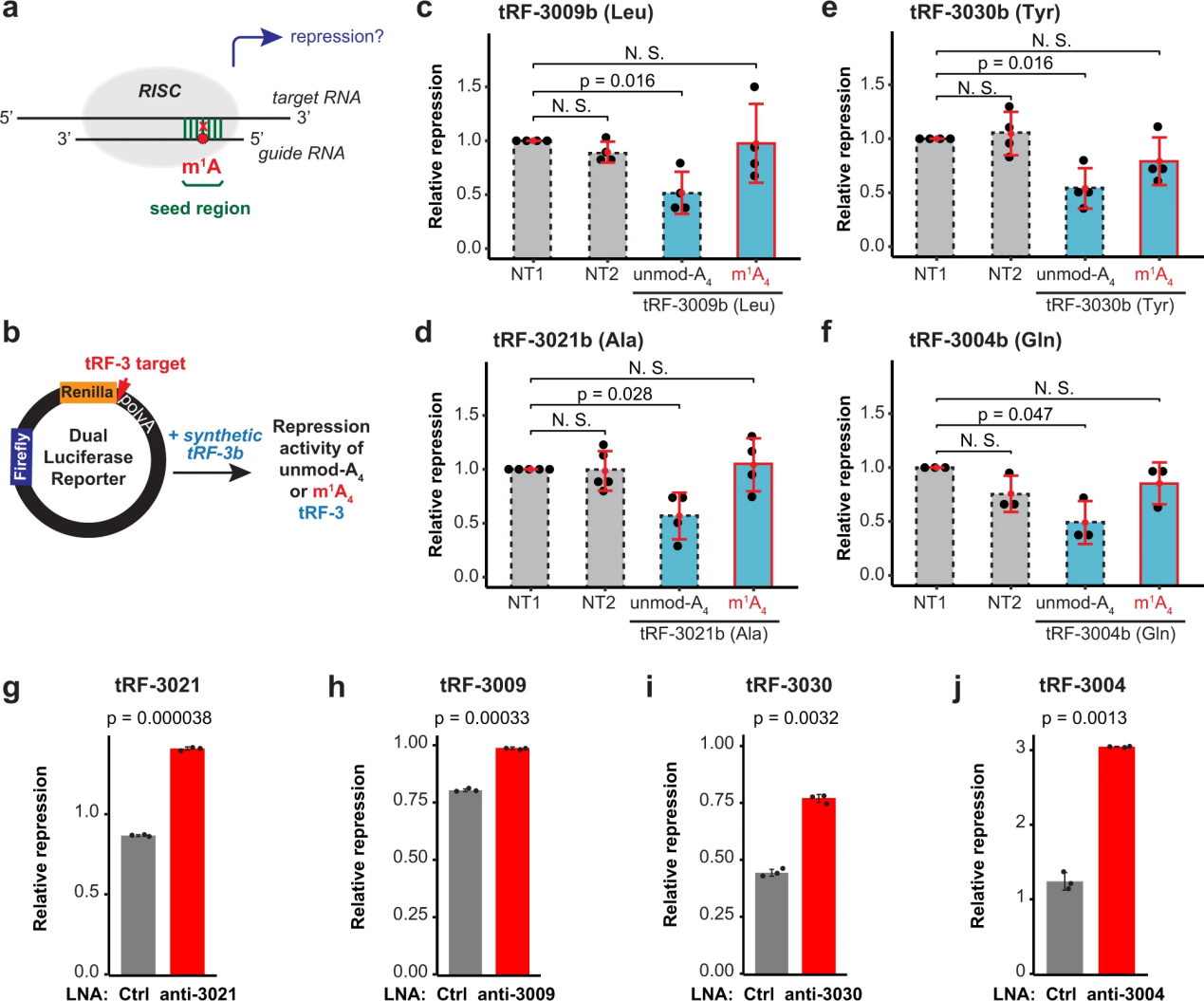
圖4 m1A減弱了trf -3的基因沉默
5. TRMT6 / 61A依賴(lài)性m1A不降低tRF-3b的Argonaute相關(guān)性
由于tRF-3b上的m1A阻止了tRF-3b的沉默(圖4),作者測(cè)試了這種修飾是否降低了內(nèi)源性trf -3與Ago2的關(guān)聯(lián)。為此,作者創(chuàng)建了一個(gè)穩(wěn)定表達(dá)flag - ha標(biāo)記的Ago2的細(xì)胞系(圖5a)。tgrt -seq在前100個(gè)與ago2相關(guān)的小RNA中鑒定出了trf -3(圖5b)。敲除TRMT6/61A后(圖5c),與m1A修飾相對(duì)應(yīng)的讀段錯(cuò)配百分比在與ago2相關(guān)的片段中(a)減少,但在與ago2相關(guān)的片段中(b)相對(duì)于輸入片段而言,沒(méi)有增加或減少(圖5d)。因此,TRMT6/61A對(duì)兩個(gè)片段中trf -3上的m1A的調(diào)節(jié)是相同的。m1A修飾不排除tRF-3b進(jìn)入與Argonaute的復(fù)合物。在敲除TRMT6/61A后,ago2相關(guān)部分中有幾種trf -3的少量(1-3倍)增加,但沒(méi)有超過(guò)FDR <0.05的閾值(圖5e)。相對(duì)于輸入部分,Ago相關(guān)部分中tRF-3水平?jīng)]有任何變化,這表明trmt6 /61依賴(lài)的m1A對(duì)tRF-3種子區(qū)域的修飾不會(huì)顯著影響Ago的直接結(jié)合。有趣的是,盡管在輸入和Ago結(jié)合的部分中,TRMT6/61A調(diào)節(jié)了總tRF-3b錯(cuò)配(m1A修飾)的百分比(圖5d)。綜合來(lái)看,m1A修飾的tRF-3s不會(huì)降低它們的Ago關(guān)聯(lián),因此基因沉默的衰減很可能是因?yàn)榕c目標(biāo)mRNA的堿基配對(duì)減少(圖4)。
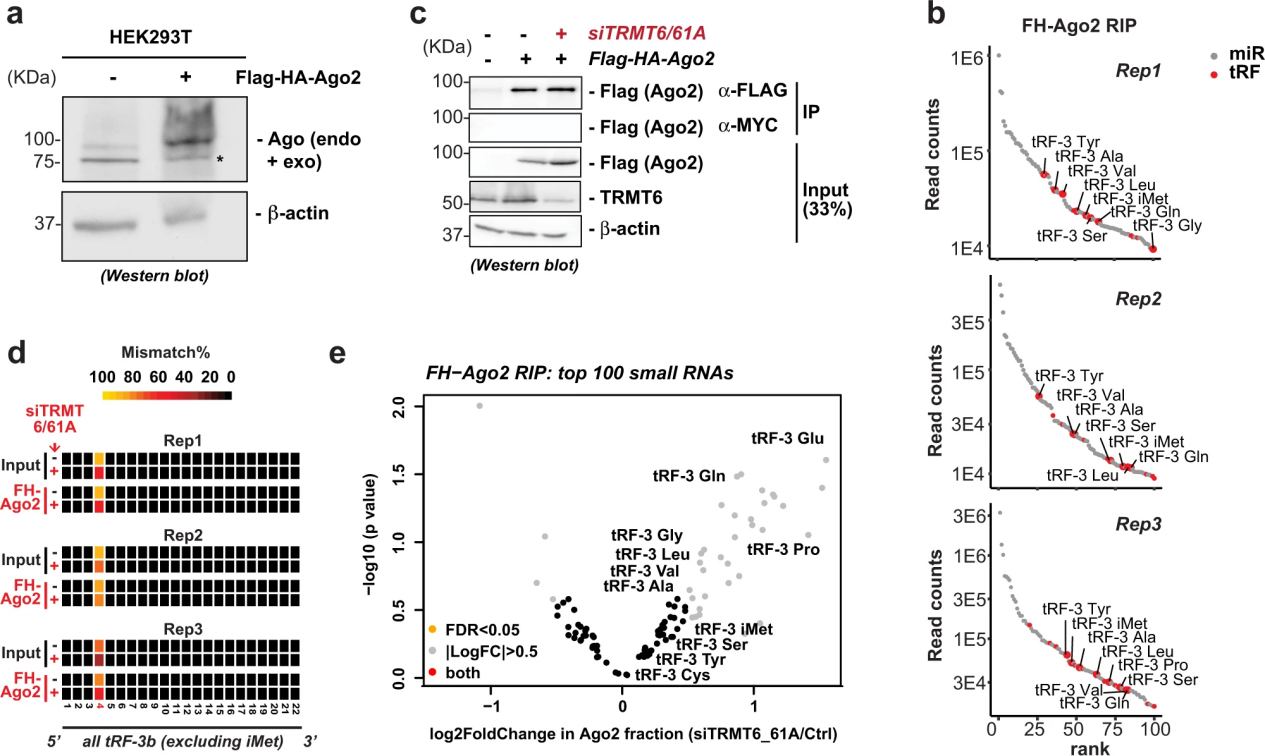
圖5 TRMT6 / 61A依賴(lài)性m1A不降低tRF-3b的Argonaute相關(guān)性
6. tRF-3b介導(dǎo)的m1a依賴(lài)性基因沉默變化
引導(dǎo)RNA 2-4位的堿基配對(duì)對(duì)于ago介導(dǎo)的基因沉默至關(guān)重要45。tRF-3b上的m1A特異性位于第4位(圖2和圖3)。由于m1A阻斷了典型的A:U堿基配對(duì),作者假設(shè),m1A在tRF-3種子區(qū)與靶RNA的堿基配對(duì)減弱,解釋了含有m1A的tRF-3中觀察到的基因沉默活性降低(圖4)。為了驗(yàn)證這一假設(shè),作者首先通過(guò)圖6a總結(jié)的策略確定了可能受m1A狀態(tài)調(diào)節(jié)的潛在tRF-3靶RNA。作者確定了頂部ago2相關(guān)的tRF-3b中的哪些種子(圖6b)也是TRMT6/61A敲除后m1A修飾減少最多的種子,以確定最有可能遭受生物學(xué)上顯著的靶標(biāo)預(yù)測(cè)干擾的種子(圖6c)。作者根據(jù)3 ' UTR中的互補(bǔ)性預(yù)測(cè)這些種子的靶標(biāo)。RNA-seq顯示,當(dāng)TRMT6/61A被敲除,tRF-3b在第4位被m1A低修飾時(shí),這些種子的靶標(biāo)比非靶標(biāo)明顯受到抑制(圖6d)。
預(yù)測(cè)具有8-mer和7-mer匹配的靶標(biāo)比種子中與6-mer匹配的靶標(biāo)受到更顯著的抑制(圖6d, e)。在siTRMT6/61A之后,分別通過(guò)qPCR驗(yàn)證了最顯著抑制的8/7-mer tRF-3靶標(biāo)(TIMP3, CREB3L2, MBTPS1, CDK19, HIPK2, HERPUD1, RMND5A, ELMOD2和HLTF)的抑制(圖6f)。
為了證實(shí)這種基因抑制是由靶向3 ' UTR的tRF-3介導(dǎo)的,作者將具有單個(gè)進(jìn)化保守的tRF-3靶向8-mer位點(diǎn)的內(nèi)源性MBTPS1 3 ' UTR序列克隆到雙熒光素酶報(bào)告基因中。MBTPS1 3 ' UTR報(bào)告基因確實(shí)被siTRMT6/61A抑制(圖6g)。另一個(gè)8-mer靶基因CREB3L2也得到了類(lèi)似的結(jié)果(圖6g)。這兩個(gè)8-mer位點(diǎn)均由種子序列“TCAAATCT”預(yù)測(cè),由tRNAGln中的tRF-3b代表(圖6b)。與預(yù)測(cè)一致,通過(guò)從tRNAGln中過(guò)表達(dá)未經(jīng)修飾的tRF-3004b可以模擬sitrmt依賴(lài)性抑制,而TRMT6/61A的表達(dá)不會(huì)減少(圖6h),而m1a修飾的tRF-3004b對(duì)3 ' UTR報(bào)告基因的抑制能力明顯較弱(圖6i)。綜上所述,tRF-3可以通過(guò)種子與目標(biāo)3 ' UTRs配對(duì)來(lái)調(diào)節(jié)基因的全局表達(dá),而這一過(guò)程受到tRF-3種子區(qū)m1A修飾的干擾。
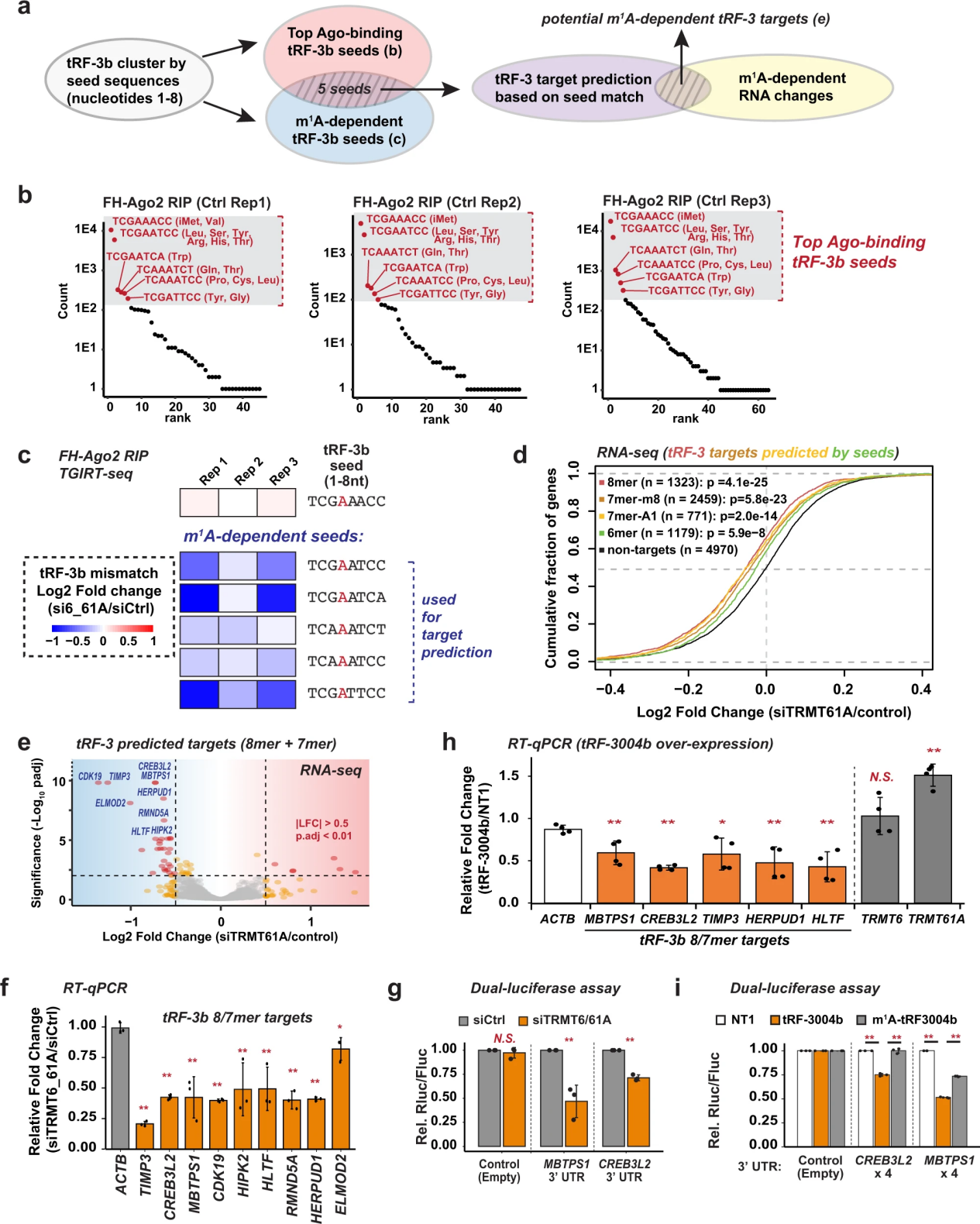
圖6 tRF-3b介導(dǎo)的m1a依賴(lài)性基因沉默變化
7. 膀胱癌中trf - 3m1a水平及tRF-3靶點(diǎn)的改變
據(jù)報(bào)道,一些tRNA修飾酶,包括TRMT6/61A,在幾種癌癥類(lèi)型中顯著上調(diào)47。TRMT6上調(diào)在膀胱尿路上皮癌(BLCA)中是顯著的(圖7a)。最重要的是,通過(guò)western blotting檢測(cè)到腫瘤樣品中TRMT6和TRMT61A蛋白水平的顯著上調(diào)(圖7b, c)。
TRMT6表達(dá)水平與tRF-3b整體m1A錯(cuò)配水平呈正相關(guān),并且在BLCA腫瘤樣本中m1A錯(cuò)配顯著增加,這與TRMT6/ 61a較高的表達(dá)水平一致(圖7d, e)。與較高水平的干擾m1A修飾相一致,在作者的實(shí)驗(yàn)數(shù)據(jù)中,與正常相比,通過(guò)種子-mer匹配預(yù)測(cè)的tRF-3b靶RNA在BLCA腫瘤樣本中比非靶點(diǎn)上調(diào)(圖7f)。組合種子和補(bǔ)充圖7e:單個(gè)種子)。此外,在TCGA BLCA數(shù)據(jù)中,TRMT6水平高的腫瘤誘導(dǎo)了tRF-3b靶點(diǎn)(圖7g)。有趣的是,在被siTRMT6/61A抑制的9個(gè)trmt3靶點(diǎn)中,有8個(gè)(圖6e)在TCGA膀胱患者樣本中與TRMT6的表達(dá)呈顯著正相關(guān)(圖7h)。綜上所述,這些結(jié)果表明TRMT6/61A調(diào)節(jié)腫瘤中tRF-3上的m1A水平,并且BLCA中TRMT6/61A的升高與腫瘤中tRF-3靶點(diǎn)的預(yù)期誘導(dǎo)有關(guān)。

圖7膀胱癌中trf - 3m1a水平及tRF-3靶點(diǎn)的改變
8. TRMT6/61A修飾tRF-3b對(duì)于維持未折疊蛋白的反應(yīng)至關(guān)重要
為了探索m1a依賴(lài)性tRF-3靶點(diǎn)的潛在生物學(xué)功能,作者通過(guò)RNA-seq數(shù)據(jù)的基因集富集分析,重點(diǎn)研究了siTRMT6/61A顯著下調(diào)和高trmt6腫瘤樣本中顯著上調(diào)的生物學(xué)途徑。針對(duì)1532個(gè)Reactome通路的富集分析在細(xì)胞系和患者數(shù)據(jù)中發(fā)現(xiàn)了7個(gè)重疊通路。其中一種途徑是未折疊蛋白反應(yīng)或UPR(圖8a, b)。
m1a依賴(lài)的tRF-3靶點(diǎn),特別是MBTPS1(也稱(chēng)為1位點(diǎn)蛋白酶或S1P)和CREB3L2,先前與UPR和蛋白質(zhì)分泌有關(guān)48,49,這表明TRMT6/61A可能通過(guò)去抑制這些tRF-3靶點(diǎn)來(lái)幫助維持生長(zhǎng)細(xì)胞中的UPR。MBTPS1 (S1P)因其切割和激活高爾基體上不同蛋白質(zhì)底物的作用而聞名,包括轉(zhuǎn)錄因子ATF6和creb3l250,51,52。為了直接測(cè)試TRMT6/61A是否在內(nèi)質(zhì)網(wǎng)應(yīng)激下調(diào)節(jié)UPR,作者使用了一個(gè)由最小啟動(dòng)子驅(qū)動(dòng)的熒光素酶報(bào)告子,該啟動(dòng)子帶有內(nèi)質(zhì)網(wǎng)應(yīng)激反應(yīng)元件2 (ERSE2),可被ATF6轉(zhuǎn)錄因子53激活。報(bào)告顯示,正如預(yù)期的那樣,熒光素酶活性增加依賴(lài)于內(nèi)質(zhì)網(wǎng)反應(yīng)元件和內(nèi)質(zhì)網(wǎng)應(yīng)激(tunicamycin, Tm)。在HEK293T和T24膀胱癌細(xì)胞系中,TRMT6/61A敲低可顯著抑制UPR誘導(dǎo)的應(yīng)激反應(yīng)(圖8c)。轉(zhuǎn)染未修飾的tRF-3004b,而不轉(zhuǎn)染m1A修飾的tRF-3004b,相對(duì)于NT1和NT2非靶向RNA,可以降低UPR報(bào)告基因的活性(圖8d),這表明tRF-3b上的m1A狀態(tài)可以直接調(diào)節(jié)未折疊蛋白的反應(yīng)。為了確保內(nèi)源性tRF-3004b抑制參與UPR的靶基因,作者通過(guò)LNA敲低了內(nèi)源性tRF-3004b,這在ER應(yīng)激后顯著增加了靶細(xì)胞基因CREB3L2、HERPUD1、MBTPS1和HLTF的水平(圖8e、f)。總之,這表明trmt6 / 61a介導(dǎo)的trf -3上的m1A修飾對(duì)維持UPR穩(wěn)態(tài)很重要。
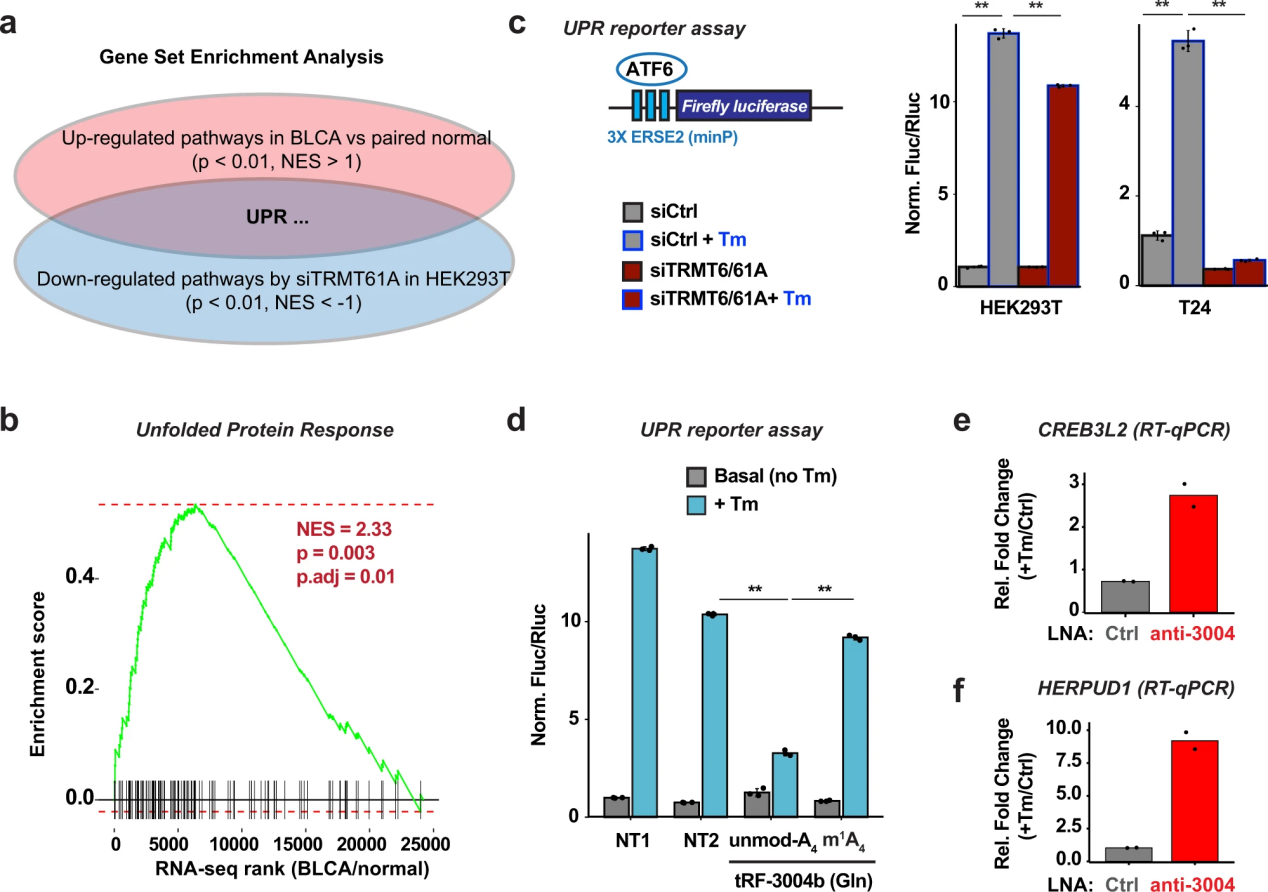
圖8 TRMT6/61A修飾tRF-3b對(duì)于維持未折疊蛋白的反應(yīng)至關(guān)重要
結(jié)論
最后,快速增殖的癌細(xì)胞通過(guò)激活促存活UPR來(lái)維持蛋白穩(wěn)態(tài)以減輕內(nèi)質(zhì)網(wǎng)應(yīng)激。因此,UPR與癌癥特征的許多方面密切相關(guān),并已成為有希望的治療靶點(diǎn)。先前已經(jīng)注意到,在包括膀胱癌在內(nèi)的幾種癌癥類(lèi)型中,uprr相關(guān)基因在全球范圍內(nèi)上調(diào)68。在這里,作者發(fā)現(xiàn)TRMT6/61A最可能通過(guò)修飾tRF-3來(lái)促進(jìn)UPR,并去抑制tRF-3在UPR通路的ATF6分支中的靶點(diǎn)MBTPS1和CREB3L2。有趣的是,MBTPS1和CREB3L2可以被tRNAGln中的tRF-3004b靶向,tRNAGln是一種被發(fā)現(xiàn)在酵母中調(diào)節(jié)UPR的tRNA 69。當(dāng)然,作者不排除TRMT6/61A通過(guò)修飾tRNA和mRNA對(duì)UPR產(chǎn)生額外影響的可能性。作者如何利用本文描述的機(jī)制使腫瘤細(xì)胞對(duì)促凋亡UPR敏感將是未來(lái)另一個(gè)有趣的研究課題。
實(shí)驗(yàn)方法
細(xì)胞培養(yǎng),RNA凈化,合成m1A RNA寡核苷酸,RIP免疫沉淀反應(yīng),小RNA-seq文庫(kù)制備,小RNA-seq圖譜和錯(cuò)配分析,敲低TRMT6/61 A,Northern blot,雙熒光素酶報(bào)告試驗(yàn),鎖定核酸(LNA)敲除內(nèi)源性tRF,RT-qPCR,RNA-seq文庫(kù)的制備和分析,蛋白提取和Western Blot,未折疊蛋白反應(yīng)報(bào)告試驗(yàn)。
參考文獻(xiàn):
Su Z, Monshaugen I, Wilson B, Wang F, Klungland A, Ougland R, Dutta A. TRMT6/61A-dependent base methylation of tRNA-derived fragments regulates gene-silencing activity and the unfolded protein response in bladder cancer. Nat Commun. 2022 Apr 20;13(1):2165. doi: 10.1038/s41467-022-29790-8. PMID: 35444240; PMCID: PMC9021294.






