DRP1驅動的線粒體可塑性誘導代謝重編程可減少乳腺癌腦轉移
擴散的腫瘤細胞具有靈活的新陳代謝,可以利用遠端器官中的營養物質,但其促進新陳代謝適應性的確切機制仍不清楚。在本研究中,作者揭示了潛伏腦轉移細胞(Lat)中的線粒體點狀片段能夠通過脂肪酸氧化(FAO)維持細胞生物能和氧化還原平衡,消耗富集的動態相關蛋白1(DRP1)并限制Lat細胞線粒體的可塑性,會導致脂滴堆積增加、FAO受損和轉移減弱。同樣,在臨床前模型中,使用小分子腦滲透抑制劑對DRP1進行藥理抑制,可減輕轉移負荷。與上述結論一致的是,與患者匹配的原發腫瘤相比,在轉移的腦轉移瘤中觀察到磷酸-DRP1表達增加。該研究結果揭示了線粒體可塑性在支持瘤細胞存活方面的關鍵作用,并強調了靶向細胞可塑性程序與腫瘤特異性改變相結合以預防轉移性復發的治療潛力,于2023年5月發表在《nature cancer》,IF:22.7。
技術路線
主要研究結果
1.潛伏細胞吸收反應性星形膠質細胞分泌的FAs
癌癥轉移到中樞神經系統是致命的。乳腺癌患者的腦轉移發生率因疾病亞型而異,晚期乳腺癌患者中約有25-50%出現腦轉移。為了解擴散的腫瘤細胞是如何作為亞臨床疾病持續存在并引發遠期轉移的,作者在小鼠體內進行了表型選擇,并從HCC1954和SKBR3 HER2+乳腺癌細胞中分離出了潛伏的腦轉移(Lat)細胞。脂質組圖譜也顯示Lat細胞中的中性脂肪酸含量較高(圖1a),這表明Lat細胞具有更好的吸收外源脂質的能力。
在心內注射 5 周后對小鼠大腦進行免疫熒光(IF)染色發現,大腦中的Lat細胞被反應性星形膠質細胞包圍(圖1b)。作者將星形膠質細胞與BODIPY-C12培養過夜,然后用溫培養基洗滌三次,并與GFP+癌細胞一起培養。對這些共培養物進行活細胞延時成像,以評估熒光標記的FA從星形膠質細胞轉移到癌細胞的情況。與Pa細胞相比,在HCC1954和SKBR3 Lat細胞中觀察到的 BODIPY-C12+脂滴(LDs)數量明顯增加(圖1 c-e)。

圖1潛伏細胞吸收反應性星形膠質細胞分泌的 FAs(a-e)
2.潛伏細胞中豐富的線粒體碎片點狀結構
為了觀察和量化Lat和Pa細胞中的LDs,作者進行了透射電子顯微鏡觀察。與之前的觀察結果相一致,兩種細胞系模型的Lat細胞與Pa細胞相比,LDs數量顯著增加(圖1f)。值得注意的是,與具有大管狀線粒體的親代細胞相比,Lat細胞中的線粒體碎片更小(圖 1f、g )。TOMM20染色證實Lat細胞中的中間線粒體和點狀線粒體數量增加(圖 1h、i)。
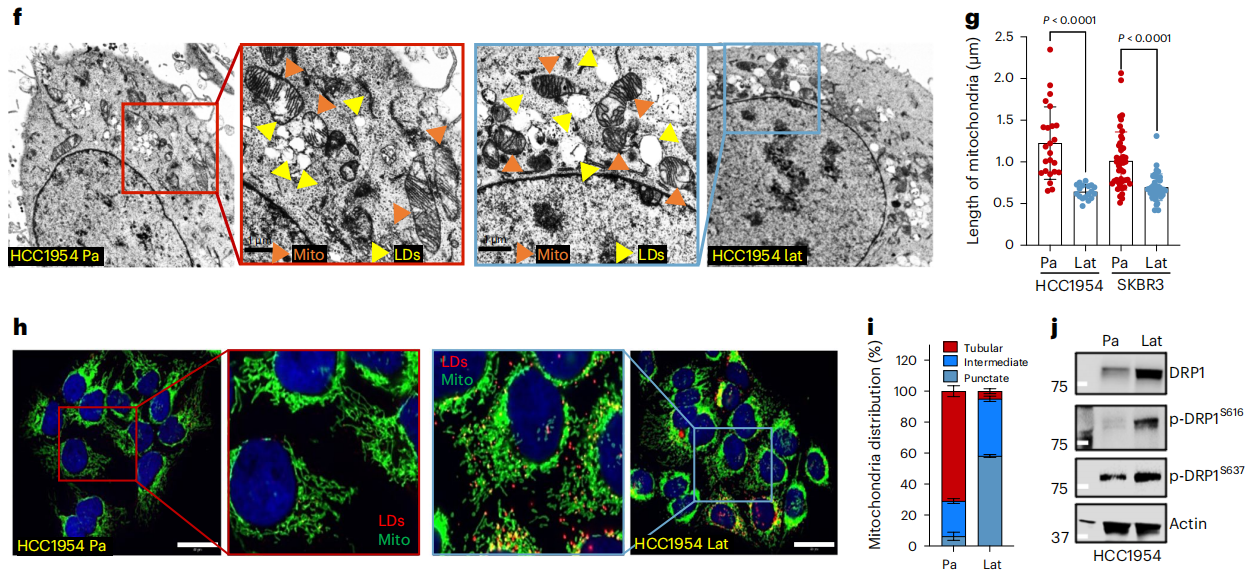
圖1 潛伏細胞吸收反應性星形膠質細胞分泌的 FAs(f-j)
3. 凋亡細胞氧化內化的 FAs 并維持氧化還原平衡內化的 FAs
內化的脂肪酸可能被導入線粒體氧化或直接儲存在低密度脂蛋白中。線粒體中增加的FAs β-氧化作用可產生乙酰-CoA,乙酰-CoA 進入三羧酸(TCA)循環,促進細胞在應激或營養耗竭條件下的存活。事實上,與Pa相比,14C 標記的棕櫚酸酯處理誘導Lat細胞產生更多的14CO2(圖 2a),表明 FAO 增加。
為了進一步評估脂肪酸的利用模式及其對所觀察到的代謝物池差異的貢獻,作者進行了 13C16 棕櫚酸酯同位素追蹤分析(圖 2b)。此外,與Pa細胞相比,檸檬酸鹽、谷氨酸鹽和蘋果酸鹽的 M+2 同位素在HCC1954和SKBR3 Lat細胞中明顯富集(圖 2c-e )。此外,在Lat細胞中,棕櫚酸酯衍生的碳富集于谷胱甘肽的 GSH(還原型谷胱甘肽)和GSSG(氧化型谷胱甘肽)形式中(圖 2f、g )。穩態谷胱甘肽定量顯示,細胞ROS減少的Lat細胞中GSH/GSSG比率升高(圖 2h)。如前所述,與親代細胞相比,Lat細胞能更好地將過量的FA儲存為LD 并存活下來(圖2 i, j)。因此,潛伏細胞氧化內化的FAs,然后通過TCA循環進行氧化,維持細胞氧化還原平衡,這對轉移啟動細胞至關重要。
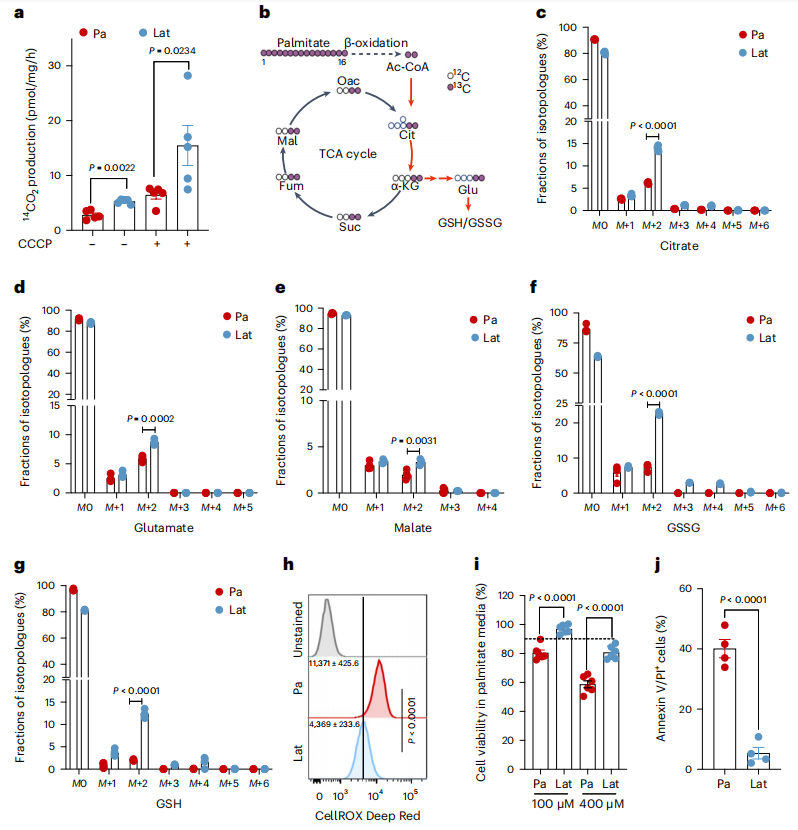
圖2 Lat細胞氧化內化的FAs并維持氧化還原平衡
4. DRP1驅動的線粒體動力學可實現FAO和氧化還原平衡
如前所述,HCC1954和SKBR3潛伏細胞的線粒體裂解蛋白DRP1和活化的磷酸化形式p-DRP1S616水平升高(圖 1j )。此外,點狀線粒體與FAO的增加有關。因此,作者檢驗了線粒體動力學的改變是否促進了Lat細胞中FAO的增加和代謝重編程。透射電子顯微鏡(TEM)和IF分析表明,與對照組相比,Lat細胞中 DRP1的缺失會導致線粒體長度增加、線粒體呈管狀以及點狀線粒體數量減少(圖 3a-c )。
接下來,作者猜想線粒體動力學的改變是否會影響潛伏細胞對FA的吸收和氧化。在對照組和去除了DRP1的Lat細胞中的13C16棕櫚酸酯示蹤表明,棕櫚酸酯的攝取沒有明顯差異。然而,DRP1缺失導致檸檬酸、谷氨酸和蘋果酸的M+2 同位素富集分數減小(圖3 d)。此外,DRP1 的缺失大大降低了谷胱甘肽 GSH 和 GSSG 的水平(圖3 d)。與這些觀察結果一致的是,去除了DRP1的Lat細胞的穩態谷胱甘肽顯著下降,細胞ROS增加(圖3e)。此外,由于棕櫚酸酯處理后細胞死亡增加和腫瘤球形成減少,DRP1 缺失導致細胞活力下降(圖 3f)。這些結果表明,DRP1驅動的線粒體動力學使Lat細胞中的FAO和氧化還原平衡得以實現。
DRP1驅動的線粒體可塑性促進了FAO并有助于Lat細胞的存活,FA圖譜顯示 CPT1A消耗后FA含量增加(圖3 g)。消耗CPT1A后,線粒體動力學發生了明顯的變化,點狀線粒體顯著減少,線粒體長度或管狀線粒體增加(圖 3h、i)。13C16棕櫚酸酯示蹤顯示,對照和CPT1A缺失細胞的棕櫚酸酯攝取量沒有實質性差異。然而,Lat細胞中肉堿共軛脂肪酸的合成以及檸檬酸鹽、谷氨酸鹽和蘋果酸鹽的 M+2同素異形體的標記在CPT1A缺失后明顯減少(圖3 j)。去除了 CPT1 的HCC1954和SKBR3 Lat 細胞的谷胱甘肽(GSH和GSSG)水平急劇下降(圖 3j)。進一步表征DRP1耗竭,在CPT1耗竭的Lat細胞中觀察到形成癌細胞球的能力降低、細胞ROS水平升高,以及服用棕櫚酸酯后細胞死亡增加(圖3k,l)。

圖3 DRP1驅動的線粒體動力學可實現 FAO 和氧化還原平衡
5. DRP1驅動的線粒體可塑性促進轉移潛伏期
為了評估DRP1消耗對轉移潛伏期的影響,作者向小鼠心內注射了Ctrl和DRP1敲除的Lat細胞。注射一周后,給小鼠補充dox飲食以消耗DRP1。注射五周后,收集小鼠大腦并進行免疫組化(IHC)分析,以評估存活的潛伏細胞數量。與對照組相比,攜帶去除了DRP1的HCC1954 Lat 細胞的小鼠的GFP+轉移病灶數量顯著減少(圖 4a)。以前的研究曾報道過自然殺傷(NK)細胞能限制Lat細胞的增殖并加強轉移潛伏。在攜帶Lat細胞的無胸腺小鼠體內傳播后,用抗asialo-GM1多克隆抗體消耗NK細胞會導致轉移爆發增加。注射了去除了 DRP1的Lat細胞的小鼠在NK細胞耗竭后沒有觀察到明顯的轉移(圖4 b,c),表明殘余疾病已被消除。
由于CPT1A缺失與DRP1缺失表型相同,作者通過向小鼠心內注射Ctrl或 CPT1A貧化的HCC1954和SKBR3 Lat細胞,評估了CPT1A貧化對轉移潛伏期的影響。注射一周后,通過給小鼠喂食dox誘導CPT1耗竭。與 DRP1 損傷類似,CPT1A損傷也導致小鼠大腦中GFP+轉移的數量顯著減少(圖4 d )。
接下來,作者進行了DRP1挽救實驗,以證明DRP1對Lat細胞的存活至關重要。在這些研究中,他們生成了誘導性HA標記的DNM1L全長構建體,并將其轉導表達在DRP1缺失的Lat細胞中,誘導DRP1表達導致線粒體形態發生逆轉,并增強了去勢 DRP1 細胞的腫瘤球形成能力(圖4 e-g)。不出所料,DRP1挽救后,在大腦中觀察到存活的Lat細胞數量增加(圖4 h)。總之,作者的數據證明了依賴于DRP1的線粒體可塑性促進了FAO并促進了小鼠潛伏轉移細胞的存活。

圖4 DRP1驅動的線粒體可塑性促進轉移潛伏期
6. 人腦轉移瘤中磷酸-DRP1升高
在HER2+乳腺癌患者中,DRP1的高表達與無遠處轉移生存率低相關。作者對7 名HER2+乳腺癌患者的匹配 PT和轉移灶進行IHC分析發現,與相應的匹配PT 相比,p-DRP1S616在腦轉移灶中的高表達(圖5 a,b)。M-BM細胞主要轉移到大腦,偶爾也會轉移到脊柱/骨骼。全身、脊柱和腦部光子通量分析表明,DRP1耗竭后,腦部和脊柱/骨骼轉移負荷顯著減少,這是由于細胞凋亡增加所致(圖 5c-e)。此外,在去除了DRP1的M-BM細胞中異位表達DRP1能夠挽救小鼠的線粒體動力學、腫瘤球形成能力和轉移發生率(圖6 a-c )。
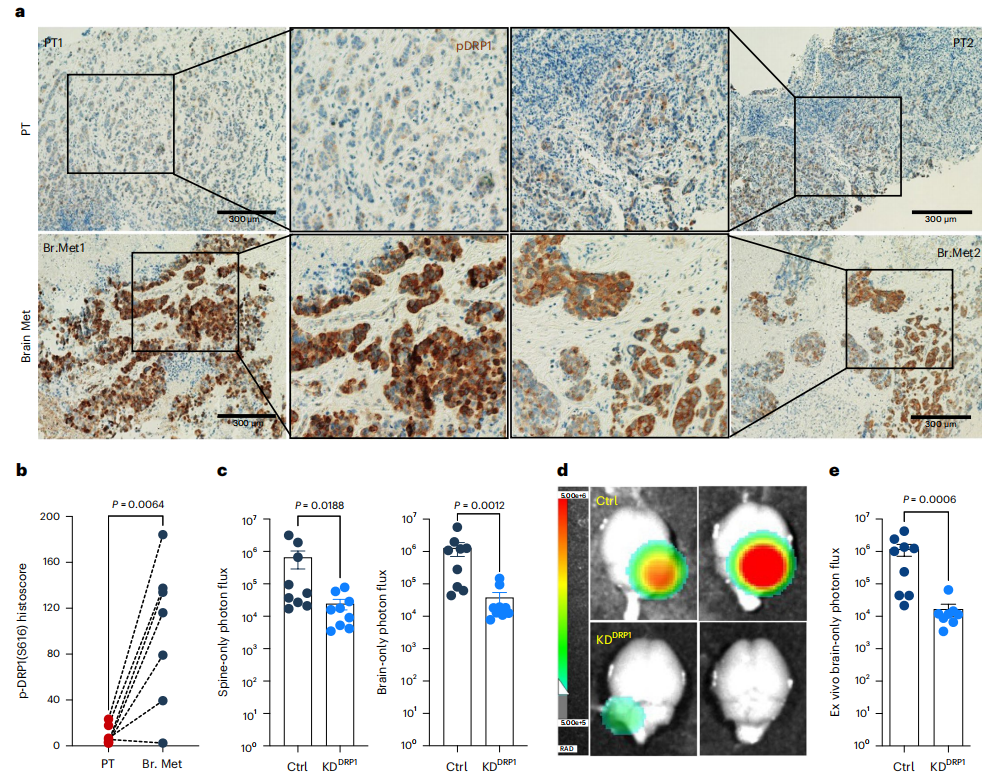
圖5 Phospho-DRP1 在人腦轉移瘤中升高

圖6 DRP1 的基因耗竭或藥物抑制可減輕腦轉移
7. 藥物抑制DRP1可減輕腦轉移
據報道,線粒體分裂抑制劑1(Mdivi-1)可抑制依賴于DRP1的線粒體分裂,并在多種腦缺血和神經變性模型中減輕神經細胞凋亡。因此,作者評估了Mdivi-1 對腦轉移的影響。為了進行這項分析,作者將HCC1954 Lat和M-BM細胞注射到無胸腺小鼠的心內。注射一周后,每天口服Mdivi-1,持續4周。在治療過程中未觀察到小鼠體重有明顯差異。IHC和生物發光成像分析表明,抑制DRP1可顯著減少攜帶M-BM細胞的小鼠中存活的潛伏細胞數量,并降低腦轉移發生率(圖6 d-f)。因此,限制DRP1的功能,進而阻礙線粒體的可塑性,可減輕潛伏和轉移的腦轉移細胞的存活率。
總之,該項研究強調了線粒體可塑性在促進潛伏轉移細胞中FAs氧化過程中的重要作用。在臨床前乳腺癌轉移模型中消耗或藥理學抑制DRP1會破壞線粒體動力學、細胞生物能和氧化還原平衡,導致腦轉移減弱(圖7)。這些研究結果表明,以線粒體可塑性為靶點是一種很有前景的預防轉移復發的治療方法。

圖7 DRP1驅動的線粒體可塑性和代謝重編程在HER2+乳腺癌腦轉移中的作用示意圖
結論
線粒體動力學異常與神經退行性疾病、衰老和癌癥有關。神經元線粒體裂變增加會導致線粒體功能障礙,而限制線粒體裂變會改善突觸功能,減少臨床前模型中認知能力的下降。此外,抑制線粒體裂變還能保護心肌缺血和急性腎缺血。另一方面,擴散的Lat乳腺癌細胞和膠質瘤誘發細胞顯示線粒體形態破碎,抑制DRP1 會導致腫瘤細胞死亡增加。因此,以DRP1和線粒體分裂為靶點可能對有擴散和定植腦部傾向的癌癥具有更廣泛的治療適用性。用DRP1抑制劑 能限制殘留疾病的發生,并能延緩臨床前模型的轉移復發。同樣,高活性小分子DRP1 GTPase 抑制劑(Drpitor1、Drpitor1a)也能有效限制腦轉移。最后,這些發現可能在其他有腦轉移傾向的癌癥類型中具有更廣泛的治療應用。
實驗方法
動物實驗,小鼠皮質星形膠質細胞的分離和培養,轉移試驗,脈沖追逐試驗,透射電鏡,線粒體成像, FA 分析,細胞活力測定,ROS,V/PI 染色比色法檢測,FAO 檢測,體外 13C16 棕櫚酸追蹤,Western 印跡,石蠟腦組織切片,質譜分析,基因敲除和挽救
參考文獻
Parida PK, Marquez-Palencia M, Ghosh S, Khandelwal N, Kim K, Nair V, Liu XZ, Vu HS, Zacharias LG, Gonzalez-Ericsson PI, Sanders ME, Mobley BC, McDonald JG, Lemoff A, Peng Y, Lewis C, Vale G, Halberg N, Arteaga CL, Hanker AB, DeBerardinis RJ, Malladi S. Limiting mitochondrial plasticity by targeting DRP1 induces metabolic reprogramming and reduces breast cancer brain metastases. Nat Cancer. 2023 Jun;4(6):893-907. doi: 10.1038/s43018-023-00563-6. Epub 2023 May 29. PMID: 37248394.






