粘蛋白-微生物組特征塑造胃癌的腫瘤微環境

胃癌(GC)是全球第五大常見癌癥類型和第四大癌癥相關死亡原因。由于胃癌早期缺乏癥狀,導致診斷延遲,預后較差。目前普遍認為胃癌是一種涉及宿主遺傳易感性和環境因素的疾病,但最常見的病因是幽門螺桿菌感染。人類胃微生物群特征的研究表明,胃內生態失調是一個與癌癥進展相關的動態過程,胃腺癌的特征是螺桿菌豐度降低和代表腸道共生菌屬或口腔微生物組的富集。此外,胃癌組織中黏蛋白(MUC)的表達和分布也存在較大差異,其中胃和腸黏蛋白均廣泛表達。根據有無黏蛋白,可分為胃、腸道、混合性或未分類/無黏蛋白表型。早期胃癌主要表現為胃黏蛋白表型,而晚期胃癌更多表現為腸黏蛋白表型。然而,在臨床病理因素的背景下,胃癌中黏蛋白表達的臨床重要性仍有爭議,尚不清楚哪種黏蛋白表型與更好或更差的預后相關。黏蛋白是覆蓋胃上皮的黏液屏障的守門人,以分泌型或跨膜糖蛋白的形式表達。此外還作為結合位點或代謝底物作為細菌的專門龕位,是細菌定點定植的重要決定因素。有研究表明,由腫瘤變化引起的異常黏蛋白改變可導致促進腫瘤進展的新微生物群的建立。因此,新類群豐度的差異可能歸因于腫瘤的黏蛋白表型,但需要進一步研究。該研究發表在《Microbiome》,IF:15.5。
技術路線

主要研究結果
1. 基于黏蛋白表達的胃腺癌表型分類
在本研究中,作者首先分析了胃癌患者隊列的腫瘤和癌旁組織以及功能性消化不良(FD)患者的活檢組織,以檢測胃(MUC1,MUC5AC,MUC6)和腸(MUC2,MUC4,MUC13)黏蛋白的mRNA相對表達量。總體而言,與腫瘤和FD組織相比,配對的癌旁非腫瘤組織中MUC1、MUC5AC和MUC6的mRNA表達顯著較高(圖1A)。對于腸黏蛋白,與鄰近的非腫瘤組織和FD組織相比,配對腫瘤組織中的MUC13 mRNA表達顯著增加,而在不同樣本類型中,MUC2和MUC4 mRNA的表達未見顯著變化(圖1A)。在鄰近非腫瘤組織中觀察到的MUC2(即腸上皮化生的標志物)和MUC4(即表達痙攣性多肽的化生(SPEM)的標志物)的可變表達模式提示這些腫瘤周圍部位存在化生性改變。根據黏蛋白mRNA的相對表達水平將胃腺癌細分為胃型、腸型、混合型或空黏蛋白表型組。在108個腫瘤樣本中,13個(12%)在胃中,19個(17.6%)在腸中,17個(15.7%)在空白組中,47個(43.5%)在混合黏蛋白表型組中(圖1B)。12個樣本(11.1%)由于RNA質量不足無法確定黏蛋白表型(圖1B)。隨后,基于黏蛋白mRNA表達數據進行主成分分析,以驗證不同表型組的腫瘤分類。值得注意的是,MUC2和MUC13 mRNA表達是具有腸黏蛋白表型的腫瘤的主要決定因素,而MUC1、MUC5AC和MUC6 mRNA表達是識別具有胃黏蛋白表型的腫瘤的最佳因素(圖1C)。最后,作者還通過IHC在蛋白水平評估了黏蛋白的表達,進一步證實了mRNA表達數據(圖1D)。
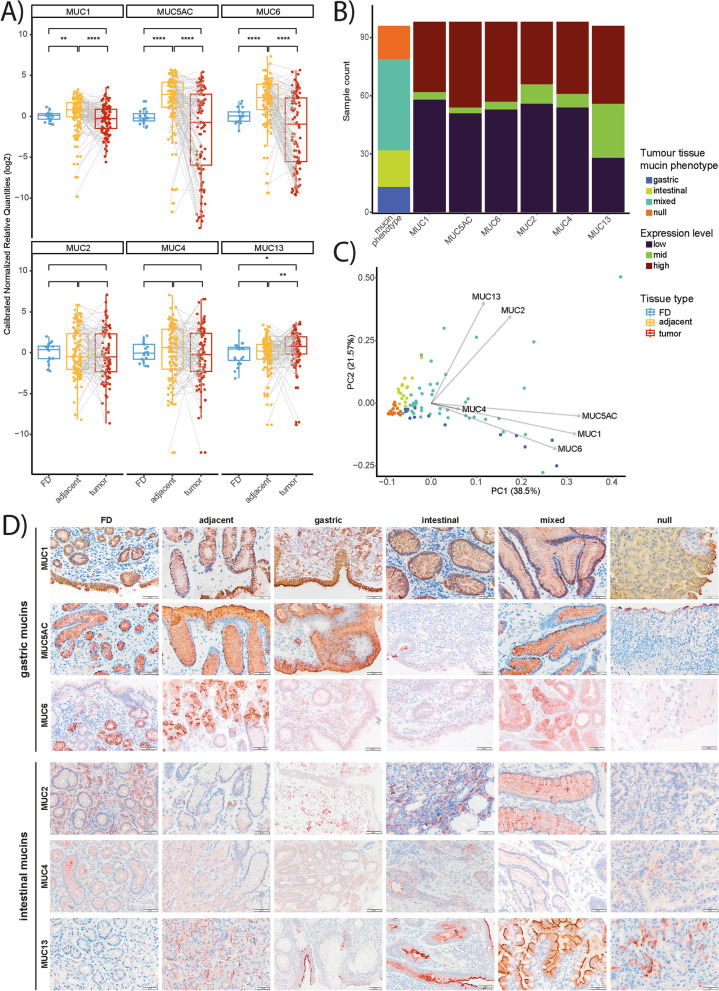
圖1 與FD患者相比,GC患者胃中的異常黏蛋白特征
2. 腸黏蛋白表型和異常MUC13 mRNA表達與較差的生存率相關
作者使用Kaplan-Meier和Cox比例風險模型研究了黏蛋白mRNA表達、黏蛋白表型和5年生存率之間的關系(圖2)。對于后者,臨床患者數據(年齡、性別、腫瘤分期和位置)也被考慮在內。兩種方法均顯示腸黏蛋白表型與較差的生存率相比胃、混合和無效黏蛋白表型(log-rank檢驗,P=0.01;Wald檢驗,P=0.016,圖2A)。作者還確定了個體黏蛋白表達水平與生存率之間的顯著相關性。Kaplan-Meier生存曲線顯示,胃癌組織中MUC5AC和MUC6 mRNA低表達與較差的生存期相關(P≤0.027;圖2B)。MUC1 mRNA的表達也有類似的趨勢,但差異無統計學意義(P=0.069;圖2B)。相反,MUC2 mRNA中表達與較差的預后相關(P=0.038),而MUC13 mRNA低表達和高表達與較差的預后相關(P=0.068;圖2B)。然而,僅Cox比例風險模型定義了MUC13高水平表達和較差的生存期之間的顯著關聯(P=0.016;圖2B)。此外,賁門(P=0.02)和3期(P=0.001)也與較差的結局相關(圖2B)。
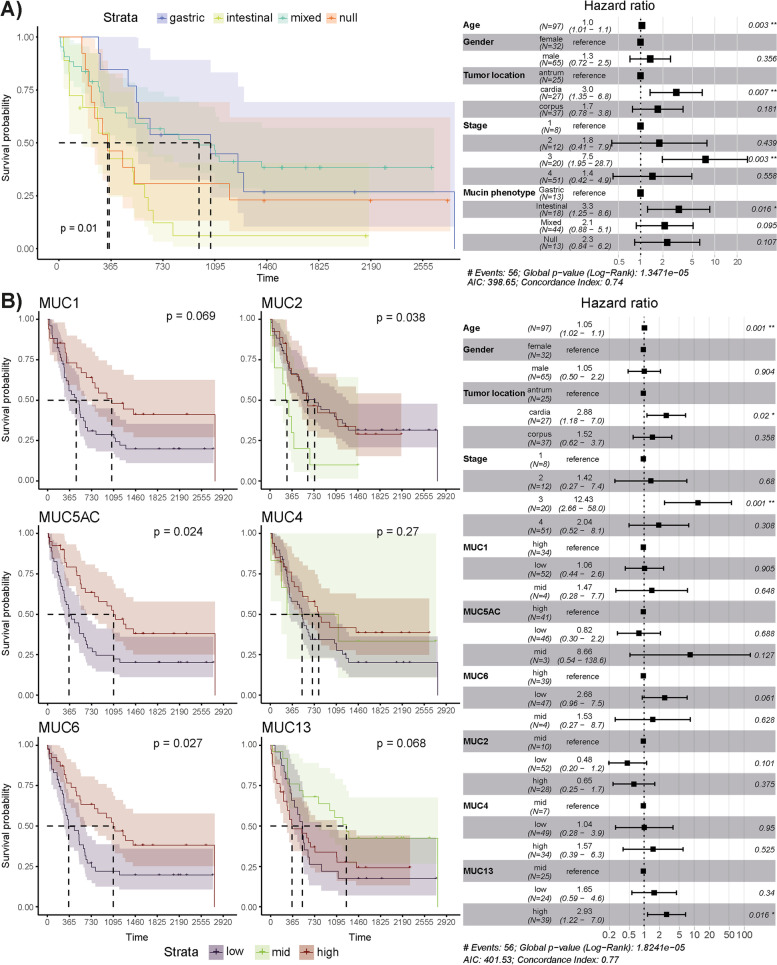
圖2 腸道黏蛋白表型和異常MUC13表達與GC患者生存率降低相關
3. 不同黏蛋白表型組之間的微生物群失調發生改變
為了確定與不同GC黏蛋白表型相關的生態失調,作者首先利用每種組織類型(腫瘤、鄰近非腫瘤組織和FD組織)和每種黏蛋白表型的相對細菌豐度評估了微生物組結構的變化(圖3A)。總體而言,Patescibacteria的豐度在FD和癌旁組織(P=0.024)、FD和腫瘤組織(P=0.014)、FD和具有腸道(P=0.057)、混合(P=0.068)和無(0.0191)黏蛋白表型的腫瘤之間存在顯著差異(圖3A)。無黏蛋白表型的腫瘤與胃(P=0.0126)或腸(P=0.0295)黏蛋白表型之間的彎曲菌屬豐度也存在顯著差異,這可以歸因于不同表型之間的螺桿菌屬豐度差異。此外,在無黏蛋白表型的腫瘤與具有胃(P=0.0067)、腸(P=0.0032)或混合(P=0.0249)黏蛋白表型的腫瘤之間,擬桿菌科的豐度有顯著差異(圖3A)。后者在FD病例和無黏蛋白表型的腫瘤之間也有顯著改變(P=0.0079;圖3A)。
為了支持上述觀點,作者使用α(即樣本內)和β(即樣本間)多樣性指標進一步研究了群落組成的變化(圖3B,C)。與基于調查的所有四項指標的腸道黏蛋白表型,以及基于Chao1和觀察到的豐富度的混合黏蛋白表型的腫瘤樣本相比,具有無黏蛋白表型的腫瘤樣本顯示出顯著較低的α多樣性(圖3B)。考慮到觀察到的豐富度和Shannon指數,作者還觀察到與有胃黏蛋白表型的腫瘤相比,有無效黏蛋白表型的腫瘤的α多樣性顯著降低(圖3B)。β多樣性使用Bray-Curtis和加權UniFrac系統發育距離指標進行分析,并在主坐標分析(PCoA)圖中可視化(圖3C)。前兩個軸獲得了Bray-Curtis距離的24.1%和16.5%,與加權UniFrac距離的結果(24.5%和15%)相似。有趣的是,具有腸黏蛋白表型的腫瘤樣本更多地分布在軸2,而具有胃表型的腫瘤仍然強烈地聚集在FD樣本周圍。相反,當使用ANOSIM測試群落組成的差異時,沒有發現顯著差異(圖3C)。
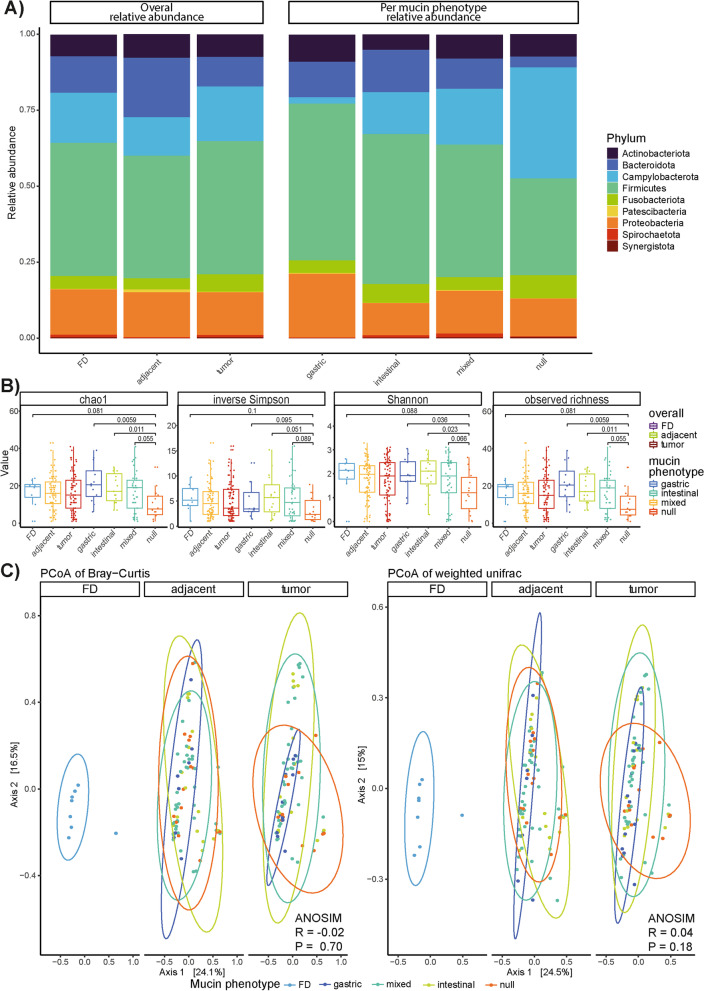
圖3 FD、腫瘤和鄰近非腫瘤組織之間,以及具有胃、腸、混合和無效黏蛋白表型的腫瘤之間的微生物群組成差異
為了進一步研究胃腫瘤中異常黏蛋白表達對細菌富集或缺失的影響,作者采用差異豐度分析和Spearman相關檢驗評估細菌屬與單個黏蛋白或黏蛋白表型的相關性。與其他表型相比,螺桿菌屬在MUC5AC低的腫瘤樣本中富集(圖4)表達。此外,Megasphaera在MUC5AC低表達的樣本中富集(圖4)。在MUC1 mRNA水平低的胃腺癌中,觀察到大量的卟啉單胞菌(圖4)。關于細菌屬和腸黏蛋白表達之間的關聯,作者在MUC2 mRNA水平高的胃腺癌中發現了鏈球菌的缺失(圖4),而在MUC4 mRNA表達處于中等水平的腫瘤中,乳桿菌的數量顯著較多(圖4)。有趣的是,乳桿菌屬、奈瑟菌屬、普雷沃菌屬和韋榮菌屬在MUC13高表達的胃腫瘤樣本中富集(圖4)。

圖4 與異常黏蛋白表達相關的GC富集和GC去除細菌的系統發育樹
4. 不同黏蛋白表型的胃腺癌中不同的群落復雜性
采用物種共現概率模型分析GC中細菌屬之間的正相關和負相關。圖5顯示了在不同黏蛋白表型組和MUC13低表達和高表達的胃腫瘤中鑒定出的細菌網絡。在不同黏蛋白表型組之間,總體交互作用數量有顯著差異,大多數交互作用見于混合黏蛋白表型和腸黏蛋白表型的腫瘤(圖5B,C)。此外,不同黏蛋白表型之間的共排除交互作用與共現交互作用的比值不同,在腸型、混合型和無黏蛋白表型的腫瘤中,相對較多的共現交互作用(陰性與陽性比值分別為0.23、0.30和0.25;圖5B-D),而胃黏蛋白表型患者的共排除交互作用多于共發生交互作用(1.4;圖5)。此外,在屬水平進行Pearsonχ2檢驗,以檢驗不同黏蛋白表型的胃癌對不同屬的網絡貢獻的差異。殘差被用作相關性的度量,僅考慮大于2的殘差。在胃黏蛋白表型的腺癌中,與有另一種黏蛋白表型的腫瘤相比,毛管厭氣帶、Gemella和Reyranella的相互作用在比例上較多(圖5A)。月形單胞菌屬(Selenomonas)和密螺旋體(Treponema)對腸黏蛋白表型的樣本細菌群落的影響較大,而羅氏菌屬(Rothia)和普雷沃菌屬(Prevotella)對無黏蛋白表型的腫瘤樣本的貢獻較大(圖5)。在腸黏蛋白表型的胃腺癌中,大多數相互作用見于細小單胞菌屬、Sediminibacterium、螺桿菌屬、月形單胞菌屬、梭桿菌屬、雷氏菌屬、密螺旋體、纖毛菌屬、嗜血桿菌屬、奈瑟菌屬、韋榮球菌屬、普雷沃菌屬和鏈球菌屬(圖5B)。在混合黏蛋白表型的腫瘤樣本中,相互作用最多的細菌屬為別普雷沃菌屬(Alloprevotella)、梭桿菌屬(Fusobacterium)、Sediminibacterium、奈瑟菌屬(Neisseria)、韋榮球菌屬(Veillonella)、雷氏菌屬(Reyranella)、羅氏菌屬(Rothia)、鏈球菌屬(Streptococcus)、嗜血桿菌屬(Haemophilus)、細小單胞菌屬(Parvimonas)、普雷沃菌屬(Prevotella)和螺桿菌屬(Helicobacter)(圖5C),而羅氏菌屬(Rothia)、普雷沃菌屬(Prevotella)和螺桿菌在無黏蛋白表型的樣本中貢獻較多(圖5D)。
最后,作者發現韋榮球菌屬、奈瑟菌屬和普雷沃菌屬在MUC13高表達的腫瘤中發揮塑造群落結構的作用(圖5E、F)。
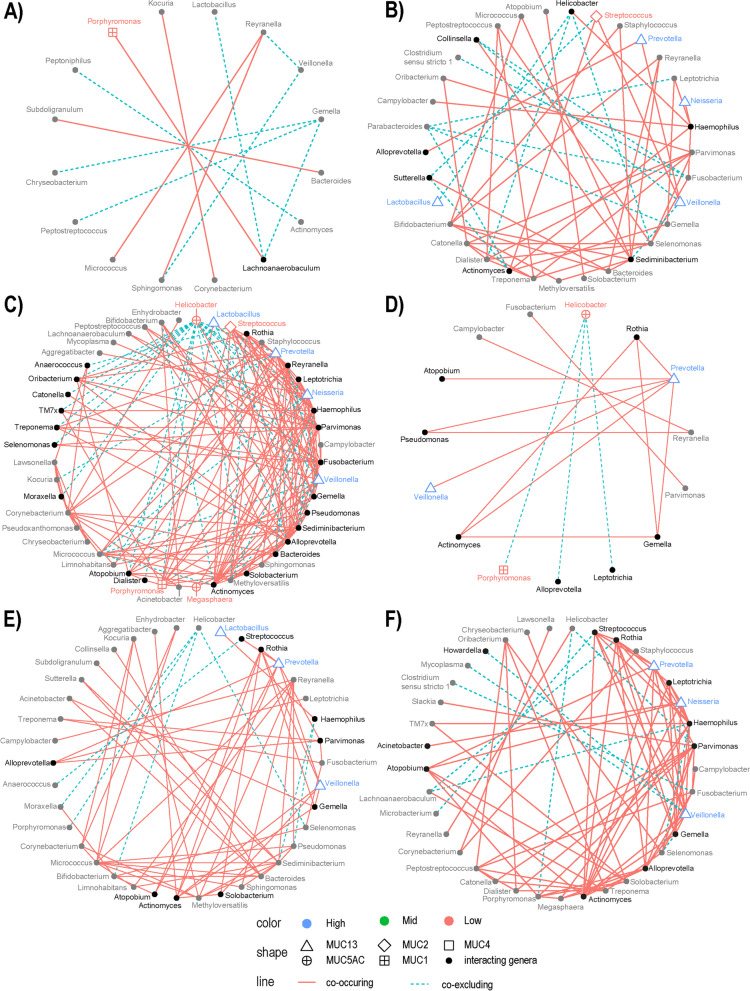
圖5 與黏蛋白表型或異常MUC13表達相關的GC富集和GC缺失屬的相關性
5. 胃癌中微生物組的功能能力由黏蛋白表型定義
通過PICRUSt2宏基因組推斷,評估每個樣本類型(FD、腫瘤和鄰近非腫瘤組織)和黏蛋白表型或胃腫瘤中異常表達的黏蛋白的黏膜相關微生物組的功能。使用ALDEx2檢驗相對通路豐度的差異。當考慮FD、腫瘤和鄰近的非腫瘤樣本時,作者發現三條通路(嘌呤、鳥苷和腺苷核苷酸降解)在GC隊列中存在差異豐度和富集(圖6A)。此外,在被分配到不同黏蛋白表型的腫瘤之間,作者發現了5條預測的KEGG通路的差異表達,除了焦點降解通路外,大多數通路在無黏蛋白表型的腫瘤中被缺失(圖6B)。
作者對每種黏蛋白重復了上述評估。對于MUC1和MUC2的mRNA表達水平,沒有發現差異豐富的通路。有趣的是,在MUC6和MUC5AC低表達的樣本中,嘌呤核糖核苷降解途徑被耗盡。相反,在MUC13高表達的樣本中,作者觀察到糖降解途徑的富集。此外,異乳酸發酵也富集在MUC13高表達的樣本中,而丙酮酸發酵至CH2=CHCOOR I在MUC13正常表達的樣本中與MUC13高表達和低表達的樣本相比被耗盡。在MUC2高表達的樣本中也觀察到蔗糖降解IV途徑的富集。胃癌微生物組代謝潛能的上述變化提示其高度依賴黏蛋白作為食物來源。
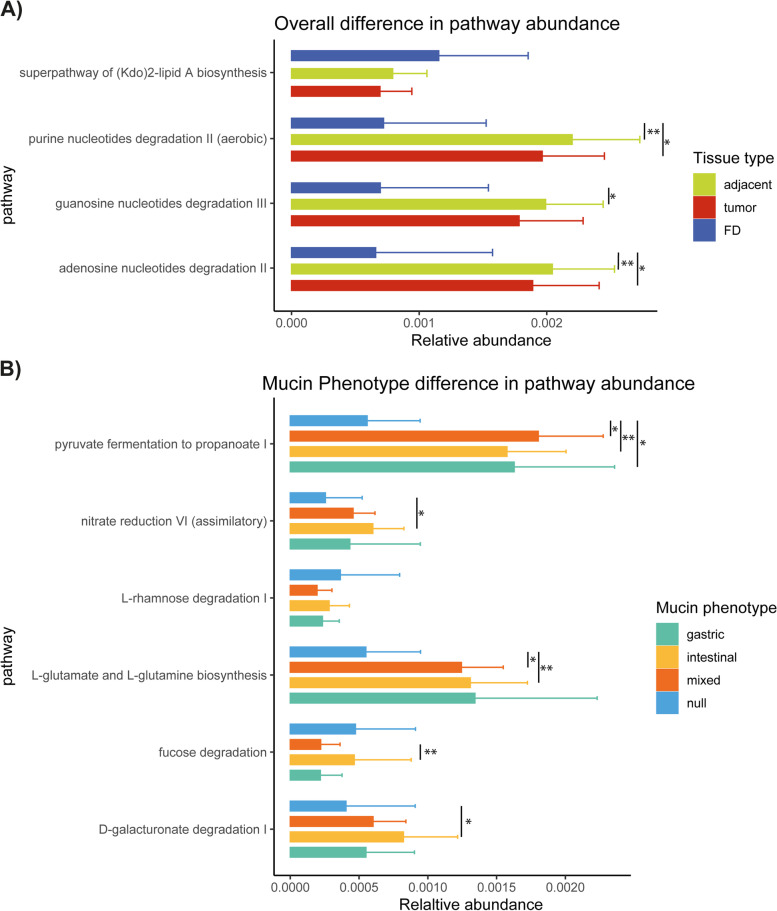
圖6 宏基因組通路的相對豐度由胃腺癌中的黏蛋白表型確定
結論
綜上所述,該研究確定了不同的黏蛋白-微生物組特征,這些特征塑造了胃癌的腫瘤微環境,腸道或異常的MUC13黏蛋白環境與不良結局相關。作者還發現,奈瑟菌屬、普雷沃菌屬和韋榮球菌屬等口腔致病性菌屬成員是胃癌中MUC13介導的信號傳導的潛在驅動因子,這些信號傳導可能是預測疾病結局的有用生物標志物。由于并非所有的胃癌前疾病最終都會演變為癌癥,因此癌前狀態患者的這種口腔分類群-MUC13特征也可能有助于預測進一步演變為癌癥的可能性。此外,具有腸黏蛋白表型的腺癌有利于促炎口腔細菌的建立,形成強大的共現網絡。最終,理解這些在胃癌發生中的黏蛋白-微生物組特征可能會影響胃癌的預防和治療策略,因此建議在其他胃癌隊列中進行充分的獨立外部驗證。
實驗方法
RT-qPCR,免疫組化,生存分析,16S rRNA基因測序,差異豐度分析,微生物網絡分析
參考文獻
Oosterlinck B, Ceuleers H, Arras W, De Man JG, Geboes K, De Schepper H, et al. Mucin-microbiome signatures shape the tumor microenvironment in gastric cancer. Microbiome. 2023 Apr 21;11(1):86.






