聯(lián)合scRNA-seq、MeRIP-Eseq、RNA-seq和Ribo-Eseq,7張圖為你揭示M6A閱讀器YTHDF1在抗結(jié)直腸癌免疫中的作用

N6-α-甲基腺苷(m6 A)是最豐富的RNA修飾之一,每個(gè)mRNA分子上估計(jì)有3-5個(gè)m6 A位點(diǎn)。M6A的甲基化修飾是甲基化轉(zhuǎn)移酶,去甲基化,甲基化閱讀蛋白共同參與。YTHDF1在m6A修飾中是作為甲基化閱讀器,已經(jīng)在許多研究中被證明YTHDF 1的上調(diào)與各種癌癥類型中的不良預(yù)后相關(guān)。本研究中,作者首先發(fā)現(xiàn)了YTHDF1表達(dá)與IFN-γ的表達(dá)和CD8+T細(xì)胞浸潤(rùn)呈負(fù)相關(guān),暗示了YTHDF1在結(jié)腸癌腫瘤微環(huán)境中的作用。通過在腫瘤模型上驗(yàn)證和scRNA-seq、MeRIP-Eseq、RNA-Eseq和Ribo-Eseq,證明了通過m6A-p65-CXCL 1/CXCR2軸抑制抗腫瘤免疫以促進(jìn)結(jié)腸癌進(jìn)展。該研究于2023年1月發(fā)表在《Gut》上,IF:24.5。
主要研究結(jié)果
1.YTHDF1與結(jié)腸癌預(yù)后不良相關(guān)以及單細(xì)胞測(cè)序揭示YTHDF1介導(dǎo)的免疫抑制
在80%以上的結(jié)腸癌(CRC)中,YTHDF1都表現(xiàn)為明顯的升高,暗示YTHDF1在促進(jìn)CRC中起作用。為了建立抗腫瘤免疫與m6 A調(diào)節(jié)子之間的聯(lián)系,分析m6A調(diào)節(jié)子與IFN-γ應(yīng)答基因和CD8+T細(xì)胞浸潤(rùn)之間的相關(guān)性,通過TCGA數(shù)據(jù)庫(kù)以及組織芯片染色分析,發(fā)現(xiàn)YTHDF 1與IFN-γ應(yīng)答途徑和CD8+T細(xì)胞浸潤(rùn)呈顯著負(fù)相關(guān)(圖A、B和C)。為了研究YTHDF1在調(diào)節(jié)抗腫瘤免疫中的作用,研究者使用CRISPR-cas9系統(tǒng)敲除MC38鼠MSI-casH CRC細(xì)胞中的YTHDF1(YTHDF1-cas9 KO),并將細(xì)胞注射到同基因C57BL6小鼠中(圖1D)。與對(duì)照相比,通過敲除YTHDF1l降低了腫瘤體積和重量(圖1E)。從腫瘤中分離CD45+免疫細(xì)胞并進(jìn)行單細(xì)胞RNA-seq(scRNA-seq)。與NC組相比,具有YTHDF1-KO的腫瘤表現(xiàn)出粒細(xì)胞髓系-衍生的抑制細(xì)胞(G-MDSC,簇3)和嗜中性粒細(xì)胞的顯著減少(圖1F)。進(jìn)一步將T細(xì)胞和NK細(xì)胞重新聚類為CD4+T、CD8+T、NKT和NK細(xì)胞亞群,與對(duì)照相比,它們?cè)赮THDF11-KO腫瘤中同時(shí)增加(圖1F)。檢查了MDSC的功能標(biāo)志物Illb、Arg2、Cxcr2和Ccr2,發(fā)現(xiàn)這些基因主要富集在MDSC簇(簇3和簇4)中,特別是來自YTHDF1未敲除的腫瘤(圖1G)。通過流式細(xì)胞術(shù)測(cè)定MC38同基因小鼠中腫瘤浸潤(rùn)免疫細(xì)胞的組成。我們證實(shí)YTHDF1敲除顯著抑制腫瘤重量和體積(圖1C),并且流式細(xì)胞術(shù)揭示YTHDF1敲除減少M(fèi)DSC,但增加腫瘤中的CD8+T和CD4+T細(xì)胞(圖1H,I)。在MDSC中,G-MDSC是主要的亞群,并且YTHDF1的敲除導(dǎo)致G-MDSC的顯著減少(圖1 I)。這些結(jié)果證明了YTHDF1在CRC中的免疫抑制功能。
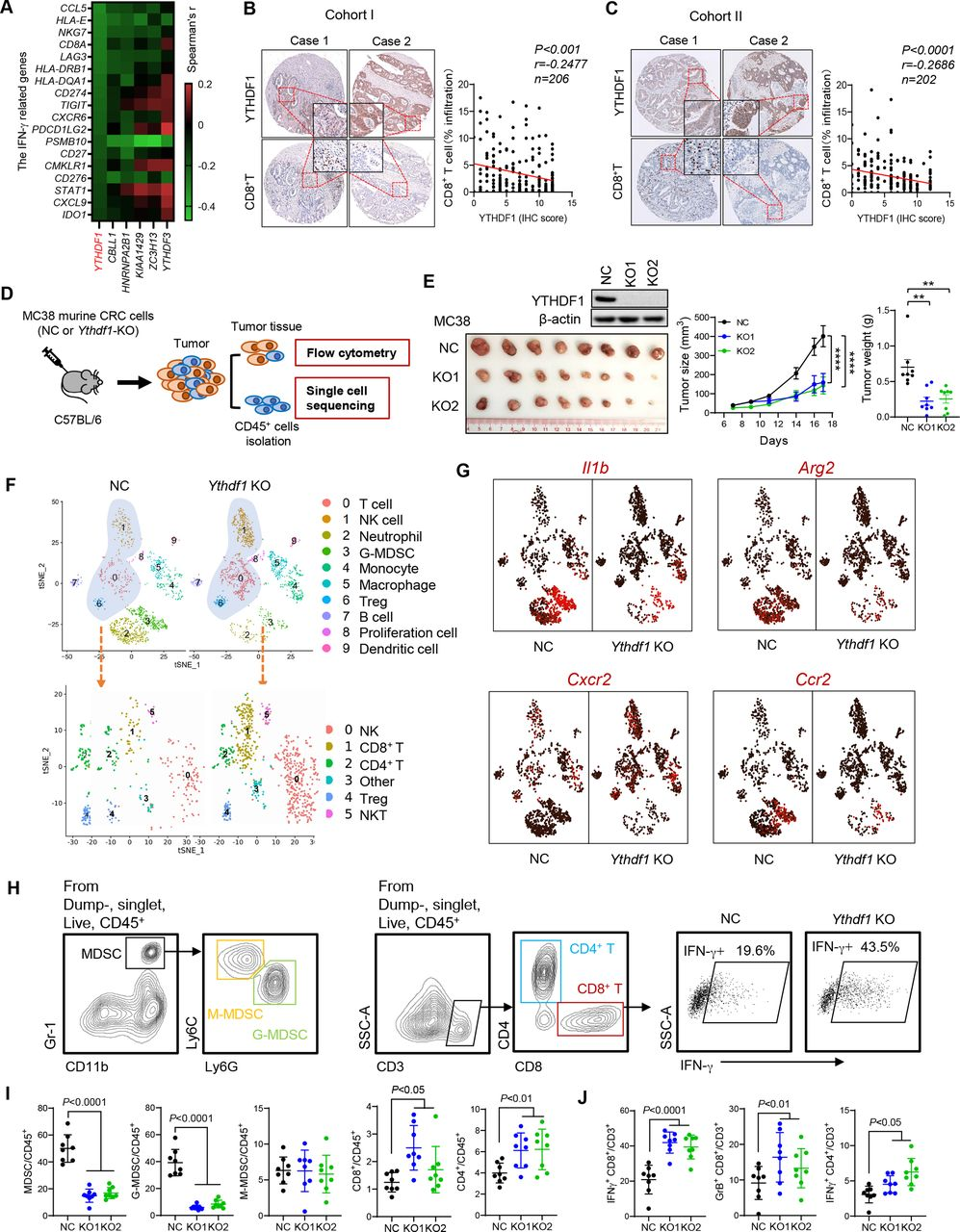
圖1:YTHDF1與CRC患者中的免疫微環(huán)境相關(guān)
2.YTHDF1敲除減少了MDSCs細(xì)胞并增加了細(xì)胞毒性T的浸潤(rùn)
接下來在CT26(MSS-CRC小鼠模型)中用YTHDF1-KO進(jìn)行實(shí)驗(yàn)以驗(yàn)證YTHDF1在調(diào)節(jié)抗腫瘤免疫中的作用。如所預(yù)期的,YTHDF1-KO導(dǎo)致CT 26同基因小鼠中腫瘤體積和重量減少(圖2A和B),以及功能性T細(xì)胞減少和MDSC積累減少(圖2C和D)。免疫熒光染色證實(shí)了在YTHDF1敲除后MC38和CT26同源腫瘤中MDSC(CD11b +Gr-b1+)的浸潤(rùn)減少(圖2 E)。總的來說,CRC細(xì)胞中的YTHDF1耗竭減少M(fèi)DSC并增加功能性T細(xì)胞浸潤(rùn)。這些發(fā)現(xiàn)與臨床數(shù)據(jù)一致,表明YTHDF1與CD8+T細(xì)胞和IFN-γ相關(guān)特征呈反相關(guān)。YTHDF1-KO中減弱的腫瘤形成是否依賴于CD8+ T細(xì)胞抗腫瘤免疫。為了解決這一點(diǎn),又在MC38同基因模型中用抗CD8抗體耗盡CD8+T細(xì)胞。與上面的假設(shè)一致,CD8+T細(xì)胞的消耗恢復(fù)了YTHDF1-KO腫瘤的生長(zhǎng)(圖2F和G),表明YTHDF1-KO的腫瘤抑制功能至少部分依賴于CD8+T細(xì)胞。這CT26同基因小鼠中得到證實(shí),顯示抗CD8抗體治療挽救了YTHDF1-KO組中停滯的腫瘤生長(zhǎng)(圖2 H,I)。總之,YTHDF1敲除通過誘導(dǎo)CD8+T細(xì)胞依賴性抗腫瘤免疫抑制CRC生長(zhǎng)。
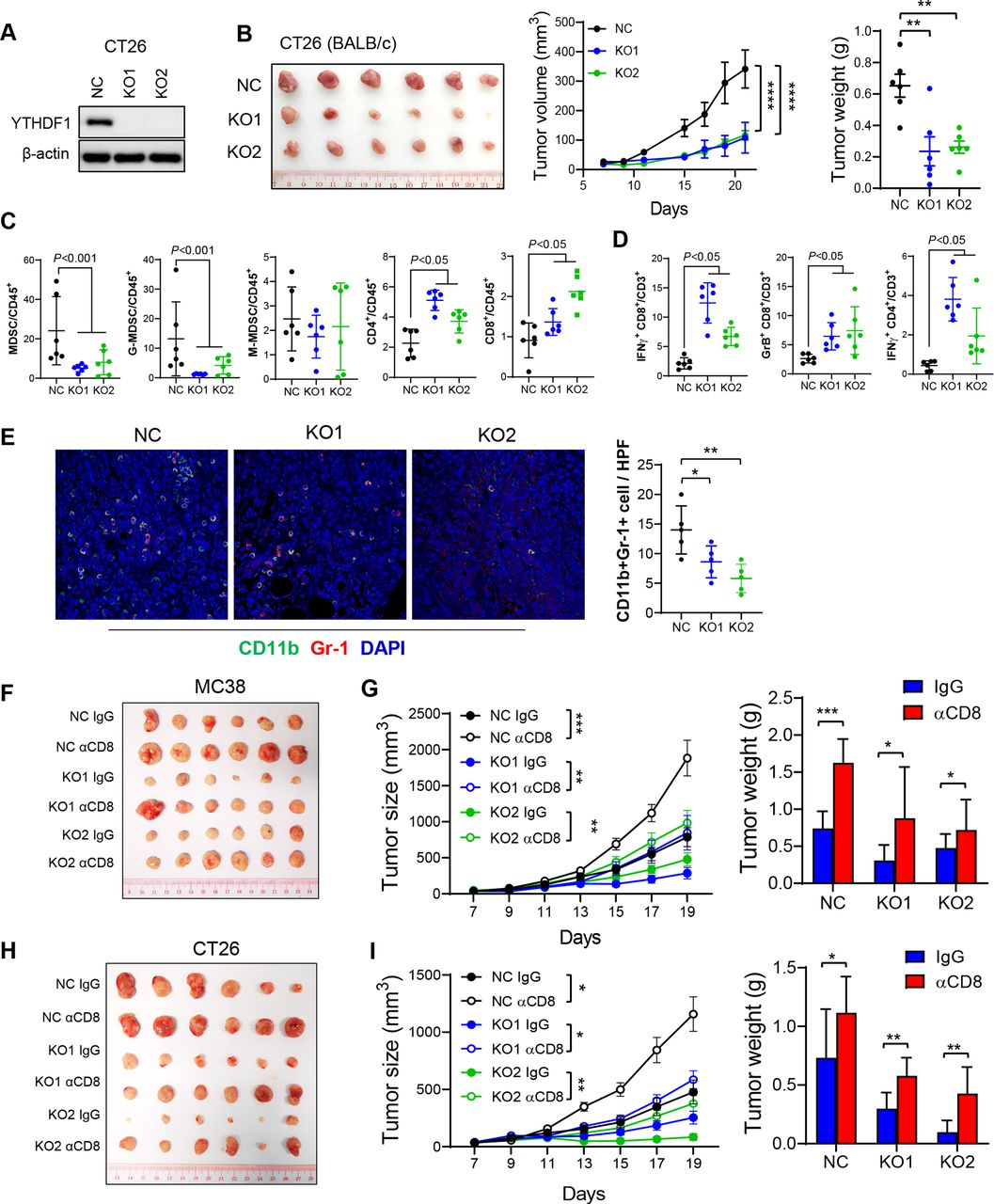
圖2:YTHDF1敲除增加了MDSC和功能性T細(xì)胞來誘導(dǎo)抗腫瘤免疫
3.腸特異性YTHDF1基因敲入促進(jìn)小鼠結(jié)直腸腫瘤發(fā)生并抑制抗腫瘤免疫
利用腸特異性YTHDF1敲入小鼠(YTHDF1loxp/loxp CDX2-cre),并通過AOM/DSS處理在這些小鼠中引發(fā)CRC(圖3A)。發(fā)現(xiàn)YTHDF1的過表達(dá)導(dǎo)致AOM/DSS模型中結(jié)腸腫瘤數(shù)量和大小增加(圖3C)。流式細(xì)胞術(shù)顯示與野生型小鼠相比,YTHDF1敲入小鼠的結(jié)腸腫瘤中MDSC浸潤(rùn)增加以及NK、CD4+T和CD8+T細(xì)胞減少(圖3D)。此外,還發(fā)現(xiàn)YTHDF1敲入降低了功能性T細(xì)胞的比例,如通過顆粒酶B、INF-γ和TNF-α表達(dá)所鑒定的(圖3E)。為了驗(yàn)證ApcMin/+驅(qū)動(dòng)的自發(fā)性CRC中的上述結(jié)果,又構(gòu)建了ApcMin/+ YTHDF1loxp/loxpCDX2-cre小鼠模型,同樣的,發(fā)現(xiàn)YTHDF1敲入的ApcMin/+小鼠中結(jié)腸腫瘤數(shù)量和大小增加(圖3B)。腫瘤浸潤(rùn)性免疫細(xì)胞顯示在具有ApcMin/+的腫瘤中NK、CD4+T和CD8+T細(xì)胞的浸潤(rùn)顯著降低,同時(shí)敲入YTHDF1,并誘導(dǎo)MDSC(圖3F)。此外,YTHDF1敲入減少ApcMin/+小鼠中的顆粒酶B+、INF-γ+或TNF-α+ T細(xì)胞(圖3G)。總的來說,這些結(jié)果支持YTHDF 1促進(jìn)促進(jìn)自發(fā)性CRC的免疫抑制微環(huán)境。
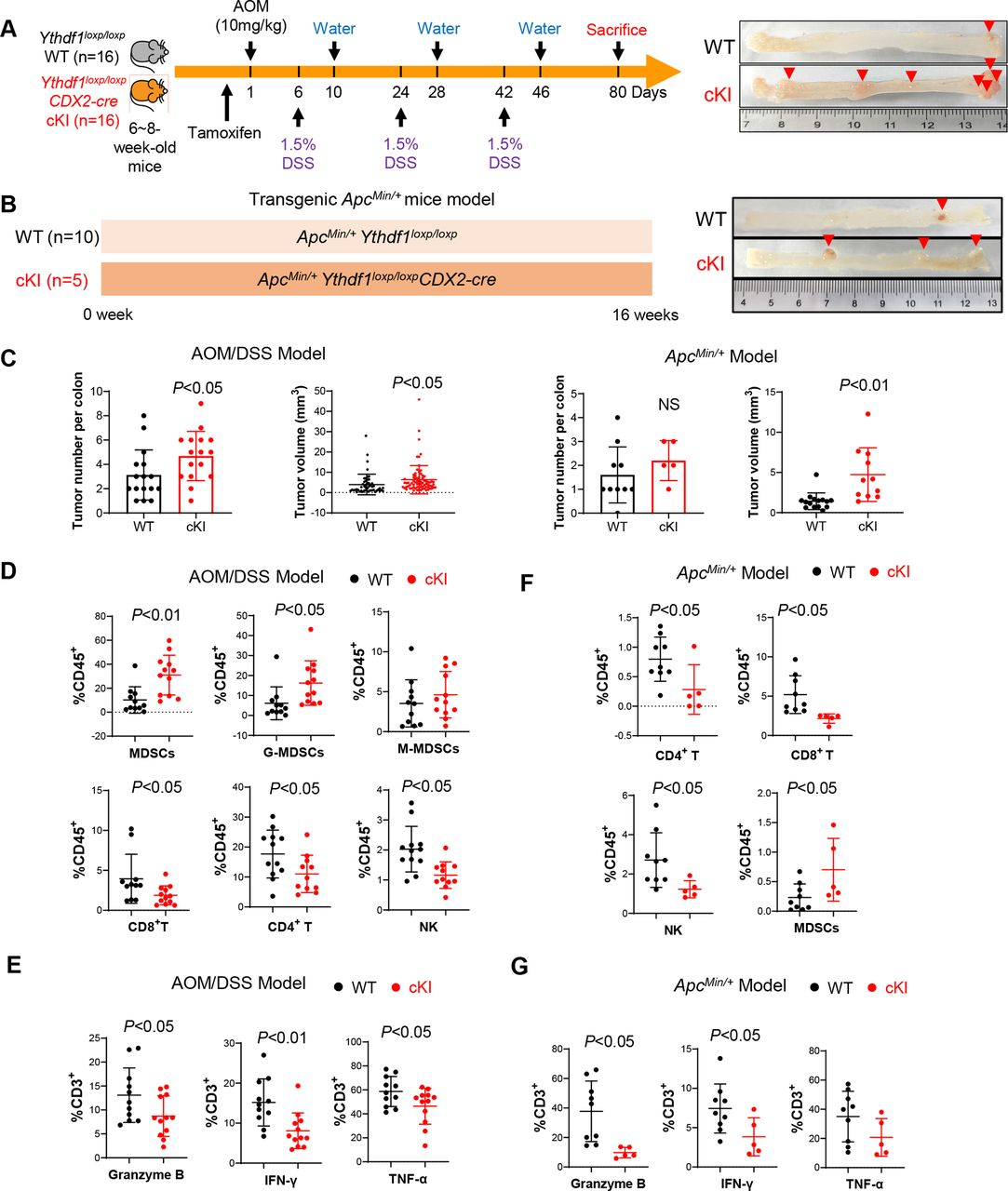
圖3:YTHDF 1敲入促進(jìn)小鼠結(jié)直腸腫瘤發(fā)生并抑制抗腫瘤免疫
4.通過VNP-siYTHDF 1靶向YTHDF1增強(qiáng)CD34+人源化小鼠的抗腫瘤免疫
構(gòu)建CD34+人源化小鼠模型(圖4A)。為了在體內(nèi)靶向YTHDF1,開發(fā)了攜帶針對(duì)YTHDF 1的siRNA的VNPs 。在腫瘤達(dá)到50-100 mm3后,用VNP-siNC或-siYTHDF 1處理攜帶人CRC HCT116異種移植物的人源化NSG小鼠(圖4 B)。與VNP-siNC相比,VNP-siYTHDF 1顯著抑制腫瘤體積和重量(圖4 B、C)。還進(jìn)行流式細(xì)胞術(shù)以分析腫瘤微環(huán)境(圖4D)。VNP-siYTHDF1減少M(fèi)DSC浸潤(rùn),但增加CD4+T細(xì)胞、CD8+T細(xì)胞和NK細(xì)胞積累(圖4 E)。此外,在接受VNP-siYTHDF1的腫瘤中鑒定出更多的IFN-γ+、TNF-α+和顆粒酶B+ 、CD 8+T細(xì)胞(圖4 E)。因此,使用VNP-siYTHDF1靶向YTHDF 1是增強(qiáng)人源化小鼠中抗腫瘤免疫力的有效的手段。
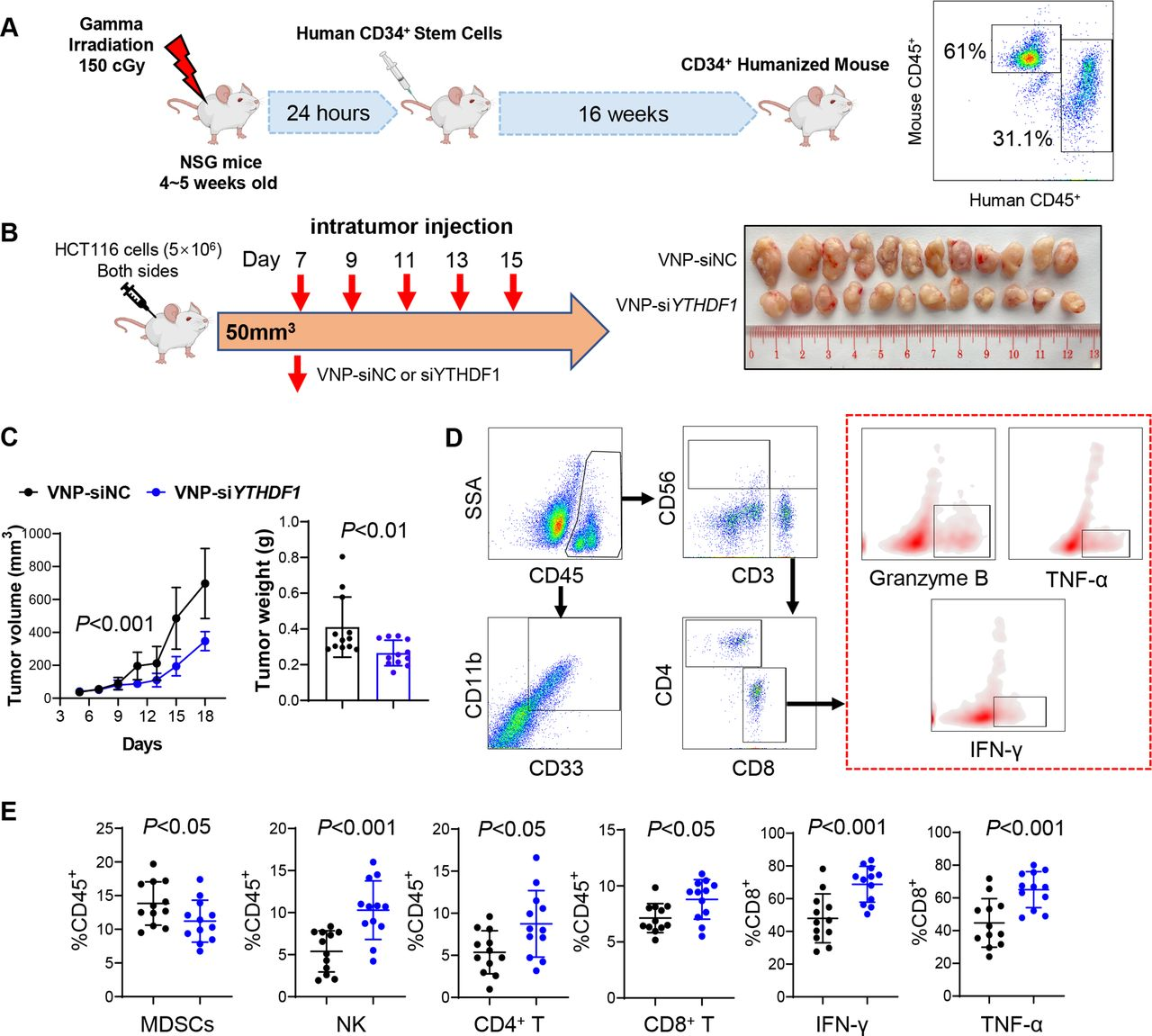
圖4:VNP-siYTHDF1增強(qiáng)CD34+人源化小鼠中的抗腫瘤免疫
5.YTHDF 1促進(jìn)p65翻譯激活TNF/NF-κB信號(hào)轉(zhuǎn)導(dǎo)
在敲除或未敲除YTHDF1的CRC細(xì)胞中進(jìn)行了RNA-seq和Ribo-seq。通過RNA-seq分析,NC和YTHDF1-KO的MC38和CT26細(xì)胞之間差異表達(dá)的基因在TNF和NF-κB信號(hào)傳導(dǎo)途徑中富集。此外,Ribo-seq數(shù)據(jù)揭示YTHDF1的缺失與TNF信號(hào)傳導(dǎo)的失活顯著相關(guān)(圖5A)。由于YTHDF1作為m6A閱讀器起作用,接下來進(jìn)行m6A免疫沉淀測(cè)序(MeRIP-seq)以精確定位m6A-seq修飾的轉(zhuǎn)錄物。通過篩選參與TNF信號(hào)傳導(dǎo)的mRNA中的m6A峰,鑒定了兩個(gè)接近p65 mRNA終止密碼子的m6A位點(diǎn)(圖5 B),并通過MeRIP-qPCR驗(yàn)證(圖5C)。通過RIP-seq和使用抗YTHDF1抗體的RIP-qPCR鑒定了YTHDF1和p65 mRNA之間的直接相互作用(圖5D)。敲除YTHDF1可減弱CT26和MC38細(xì)胞中p65蛋白表達(dá),尤其是核p65表達(dá),而不影響NF-κB通路的其他調(diào)節(jié)因子如IKKα和IκBα的表達(dá)(圖5E)。在人CRC細(xì)胞中,顯示野生型YTHDF 1的過表達(dá),升高p65蛋白表達(dá),相反地,YTHDF1敲低減弱人CRC細(xì)胞中的p65蛋白(圖5 F)。使用抗YTHDF1抗體的RIP-α qPCR也證實(shí)了人CRC細(xì)胞中YTHDF1和p65 mRNA之間的直接相互作用(圖5G)。驗(yàn)證YTHDF1和p65在體內(nèi)的關(guān)聯(lián),將YTHDF1敲入小鼠中,發(fā)現(xiàn)結(jié)腸腫瘤中p65和磷酸化p65蛋白均增加(圖5 H)。總之,上述的實(shí)驗(yàn)證明了YTHDF1促進(jìn)p65蛋白的表達(dá),以激活TNF和NF-κB信號(hào)傳導(dǎo)。
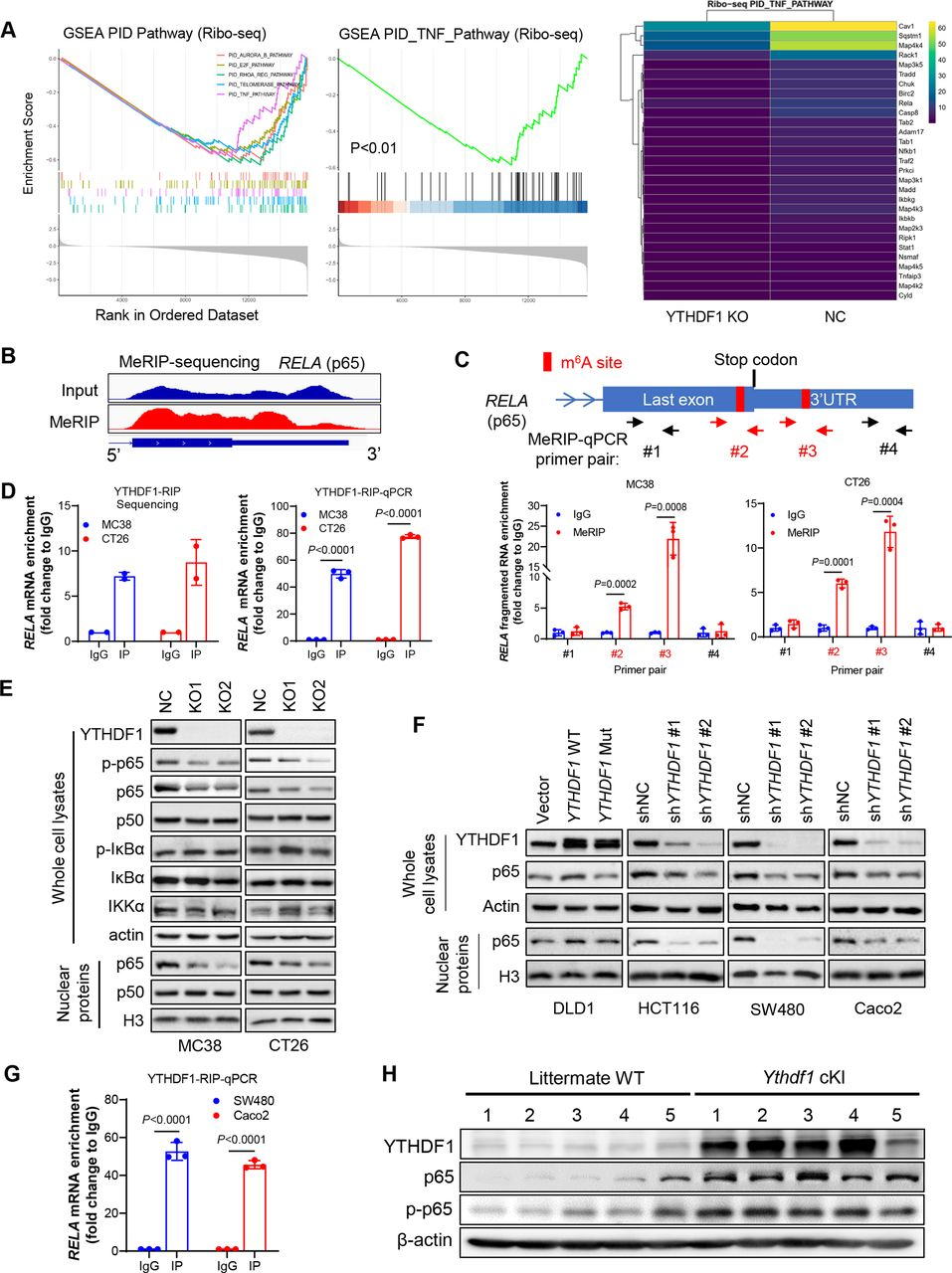
圖5:YTHDF1通過促進(jìn)p65mRNA翻譯促進(jìn)CRC中的TNF/NF-κ B信號(hào)傳導(dǎo)
6.YTHDF1通過p65-CXCL 1軸促進(jìn)MDSC遷移
進(jìn)行細(xì)胞因子多重免疫測(cè)定,檢測(cè)CRC細(xì)胞、腫瘤裂解物和來自攜帶同基因腫瘤的小鼠的血清的條件培養(yǎng)基中的23種不同的小鼠細(xì)胞因子。在這些細(xì)胞因子中,CXCL1在YTHDF1-KO組中一致地減少(圖6A和B)。進(jìn)行體外MDSC 迀移測(cè)定,發(fā)現(xiàn)來自野生型CRC細(xì)胞的條件培養(yǎng)基增強(qiáng)MDSC迀移(圖6C)。通過CXCR2抑制劑阻斷CXCL1/CXCR2相互作用,發(fā)現(xiàn)消除了對(duì)照和YTHDF1-KO培養(yǎng)物上清液在介導(dǎo)MDSC迀移方面的差異(圖6C)。另外,YTHDF1敲除顯著抑制鼠的CXCL1 mRNA水平(圖6D)。接下來研究了YTHDF1是否影響MDSC功能。從MC38同基因腫瘤中分離CD11b+Gr- 1+ MDSC,然后與T細(xì)胞體外共培養(yǎng)(圖6 E)。從對(duì)照腫瘤分離的MDSC抑制T細(xì)胞增殖。然而,與來自對(duì)照的MDSC相比,來自YTHDF1-KO腫瘤的MDSC對(duì)CD8+T細(xì)胞和CD4+T細(xì)胞的增殖表現(xiàn)出顯著更低的抑制活性(圖6 F和G),支持表達(dá)表達(dá)YTHDF1的CRC募集功能性MDSC。
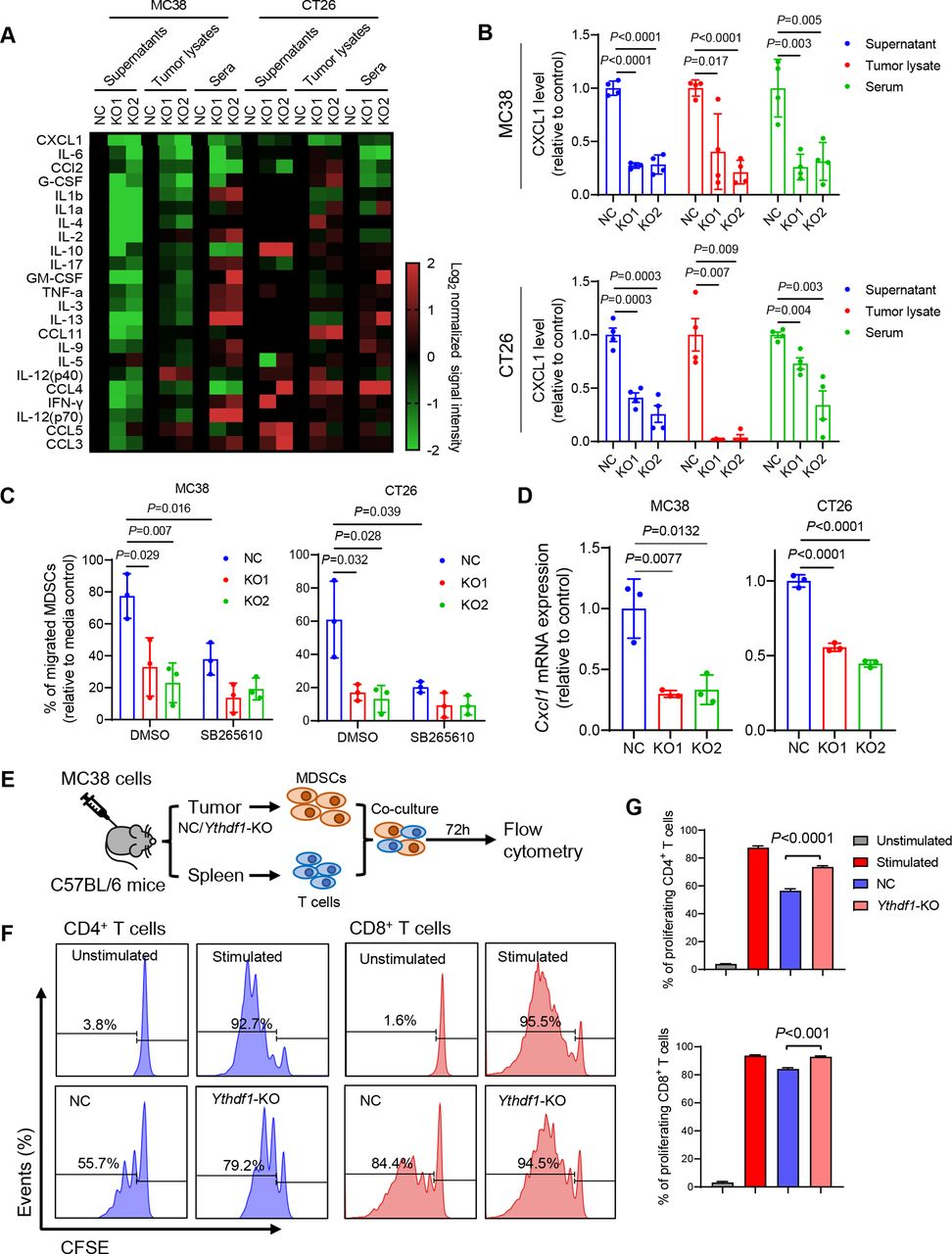
圖6:YTHDF1通過調(diào)節(jié)CXCLl分泌介導(dǎo)MDSC的遷移
7.YTHDF1是結(jié)直腸癌免疫治療的潛在治療靶點(diǎn)
在小鼠中對(duì)YTHDF1的敲除,發(fā)現(xiàn)增強(qiáng)了抗PDl在MC38微衛(wèi)星不穩(wěn)定性高(MS1- H)同基因腫瘤中的功效,并延長(zhǎng)了荷瘤小鼠的存活期(圖7A)。當(dāng)MC38同系腫瘤達(dá)到50~100 mm3時(shí),用VNP-siYTHDF1(或VNP-siNC)和抗PD 1處理(或IgG)處理小鼠。與VNP-A siNC相比,VNP-siYTHDF1顯著抑制MC38腫瘤生長(zhǎng)(圖7 B和C)。值得注意的是,VNP-siYTHDF1加抗PDl的組合對(duì)腫瘤生長(zhǎng)發(fā)揮最強(qiáng)的抑制作用(圖7 B和C)。基于同基因CT26(MSS-CRC)腫瘤模型,進(jìn)一步解決了靶向YTHDF1是否可以克服MSS-CRC中的抗PD1抗性。因此,將具有YTHDF1敲除的CT26細(xì)胞注射到同基因小鼠中并用抗PDl處理。發(fā)現(xiàn)YTHDF1的敲除顯著增強(qiáng)了CT26同基因腫瘤中的抗PDl治療功效(圖7 D和E)。流式細(xì)胞術(shù)分析進(jìn)一步揭示,在CT26和MC38同基因模型中,YTHDF1沉默和抗PDl的組合顯著增加腫瘤浸潤(rùn)功能性CD8+T細(xì)胞,包括IFN-γ+ CD8+T細(xì)胞和顆粒酶B+ CD8+T細(xì)胞(圖7 F和G)。此外,組合治療顯著減少M(fèi)DSC的積累,而誘導(dǎo)CD4+T細(xì)胞和CD8+T細(xì)胞(圖7 G)。因此,這些結(jié)果表明YTHDF1的靶向不僅增強(qiáng)MSI-H CRC中的ICB治療功效,而且還通過抑制MDSC的募集和改善CD8+T細(xì)胞的功能性來克服MSS-CRC中的ICB抗性。
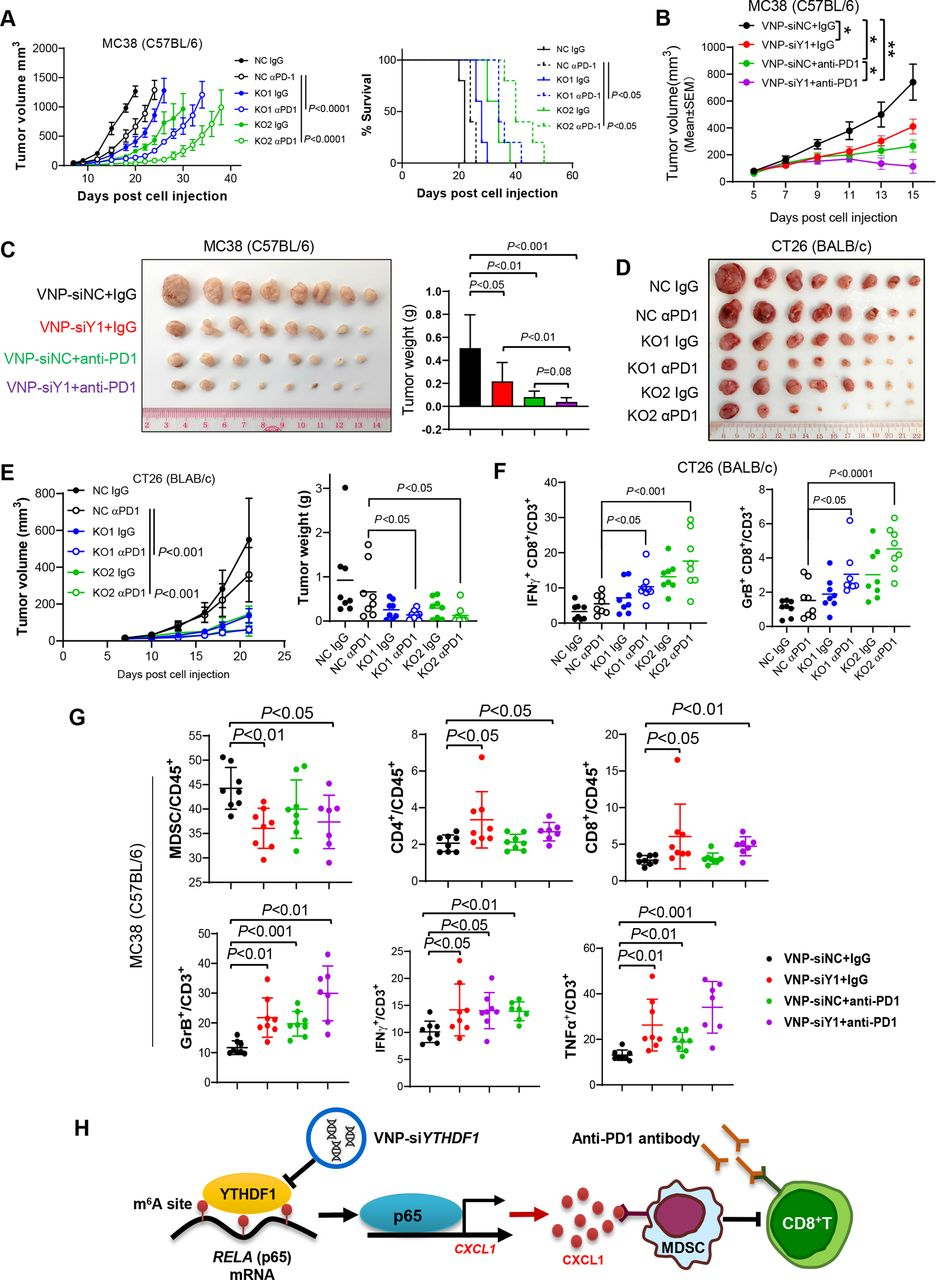
圖7:YTHDF1增強(qiáng)了CRC中的抗PD 1阻斷療法
結(jié)論
綜上所述,CRC中的YTHDF1表達(dá)通過激活m6A-p65-pCXCL1軸來募集免疫抑制性MDSC以抑制T細(xì)胞,從而促進(jìn)CRC。靶向YTHDF1加抗PD 1治療顯示出針對(duì)CRC的抗腫瘤功效,證實(shí)YTHDF1是CRC的潛在治療靶標(biāo)。
實(shí)驗(yàn)方法
臨床樣本收集和收集細(xì)胞,TCGA數(shù)據(jù)分析,組織芯片,單細(xì)胞測(cè)序,AOM/DSS小鼠模型,Apcmin/+小鼠模型,人源化小鼠模型,RNA-seq,Rio-seq,MeRIP-seq,測(cè)序結(jié)果生信分析,多重小鼠細(xì)胞因子免疫測(cè)定,ELISA,transwell,western blot,RT-qPCR,. VNP-siNC和 VNP-siYTHDF1載體構(gòu)建,細(xì)胞轉(zhuǎn)染,流式細(xì)胞術(shù),體內(nèi)成瘤實(shí)驗(yàn)。
參考文獻(xiàn)
Bao Y, Zhai J, Chen H, Wong CC, Liang C, Ding Y, Huang D, Gou H, Chen D, Pan Y, Kang W, To KF, Yu J. Targeting m6A reader YTHDF1 augments antitumour immunity and boosts anti-PD-1 efficacy in colorectal cancer. Gut. 2023 Aug;72(8):1497-1509. doi: 10.1136/gutjnl-2022-328845. Epub 2023 Jan 30. PMID: 36717220.






