B4GALT1通過多水平調控PD-L1的表達來促進肺腺癌的免疫逃逸

隨著肺癌篩查的普及和計算機斷層掃描在臨床實踐中的應用,檢出的肺結節數量明顯增加,其中許多為原位腺癌(AIS)、微浸潤性腺癌(MIA)和浸潤性腺癌(IAC)。手術切除后,AIS和MIA的5年生存率均接近100%,而IAC則沒有如此好的生存獲益。多個專業學會修訂了肺腺癌(LUAD)及其癌前病變的分類,包括從不典型腺瘤樣增生(AAH)到AIS、MIA和最終IAC的逐步進化譜。之前的研究描述了AIS、MIA和IAC的基因組、免疫和代謝情況,這可能有助于早期癌癥的檢測和預防。然而,對于早期肺腺癌從MIA到IAC的發展軌跡,仍然缺乏深入的分子事件。多原發肺癌(MPLC)是指同一患者存在多個獨立來源的腫瘤,常以多個肺結節的形式出現,多為MIA或IAC。同一腫瘤龕內不同病灶的比較可以排除患者遺傳背景差異造成的偏倚,從而更深入地了解MIA向AIS進展過程中腫瘤內部的分子改變。β-1,4-半乳糖基轉移酶1(B4GALT1),一個與N-糖合成相關的基因,在早期肺腺癌的進展中至關重要。N-糖基化模式有助于許多致癌蛋白的穩定性和活性,從而促進癌癥進展。B4GALT1通過將β-1,4鏈半乳糖轉移到受體糖,參與N-糖基化的形成,越來越多的證據表明該蛋白與腫瘤的生物學和進展相關。然而,B4GALT1在肺癌中的作用及其潛在的分子機制尚不清楚。該研究發表在《Journal of Experimental & Clinical Cancer Research》,IF:11.3。
技術路線

主要研究結果
1. B4GALT1是早期肺腺癌發生的關鍵因子
作者收集了4例MPLC患者的8例LUAD樣本,圖1A總結了其影像組學特征和臨床病理特征。每例患者的兩個原發腫瘤病理類型不同,MIA或IAC。然后,作者進行了RNA測序,以探索驅動這些樣本中侵襲前LUAD進展為侵襲性LUAD的關鍵分子事件(圖1B)。隨后,作者利用UMAP對RNA測序數據進行了無監督聚類,發現了與這4例患者的MIA和IAC病變完全對應的兩個聚類(圖1C),提示MIA和IAC具有不同的轉錄特征。GO和KEGG分析顯示,IAC中高表達的基因顯著富集于葡萄糖代謝通路(圖1D)。此外,隨著β-1,4-半乳糖基轉移酶活性信號通路的富集,N-糖的生物合成也被發現,表明糖基化在早期肺癌的發展中起關鍵作用。作為糖基化的一種類型,N-糖基化模式可以調節蛋白質的穩定性,而β-1,4-半乳糖基轉移酶是參與N-糖基生物合成的關鍵酶。B4GALT1,一個編碼β-1,4-半乳糖基轉移酶的基因,是IAC樣本中上調最顯著的基因。因此,作者推測B4GALT1可能在早期肺腺癌MIA向IAC演變過程中發揮關鍵作用。對TCGA-LUAD數據的進一步分析表明,B4GALT1 mRNA表達確實在早期LUAD中隨著分期增加而增加,但在晚期LUAD中沒有(圖1E)。此外,GSE166720數據集根據病理分級將53例早期肺腺癌分為惰性(AIS和MIA)和浸潤性腫瘤(IAC),結果顯示侵襲性腫瘤中的B4GALT1 mRNA表達高于惰性腫瘤(圖1F)。此外,B4GALT1高表達預測TCGA-LUAD患者較差的DFS和OS(圖1G-H)。在GSE31210數據集的I期和II期LUAD患者中,高B4GALT1也預示著較差的OS(圖1I)。綜上所述,B4GALT1可能在早期肺腺癌的發生發展中起重要作用。
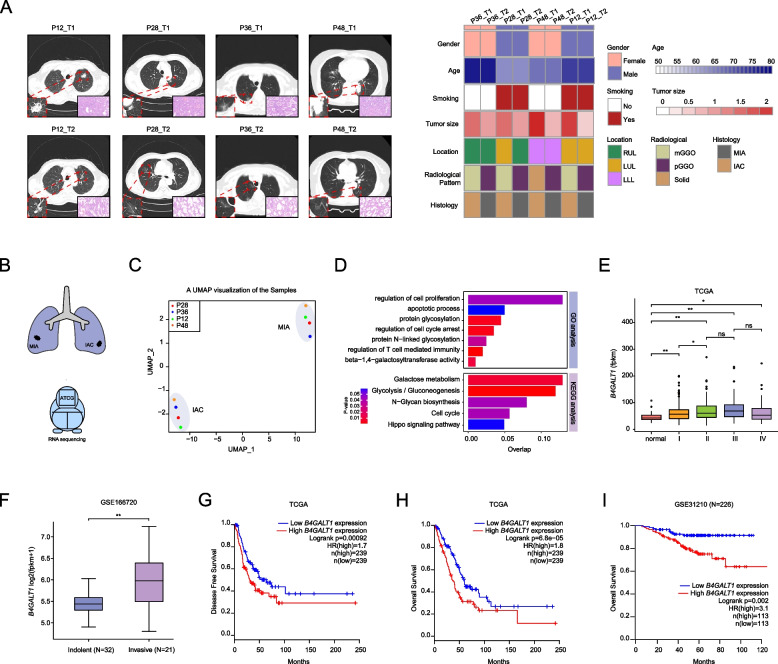
圖1 B4GALT1是早期肺腺癌發生的關鍵因子
2. B4GALT1在體內外調控肺腺癌細胞的增殖和轉移
通過MTT實驗、克隆形成實驗和EdU實驗驗證B4GALT1對細胞增殖的影響。MTT結果顯示,B4GALT1敲低后細胞活力明顯下降。相反,B4GALT1過表達增加了細胞活力(圖2A)。同樣,EdU實驗顯示B4GALT1對LUAD細胞增殖有顯著影響(圖2B)。集落形成實驗表明B4GALT1表達對克隆形成能力也有影響(圖2C)。此外,B4GALT1敲低顯著誘導LUAD細胞凋亡(圖2D)。然后,作者確定B4GALT1是否通過改變細胞周期影響LUAD細胞增殖。流式細胞術結果顯示,B4GALT1敲低伴隨著G1/G0期的細胞周期阻滯(圖2E)。
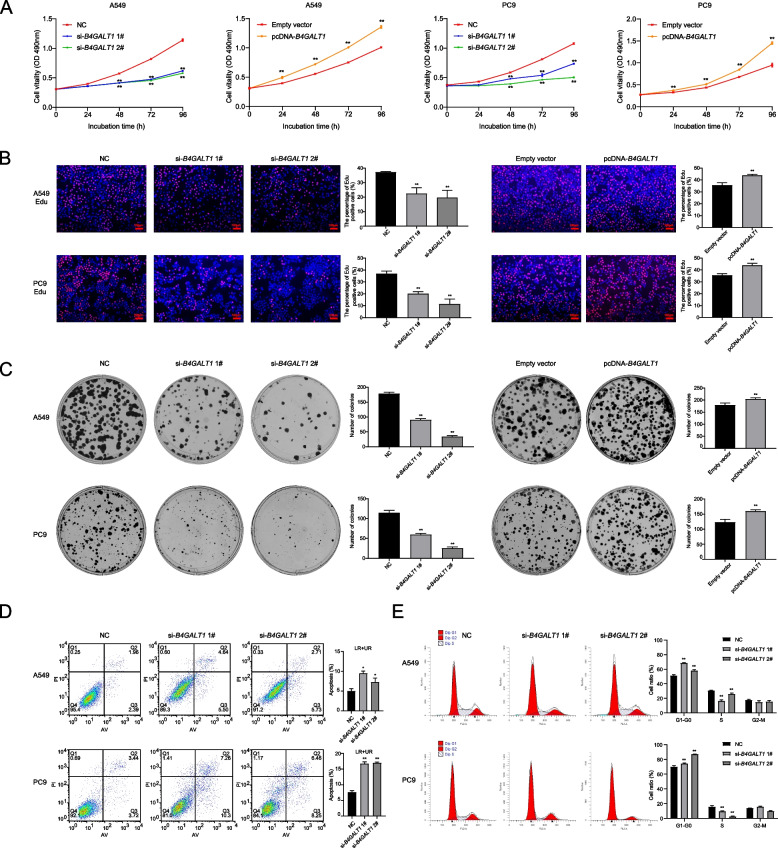
圖2 B4GALT1在體內外調節肺腺癌細胞的增殖
接下來,作者檢測了B4GALT1對細胞遷移和侵襲的潛在影響。在傷口愈合試驗中,B4GALT1表達顯著損害了傷口閉合(圖3A)。Transwell實驗也表明B4GALT1的敲低阻礙了腫瘤的遷移。相反,B4GALT1過表達顯著促進細胞遷移(圖3B)。此外,B4GALT1敲低抑制了LUAD細胞通過基質侵襲,而B4GALT1過表達促進了LUAD細胞的侵襲(圖3C)。
作者將A549細胞注射到BALB/c裸鼠皮下,以確定B4GALT1是否影響體內LUAD腫瘤的生長。B4GALT1敲低組的腫瘤體積較對照組明顯減小。在實驗終點,B4GALT1敲低組的腫瘤平均重量顯著低于對照組(圖3D)。此外,Ki67染色顯示,在B4GALT1敲低形成的腫瘤中,Ki67陽性細胞的比例降低(圖3E)。
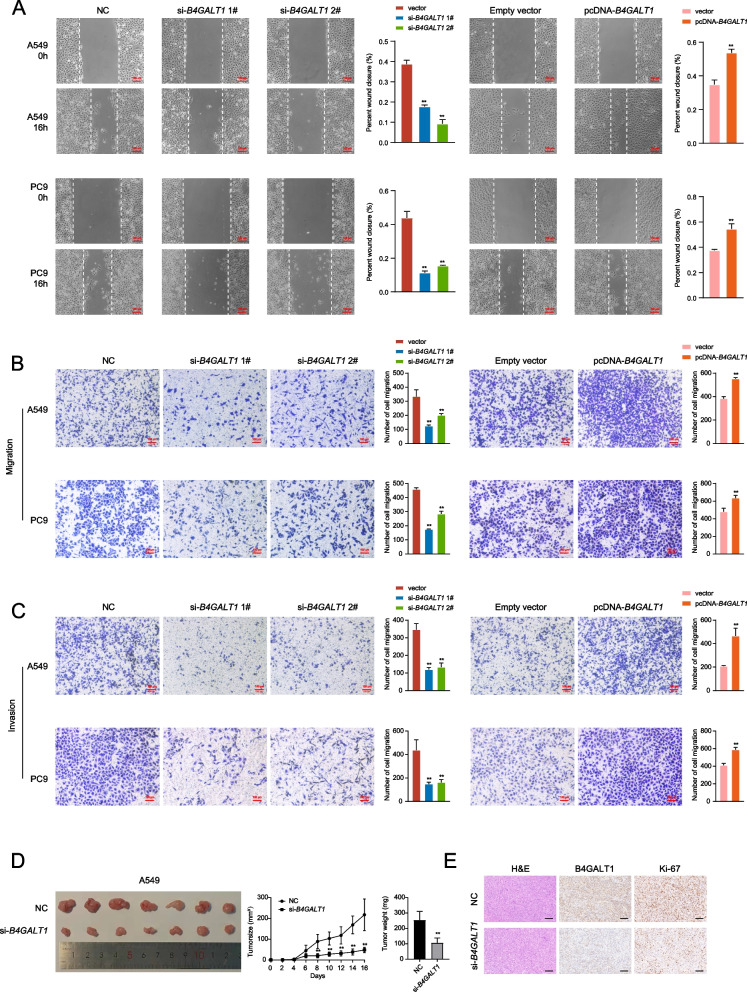
圖3 B4GALT1調控肺腺癌細胞的遷移和侵襲
3. B4GALT1限制了CD8+T細胞的浸潤和活性
通過對IAC中高表達基因的GO分析,作者還發現了與T細胞免疫應答相關功能的基因的富集(圖1D)。既往研究報道,在從MIA到IAC的LUAD進展過程中,免疫抑制增強。因此,作者應用CIBERSORT算法來估計MIA和IAC腫瘤中免疫細胞的相對豐度。作者發現,與MIA相比,IAC的CD8+T細胞浸潤較少(圖4A)。隨后的免疫熒光染色分析也表明,IAC腫瘤中的CD8+T細胞比MIA腫瘤中的少(圖4B)。關鍵CD8+T細胞效應分子GZMB的免疫組織化學染色顯示,IAC腫瘤的GZMB水平較低,表明IAC腫瘤中CD8+T細胞的活性減弱(圖4C)。為了確定B4GALT1是否引起了這種免疫狀態的改變,作者對這些樣本進行了BGALT1的免疫組織化學染色(圖4D),發現B4GALT1的水平與CD8 +T細胞的數量之間存在明顯的負相關,GZMB的水平也存在明顯的負相關(圖4E)。
為了確定B4GALT1是否為功能失調T細胞的重要調節因子,作者研究了在小鼠癌細胞與特異性靶向癌細胞抗原的小鼠原代T細胞共培養的背景下,公開可用的規律成簇的分散短回文重復序列(CRISPR)篩查的數據。基于5個獨立研究中的9個這樣的篩選,作者發現靶向B4GALT1的gRNAs一致被負向選擇(圖4F)。這些結果表明,B4GALT1可能導致CD8+T細胞功能障礙,并可能使肺腺癌細胞在失活時更容易受到CD8+T細胞介導的細胞毒性。為了進一步驗證這一結論,作者進行了T細胞介導的腫瘤細胞殺傷試驗,以測試B4GALT1表達對CD8+T細胞活性的影響,CD8+T細胞活性是從健康供者的外周血和C57BL/6小鼠的脾臟中分離出來的(圖4G)。正如預期,B4GALT1抑制顯著增強了CD8+T細胞介導的LUAD細胞死亡,并且在A549和LLC細胞系中,B4GALT1上調使LUAD細胞對CD8+T細胞更具抗性(圖4H)。
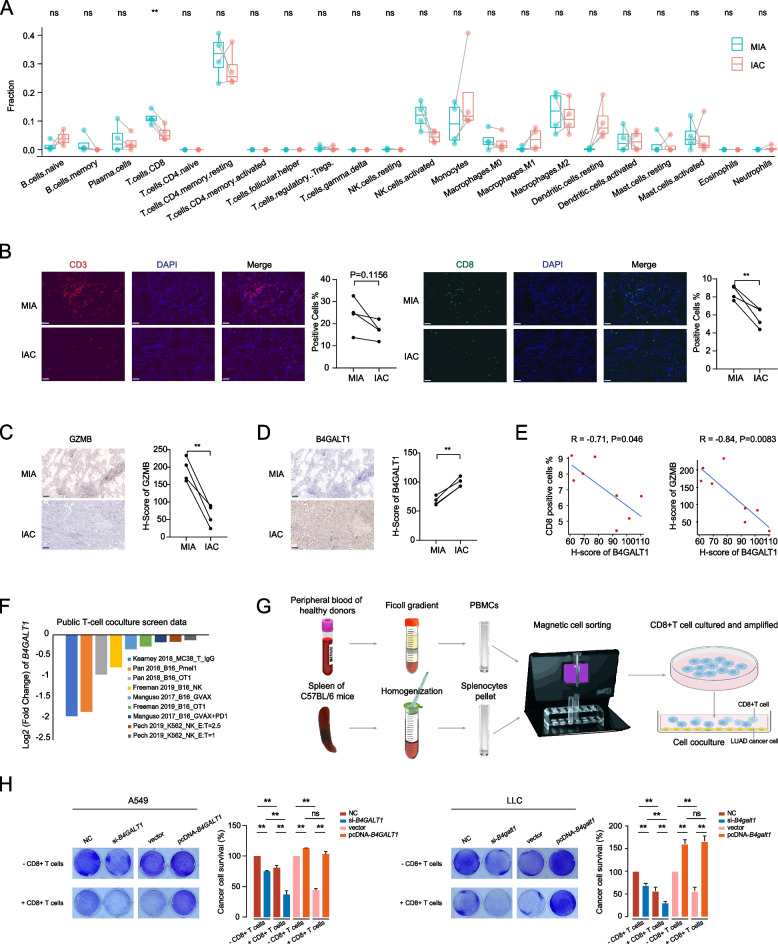
圖4 B4GALT1限制了CD8+T細胞的浸潤和活性
4. B4GALT1與PD-L1相互作用并通過介導其糖基化增強PD-L1蛋白穩定性,從而促進肺腺癌的免疫逃逸
越來越多的證據表明,免疫抑制與免疫檢查點的失調有關。因此,作者在B4GALT1高表達和低表達的腫瘤之間比較了著名的免疫檢查點分子的表達水平(圖5A)。值得注意的是,CD274(PD-L1)在B4GALT1高表達的腫瘤中比在B4GALT1低表達的腫瘤中表達最顯著。在A549和LLC細胞中,敲低或過表達B4GALT1均可引起PD-L1 mRNA和蛋白水平的降低或升高(圖5B-C)。因此,作者有理由假設B4GALT1通過影響肺腺癌中PD-L1的表達來介導CD8+T細胞功能障礙。在過表達B4GALT1的LUAD細胞中,敲低CD274可恢復CD8+T細胞殺傷能力,這證實了這一推測(圖5D)。
接下來,作者研究了B4GALT1如何影響PD-L1水平。B4GALT1是參與N-糖基生物合成的關鍵基因,參與N-糖基化的形成。因此,作者推測N-糖基化可能通過涉及翻譯后修飾的機制參與B4GALT1介導的PD-L1調控。首先,在CHX處理后,作者發現B4GALT1敲除降低了A549和LLC細胞中PD-L1蛋白的半衰期,而B4GALT1穩定表達顯著增加了PD-L1蛋白的穩定性(圖5E)。此外,co-IP驗證了B4GALT1與PD-L1之間的相互作用(圖5F)。為了在生物化學上證實兩者的相互作用,作者表達并純化了含有B4GALT1的GST融合蛋白,并進行了GST pull down實驗。結果表明,GST-B4GALT1可以下調A549細胞裂解液中的PD-L1(圖5G)。然后,作者試圖研究B4GALT1是否通過N-連接糖基化來調節PD-L1蛋白。用衣霉素(N-連鎖糖基化抑制劑)處理A549和LLC細胞,與未處理細胞相比,PD-L1表達顯著下調,與B4GALT1敲低一致。此外,衣霉素恢復了B4GALT1過表達誘導的PD-L1表達(圖5H)。為了進一步鑒定PD-L1的N-連接糖基化位點,作者首先使用NetNGlyc 1.0服務器工具預測了PD-L1的N-連接糖基化基序。然后,使用flag標記的質粒轉染B4GALT1過表達細胞,這些質粒攜帶PD-L1的全長編碼序列,或者含有N35、N192或N200處突變的N-連鎖糖基化位點的編碼序列,用于CHX分析(圖5I)。結果顯示,即使在B4GALT1過表達的情況下,突變N192和N200的N-糖基化位點也顯著降低了PD-L1蛋白的穩定性,提示這些殘基是B4GALT1修飾的PD-L1的N-糖基化位點。綜上所述,B4GALT1通過介導PD-L1的糖基化與PD-L1相互作用,從而促進肺腺癌的免疫逃逸。
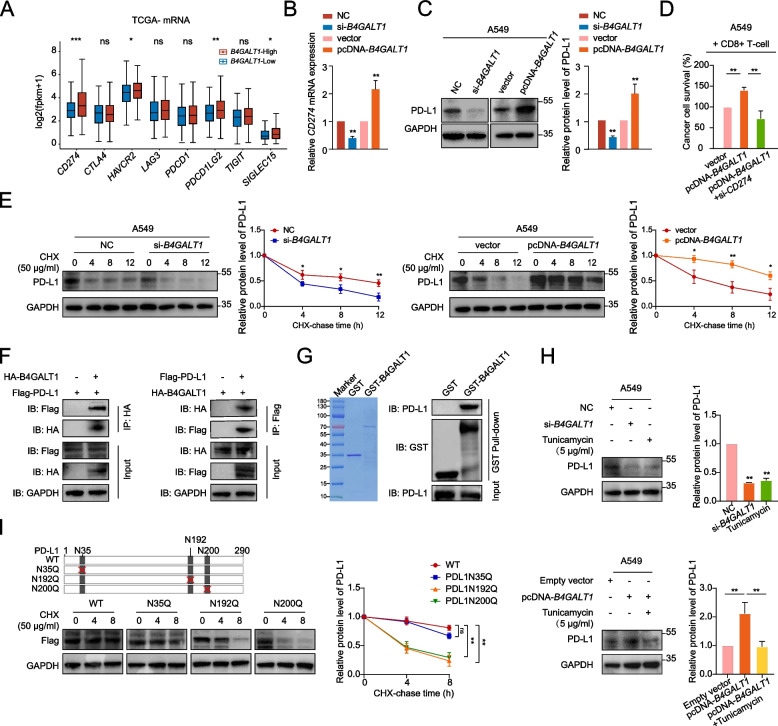
圖5 B4GALT1與PD-L1相互作用并通過介導其糖基化增強PD-L1蛋白穩定性,從而促進早期肺腺癌的免疫逃逸
5. B4GALT1通過調控TAZ糖基化促進PD-L1轉錄
以上數據表明,B4GALT1可以增強PD-L1蛋白的穩定性。此外,作者注意到B4GALT1敲低或過表達后CD274 mRNA的變化(圖5B)。這些結果表明,B4GALT1也可能對CD274有轉錄作用。為了驗證這一假設,作者進行了熒光素酶報告基因檢測,結果顯示B4GALT1過表達增強了CD274啟動子活性(圖6A)。此外,有趣的是,作者發現IAC腫瘤中高表達的基因在Hippo信號通路中富集(圖1D)。在之前的研究中,作者發現Hippo信號通路中一個重要的轉錄因子——含WW結構域的轉錄調節因子1(TAZ)可以通過增加CD274啟動子的活性來誘導PD-L1的上調。在本研究中,作者還驗證了TAZ在肺腺癌中對CD274的調控作用。TAZ敲低導致A549和LLC細胞中CD274 mRNA和蛋白表達水平顯著降低(圖6B-C)。進一步的報告基因分析表明,TAZ敲低降低了全長CD274啟動子的活性,但對缺失區域的啟動子結構無影響(圖6D)。重要的是,B4GALT1過表達不影響帶有缺失區域的CD274啟動子結構的活性,表明B4GALT1通過TAZ影響CD274啟動子的活性(圖6E)。此外,TAZ敲低顯著降低了B4GALT1誘導的全長CD274啟動子活性和CD274 mRNA水平的增加(圖6F-G),表明B4GALT1通過TAZ介導了CD274的轉錄調控。此外,TAZ敲低逆轉了B4GALT1誘導的PD-L1蛋白水平(圖6H)。
作者進一步探索了B4GALT1影響TAZ水平的機制。通過對TCGA和GEO數據集的分析,作者觀察到B4GALT1的表達在蛋白水平而不是mRNA水平與TAZ水平顯著相關,這與qRT-PCR和WB結果一致(圖6I-J)。因此,作者懷疑TAZ蛋白可能通過獲得N-糖基修飾而在翻譯后水平受到B4GALT1的調節。通過CHX分析,作者發現B4GALT1可以增加TAZ蛋白的穩定性(圖6K)。此外,co-IP(圖6L)和GST pull-down實驗(圖6M)表明B4GALT1直接與TAZ相互作用。此外,在B4GALT1過表達細胞中,衣霉素處理后TAZ蛋白水平顯著降低(圖6N),表明TAZ的N-連接糖基化受B4GALT1調節。然后,作者應用NetNGlyc 1.0服務器工具預測TAZ的潛在N-連接糖基化位點,并突變N184和N256位點(圖6O)。CHX分析結果表明,B4GALT1過表達不能促進TAZ蛋白穩定性,但N256位點發生了突變,提示N256是B4GALT1修飾的TAZ的N-糖基化位點。
這些結果表明,B4GALT1/TAZ介導了PD-L1的翻譯修飾。

圖6 B4GALT1通過調控TAZ糖基化促進PD-L1轉錄
6. 抑制B4GALT1可增強抗PD-1治療LUAD的療效
為了評估B4GALT1在體內的免疫調節作用,作者使用LLC小鼠LUAD細胞系在免疫正常的C57BL/6小鼠中構建皮下異種移植瘤,然后使用PD-1 mAb或IgG同型CTRL(IgG2a)處理移植瘤(圖7A)。作者發現,與對照組相比,B4GALT1敲低限制了腫瘤生長,這與PD-1單抗治療一致。此外,與其他組相比,B4GALT1抑制和PD-1阻斷聯合治療組的腫瘤負荷下降最顯著,且未觀察到體重減輕和其他常見毒性作用(圖7B-F)。在治療結束時收集腫瘤樣本進行進一步分析,免疫組織化學染色和流式細胞術分析表明,B4GALT1缺陷顯著降低了PD-L1水平,增加了CD8+T細胞和CD8+GZMB+細胞密度(圖7G-H)。特別是,PD-1 mAb和B4GALT1抑制聯合治療導致了腫瘤區域中活化CD8+T細胞的最顯著富集(圖7H)。這些結果證實抑制B4GALT1通過下調PD-L1表達增強CD8+T細胞浸潤和功能,從而提高抗PD-1治療的療效。綜上所述,這些結果表明B4GALT1通過上調PD-L1表達和抑制CD8+T細胞浸潤促進腫瘤免疫逃逸。
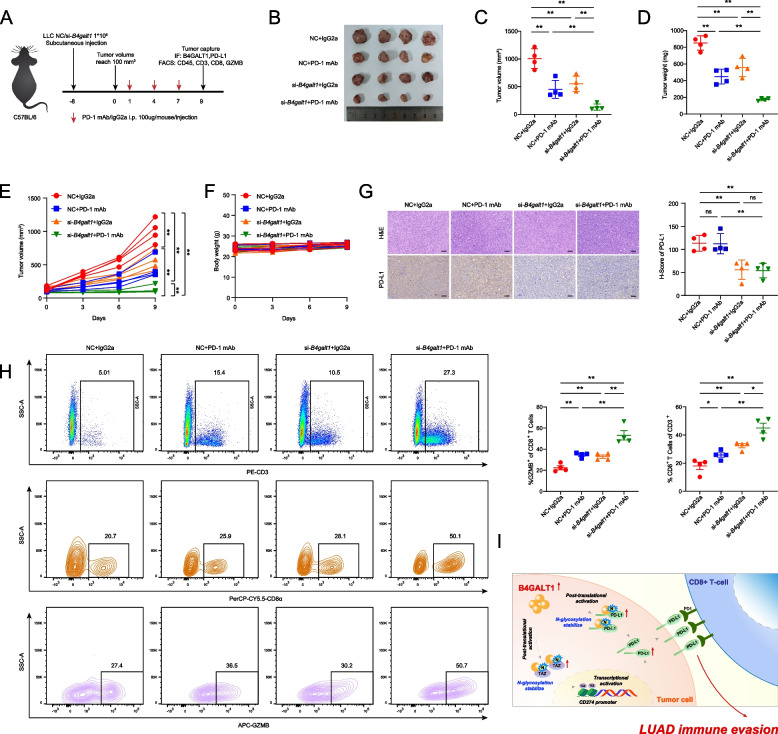
圖7 抑制B4GALT1可增強抗PD-1治療LUAD的療效
結論
基于獨特的MPLC模型,作者揭示了B4GALT1促進了早期LUAD的免疫逃避和腫瘤發生,并確定了B4GALT1在轉錄水平通過穩定TAZ蛋白調節PD-L1,在翻譯后水平直接通過PD-L1的N-連接糖基化蛋白修飾來調節PD-L1的新機制。該研究為將B4GALT1作為LUAD的潛在治療靶點提供了一定的理論基礎。
實驗方法
RNA測序,qRT-PCR,蛋白質印跡,MTT增殖測定,菌落形成測定,細胞遷移和侵襲測定,流式細胞術,動物實驗,免疫組織化學(IHC),免疫熒光,免疫共沉淀,GST pull-down,雙熒光素酶報告基因檢測
參考文獻
Cui Y, Li J, Zhang P, Yin D, Wang Z, Dai J, et al. B4GALT1 promotes immune escape by regulating the expression of PD-L1 at multiple levels in lung adenocarcinoma. J Exp Clin Cancer Res. 2023 Jun 12;42(1):146.






