膜蛋白聯動——TREM2/CD36促進泡沫細胞形成加速AS進展
動脈壁上的脂質堆積異常是動脈粥樣硬化(AS)的一個標志。以前研究發現,在小鼠AS的主動脈斑塊中,骨髓細胞上的觸發受體2(TREM2)(一種免疫球蛋白家族的跨膜受體)的表達增加。然而,TREM2是否在AS中起作用仍未知。本研究利用ApoE knockout (ApoE?/?) 小鼠模型,原代血管平滑肌細胞(SMCs)和骨髓來源巨噬細胞(BMDMs)探究得知TREM2通過CD36表達促進SMC和巨噬細胞來源的泡沫細胞形成加速AS進展。本研究于2023年5月發表在《Cell and Molecular Life Sciences》IF:8期刊上。
技術路線

主要實驗結果
1、TREM3的表達在AS斑塊中增加
此前研究表明TREM2參與脂質代謝,并且在AS中TREM表達增加。作者分析了GSE43292數據集發現TREM2的表達相比于正常組織,在硬化斑塊中增加(Fig. 1a)。鑒于該結果,作者檢測了小鼠斑塊進展時TREM2的表達,發現其在ApoE?/?小鼠主動脈中的表達隨著時間增加(Fig. 1b)。此外,作者使用硬化因子oxLDL (50 μg/mL)處理RAW264.7細胞和mSMCs細胞,發現TREM2的表達也隨著時間增加(Fig. 1c)。共聚焦熒光建偉就證實了TREM2的表達在Trem2+/+/ApoE?/?小鼠斑塊中的表達趨勢(Fig. 1d, e)。以上結果表明TREM3的表達在AS斑塊中增加。
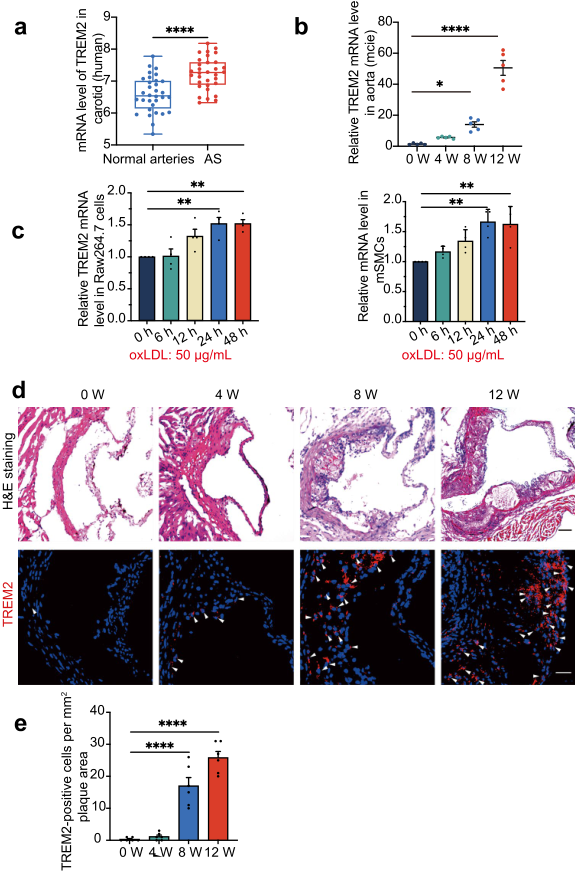
圖1 TREM3的表達在AS斑塊中增加
2、敲低TREM2緩解斑塊形成和脂質沉積
為確定TREM2在AS中因果關系,作者在ApoE?/?小鼠中敲低TREM2構建了Trem2?/?/ApoE?/?小鼠,高脂飲食喂養12周誘導AS發生。ORO染色顯示,相比對照組,Trem2?/?/ApoE?/?小鼠的整個主動脈病變區域減少(Fig. 2a)。此外,主動脈弓病變面積減小,主動脈組織壞死核減小,纖維帽厚度增加(Fig. 2a–c)。類似的,脂質染色也在Trem2?/?/ApoE?/?小鼠主動脈竇水平下降(Fig. 2b, c)。這些結果表明敲低TREM2降低斑塊進展和脂質沉積。
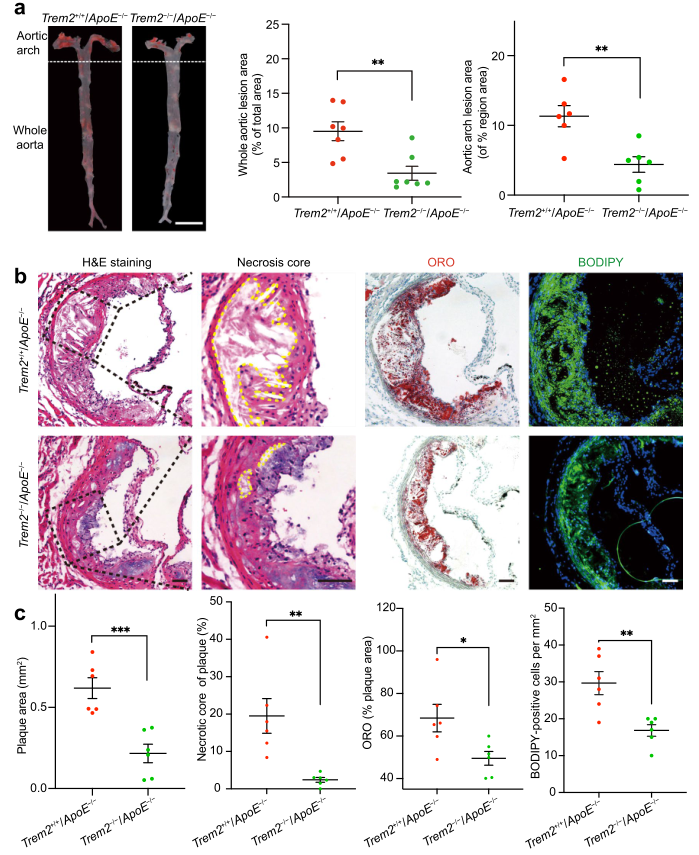
圖2 敲低TREM2緩解斑塊形成和脂質沉積
3、TREM2在斑塊中的巨噬細胞和SMCs衍生的泡沫細胞中表達
脂質沉積是AS的標志,有助于斑塊的進展和不穩定。作者研究了TREM2是否直接參與AS的脂質代謝功能障礙。將TREM2特異性抗體與斑塊中的BODIPY共免疫染色。結果顯示,BODIPY陽性細胞與TREM2在斑塊中共定位(圖3)。隨著AS的進展,BODIPY/TREM2陽性細胞的數量逐漸增加(Fig. 3a, d)。這些結果與前面在體內的觀察結果一致,即TREM2缺乏會降低主動脈根部的脂質負擔。
由于泡沫細胞的主要來源是SMCs和巨噬細胞,所以作者研究了TREM2在這兩種細胞的泡沫過程中的作用。用細胞SMC標記物(α-SMA)和巨噬細胞標記物(CD68)對不同時期飼喂HFD小鼠主動脈竇的TREM2抗體進行免疫熒光共染色。結果表明,TREM2在斑塊中與α-SMA和CD68共定位,并且TREM2/α- SMA陽性和TREM2/ CD68陽性細胞的數量隨著動脈粥樣硬化的進展而增加(Fig. 3b, c, e, f),表明TREM2在動脈粥樣硬化病變中上調,并在SMCs和巨噬細胞中富集,即TREM2參與動脈粥樣硬化過程中SMCs和巨噬細胞的泡化。

圖3TREM2在斑塊中的巨噬細胞和SMCs衍生的泡沫細胞中表達
4、TREM2通過CD36受體促進泡沫細胞的形成
為探究TREM2是否促進巨噬細胞和SMCs細胞形成泡沫細胞,作者利用慢病毒在Raw264.7和mSMCs細胞中過表達TREM2。ORO染色顯示,用50 μg/mL oxLDL處理24小時后,TREM2過表達組的ORO陽性細胞顯著增多(Fig. 4a, b)。此前研究表明TREM2促進小膠質細胞的脂質攝取。為闡明TREM2促進泡沫細胞形成的機制,作者進一步檢測了動脈粥樣硬化中參與脂質代謝的主要脂質攝取受體(CD36, MSR1和OLR1)和外排受體(ABCG1和ABCA1)的蛋白水平變化。結果表明,TREM2對脂質攝取受體MSR1和OLR1的表達無顯著影響,同樣,脂質外排受體ABCG1和ABCA1的表達也不受TREM2表達的影響,然而,與LV-GFP組相比,LV-TREM2組Raw264.7細胞和mSMCs中CD36蛋白水平顯著升高(Fig. 4c, d)。此外,TREM2增加了CD36的mRNA水平,但沒有增加其他受體的轉錄(Fig. 4e, f)。在原代BMDMs和mSMC中,敲除TREM2導致CD36的表達降低(Fig. 4g)。
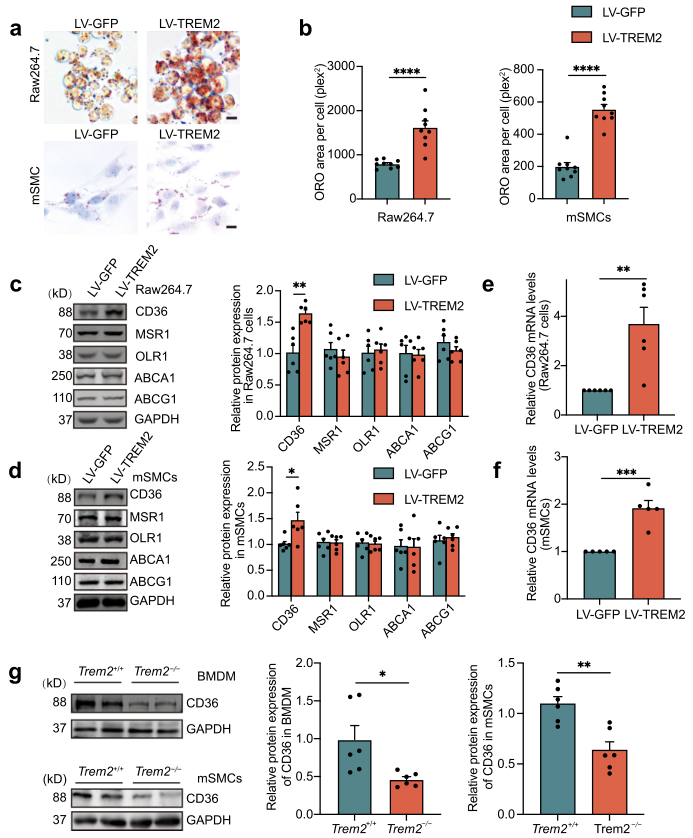
圖4 在體外TREM2促進泡沫細胞的形成
CD36是動脈粥樣硬化中影響脂質攝取的主要受體,因此使用DiI-oxLDL來評估脂質攝取水平。免疫熒光分析和流式細胞術顯示,TREM2促進了Raw264.7細胞和mSMCs對DiI-oxLDL的攝取(圖5a, b),這與先前在小膠質細胞中的研究一致。為進一步評估TREM2對CD36表達的影響,在過表達TREM2的細胞中使用siRNA抑制CD36的表達。結果顯示CD36沉默抑制TREM2誘導的Raw264.7細胞和mSMCs中脂質積累和攝取的增加(Fig. 5c–f)。
以上數據表明TREM2通過CD36促進脂質攝取進而促進泡沫細胞的形成。
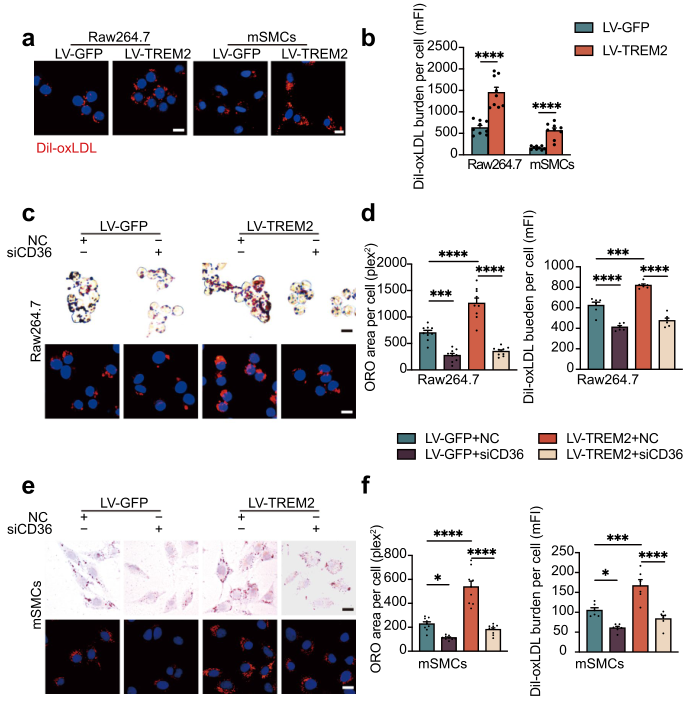
圖5 TREM2通過調節CD36刺激膽固醇攝取
5、TREM2通過調節MAPK-p38和PPARγ的磷酸化調控CD36的表達
轉錄因子PPARγ是調控CD36轉錄的最重要因子。WB結果顯示TREM2不改變oxLDL刺激下的PPARγ的蛋白表達,但顯著抑制PPARγ的磷酸化活性(Fig. 6a–d)。這些結果表明,TREM2通過調控PPARγ的磷酸化水平調控CD36的轉錄水平,進而調控動脈粥樣硬化過程中脂質積累和泡沫細胞的形成。
MAPK信號通路調控AS和肥胖期間的多種轉錄印制的激活,其參與TREM2和PPARγ信號通路,因此,作者檢測了TREM2過表達后的MAPK信號通路,包括p38,JNK1/2,ERK1/2。結果顯示,過表達TREM2顯著降低兩株細胞中p36的磷酸化,而不影響JNK1/2,ERK1/2的磷酸化和表達(Fig. 6a–d)。這些結果表明p38參與了PPARγ的磷酸化。接下來,利用p38磷酸化激動劑Deh探究p38的作用。發現Deh刺激后,TREM2誘導的脂質攝取和積累增加受到抑制(Fig. 6e, f)。WB結果也顯示p38磷酸化激動劑處理后PPARγ活性降低,CD36表達降低(Fig. 6g, h)。這些數據表明,TREM2通過抑制p-p38的磷酸化水平來調節PPARγ的活性,從而促進CD36的表達和脂質攝取。
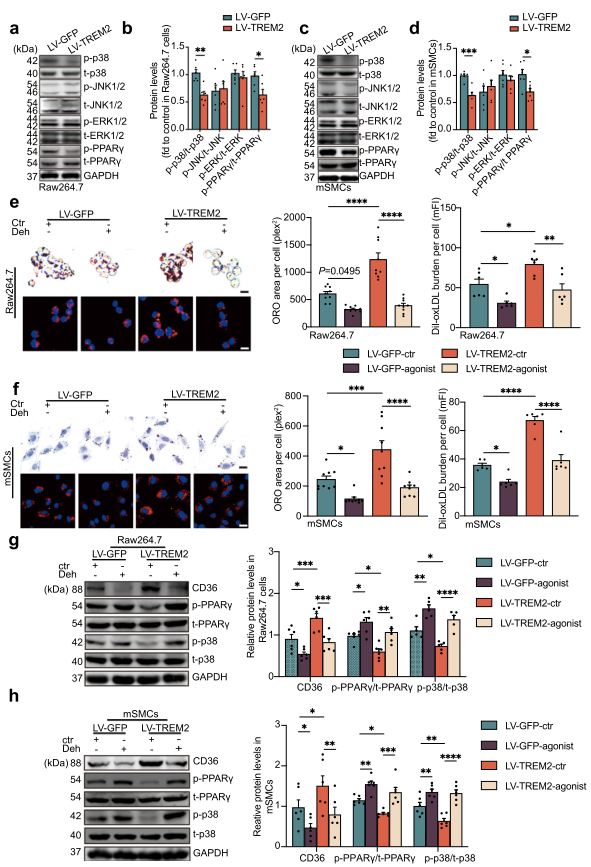
圖6 TREM2調節MAPK-p38和PPARγ的磷酸化
作者檢測了上述蛋白在小鼠體內的表達變化。結果進一步證實,TREM2通過p38/PPARγ信號傳導和下調CD36的表達來影響動脈粥樣硬化的進展(圖7a,b)。此外,與Trem2+/+/ApoE-/-小鼠相比,Trem2-/-/ApoE-/-小鼠的CD36有所下降。通過CD68-BODIPY和α-SMA-BODIPY雙染色,主動脈竇內的脂質負荷和泡沫細胞也明顯減少(圖7c-e)。總之,這些數據表明,TREM2的缺失通過調節CD36的表達來抑制動脈粥樣硬化中泡沫細胞的形成。
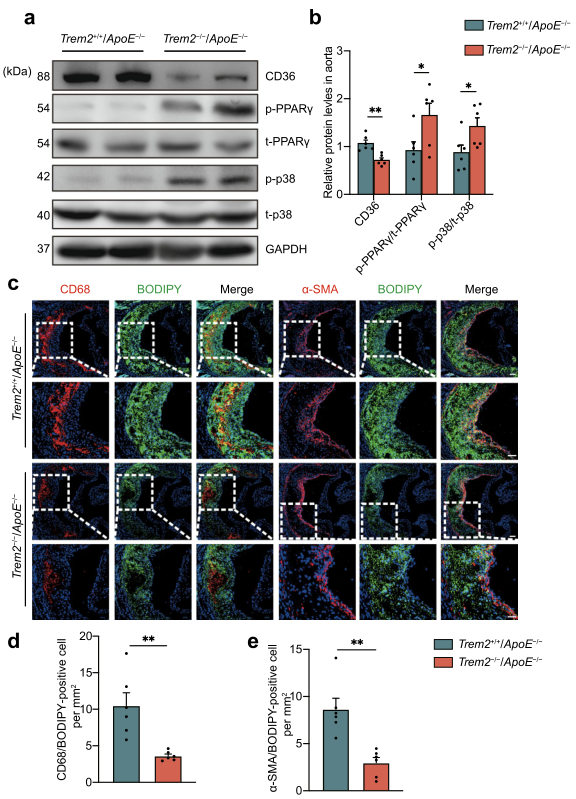
圖7 在體內TREM2缺失降低泡沫細胞的形成
總之,這項研究發現,TREM2在動脈粥樣硬化斑塊中增加,而且TREM2的缺失會減弱ApoE-/-小鼠的動脈粥樣硬化進展。在體外,TREM2的過度表達通過調節CD36的表達促進脂質吸收,加劇巨噬細胞和mSMCs中泡沫細胞的形成。因此,TREM2是治療動脈粥樣硬化的一個潛在目標。

圖形摘要
實驗方法
GEO芯片數據分析,TREM2-knockout mice (Trem2?/?)構建,AS斑塊分析,免疫熒光(IF)染色,細胞培養和誘導,DiI-oxLDL攝取實驗,ORO染色,BODIPY染色,WB實驗,qRT-PCR
參考文獻
Guo X, Li B, Wen C, Zhang F, Xiang X, Nie L, Chen J, Mao L. TREM2 promotes cholesterol uptake and foam cell formation in atherosclerosis. Cell Mol Life Sci. 2023 May 3;80(5):137. doi: 10.1007/s00018-023-04786-9. PMID: 37133566.






