單細胞分析顯示與肺癌的分子和免疫亞型有關的預后成纖維細胞亞群
成纖維細胞是一類未充分表征且在腫瘤進展中具有多樣影響的細胞。本研究利用單細胞RNA測序、多重免疫組織化學和數字細胞學(CIBERSORTx)技術,在人類非小細胞肺癌中鑒定和表征了三個主要的成纖維細胞亞群:外膜、泡狀和肌成纖維細胞。泡狀和外膜成纖維細胞。肺泡和外膜成纖維細胞(在對照組織樣本中豐富)定位于組織學正常肺組織中離散空間小生境,并在肺腺癌(LUAD)中存在時表明改善了總體生存率。軌跡推斷確定了控制組織成纖維細胞激活的三個階段,導致腫瘤樣本中肌成纖維細胞的富集:首先炎性細胞因子的上調,然后應激反應信號的激活,最終導致纖維蛋白原膠原的表達增加。肌成纖維細胞與LUAD的較差總體生存率相關,與上皮分化喪失、TP53突變、近端分子亞型和髓系細胞募集有關。在鱗癌中,肌成纖維細胞盡管在轉錄水平上是相同的,但并無預后價值。這些發現對開發成纖維細胞靶向癌癥治療策略具有重要意義。
該研究于2023年1月發表在《Nature communications》,IF:17.694。
技術路線:

1、scRNA-seq數據計算鑒定成纖維細胞
我們對人類肺組織樣本進行了scRNA-seq(n = 18;六個對照組、七個鱗狀細胞癌[LUSC]和五個腺癌[LUAD];圖1a),在組織解聚過程中富集成纖維細胞。鑒于樣本是從手術切除中獲取的,并非同時處理,我們評估了這是否在scRNA-seq數據中產生批次效應,通過對來自各個患者收集的細胞之間的k最近鄰重疊進行分析。結果發現明顯增加的重疊,因此會影響聚類結果。為了減輕這個問題,我們應用了基于互補PCA(reciprocal PCA, rPCA)的數據整合方法。然后進行聚類和差異基因表達分析。這識別出多個不同的間質、免疫和上皮細胞群體(圖1c)。間質細胞包括兩個單獨的簇:內皮細胞(通過VWF等經典標記物標記)和基質細胞(通過DCN和DPT標記)(圖1c)。
為了研究成纖維細胞,我們檢查了基質細胞簇。鑒于壁細胞是肺組織中突出的基質細胞類型,并且在我們最初的聚類中沒有被鑒定出來,我們嘗試確定基質細胞簇是否包含了成纖維細胞和壁細胞。這是很重要的,因為肌成纖維細胞通常通過表達參與細胞收縮的蛋白編碼基因(例如ACTA2 [編碼αSMA的基因])來鑒定,這些基因在壁細胞中高度表達。為了區分這些細胞,我們使用人類肺細胞圖譜(HLCA)的scRNA-seq數據,識別在人類肺組織中成纖維細胞和壁細胞之間差異表達的基因(圖1e)。我們將這些標記限制為先前描述的在多個小鼠器官中界定成纖維細胞和壁細胞的基因的人類同源基因,生成了成纖維細胞和壁細胞的一致基因標記(圖1e)。為了確定這些基因標記是否能夠有效區分壁細胞和成纖維細胞,我們計算了它們在HLCA數據集中每個細胞的平均表達,顯示出99%的準確性來識別這兩種細胞類型(圖1f、g)。然后,我們檢查了這些基因標記在我們的數據集中的表達情況(圖1h-j),證明在基質細胞簇中檢測到了壁細胞(n = 69)和成纖維細胞(n = 885)。為了進一步測試在分析整個組織均質化的腫瘤樣本時,成纖維細胞和壁細胞是否常常聚集在一起,我們在多個公開可用的數據集上重復了這個分析,始終觀察到類似的結果。
總之,我們已經確定了一種廣泛適用的方法,可以在scRNA-seq數據集中區分成纖維細胞和壁細胞,這是表征腫瘤微環境中成纖維細胞(或壁細胞)異質性的關鍵步驟。

2、NSCLC中存在三種成纖維細胞亞群
由于成本、樣本可用性以及從組織中分離這些細胞的困難導致在scRNA-seq數據集中獲得足夠的樣本以實現成纖維細胞亞群的人群水平(跨多個患者)表征具有挑戰性,導致不同組織中的比例不一致。為了克服這個挑戰并全面研究非小細胞肺癌中成纖維細胞的異質性,我們在來自人類非小細胞肺癌和對照組織樣本的另外六個scRNA-seq數據集上重復了體外成纖維細胞分選的過程(排除壁細胞)。這產生了一個包含9673個成纖維細胞的數據集(圖2a;其中5183來自39個對照組織;3440來自46個LUAD樣本和654來自16個LUSC樣本)。為了整合和校正數據集之間的批次效應,我們使用了經典相關分析。然后,我們使用共享最近鄰模塊化優化算法進行了無監督聚類。為了確定最具生物學信息的聚類解決方案,我們在不斷變化的分辨率參數下運行了這個分析,以逐步增加確定的聚類數,并檢查了每個聚類中識別的標記基因的數量(樣本水平的平均對數折疊變化 > 1,調整p值 < 0.01,并由至少50%的樣本表達)。結果顯示出三個主要聚類一致地被確定,而更高分辨率的聚類則導致識別到不符合這些標準的聚類或只有極少數標記基因(圖2b)。
所確定的三個聚類與先前在對照肺組織中描述的成纖維細胞亞群一致(外膜、肺泡和肌成纖維細胞)。為了全面表征這些成纖維細胞亞群的人群水平特征,我們首先計算了每個亞群的樣本級基因表達譜,然后進行差異基因表達分析(圖2c);使用REACTOME通路進行基因集變異分析(GSVA)(圖2d)以及使用先前描述的成纖維細胞亞群的基因標記進行GSVA。
使用單細胞數據進行差異表達分析發現了622個被肌成纖維細胞上調的基因,其中188個在樣本級別分析中仍具有顯著性(adj.P < 0.01)。從單細胞分析到樣本級別分析中標記物識別的 減少表明,在樣本數量方面,確保scRNA-seq數據集具有足夠的能力來檢測人群水平的差異是非常重要的。肌成纖維細胞亞群的關鍵標記物包括MMP11、POSTN、CTHRC1、COL1A1、ACTA2和COL3A1。GSVA顯示這些細胞在多個與生成膠原基質相關的通路中顯著上調(圖2d),這與肌成纖維細胞在纖維化和腫瘤中的重要作用一致。除了涉及基質生物合成的通路外,還有多個涉及細胞-基質相互作用的通路上調,包括整合素細胞表面相互作用和突觸蛋白相互作用(圖2d)。這些細胞還上調了多個先前描述的肌成纖維細胞和myoCAF基因標記。
差異表達分析使用單細胞數據發現了481個在外膜成纖維細胞中上調的基因,與其他亞群相比,其中73個基因在跨樣本的差異表達分析中仍然顯著——包括PI16、IGFBP6、MFAP5、APOD、PLA2G2A和GSN。GSVA確定了涉及前列腺素I2合酶(PTGIS)的多個通路的表達上調,包括前列腺素和膽酸/鹽的合成(圖2d),這對于從肺吞噬細胞中釋放膽固醇至關重要。另外,替代補體激活通路也顯著上調,涉及C3和CFD(圖2d)。周邊成纖維細胞還上調了與COL14A1 + 基質成纖維細胞、PI16 + 'universal'成纖維細胞群以及胰腺癌和乳腺癌中描述的iCAF亞群相關的基因標記物。
對于肺泡成纖維細胞,單細胞差異表達分析發現了672個上調基因,其中78個在樣本級別分析中仍具有顯著性,包括MACF1、RGCC、INMT、LIMCH1、A2M和GPC3。GSVA確定了TRP通道的上調(圖2d),這些通道可以檢測和傳導感覺信號(如氧化應激、pH和熱量),將其轉化為化學或電信號來調節細胞反應。涉及SLIT和ROBO基因家族成員的通路也上調(圖2d),這些通路在調節縱向軸突路徑選擇中發揮了重要作用,但也已被證明在關節炎中調節成纖維細胞遷移。肺泡成纖維細胞還上調了與COL13A1+基質成纖維細胞群和肺特異性NPNT+成纖維細胞群相關的基因標記。
細胞外基質(ECM)的生成和重塑是所有組織中成纖維細胞的關鍵功能。與此一致的是,差異表達的基因在ECM成分中顯著富集(Fisher精確檢驗p = 1.34e-62),其中31%的差異表達基因與基質組分相關。因此,我們檢查了每個成纖維細胞亞群是否上調了與特定基質組分相關的基因(基底膜、間質膠原、ECM糖蛋白和蛋白聚糖;圖2e)。結果顯示,肌成纖維細胞在每個基質組分中上調了多個基因,包括大部分上調的間質膠原基因(圖2e);肺泡成纖維細胞上調了與基底膜和ECM糖蛋白相關的多個基因;周邊成纖維細胞上調了多個ECM糖蛋白和蛋白聚糖(圖2e)。為了進一步研究這些差異,我們計算了每個基質組分的模塊分數,并比較了它們在不同成纖維細胞亞群中的整體表達水平(圖2)。結果顯示,與周邊和肺泡成纖維細胞相比,肌成纖維細胞顯著上調了間質膠原的表達(圖2f);而肺泡和肌成纖維細胞相比,周邊成纖維細胞顯示出基底膜基因的顯著增加表達(圖2g)。眾所周知,過度的膠原沉積是肌成纖維細胞的主要功能。為了確定這是否是這些細胞的病理特異性功能,我們檢查了從對照組織或腫瘤組織中分離的成纖維細胞亞群中特定基質組分的表達是否存在差異。結果顯示,間質膠原的表達在腫瘤樣本中的三個亞群中均顯著增加(圖2h)。
這些結果表明,不同病理條件可能會導致成纖維細胞亞群內的變異,這可能反映了它們的活化水平。為了進一步研究這一點,我們在每個亞群中對對照樣本和腫瘤樣本之間進行了差異表達分析。這一分析確定了在與腫瘤相關的外膜成纖維細胞中下調的多個基因,包括IGFBP6、FABP4和DCN。相反,與對照組相比,與腫瘤相關的肌成纖維細胞中上調了多個基因,包括SULF1、COL11A1和LRRC15。我們還檢查了之前描述的CAF亞群的基因標記是否在來自對照或腫瘤樣本的成纖維細胞中差異表達。預期的是,無論腫瘤亞型如何,腫瘤樣本中的myoCAF基因標記都顯著上調(圖2i)。然而,與此相反,與腫瘤相關的成纖維細胞中iCAF基因標記顯著下調,與對照組織相比(圖2j)。
總而言之,這些數據顯示,在非癌性肺組織中識別出的三個主要亞群與NSCLC中的成纖維細胞一致,并且可能對ECM的維持/重塑具有不同的調控作用。這些數據還表明,與NSCLC腫瘤的相互作用導致了每個亞群內基因表達的顯著變化,其中除了亞群特異性的表型變化外,還始終涉及間質膠原的上調。此外,我們還表明,在NSCLC中,myoCAF基因標記在肺成纖維細胞中上調,而iCAF基因標記在對照肺組織中上調。
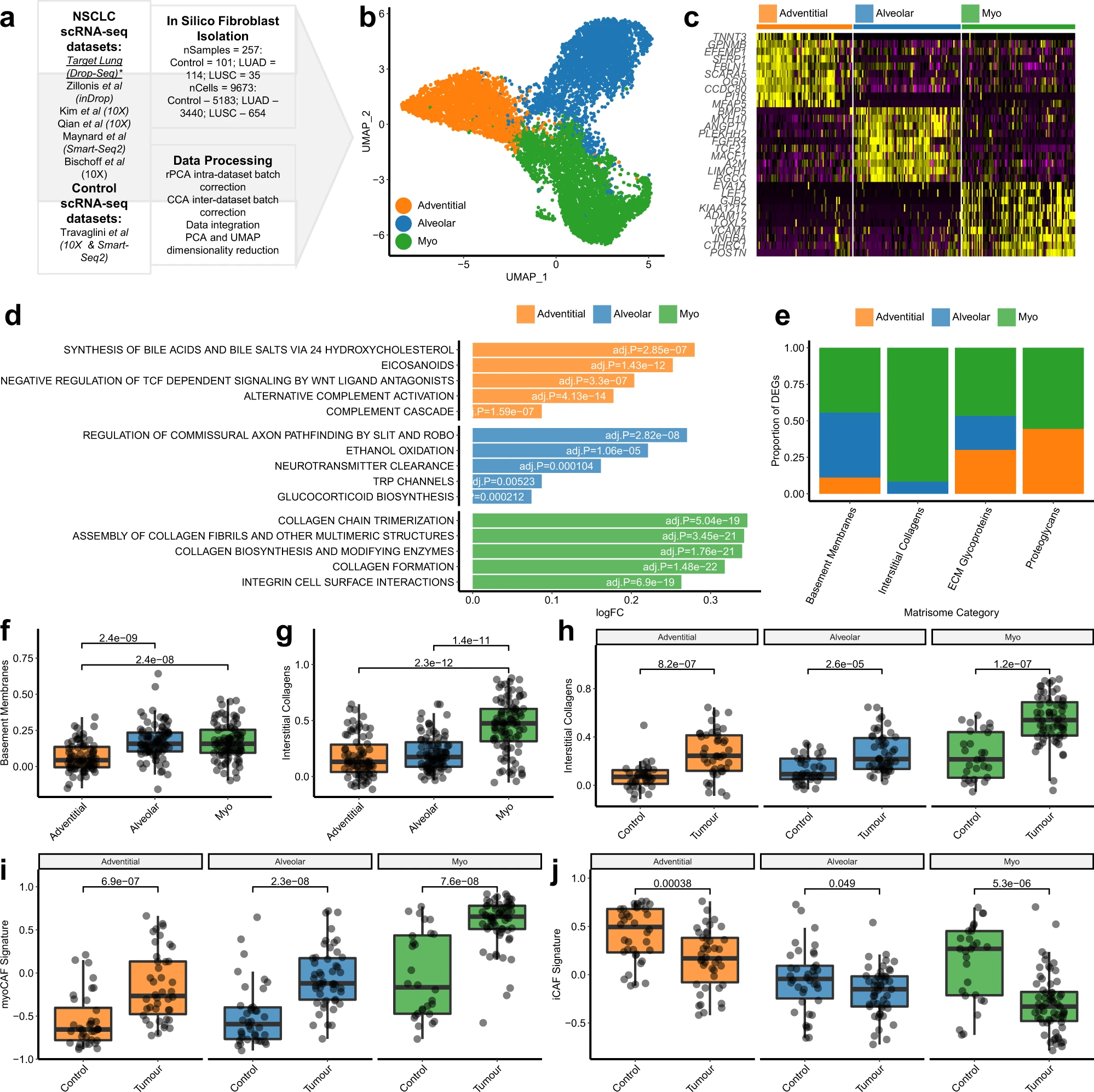
3、查看不同亞型的空間分布和豐度
為了對通過scRNA-seq鑒定的三個成纖維細胞亞群進行正交驗證,我們設計了一個多重免疫組織化學(mxIHC)面板。在這項分析中,我們使用人類蛋白質圖譜數據庫(Human Protein Atlas)來確定每個亞群的標記基因,這些基因具有“增強型”抗體驗證,表示在免疫組織化學或RNA測序中測量時具有一致的表達水平;并且已有文獻證明該蛋白質在細胞內可檢測(圖3a)。通過人類蛋白質圖譜的圖像,經咨詢病理學家篩選通過這些標準的基因在成纖維細胞中的表達情況,選擇CD34、AOC3和POSTN或ACTA2(α-SMA)作為外膜、肺泡和肌成纖維細胞的最佳免疫組織化學標記(圖3a)。此外,排除標記物Pan-CK、CD31和MCAM(分別為上皮、內皮和腔內細胞標記物)也被納入到mxIHC面板中。
與先前定義的肺成纖維細胞表型命名一致,我們的mxIHC顯示肺泡和外膜亞群存在于對照(組織學正常)肺組織的這些區域(圖3b)。值得注意的是,AOC3+(肺泡)成纖維細胞也觀察到存在于間質性肺組織中(圖3b),而CD34+(外膜)成纖維細胞也觀察到存在于周圍支氣管區域(圖3b)。然后,我們將該mxIHC面板應用于NSCLC組織的整塊切片(15個LUAD和10個LUSC,包括我們的scRNA-seq隊列中的十個樣本)。如預期的一樣,我們鑒定出的三個成纖維細胞亞群顯示出離散的成纖維細胞亞群,并且每個亞群在分析的三種組織類型中均存在(對照、LUAD和LUSC;圖3c、d)。
隨后,我們將該mxIHC面板應用于NSCLC組織的整塊切片(15個LUAD和10個LUSC,包括來自我們的scRNA-seq隊列的十個樣本)。如預期的一樣,我們鑒定出的三個成纖維細胞亞群顯示出離散的成纖維細胞亞群,并且每個亞群在分析的三種組織類型中均存在(對照、LUAD和LUSC;圖3c、d)。
為了在更大的隊列中研究這些成纖維細胞表型,使用CIBERSORTx介導的數字細胞計數法進行分析,使用scRNA-seq數據生成了一個簽名矩陣,包括每個成纖維細胞亞群、內皮細胞、腔內細胞、上皮細胞和免疫細胞。使用組合單細胞轉錄組生成的偽批量數據集測試了該方法的準確性,為每個偽批量樣本提供了基準真值。這證實了對所有細胞類型的準確計數,包括三個成纖維細胞亞群(R2 = 0.81 [外膜],0.91 [肺泡]和0.92 [肌];p < 3.53e-76)。
我們檢查了對照、LUAD和LUSC組織樣本中每個亞群的相對豐度。在scRNA-seq數據集中,與LUAD和LUSC相比,外膜成纖維細胞在對照組織樣本中顯著更豐富(圖3e)。肺泡成纖維細胞在對照組織中同樣最豐富,但在一些LUAD樣本中也檢測到高水平,并且在LUSC中很少存在(圖3e)。相反,肌成纖維細胞在LUAD和LUSC中豐度增加,但在LUSC中相對于LUAD顯著更豐富(圖3e)。通過使用CIBERSORTx分析TCGA RNA-seq數據集(圖3g)來確認這些成纖維細胞亞群與組織類型之間的關聯。然后通過mxIHC進一步驗證(圖3f),在分析中排除了組織塊中被困的非腫瘤組織(如圖3c所示)
考慮到LUSC腫瘤中肌成纖維細胞的水平高于LUAD腫瘤,我們假設腫瘤亞型可能也會對相鄰組織產生不同的影響。為了驗證這一點,我們使用mxIHC數據集比較了LUSC和LUAD病例的腫瘤鄰近組織區域。結果顯示,類似于腫瘤內區域,與LUSC相鄰的肺部區域中的肌成纖維細胞增多,肺泡成纖維細胞減少,相比之下與LUAD相鄰的肺組織。然后,病理學家評估了這些腫瘤鄰近區域,以確定是否存在炎癥和/或纖維化的證據,發現55%的LUSC病例存在炎癥和/或纖維化,而LUAD中則不存在。當按炎癥和/或纖維化的存在將這些對照組織區域分組時,肺泡和肌成纖維細胞的豐度也存在顯著差異。然而,在任何比較中,外膜成纖維細胞的豐度均沒有顯著差異。
總之,對照肺組織富集了外膜和肺泡成纖維細胞亞群,而這些亞群在NSCLC中被肌成纖維細胞取代。此外,成纖維細胞亞群的豐度在NSCLC亞型之間也存在差異,LUAD腫瘤在這三個亞群之間的異質性更大,而LUSC腫瘤的肌成纖維細胞水平始終較高。
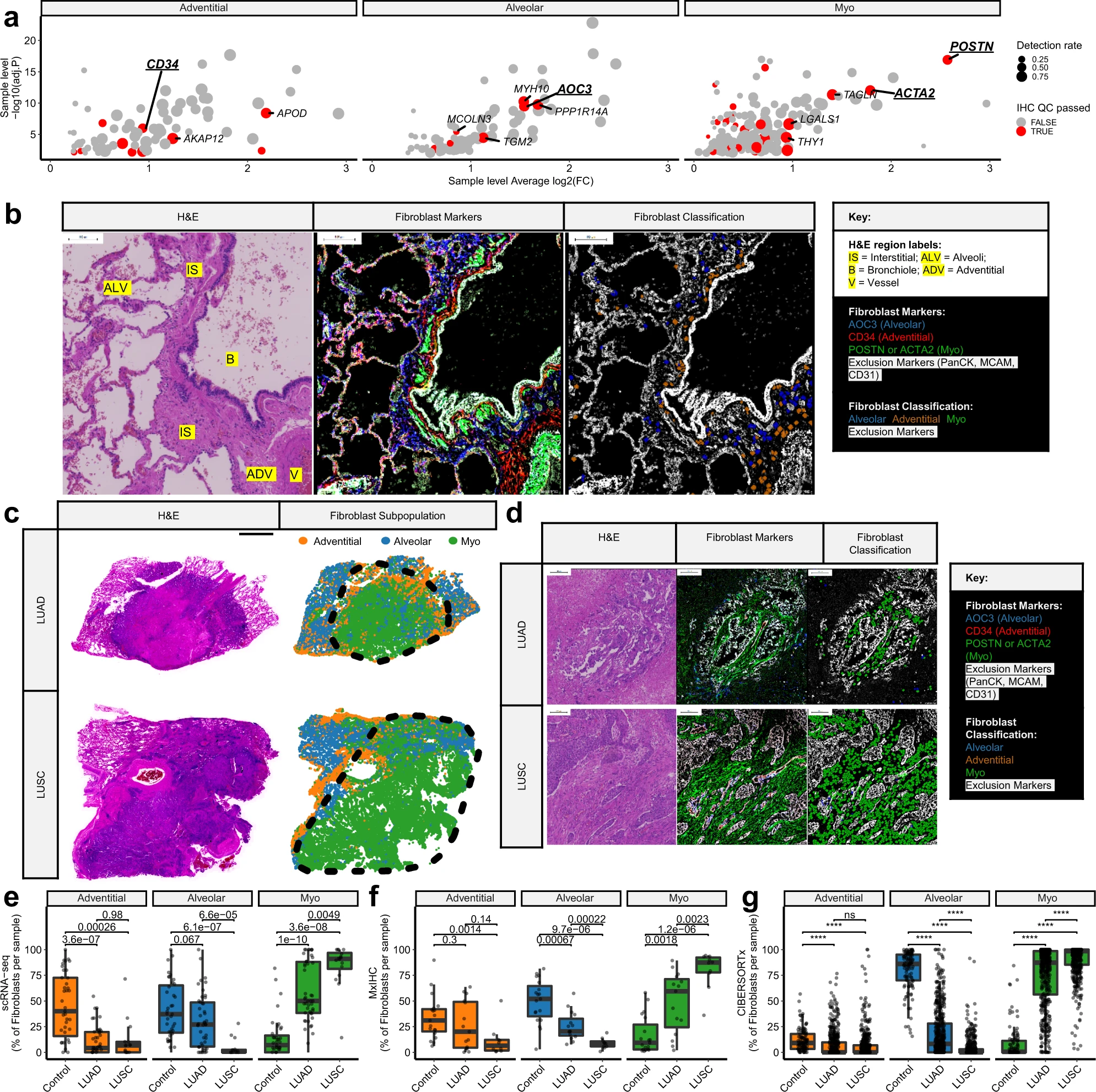
4、用軌跡推斷研究MyoCAF的激活
為了研究從富集于對照組織的肺泡和外膜成纖維細胞亞群向富集于腫瘤組織的肌成纖維細胞轉分化的過程,我們對scRNA-seq數據集進行了軌跡推斷,使用擴散映射降維方法。結果顯示,外膜和肺泡成纖維細胞可能作為獨立的祖細胞,可以進行向肌成纖維細胞的轉分化(圖4a,b)。然后,我們將細胞按照“偽時間”排序,表示它們相對于肌成纖維細胞表型的進展(圖4c)。通過分別檢查每個數據集,并使用Stouffer方法計算元p值,識別了偽時間上差異表達的基因。然后,基于在“偽時間”上的相關表達,將具有顯著差異表達的基因(經過調整的元p值< 1 × 10?10,并且在至少三個數據集中的名義p值< 0.05)聚類成模塊。這在兩個軌跡上識別出了四個模塊,代表了轉分化的不同階段:祖細胞、早期激活、原始分化和分化(圖4d,e)。將分配給每個模塊的基因進行比較,發現兩個軌跡之間存在顯著的重疊,表明無論前體亞群如何,肌成纖維細胞的轉分化過程是相似的(Fisher精確p值< 1.03e-10)。
為了對這些轉分化階段進行功能注釋,我們使用REACTOME通路數據庫進行富集分析(圖4h)。早期激活模塊顯著富集了已知參與細胞因子信號傳導的基因(圖4h),并且還包含多個先前描述的iCAF標記基因(例如IL6和CCL2)。值得注意的是,當分析僅包含對照樣本或包含對照樣本和NSCLC樣本的數據集時,發現類似的表達模式(圖4f),這表明轉分化過程的這個階段可能獨立于與NSCLC腫瘤相關的刺激。為了驗證這一點,我們根據細胞在偽時間中的位置,將scRNA-seq數據集中的所有成纖維細胞分為五個區間,然后計算每個模塊的表達的樣本平均值。結果顯示,與轉分化過程的所有階段相比,對照樣本中的早期激活模塊在成纖維細胞中顯著增加,而在腫瘤樣本中顯著降低(圖4g)。
相比之下,對于原始分化和分化模塊,偽時間上的表達趨勢在僅包含對照樣本或包含對照樣本和NSCLC樣本的數據集之間存在定性差異(圖4f)。因此,我們采用相同的方法來確定樣本類型對Proto-differentiation模塊的表達是否有影響。結果發現,在轉分化的中間階段,腫瘤樣本中這個模塊的表達顯著增加(圖4g)。這個模塊富集了許多編碼核糖體蛋白的基因(圖4h),這是肌成纖維細胞的一個良好描述的超結構特征,可能表明這些細胞具有增加的蛋白質翻譯能力。熱休克家族基因參與了HSF1轉錄激活(例如HSPA1A、DNAJB1和HSP90AB1),在這個模塊中也顯著富集(圖4h),先前的研究已經顯示它們調節了腫瘤介導的成纖維細胞活化。此外,與氧化應激反應有關的基因(如HIF1A、GGT和SERPINE1),這是熱休克應激和成纖維細胞活化的已知驅動因素,在這個模塊中也被發現。為了進一步研究熱休克/應激反應在肌成纖維細胞活化中的作用,我們使用mxIHC檢查了HSPA1A/Hsp70的表達。結果顯示,在將位于腫瘤內的細胞與腫瘤旁對照區域的細胞進行比較時,每個成纖維細胞亞群中的HSPA1A/Hsp70表達顯著增加(圖4i),確認與NSCLC腫瘤相關的刺激引起的熱休克反應比來自對照組織的刺激更為明顯。
與對照組織相比,分化模塊在所有轉分化階段的腫瘤組織中顯著增加(圖4g)。該模塊富集了參與膠原形成和細胞外基質組織的基因(圖4h),與肌成纖維細胞表型一致,以及上述數據顯示與對照組織樣本相比,腫瘤樣本中纖維蛋白膠原的上調。
綜上所述,這些結果表明,對照組織富集的兩個成纖維細胞亞群(外膜和肺泡)可能作為組織內駐地的肌成纖維細胞的祖細胞。這些數據還表明,不考慮祖細胞亞群,轉分化的過程是相似的:涉及短暫的炎癥基因上調階段,與腫瘤的直接相互作用無關;隨后是通過與腫瘤的相互作用增加的熱休克反應信號介導的原始分化;最后形成完全分化的肌成纖維細胞表型,具有增強的細胞外基質組織和膠原形成能力,該過程受到腫瘤相關刺激的顯著增強。
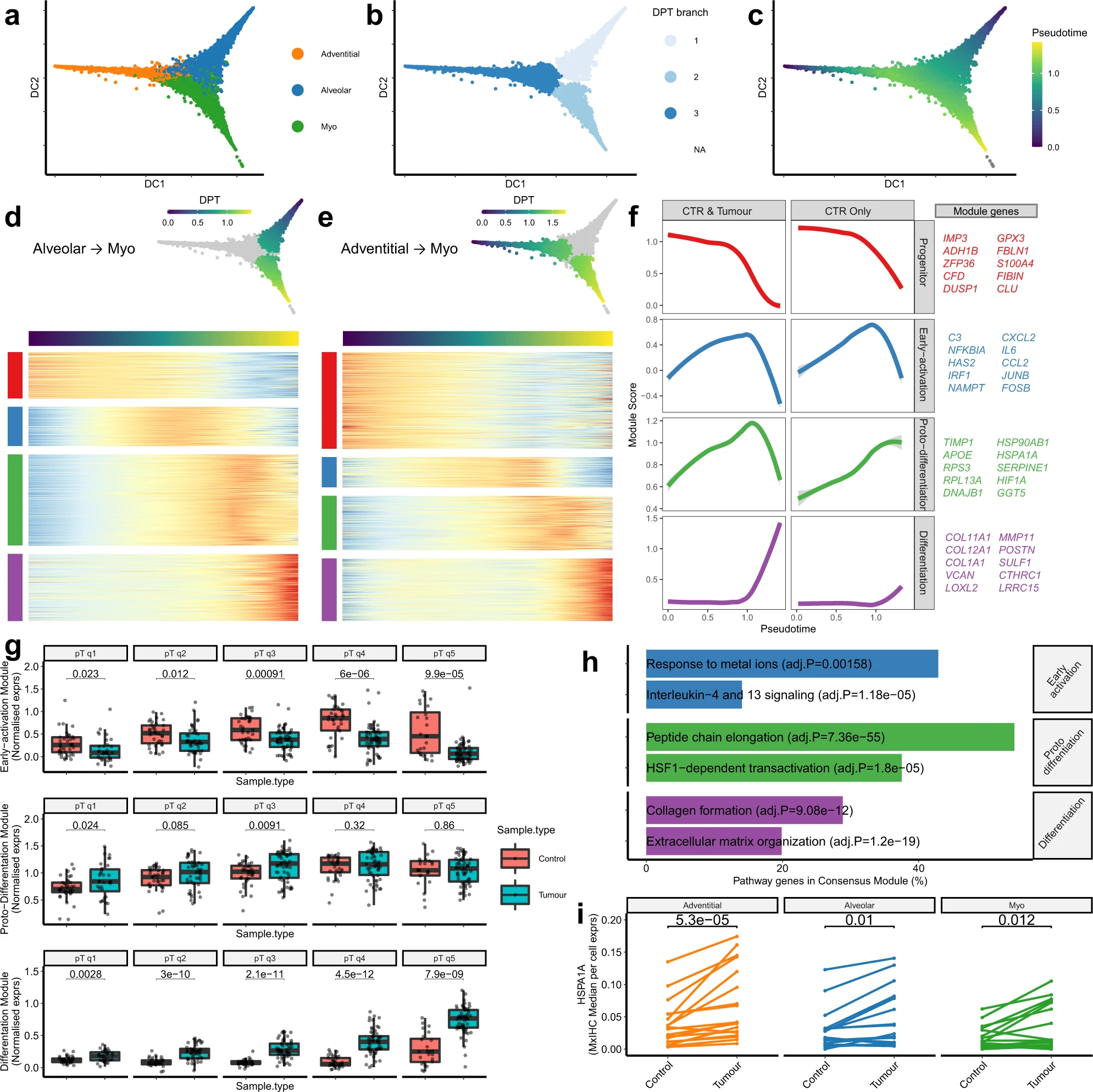
5、成纖維細胞表型的跨組織分析
為了確定這些成纖維細胞表型是否在不同的癌癥類型中保持一致,我們分析了公開可用的胰腺導管腺癌(PDAC)、頭頸部鱗狀細胞癌(HNSCC)和結直腸癌(CRC)的數據。在每種情況下,通過無監督聚類和Mural cell的排除來識別成纖維細胞,如上所述(圖5a)。然后使用概率機器學習模型將這些細胞分類為在NSCLC中識別出的三個亞群(圖5b,c)。結果顯示,無論是PDAC(冠狀動脈中位數概率=0.67),HNSCC(0.75),還是CRC(1),冠狀動脈和肌成纖維細胞人群在所有分析的癌癥類型中都保持高度一致(肌中位數概率=1)。然而,被歸類為肺泡亞群的成纖維細胞具有更低的概率分數(PDAC中位數概率=0.49,HNSCC=0.52,CRC=0.56),這表明它們與肺之間存在更大程度的表型分化。
然后,我們通過將我們的多重免疫組織化學(multiplex IHC)面板應用于由PDAC、HNSCC和CRC的腫瘤和對照組織核心組成的組織微陣列,來驗證這些結果。與單細胞轉錄組測序結果一致,這顯示冠狀動脈和肌成纖維細胞是每種癌癥類型中主要識別出的亞群(圖5d)。此外,與我們在NSCLC中發現的結果一樣,無論是PDAC、HNSCC還是CRC,冠狀動脈成纖維細胞在對照組織中明顯更豐富,而肌成纖維細胞在腫瘤組織中更豐富(圖5e和圖5f)。
為了測試肺泡表型是否特異于肺組織,我們對由特發性肺纖維化(IPF)樣本[15](即非癌性肺病理)生成的單細胞轉錄組測序數據進行了類似的分析。結果顯示,在所有三個亞群中都高概率地識別出特發性肺纖維化樣本(中位數概率=0.95 [冠狀動脈],0.88 [肺泡],0.90 [肌])。值得注意的是,這種分析還顯示,與癌癥數據集中的肌成纖維細胞分類相比,IPF中的肌成纖維細胞分類概率較低,這表明癌癥和纖維化中的肌成纖維細胞可能存在細微的差異。
6、應用多個非小細胞肺癌隊列進行生存分析
為了研究成纖維細胞亞群在非小細胞肺癌(NSCLC)中的臨床相關性,我們利用CIBERSORTx介導的數字細胞學的計算細胞豐度,對大規模的臨床注釋的NSCLC隊列進行了分析(四個LUAD隊列,n = 1669;四個LUSC隊列,n = 1104)。我們使用每個成纖維細胞亞群的相對豐度進行Cox比例風險回歸建模。結果顯示,在LUAD中,肌成纖維細胞與較差的總體生存率之間存在一致的關聯(p < 0.01),但在LUSC中沒有發現顯著相關性。鑒于肌成纖維細胞在這兩種NSCLC亞型中豐度高,我們推測這種差異可能是由于亞型之間的表型變化。然而,通過樣本水平的分析未能發現任何顯著差異表達的基因,這表明這兩種NSCLC亞型中的肌成纖維細胞在轉錄組水平上的表型差異很小。
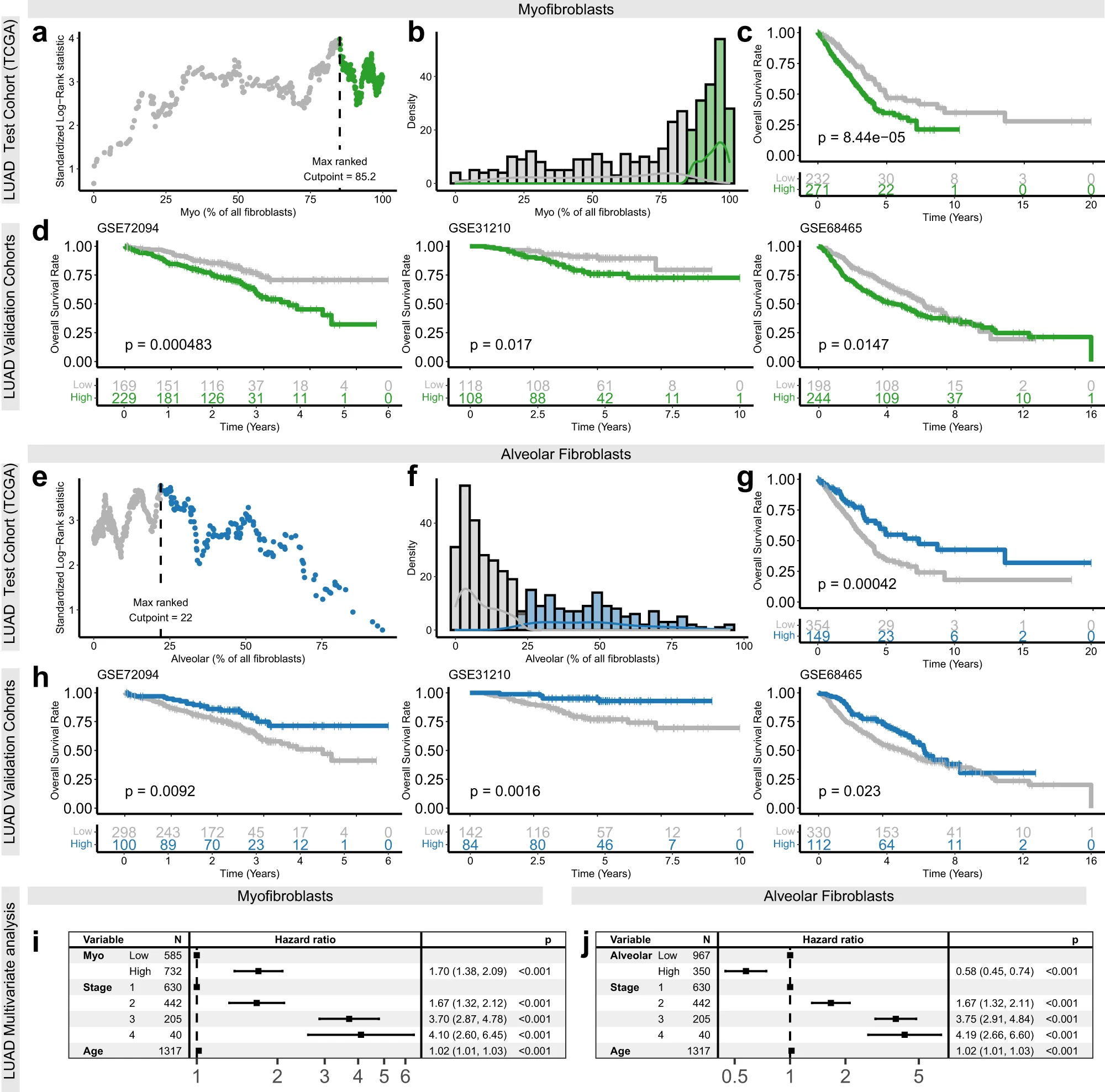
為了研究在LUAD中使用肌成纖維細胞豐度作為患者分層的預后生物標志物的潛力,我們使用TCGA-LUAD數據集作為測試隊列,確定將樣本分為肌成纖維細胞高(> 85.2%)和低(< 85.2%)的最佳閾值(圖6a-c)。然后將這個閾值應用于三個驗證隊列,結果顯示始終存在顯著的患者分層效果(log-rank p ≤ 0.02;圖6d)。多變量Cox回歸分析還表明,這些預后相關性與疾病階段和患者年齡無關(p < 0.0001,HR [95% CI] = 1.70 [1.38, 2.09];圖6i)。
相反,肺泡和冠狀動脈成纖維細胞的豐度與多個LUAD數據集中更好的總體生存率相關。這種關聯尤其在肺泡成纖維細胞中非常一致,在所有分析的數據集中都顯著(p < 0.01)。因此,我們采用上述相同的方法,測試將LUAD隊列作為肺泡成纖維細胞高(> 22.0%)或低(< 22.0%)進行分組的潛力作為預后標志物(圖6e-g)。結果同樣顯示,將LUAD隊列按肺泡成纖維細胞的豐度分為高和低,能夠有效地分層總體生存率(log-rank p < = 0.02;圖6h);并且這種關聯與疾病階段和患者年齡無關(圖6j)。
7、研究LUAD與關鍵預后特征的相關性
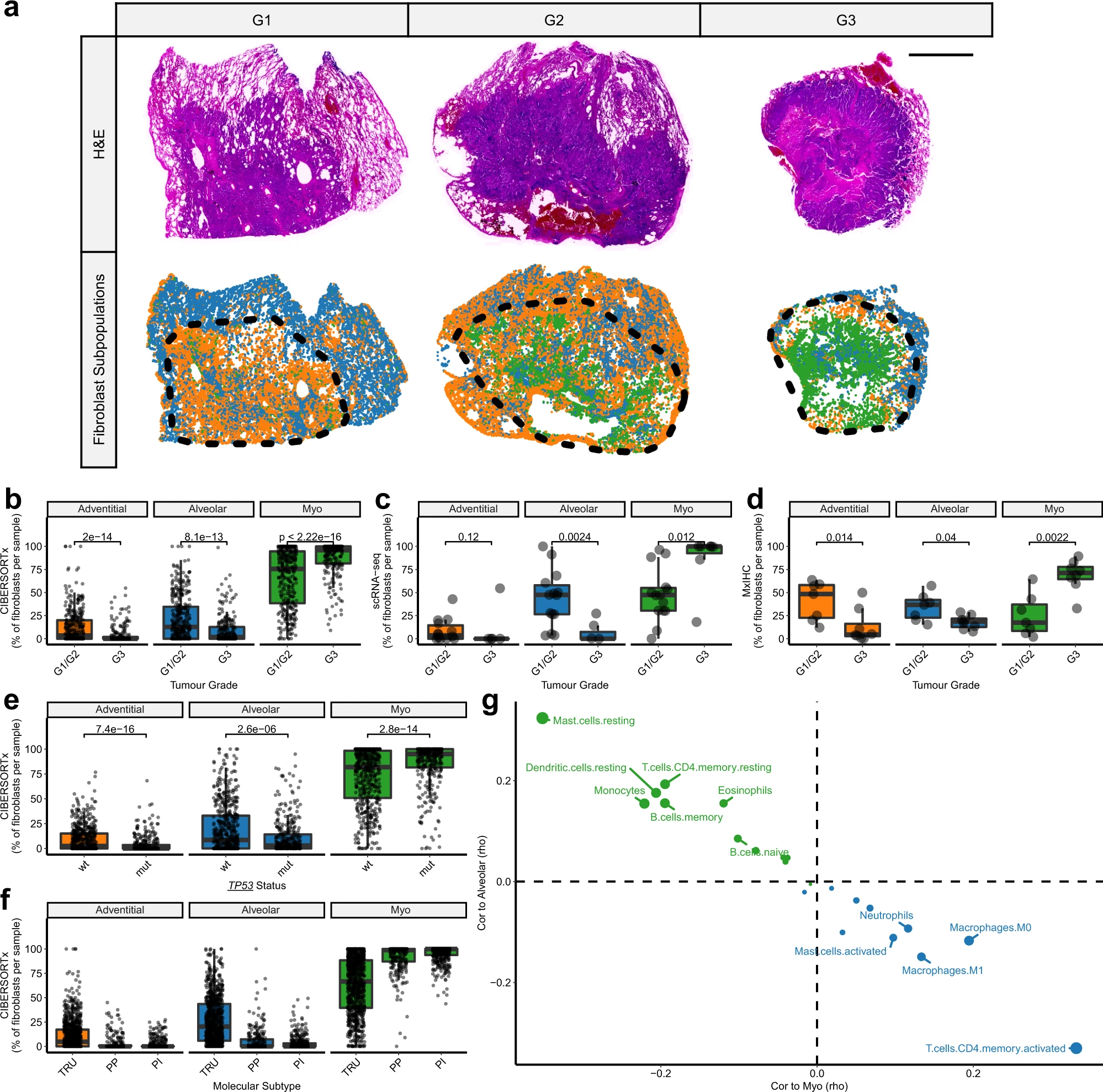
已知,LUAD腫瘤的形態亞型與患者的生存率相關。根據CIBERSORTx(n = 623,p < 0.0001;圖7b)、scRNAseq(n = 21;圖7c)和mxIHC(n = 15;圖7a,d)的結果顯示,成纖維細胞亞群的豐度在LUAD的形態亞型之間存在顯著差異。與中度/良分化(G1/G2;鱗狀、腺泡和乳頭狀)的腫瘤相比,肌成纖維細胞在差分化較差(G3;實性或微乳頭狀)的腫瘤中增加。盡管存在這種關聯,成纖維細胞亞群的豐度仍然是多元Cox回歸中的一個重要獨立預后指標,包括年齡、分期和分級作為協變量(肌成纖維細胞:HR [95% CI] = 1.44 [1.07, 1.95],adj.P = 0.015;肺泡成纖維細胞:HR [95% CI] = 0.67 [0.46, 0.96],adj.P = 0.028;n = 601)。
LUAD腫瘤內部的形態可以具有異質性。因此,我們利用我們的MxIHC數據集來研究成纖維細胞亞群與特定形態模式之間的關聯。結果發現,肌成纖維細胞與實性生長模式在腫瘤中所占比例之間存在顯著相關性(rho = 0.60,p < 0.01);肌成纖維細胞明顯是混合形態腫瘤實性區域中的主要基質細胞類型。與微乳頭狀生長模式之間存在較弱且不顯著的相關性(rho = 0.44,p = 0.07)
先前的研究已經描述了LUAD的形態亞型和分子亞型(近端-炎癥性[PI]、近端-增殖性[PP]和末端呼吸單位[TRU])之間的關聯。我們在大樣本組織數據集中驗證了這一關聯,發現77%的TRU腫瘤為中度/良分化(G1/G2),而69%的PP腫瘤為差分化較差(G3)。符合這種關聯的預期,肌成纖維細胞在PP腫瘤中豐度最高,而肺泡和外膜成纖維細胞在TRU腫瘤中最為突出(圖7f)。此外,與先前描述的PP腫瘤與TP53突變之間的關聯一致,我們還發現在攜帶TP53突變的LUAD腫瘤中,肌成纖維細胞的豐度增加(圖7e)。
我們還使用CIBERSORTx來檢查免疫細胞亞群(LM22-57)的豐度以及它們與成纖維細胞亞群之間的相關性。這顯示了與肌成纖維細胞和肺泡成纖維細胞相關的免疫細胞之間的反向關系,在所有分析的LUAD轉錄組數據集中一致觀察到(圖7g)。結果顯示,肺泡成纖維細胞與多個靜息型免疫細胞亞群呈正相關(圖7g,例如肥大細胞、CD4 + 記憶T細胞和樹突狀細胞),還包括單核細胞和B細胞(記憶型和未經刺激的亞群)。相反,肌成纖維細胞與巨噬細胞、中性粒細胞、活化肥大細胞和活化CD4 + 記憶T細胞呈正相關(圖7g)。這表明,在腫瘤微環境中,肌成纖維細胞的分化也與輔助T細胞和髓系細胞的激活/分化相關聯。
實驗方法
scRNA-seq數據處理與分析、成纖維細胞的鑒定、多重免疫組織化學(MxIHC)、多重序列優化和驗證、多重圖像生成、多重圖像分析、基質細胞鑒定和組織細胞計數法、空間分析、批量轉錄組數據分析、利用CIBERSORTx進行數字細胞學分析、生存分析、統計分析。
參考文獻
Hanley, C.J., Waise, S., Ellis, M.J. et al. Single-cell analysis reveals prognostic fibroblast subpopulations linked to molecular and immunological subtypes of lung cancer. Nat Commun 14, 387 (2023).






