一種由circINSIG1編碼的新蛋白通過促進結直腸癌中INSIG1的泛素依賴性降解來編碼膽固醇代謝
缺氧是實體腫瘤的一個標志,并導致癌細胞的代謝重編程。在結腸直腸癌(CRC)中,表觀遺傳調控在缺氧和異常膽固醇代謝之間的作用尚不清楚。采用高通量RNA測序方法,在常氧和低氧培養的結直腸癌細胞中鑒定低氧反應環狀RNA (circRNAs)并通過多體分析和LC-MS鑒定了circINSIG1的蛋白編碼潛能。circINSIG1的功能在體外和體內通過功能增益或喪失試驗得到驗證并通過免疫沉淀分析得出機制結果。結果發現了一種新的低氧應答環狀RNA circINSIG1,該環狀RNA在結直腸癌組織中表達上調,并與晚期臨床分期和低生存率相關。機制上,circINSIG1編碼一個121個氨基酸的蛋白circINSIG1-121,通過募集CUL5-ASB6復合物(一種泛素E3連接酶復合物),促進賴氨酸156和158處關鍵膽固醇代謝調節因子INSIG1的k48連鎖泛素化,從而誘導膽固醇生物合成,促進結直腸癌的增殖和轉移。原位異種移植腫瘤模型和患者來源的異種移植模型進一步確定了circINSIG1在CRC進展中的作用和CRC的潛在治療靶點。circINSIG1具有表觀遺傳機制,為研究缺氧與膽固醇代謝之間的串擾提供了新的思路,為CRC的治療提供了一個有前景的靶點。本文于2023年4月發表在《Molecular Cancer》IF:41.444期刊。
技術路線:

主要實驗結果:
1、CRC中缺氧誘導的circINSIG1的特征及臨床意義
為了鑒定CRC中與缺氧相關的環狀RNA,作者對HCT8、HCT116和DLD1細胞在常氧或缺氧(1% O2, 48 h)培養下進行了環狀RNA測序,結果顯示,這三種細胞系中有18個環狀RNA失調(圖1A)。接著,選擇在缺氧條件下具有相同趨勢的四個circRNA ((circNPHP4, circINSIG1, circGART 和 circZDHHC5)進一步鑒定(圖1B)。通過實時熒光定量PCR (qRT-PCR)分析這些circRNAs在CoCl2誘導的細胞假性缺氧模型和32對CRC樣本中的表達水平,結果顯示,circINSIG1(hsa_circ_0133744)在CoCl2處理的CRC細胞系和CRC組織樣本中顯著上調(圖1C, S1A和S1B),因此選擇circINSIG1進行進一步研究。進一步分析了85個配對CRC樣本中circINSIG1的表達水平,證實了circINSIG1在CRC中表達上調(圖1D)。結果表明,circINSIG1在晚期T期或臨床分期患者中表達更高(圖1E - F)。
circINSIG1是胰島素誘導基因1 (INSIG1)的外顯子3和4與292nt反向剪接而形成的(圖1G)。Sanger測序與之吻合,驗證了circINSIG1的反向剪接連接(圖1H)。作者采用發散引物和收斂引物分別檢測互補DNA (cDNA)和基因組DNA (gDNA)中的circINSIG1和INSIG1的線性轉錄本,結果表明,circINSIG1只能通過不同的引物在cDNA中擴增(圖1I)。半衰期分析顯示circINSIG1比線性INSIG1 mRNA穩定得多(圖1J)。此外,circINSIG1被觀察到抵抗RNase R的消化(圖1K)。核質量分離實驗和熒光原位雜交(FISH)實驗表明,CRC細胞的細胞質中富集了circINSIG1(圖1L-M)。
作者通過原位雜交分析了大量CRC患者中circINSIG1的表達(n=227)。結果還證實,與配對的正常鄰近組織相比,CRC組織中circINSIG1的表達水平升高(圖1N)。隊列中circINSIG1的表達與CRC患者TNM分期、臨床分期等臨床病理特征顯著相關(p<0.05)。此外,Kaplan-Meier曲線顯示,高circINSIG1表達與CRC患者較差的生存率相關(圖1O)。綜上所述,這些結果表明了circINSIG1的循環性和臨床意義。
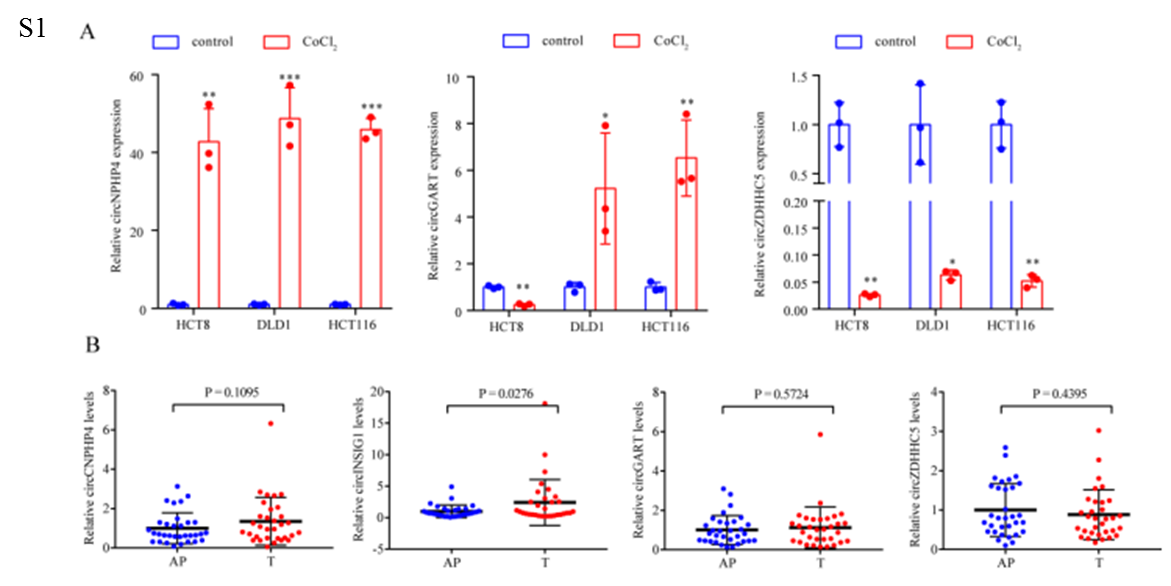
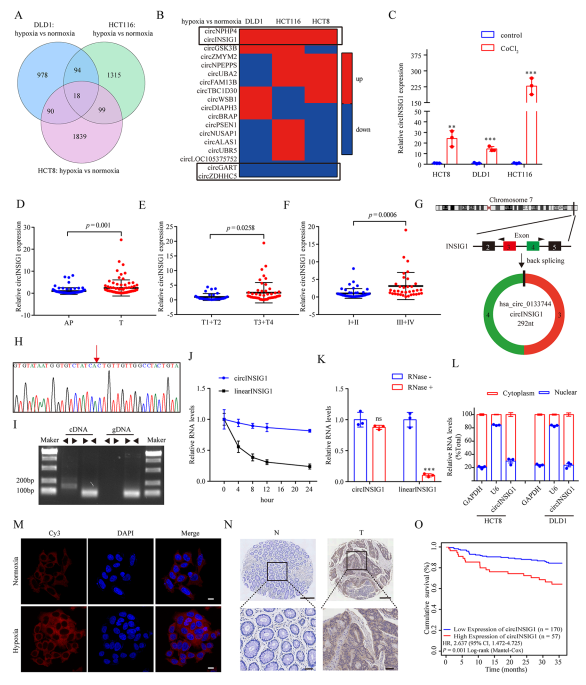
圖1 CRC中缺氧誘導的circINSIG1的特征及臨床意義
2、circINSIG1編碼121個氨基酸的與CRC的不良預后相關的新蛋白
為了確定circINSIG1的蛋白質編碼潛力,作者首先分析了circRNADb數據庫中注釋的circINSIG1的開放閱讀框(ORF)和內部核糖體進入位點(IRES)。結果顯示,circINSIG1序列中包含一個具有編碼121個氨基酸蛋白潛能的跨越連接ORF(以下簡稱circINSIG1-121)和一個位于207-292 nt的IRES(圖2A)。接著,作者進行了基于蔗糖密度梯度離心的多體分析,細胞裂解液中的核糖體分為40和60 S核糖體亞基,以及單體(80 S)和多體(圖2B)。線性INSIG1 mRNA作為陽性對照,circCAMSAP1作為陰性對照,circCAMSAP1是作者在之前的研究中發現的不具有蛋白質編碼能力的circRNA。、結果顯示circINSIG1可以在單體和多體中檢測到(圖2B)。此外,通過雙熒光素酶測定驗證了IRES驅動ORF翻譯的活性(圖S2A和S2B)。由于在第一輪讀取中缺少終止密碼子,circINSIG1-121在第二輪翻譯中由自然移碼形成的C端有一條獨特的20個氨基酸的尾巴(圖2A)。接著制備了一種針對尾20個氨基酸序列的單克隆抗體,用于檢測circINSIG1-121的表達。構建circINSIG1-flag載體,轉染CRC細胞,結果顯示,Flag抗體在轉染circINSIG1-flag載體的細胞中檢測到14KD條帶,而在轉染對照載體的細胞中未檢測到(圖2C,左)。circINSIG1-121抗體證實了circINSIG1-121的內源性存在(圖2C,右)。使用過表達circINSIG1的CRC細胞進行質譜分析和SDS-PAGE進一步驗證了circINSIG1-121蛋白的特異性肽片段與預測的分子量(圖2D-E和S2C)。
接下來,分別通過免疫組化(IHC)和western blot分析20例和10例配對CRC樣本中circINSIG1-121和INSIG1的蛋白水平。結果顯示,circINSIG1-121在結直腸癌組織中表達上調,而INSIG1蛋白水平在配對的正常鄰近組織和結直腸癌組織中無顯著差異(圖2F-G)。此外,通過免疫組化(IHC)在結直腸癌隊列中檢測了circINSIG1-121和INSIG1蛋白水平(n=227)。結果表明,高circINSIG1-121表達與CRC患者較差的生存率相關(圖2H)。而在本研究結果中或TCGA數據庫中,INSIG1的線性表達水平與CRC患者的生存率沒有相關性(圖2I-J)。總之,這些數據證實circINSIG1編碼一種121個氨基酸的新蛋白,該蛋白與CRC的不良預后相關。
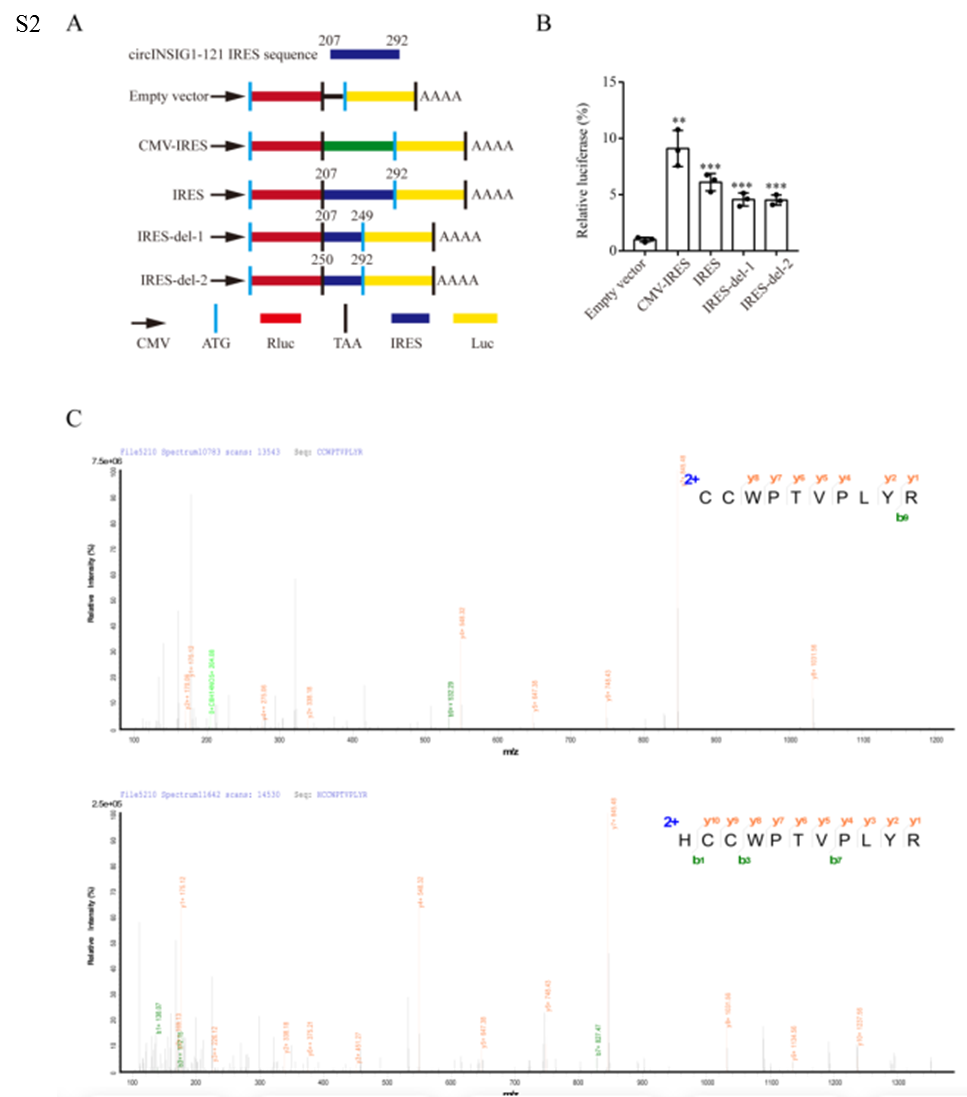
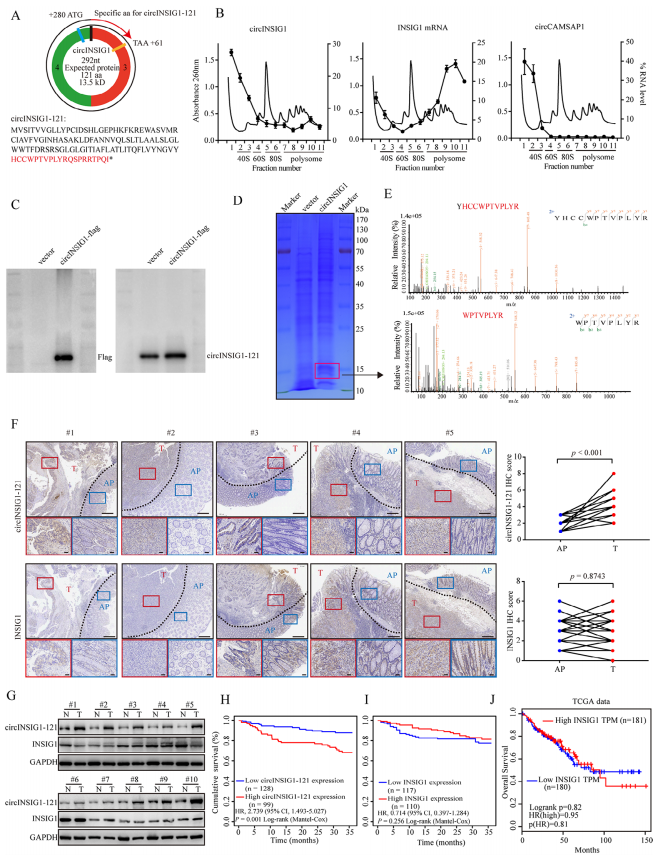
圖2 circINSIG1編碼121個氨基酸的與CRC的不良預后相關的新蛋白
3、circINSIG1-121促進結直腸癌的增殖和轉移
為了闡明circINSIG1在糖尿病中的生物學功能,作者首先利用qRT-PCR分析了circINSIG1在正常人腸上皮細胞系和CRC細胞系中的表達。與此一致,circINSIG1在CRC細胞中被發現上調(圖S3A)。由于circINSIG1表達適中,作者選擇HCT8和DLD1 CRC細胞系進行細胞實驗(圖S3A),生成穩定過表達circINSIG1或circINSIG1-121的CRC細胞系(圖3A、B和S3B)。球體形成實驗證實circINSIG1或circINSIG1-121增強CRC細胞增殖(圖3C)。接著在CRC患者源性類器官(PDOs)中過表達circINSIG1或circINSIG1-121,結果也表明circINSIG1或circINSIG1-121促進了PDOs的生長(圖3D)。同樣,circINSIG1或circINSIG1-121的過表達促進了CRC細胞的遷移和侵襲(圖3E和S3C)。作者用兩個短發夾RNA敲低了circINSIG1特異性靶向HCT8和DLD1細胞中circINSIG1的后剪接連接的shRNAs(圖S3D和S3E)。正如預期的那樣,敲低circINSIG1或circINSIG1-121顯著抑制CRC細胞的生長、遷移和侵襲(圖3F-H和S3F)。此外,構建一個帶有起始密碼子的突變circINSIG1載體(circINSIG1-ATGmut)。過表達circINSIG1- atgmut不能增強CRC細胞的增殖、遷移和侵襲(圖S3G-S3I),提示circINSIG1通過編碼circINSIG1-121而不是circINSIG1的環狀RNA形式促進CRC細胞的增殖和轉移。
接下來,使用原位異種移植腫瘤模型確定circINSIG1-121在CRC進展中的體內功能。結果證實過表達circINSIG1或circINSIG1-121可顯著促進腫瘤生長(圖3I-J)。對人的分析小鼠肝臟中HPRT mRNA的表達證實了circINSIG1或circINSIG1-121可導致肝轉移的腫瘤負荷顯著增加(圖3 K)。這些結果證明了circINSIG1-121在促進結直腸癌增殖和轉移中的關鍵作用。

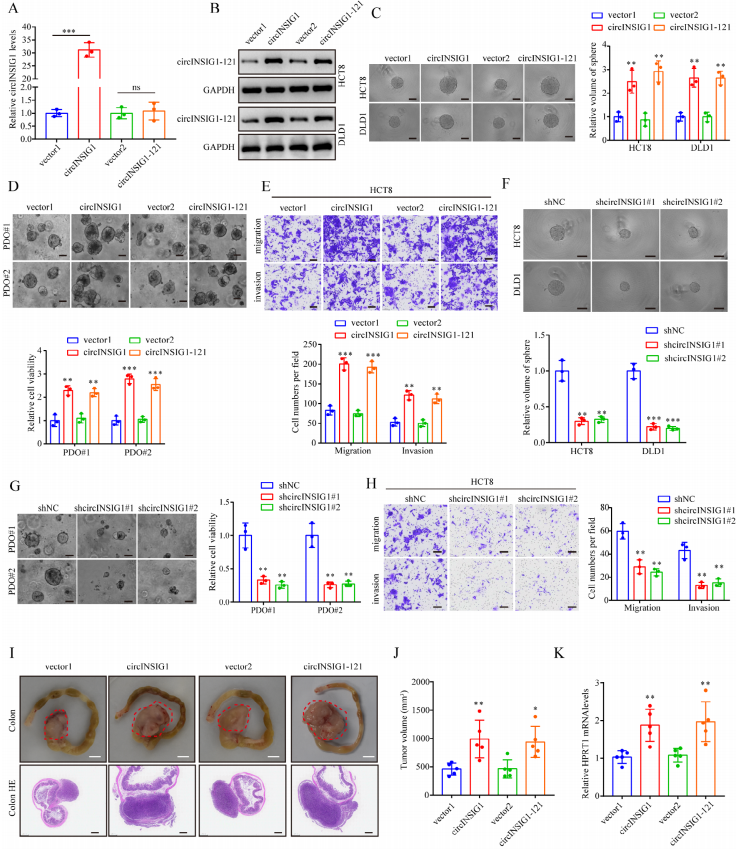
圖3 circINSIG1-121促進結直腸癌的增殖和轉移
4、circINSIG1-121通過與INSIG1相互作用促進INSIG1不依賴于泛素的降解并誘導膽固醇的生物合成
為了確定circINSIG1-121促進CRC進展的分子機制,作者分析了circINSIG1或circINSIG1-121過表達的HCT8和DLD1細胞中INSIG1的RNA和蛋白水平。有趣的是,INSIG1的RNA水平隨著circINSIG1或circINSIG1-121的過表達而升高,而INSIG1的蛋白水平則降低(圖4A、B和S4A)。隨即通過免疫熒光觀察到circINSIG1-121和INSIG1在CRC細胞中的共定位(圖4C)。免疫沉淀(IP)實驗證實circINSIG1-121與INSIG1相互作用(圖4D)。有報道稱,INSIG1的磷酸化促進了INSIG1蛋白的降解。因此,作者首先分析了并發現INSIG1的表達磷酸化INSIG1 (p-INSIG1)不因circINSIG1或circINSIG1-121過表達而升高(圖S4B)。這些結果表明circINSIG1或circINSIG1-121可能不會通過影響其磷酸化水平來調節INSIG1的降解。由于泛素-蛋白酶體和自噬-溶酶體途徑是真核細胞中蛋白質清除的兩個主要系統,作者用蛋白酶體抑制劑MG132或自噬-隔離抑制劑3-甲基腺嘌呤(3-MA)處理CRC細胞,以進一步研究circINSIG1-121介導的INSIG1降解的分子機制。我們觀察到MG132而不是3-MA提高了INSIG1的蛋白水平,并且在circINSIG1或circINSIG1-121過表達的CRC細胞中,INSIG1的泛素化水平升高,表明circINSIG1-121通過泛素-蛋白酶體途徑促進了INSIG1的降解(圖4E-F)。
固醇調節元件結合蛋白(SREBPs)在哺乳動物膽固醇和脂質穩態中起著至關重要的作用。INSIG蛋白與與SREBP和SREBP裂解激活蛋白(SCAP)復合物結合,將該復合物錨定在內質網(ER)中,以調節脂肪生成。此外,SREBP1負責脂肪酸合成和能量儲存,SREBP2負責膽固醇調節。因此,作者首先分析了全長SREBPs (fSREBPs)和活性核SREBPs (nSREBPs)的蛋白水平。Western blot分析顯示,在過表達circINSIG1或circINSIG1-121的CRC細胞中,nSREBP2顯著增加,但nSREBP1無顯著變化,提示circINSIG1-121可能促進SREBP2激活,從而增強膽固醇的生物合成(圖4G)。此外,對SREBP1和SREBP2靶基因進行分析,結果表明SREBP2靶基因表達水平升高,而SREBP1靶基因的表達無明顯變化。(圖4H和S4C)。與膽固醇生物合成基因的表達增強一致,與對照組相比,circINSIG1-121過表達增加了游離膽固醇含量(圖4I)。綜上所述,這些數據表明circINSIG1-121促進了INSIG1的泛素依賴性降解,導致內質網釋放SREBP2-SCAP復合物,隨后誘導膽固醇的生物合成。
為了確認circINSIG1是否以INSIG1依賴的方式重編程膽固醇,進行了體外拯救試驗。如圖S4D-F所示,過表達circINSIG1可促進CRC細胞增殖、遷移和侵襲,而過表達INSIG1可顯著拮抗這一作用。過表達circINSIG1增加了CRC細胞中SREBP2靶基因的表達水平和游離膽固醇的含量,但可以通過過表達INSIG1來下調(圖S4G和H)。這些數據表明,circINSIG1通過調節INSIG1的水平,至少在一定程度上重編程膽固醇代謝,促進CRC的惡性進展。
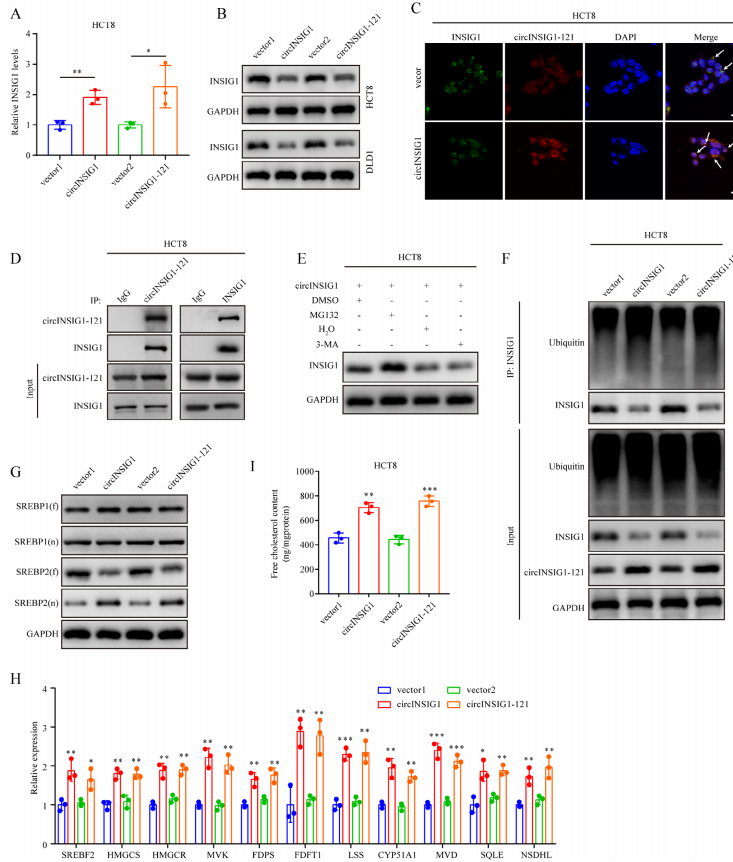

圖4 circINSIG1-121促進INSIG1不依賴于泛素的降解并誘導膽固醇的生物合成
5、circINSIG1-121通過招募CUL5-ASB6復合體促進與k48相關的INSIG1泛素化
泛素鏈是主要的降解信號,負責靶向不同類型的底物,不同種類的泛素鏈具有不同的生物學功能。為了確定導致INSIG1降解的泛素鏈類型,我們用不同的HA標記的泛素鏈載體轉染CRC細胞。
研究結果顯示,INSIG1主要通過K48連鎖泛素化,而不與其他類型的泛素鏈泛素化(圖5A)。在circINSIG1-121過表達的細胞中,k48關聯的多泛素化作用增強(圖5B)。這些發現表明circINSIG1-121通過k48連鎖泛素化介導了INSIG1的降解。然后,作者試圖確定INSIG1的哪些賴氨酸殘基是導致INSIG1降解的主要泛素化位點,因此,在INSIG1蛋白中鑒定出5個保守賴氨酸(K)點(圖S5A),將5個相應賴氨酸殘基分別突變為精氨酸(R)的INSIG1突變體分別用于轉染的CRC細胞。結果發現,與野生型組相比,轉染INSIG1 K156R和K158R組的INSIG1蛋白水平略有下降(圖5C-D)。為了進一步證實INSIG1的這兩個泛素化位點,構建了具有兩個賴氨酸點突變的INSIG1突變體。隨后的Western blot和免疫沉淀實驗表明,該突變體顯著減弱了circINSIG1-121介導的INSIG1降解,且INSIG1的k48連鎖泛素化水平顯著低于野生型組(圖5E-G)。這些結果表明,circINSIG1-121促進了INSIG1在K156和K158殘基上的k48連鎖泛素化。
由于circINSIG1-121不是E3連接酶,作者推斷circINSIG1-121可能作為適配器招募某些E3連接酶使INSIG1泛素化。因此用circINSIG1-121抗體進行免疫沉淀試驗,質譜分析鑒定出ASB6的存在(圖S5B)。ASB6是一種底物識別適配器,可與Cullin5 (CUL5)相互作用形成CUL5-ASB6復合物,其功能為泛素E3連接酶復合物。進一步的免疫沉淀實驗驗證了circINSIG1-121和CUL5-ASB6復合物之間的相互作用(圖5H-I)。作者發現蛋白酶體抑制劑MG132和Cullin-Ring E3連接酶活性抑制劑MLN4924導致內源性INSIG1蛋白水平明顯升高(圖5J)。ASB6過表達增強了與k48相關的INSIG1泛素化,降低了INSIG1蛋白的豐度(圖5K)。相反,ASB6敲低增加了INSIG1蛋白的豐度,抑制了與k48相關的INSIG1泛素化(圖5K)。此外,ASB6的過表達促進膽固醇的生物合成,反之亦然(圖5L)。因此,circINSIG1-121招募CUL5-ASB6復合物,促進k48相關的INSIG1在K156和K158的泛素化。


圖5 circINSIG1-121促進與k48相關的INSIG1泛素化分析
6、缺氧誘導的EIF4A3促進circINSIG1的表達
作者接著探討了circINSIG1在結直腸癌細胞中的上調機制。研究表明,RNA結合蛋白(RBP)通過結合環狀RNA的側翼內含子區域參與環狀RNA的生物發生。在這里,CircInteractome(探索circRNA及其相互作用蛋白的工具)被用來尋找負責circINSIG1循環化的潛在RBP。在circINSIG1反剪接位點的上游和下游分別鑒定出4個和6個EIF4A3結合位點(圖6A和S6A)。EIF4A3是外顯子連接復合體的核心組分,在pre-mRNA剪接中發揮重要作用。然后,作者分析了TCGA數據庫中EIF4A3的表達,發現EIF4A3在CRC中表達上調(圖S6B)。此外,EIF4A3的表達與缺氧標志物HIF-1α的表達呈正相關(圖S6C)。Western blot和qRT-PCR檢測顯示,缺氧條件下EIF4A3蛋白表達上調,circINSIG1表達與EIF4A3表達呈正相關(圖6B-C)。為了驗證EIF4A3與circINSIG1側翼序列結合的能力,進行了RNA下拉試驗。結果表明,EIF4A3可以與circINSIG1的下游側翼序列結合,但不是上游序列(圖6D和S6D)。然后,我們構建了circINSIG1小基因,并進行了RNA免疫沉淀(RIP)檢測。如圖6E所示,抗EIF4A3組中6個推測的EIF4A3結合位點的富集程度高于抗IgG組,而轉染circINSIG1 miniigene進一步提高了富集程度,表明EIF4A3可以結合到側翼區域上這些推測的結合位點。我們進一步構建了穩定過表達EIF4A3和一系列具有EIF4A3結合位點突變的circINSIG1小基因的CRC細胞系(圖S6E和6F)。值得注意的是,單個推定結合位點的突變對circINSIG1的表達幾乎沒有影響,而所有六個EIF4A3結合位點的突變大大減少了circINSIG1的形成(圖6G)。這些結果表明,這六個位于circINSIG1下游側翼區域的EIF4A3結合位點是EIF4A3介導的circINSIG1環狀化所必需的。此外,我們觀察到circINSIG1水平隨著EIF4A3過表達而升高,而通過敲低EIF4A3而降低(圖6H、I和S6F)。EIF4A3的過表達促進了SREBP2靶基因的激活和膽固醇的生物合成,這可以通過沉默circINSIG1來部分減弱(圖6J-L)。總之,這些數據表明缺氧誘導的EIF4A3促進了circINSIG1的生物發生。
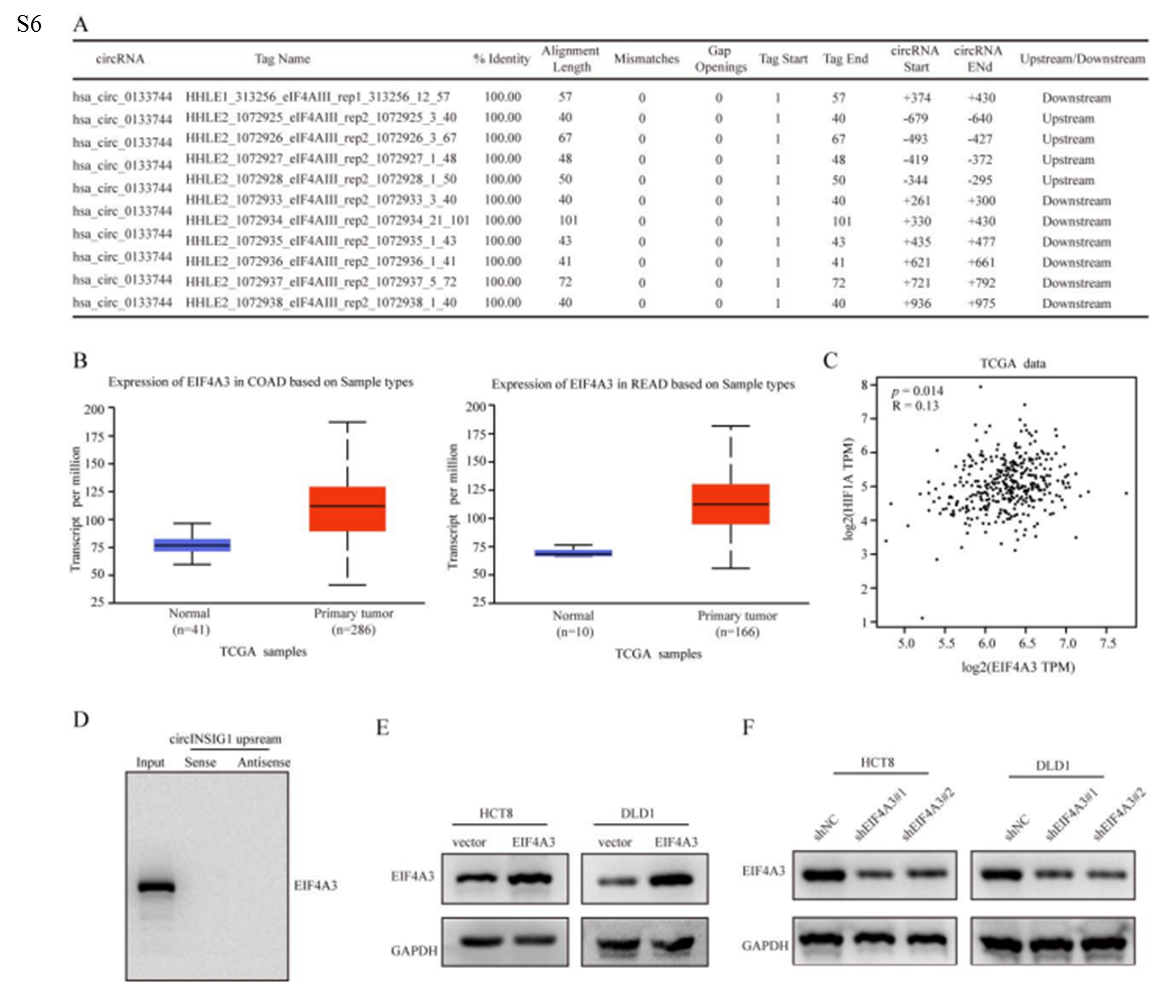
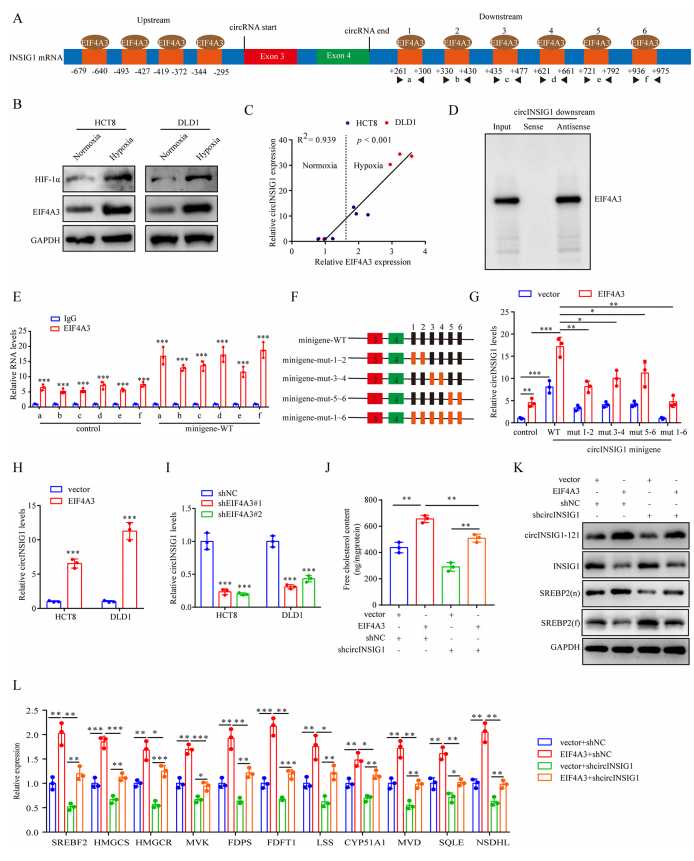
圖6缺氧誘導的EIF4A3促進circINSIG1的表達
7、circINSIG1是CRC患者的潛在治療靶點
為了驗證circINSIG1是否可以作為CRC的潛在治療靶點,我們分析了circINSIG1和circINSIG1-121在6種患者來源的異種移植(PDX)模型中的表達。作者選擇circINSIG1上調的PDX3和PDX6靶向circINSIG1檢測其治療效果(圖S7A和S7B)。結果顯示,shcircINSIG1慢病毒治療導致腫瘤生長明顯低于對照組(圖7A-B)。免疫組化分析顯示,shcircINSIG1慢病毒治療組的Ki67陽性細胞百分比明顯低于對照組(圖7C)。為了進一步驗證circINSIG1在體內的作用機制,作者評估了circINSIG1下游靶點的表達并檢測了這些腫瘤中的膽固醇含量。結果表明,敲低circINSIG1可降低circINSIG1-121的蛋白水平,抑制INSIG1介導的SREBP1信號傳導(圖7D-F)。此外,敲低circINSIG1的PDX腫瘤中游離膽固醇含量降低(圖7G)。綜上所述,這些數據表明circINSIG1是CRC患者的一個新的治療靶點。
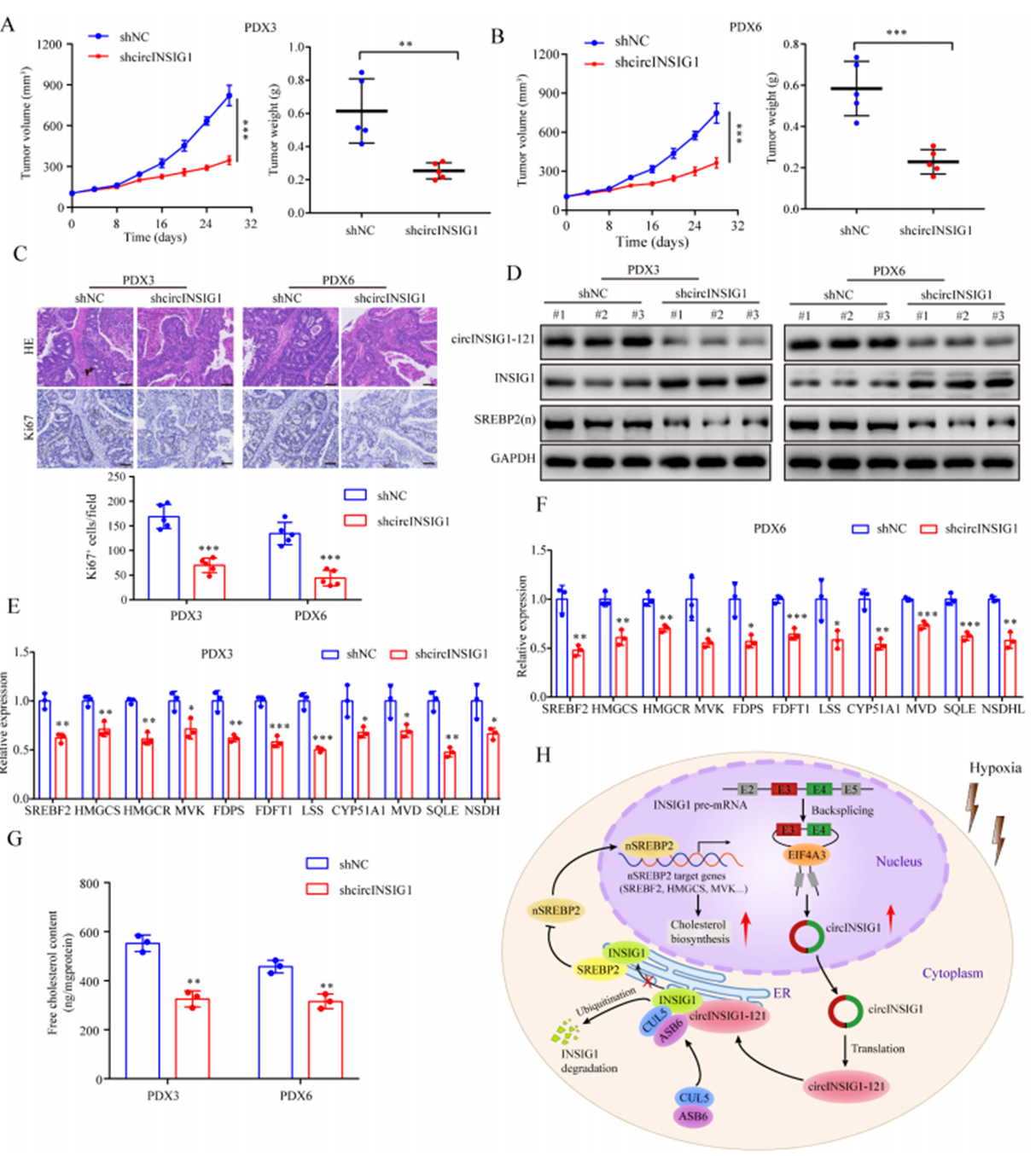
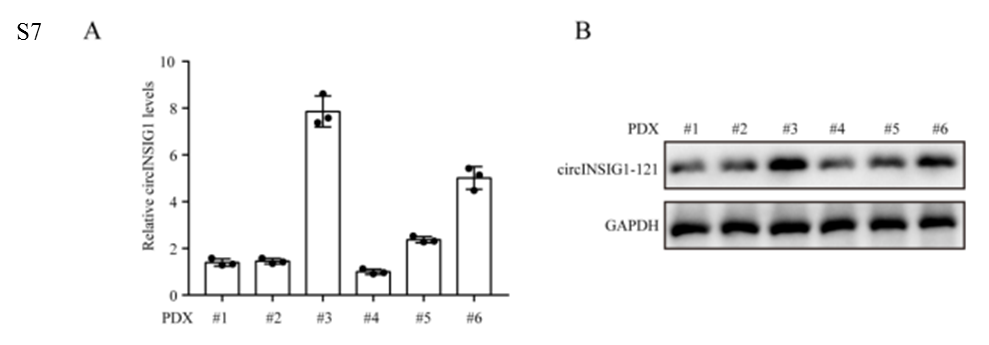
圖7 circINSIG1作為CRC患者的潛在治療靶點分析
實驗方法:
高通量RNA測序,RNase R消化實驗,qRT-PCR,Western blot,RNA 干擾,過表達,C62H86N12O16測定實驗,細胞遷移實驗,細胞增殖抑制試驗,熒光原位雜交(FISH),原位雜交(ISH),免疫組化(IHC),RNA pull-down,RNA免疫沉淀(RIP)。
參考文獻:
Xiong ZL, Liu HS, Zhou C, Yang X, Huang L , Jie HQ, Zeng ZW, Zheng XB, Li WX, Liu ZZ, Kang L, Liang ZX. A novel protein encoded by circINSIG1 reprograms cholesterol metabolism by promoting the ubiquitin-dependent degradation of INSIG1 in colorectal cancer. Molecular Cancer, 2023, April, 22(1):72.
https://doi.org/10.1186/s12943-023-01773-3.






