靶向誘導細胞焦亡促進膠質母細胞瘤治療
膠質母細胞瘤(GBM)是一種高度侵襲性的腫瘤,目前缺乏有效的治療方法。細胞焦亡已成為一種有前途的癌癥治療方法,但仍需要新的焦亡促進劑來靶向癌細胞。本研究報道來源于植物的天然化合物蘆薈大黃素(AE)可以通過誘導細胞焦亡抑制GBM細胞,使其成為焦亡介導的GBM治療的潛在助推器。然而,由于血腦屏障(BBB)及其非選擇性,給藥AE具有挑戰性。為克服這一障礙,開發了AE @ ZIF-8 NPs,一種生物礦化的納米載體,可以響應腫瘤的酸性微環境(TAM)釋放AE。進一步用轉鐵蛋白(Tf)和聚乙二醇-聚嵌段共聚物(乳酸-羥基乙酸)(PEG-PLGA)修飾納米載體,分別提高其穿過BBB和腫瘤靶向性。結果表明,AE-NPs(Tf-PEGPLGA修飾AE @ ZIF-8 NPs)顯著增加顱內分布和腫瘤組織蓄積,增強GBM焦亡。此外,AE-NPs激活抗腫瘤免疫并降低AE相關毒性。總的來說,本研究為GBM治療提供了一種新的方法,并提供了一種能夠穿透BBB、靶向腫瘤和減輕毒性的納米載體。研究于2023年4月發表在期刊《Small》上,IF: 15.153。
技術路線:

主要研究結果:
1、AE抑制GBM細胞增殖,誘導細胞焦亡
蘆薈大黃素(Aloe-emodin, AE)是一種具有抗腫瘤作用的天然單體化合物(圖1A)。為探索AE潛在的抗GBM活性,作者對GBM人細胞系U87MG和GBM小鼠細胞系GL261給予AE。Cell Counting Kit 8(CCK-8)實驗表明AE以時間和濃度依賴的方式抑制GBM細胞(圖1B),并且AE處理的GBM細胞的形態表現出焦亡特異性特征,如細胞膜腫脹和起泡(圖1C),提示AE可能誘導GBM細胞焦亡。由于細胞焦亡伴隨著乳酸脫氫酶(lactate dehydrogenase,LDH)的胞外釋放,為進一步證實AE誘導的細胞焦亡,作者下面檢測AE處理的U87MG細胞中LDH的釋放,結果顯示LDH的釋放隨著AE濃度的增加而增加(圖1D)。這些結果表明,AE抑制GBM細胞增殖并誘導細胞焦亡。
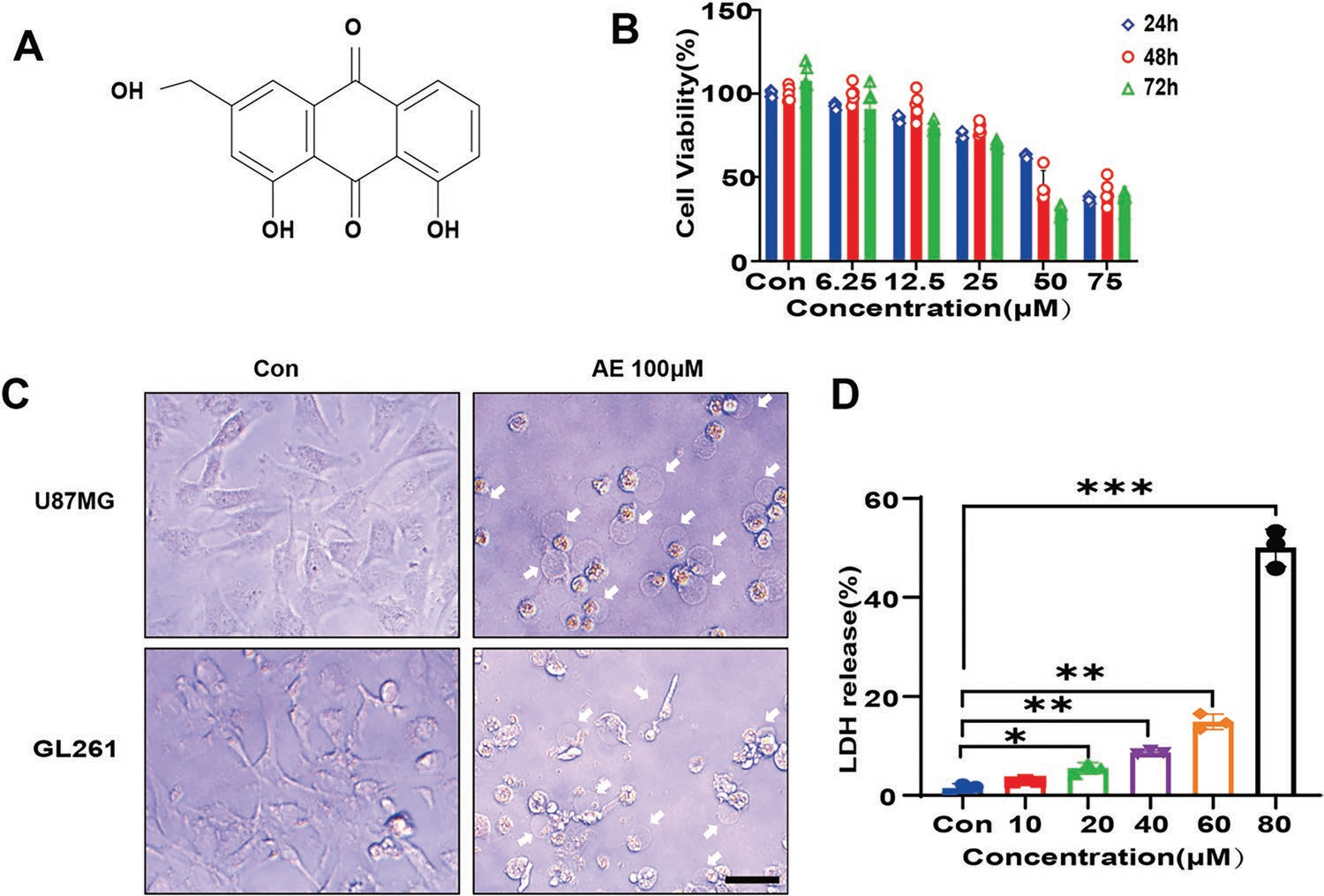
圖1 AE誘導GBM細胞焦亡
2、AE激活GBM細胞中的CASP3 / GSDME焦亡通路
細胞焦亡主要通過caspase-1 / gasdermin D(CASP1 / GSDMD)途徑或CASP3 / GSDME途徑激活。為明確AE介導細胞焦亡的機制,進行AE-GBM網絡藥理學分析。與AE和GBM相關的重疊靶點的Venn圖確定了44個GBM治療AE的潛在靶點(圖2A)。用STRING數據庫對這44個靶點進行網絡分析(圖2B),PPI網絡顯示44個節點和473條邊。作者接下來對每個節點進行分析,篩選出節點度大于23的前20個靶點。這些靶點包括AKT1、ALOX5、AKT2、BCL2L1、CASP3、CASP9、CDK2、CDK6。其中,CASP3是核心交集靶點之一(圖2C)。由于CASP3是CASP3 / GSDME焦亡通路的關鍵蛋白,作者推測AE可能通過CASP3 / GSDME通路誘導GBM焦亡。體外研究證實AE誘導CASP3和GSDME的激活,但不誘導GSDMD(圖2D-E)的激活,這與經典的焦亡誘導劑順鉑相似。
有報道顯示GSDME的表達決定了細胞焦亡是否在化療藥物誘導的抗腫瘤過程中占主導地位。作者接下來通過Western blot(WB)和TCGA數據庫分析GSDME在GBM細胞系和腫瘤組織中的表達情況。TCGA數據庫(http://ualcan.path.uab.edu/index. html)分析結果顯示,與其他腫瘤和正常腦組織相比,GSDME在GBM(圖2F-G)中高表達。WB顯示GSDME在HMO6(人小膠質細胞系)細胞中呈陰性表達,在人GBM細胞系U87MG、DBTRG中表達較高,其次是HepG2、Hela、A549,甚至在小鼠細胞中也有表達。最重要的是,GSDME在GBM細胞系GL261中的表達高于小膠質細胞系BV2(圖2H)。這些結果提示GSDME通過激活CASP3 / CASP3 / CASP3 / CASP3是抗GBM治療的良好靶點。
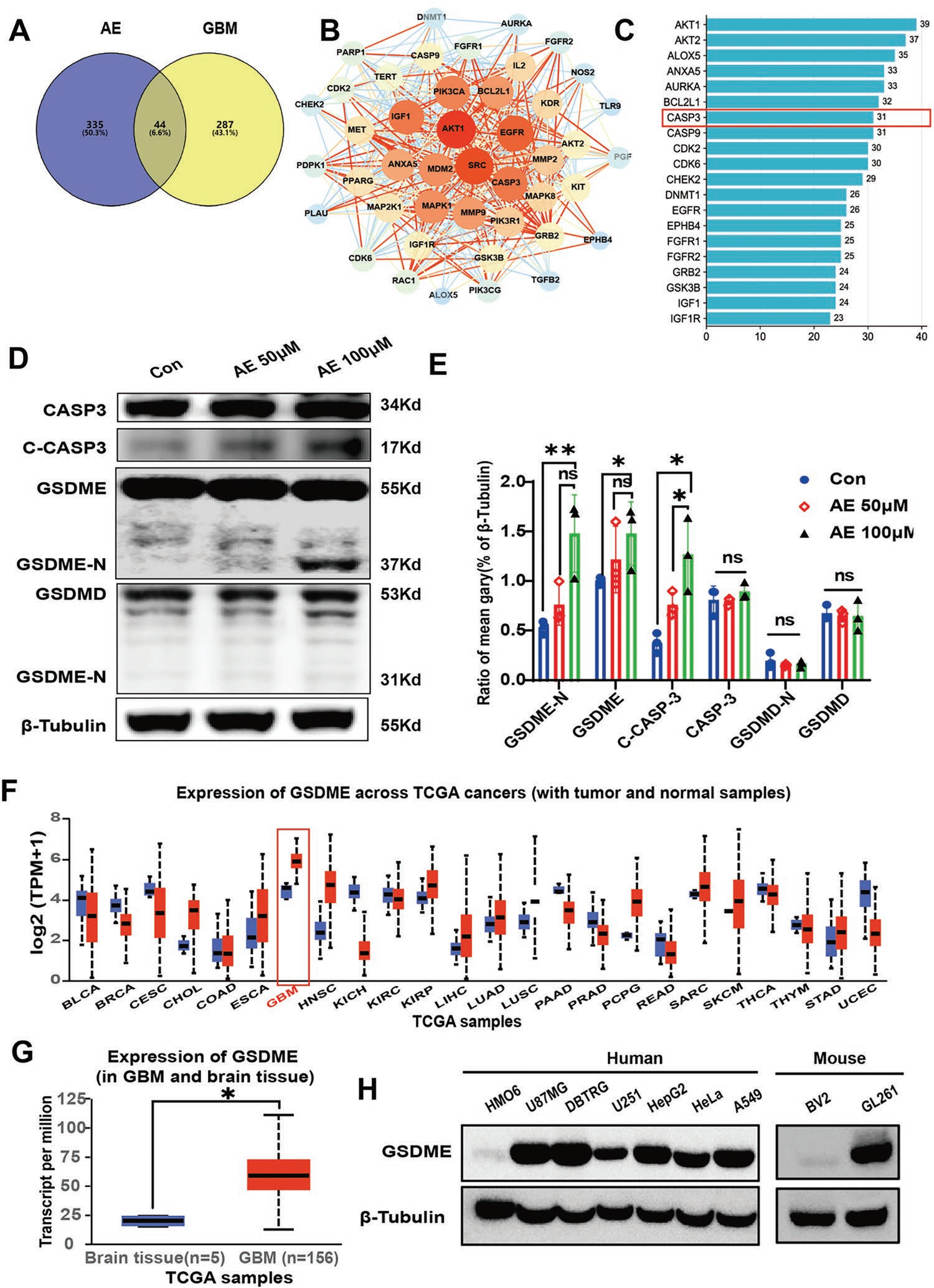
圖2 AE激活GBM細胞中的CASP3 / GSDME焦亡通路
3、AE-NPS的表征及其酸性微環境響應性研究
為改善AE的顱內分布和腫瘤富集,作者通過兩步法構建了AE-NPs(Scheme 1A)。首先,通過在Zn(NO3)2和2 -甲基咪唑礦化過程中包裹AE合成了AE @ ZIF-8納米顆粒。隨后,用Tf-PEG-PLGA聚合物包覆AE @ ZIF-8 NPs。空白ZIF-8、AE @ ZIF-8和AE-NPs的外觀如圖3A所示。本研究選擇10 mg AE用于最終的AE @ ZIF-8 NPs處方和后續實驗。AE的負載量為43.2%,AE @ ZIF-8的包封率為32.6%,動態光散射(DLS)測得AE @ ZIF-8的流體力學尺寸為155.1 ± 42.41 nm(圖3B),表面zeta電位為20.3 ± 7.95 mV(圖3C)。本研究選擇7:3的體積比進行AE-NPs的制備及后續實驗。作者通過DLS測得AE-NPs的水動力學粒徑為199 ± 85 nm(圖3B),并在96 h內保持穩定(圖3G),表面Zeta電位為13.8 ± 6.49 nm(圖3C),AE-NPs的包封率為22.5 %。由于正常腦組織的細胞間隙為38-68 nm,而腫瘤組織的細胞間隙為7-100 nm,這表明作者制備的AE-NPs可以自由通過腦組織間隙和腫瘤細胞間隙。
通過TEM檢測空白ZIF-8 NPs、AE @ ZIF-8 NPs、AE-NPs時,AE-NPs表面有突出的Tf-PEG-PLGA包裹(圖3E中的紫紅色箭頭)。與AE @ ZIF-8相比,AE-NPs的傅里葉變換紅外(FTIR)光譜在1500-1700 cm-1之間也出現了新的吸收峰(圖3F)。這可能是由轉鐵蛋白與PEG-PLGA的酰胺鍵上-CO-NH-的伸縮振動峰引起的,提示AE-NPs制備成功。
酸性環境響應的降解能力使ZIF-8 NPs成為靶向腫瘤和細胞內環境的高效載體。為測試Tf-PEG-PLGA聚合物涂層是否會干擾ZIF-8 NPs的pH響應性能,作者進一步進行了pH降解實驗。作者的實驗表明AE-NPs在中性環境中穩定,而在酸性環境中隨著AE的釋放而降解(圖3H-K)。這些結果表明AE-NPs與酸性微環境發生了反應。
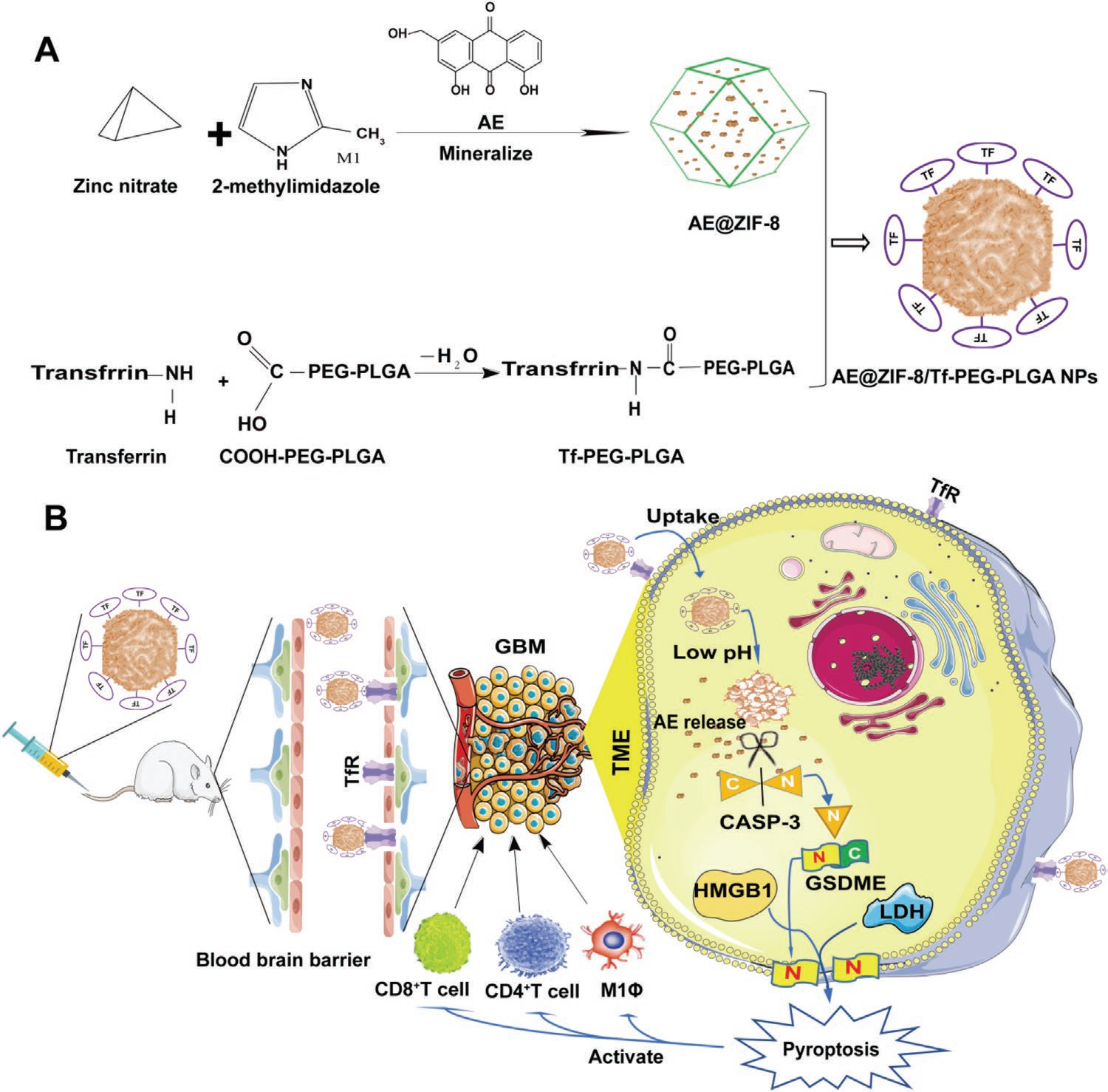
Scheme 1
圖3:AE-NPS的表征及其酸性微環境響應性研究
4、NPs促進細胞內攝取和AE介導的GBM細胞焦亡
為評估GBM細胞對AE-NPs的攝取情況,作者將熒光染料吲哚菁綠包裹在ZIF-8顆粒(ICG @ ZIF-8)和Tf-PEG-PLGA聚合物包裹的ZIF-8 NPs(ICG-NPs)中。流式細胞術分析顯示ICG、ICG @ ZIF-8和ICGNPs以時間依賴性方式進入U87MG細胞(圖4A)。各時間點ICG-NPs組ICG陽性細胞比例及其熒光強度均顯著高于ICG組和ICG @ ZIF-8組(圖4B)。因此,作者推測Tf-PEG-PLGA聚合物包裹的ZIF-8 NPs增加U87MG細胞對ICG的細胞內攝取。接下來用ICG、ICG @ ZIF-8和ICG-NPs處理U87MG細胞6 h。激光共聚焦顯微鏡(LSCM)顯示ICG-NPs處理組的熒光強度明顯增強(圖4C),證實攝取增加。
由于Tf-PEG-PLGA聚合物包裹的ZIF-8 NPs增加了細胞內對貨物的攝取,因此作者想知道Tf-PEG-PLGA聚合物包裹的ZIF-8 NPs是否也增強了AE的抗腫瘤效果。因此,作者接下來用AE和AE-NPs處理U87MG細胞24 h,測定細胞存活率。納米粒包載AE表現出明顯更高的抑制效果(圖4D)。為研究細胞攝取增加是否影響細胞死亡機制,作者接下來用共聚焦高強度成像分析系統觀察了AE和AE-NPs處理的U87MG細胞。結果顯示,AE-NPs處理組細胞焦亡發生在24 h內,而AE組細胞焦亡時間超過60 h(圖4E),AE-NPs處理組細胞焦亡發生在24 h內,而AE組細胞焦亡發生在24 h內(圖4F)。這表明TfPEG-PLGA聚合物包裹的ZIF-8 NPs對AE的包裹通過增強細胞焦亡進一步增強了抗GBM細胞的作用。

圖4 NPs促進細胞內攝取和AE介導的GBM細胞焦亡
5、AE-NPS增加AE在體內的顱內分布和腫瘤富集
化療藥物在GBM治療中面臨的主要挑戰是BBB穿透和腫瘤靶向性。因此,制備游離ICG、ICG @ ZIF-8、ICG-NPs作為納米示蹤劑,評價Tf-PEG-PLGA包裹ZIF-8 NPs的體內生物分布、BBB滲透和腫瘤靶向能力。按計劃,首先通過尾靜脈注射(ICG標準化為3 mg kg-1)對C57BL/6j小鼠進行ICG、ICG @ ZIF-8和ICG-NPs處理,然后進行光學活體成像,檢測各時間點ICG在腦和主要器官的生物分布。結果表明,與ICG和ICG @ ZIF-8相比,ICG-NPs在15 min內具有更好的顱內富集性,在(圖5A、B)后24 h具有明顯的顱內滯留,液相色譜-質譜聯用(LC-MS)定量進一步證實了AE-NPs組在(圖5D ;圖S10 ,支持信息)后2 h內腦內AE濃度高于其他組。器官分布顯示Tf-PEG-PLGA包裹的ZIF-8 NPs延長了在體內的滯留時間。作者的研究還表明,與游離ICG相比,ICG @ ZIF-8早期腦分布較低,但(圖5A ~ C)滯留時間較長。這些結果表明,負載Tf-PEG-PLGA包裹的ZIF-8 NPs增強了貨物進入腦內的能力,延長了滯留時間。隨后,為了評估腫瘤靶向能力,制備了ICG和ICG-NPs處理小鼠的荷瘤腦冷凍切片。結果顯示,ICGNPs在腫瘤組織(圖5E ;圖S11 ,支持信息)中顯著富集,LC-MS定量進一步證實AE-NPs組腫瘤組織具有較高的AE濃度(圖5D ;圖S10 ,支持信息)。
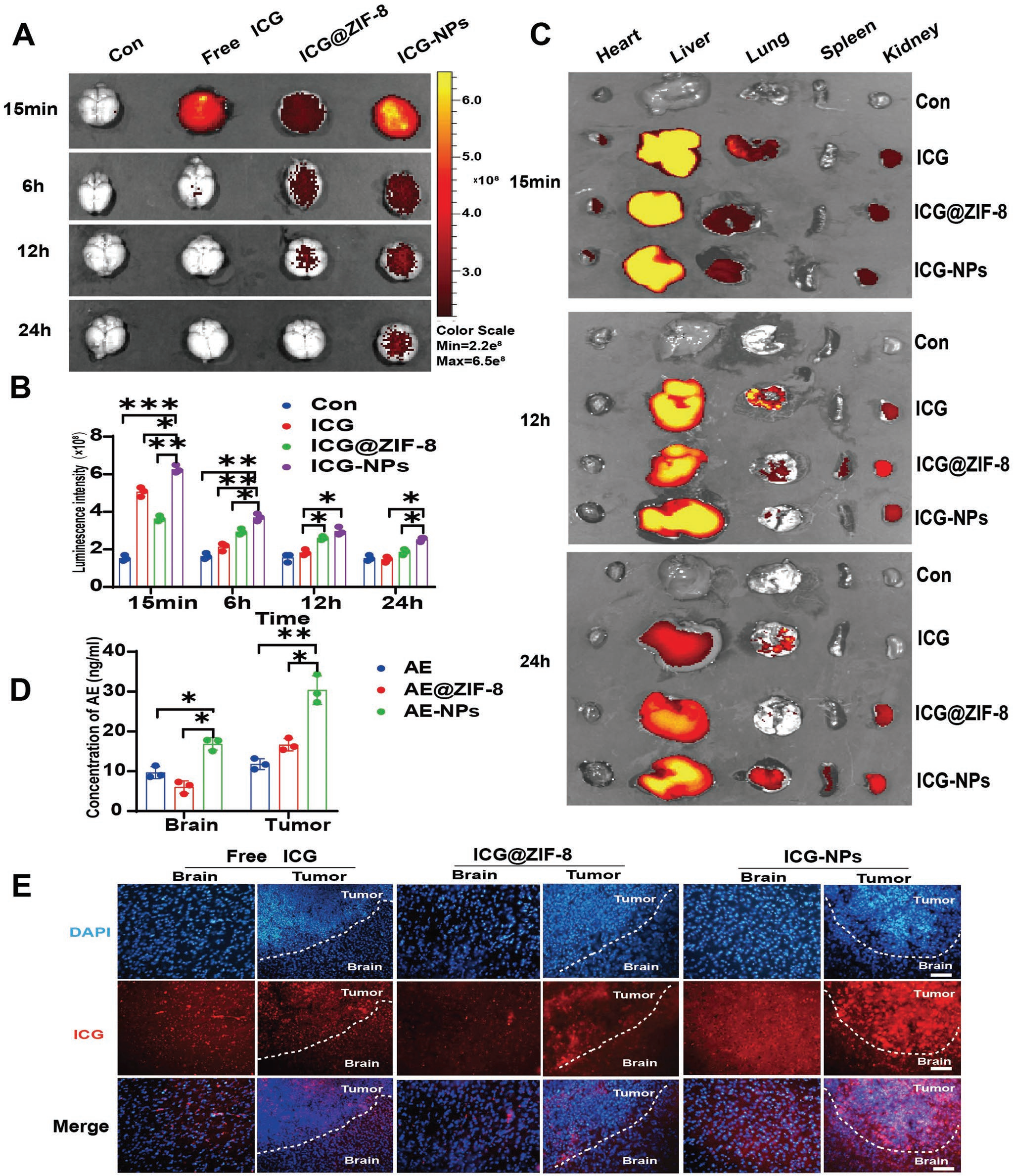
圖5 AE-NPS增加AE在體內的顱內分布和腫瘤富集
6、AE-NPs增強了AE介導的體內抗腫瘤作用
為進一步評價AE-NPs的抗腫瘤作用,作者進行GL261原位GBM小鼠模型的體內實驗。接種和成瘤后,動物隨機分為4組,每2天經尾靜脈注射1 % F127 NS、AE、Tf-PEG-PLGA聚合物包裹的ZIF-8 NPs(NPs)、AE @ ZIF-8 AE-NPs。每周測量體重、腫瘤熒光素酶表達和精神狀態(圖6A)。結果顯示,給藥1周后,對照組(Con)組、NPs組、AE組GBM的熒光持續增強,其中Con組熒光增強最為明顯。相比之下,在AE-NPs組中降低(圖6B、C)。與其他3組相比,AE-NPs對腫瘤體積和重量的降低作用更強。此外,與對照組相比,NPs還降低腫瘤體積和重量(圖6D-E),這可能歸因于ZIF-8 NPs的細胞毒性作用。盡管NPs和AE對腫瘤體積和重量的減少具有相似的效果,但AE組在組織病理學上顯示腫瘤壞死增加(圖6F)。
最后,通過HE、Ki-67染色和WB實驗明確AE-NPs作用于GBM的機制。HE染色顯示各組均有腫瘤壞死,但AE組、AE @ ZIF-8組和AE-NPs組腫瘤壞死更明顯(圖6F)。Ki-67染色是增殖的生物標志物,免疫組化結果顯示AE-NPs處理的GBM組織中Ki-67表達較低(圖6G-H),支持抑制增殖。給藥結束時,AE-NPs組的終末生存率優于其他4組(圖6I)。這些結果表明AE-NPs促進壞死,抑制GBM生長,改善預后。隨后,為進一步在分子水平上證實其抗腫瘤機制,作者通過WB檢測了不同處理的腫瘤組織中焦亡關鍵生物標志物CASP3、C-CASP3、GSDME和GSDME-N的表達水平。與其他3組相比,AE-NPs顯著增強了CASP3和GSDME的活化(圖6J-K)。同時,AE @ ZIF-8顯示出焦亡激活能力,這可能是由于AE @ ZIF-8在腫瘤組織中富集引起的。
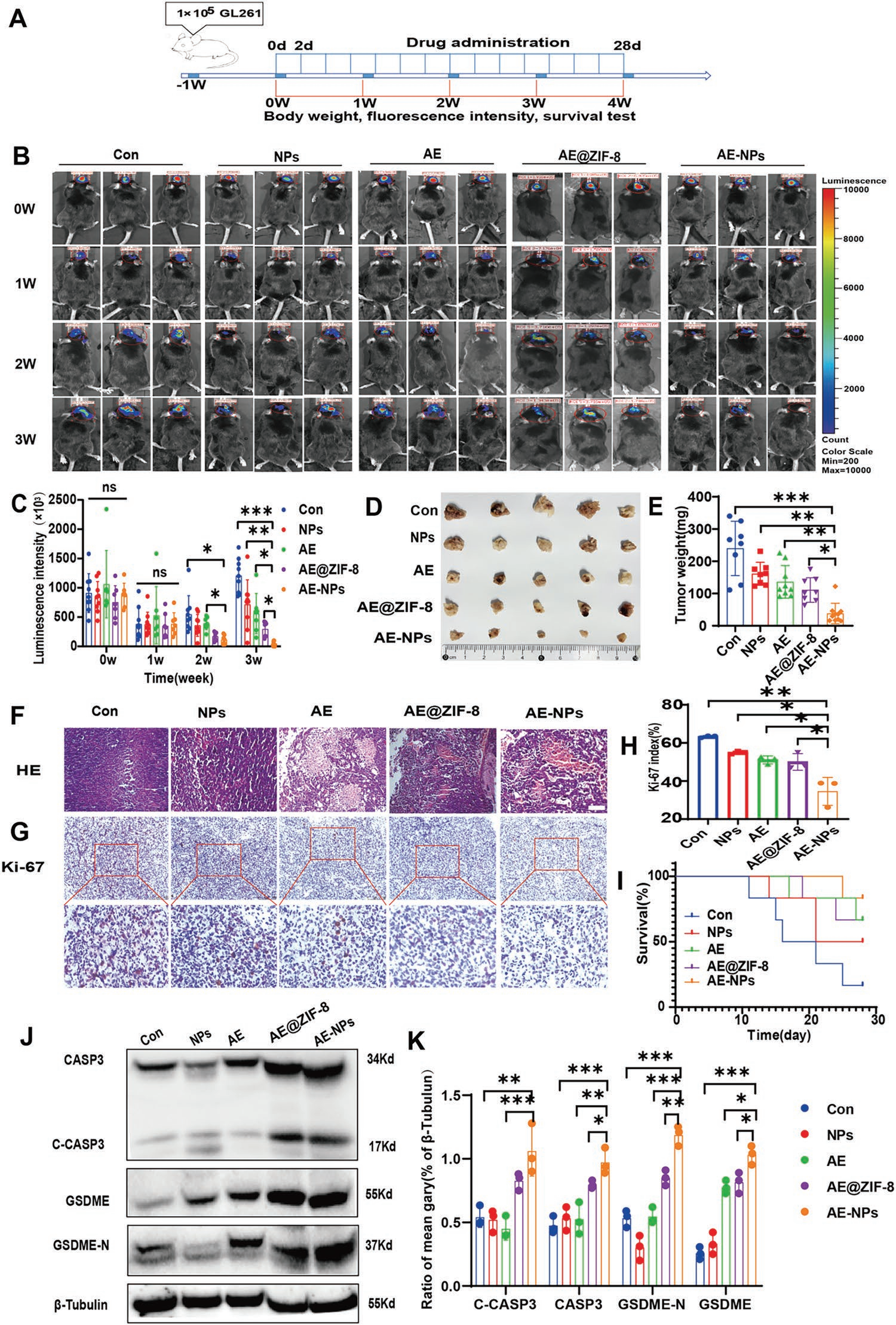
圖6 AE-NPs增強了AE介導的體內抗腫瘤作用
7、AE-NPs調控GBM免疫微環境
以上實驗證實AE-NPs在體內外均激活CASP3 / GSDME焦亡通路。作為一種免疫原性死亡模型,細胞焦亡具有激活固有免疫和適應性免疫以放大抗腫瘤效應的潛力。因此,通過流式細胞術(FCM)和免疫熒光檢測免疫細胞CD8 + T細胞、CD4+ T細胞、Treg細胞(Fox P3+)、巨噬細胞及其M1亞型(抗炎、抗腫瘤亞型, CD86+)。CD8 + T細胞是抗腫瘤免疫的關鍵免疫細胞。因此,采用流式細胞術檢測不同處理組腫瘤組織中CD8 + T細胞的浸潤水平。結果顯示,與con組相比,AE、AE @ ZIF-8和AE-NPS組CD8表達水平均有提高,尤其是AE-NPs組(CD8 + T細胞占CD3 + T細胞的比例由31 %提高到64 %)(圖7A、E)。傳統觀點認為CD8 + T細胞上表達的PD-1作為抑制性受體介導免疫耐受,但也有報道稱PD-1表達于抗原刺激后CD8 + T細胞活化的早期階段。因此,PD-1升高可能來自于CD8 + T細胞活化,即[ 34、35],但其確切作用有待進一步探討。CD4 + T細胞是重要的免疫細胞,CD4 + T細胞及其亞型Treg細胞(FoxP3 + ,介導免疫耐受)也被檢測到。FCM顯示與con組相比,AE-NPs組CD4 + T由71.45 %上升至86.18 %,Treg細胞(圖7B、E、F)無明顯差異。腫瘤相關巨噬細胞功能復雜,但M1亞型(M1Φ)浸潤有利于其發揮抗腫瘤作用。進一步,作者通過qPCR檢測抗腫瘤免疫相關細胞因子IFN-γ、HMGB1、TNF-α,結果如圖7HJ所示,與對照組相比,AE-NPs組IFN-γ、HMGB1、TNF-α mRNA表達增加6 ~ 17倍,驗證了免疫微環境的激活。

圖7 AE-NPs調控GBM免疫微環境
8、AE-NPs可減輕AE相關的肝毒性和腎毒性
與許多化療藥物類似,高濃度AE的肝毒性和腎毒性作用已被報道。同時,高濃度和未修飾的ZIF-8 NPs也有明顯的毒性反應。因此,有必要對新構建的AE-NPs進行安全性評價。因此,作者對荷瘤小鼠進行了體內CCK-8、體重、血液生化和組織病理學檢測。盡管空白納米粒在體內(圖6B、E、F)有明顯的GBM抑制作用,但低劑量的Zn(NO3)2、2 -甲基咪唑、ZIF-8、Tf-PEG-PLGA和空白納米粒在體外均未表現出明顯的細胞毒性(圖8A)。血液生化分析顯示,AE、AE @ ZIF-8和NPs處理組的肝損傷標志物谷丙轉氨酶(ALT)、谷草轉氨酶(AST)(圖8B、C)和腎損傷標志物BUN升高(圖8E),而γ-GT和CRE無變化(圖8D、F)。令人驚訝的是,在AE-NPs處理的小鼠中,ALT、AST和BUN沒有明顯變化。此外,通過HE染色的組織病理學顯示,AE處理組的肝臟中檢測到局灶性壞死,而NPs和AE-NPs處理組沒有檢測到(圖8G)。這些結果表明AE和NPs引起的肝腎損傷均被AE-NPs顯著減輕。這可能是腫瘤靶向性增強的結果,降低了藥物相關的脫靶毒性和副作用。4周內,對照組和NPs組小鼠體重下降,AE @ ZIF-8和AE-NPs組小鼠體重下降不明顯。NPs組ALT輕度升高,AST、γ-GT、Cr、BUN無統計學差異。

圖8 AE-NPs可減輕AE相關的肝毒性和腎毒性
實驗方法:
體外釋放和PH響應分析,C57BL/6J小鼠,CCK-8, LDH Release Assay,qPCR,Body Distribution,生信分析(Swiss Target Prediction數據庫查詢AE靶點及相關靶基因,UniPort蛋白標準化數據庫,AE-GBM靶蛋白-蛋白相互作用(PPI)的網絡構建),血液生化檢查,HE染色,免疫組織化學,流式細胞術.
參考文獻
Fang X, Chen Z, Zhou W, Li T, Wang M, Gao Y, Ma S, Feng Y, Du S, Lan P, Chen H, Wei J, Zhang S, Li Z, Liu X, Zhang H, Guo X, Luo J. Boosting Glioblastoma Therapy with Targeted Pyroptosis Induction. Small. 2023 Apr 17:e2207604. doi: 10.1002/smll.202207604. Epub ahead of print. PMID: 37066699.






