細胞外囊泡中的miR-126-5p和miR-212-3p在輻射誘導的血管炎癥早期激活單核細胞參與動脈粥樣硬化
實驗方法:細胞培養,Western blotting,巨噬細胞浸潤測量,RNA提取,qRT-PCR,Small RNA-sequencing,生信分析,GO和KEGG分析,雙熒光素酶分析
在癌癥治療和核事故中暴露于輻射的人在長期存活者中心血管結果的風險增加。細胞外囊泡(EVs)參與輻射誘導的內皮功能障礙,但其在輻射后血管炎癥早期階段的作用尚不完全清楚。在這里,作者證明了含有miRNAs的內皮細胞來源的EVs在輻射誘導的血管炎癥中啟動單核細胞活化。體外共培養和體內實驗數據表明,內皮EVs可以敏感地通過輻射暴露以劑量依賴的方式增加,并刺激單細胞釋放單核EVs和粘附到內皮細胞,同時增加編碼細胞-細胞相互作用的特異性配體的基因的表達。小RNA測序和使用模擬物和抑制劑轉染解釋了富集在內皮EVs中的miR-126-5p和miR-212-3p在輻射暴露后通過單核細胞激活啟動血管炎癥。此外,在輻射誘導的動脈粥樣硬化模型小鼠循環內皮EVs中可以檢測到miR-126-5p,并且發現其與血漿致動脈粥樣硬化指數密切相關。綜上所述,作者的研究表明,在輻射誘導的血管損傷中,內皮EVs中存在的miR-126-5p和miR-212-3p介導炎癥信號激活單核細胞。更好地了解循環內皮EVs含量可以促進其作為輻射暴露后動脈粥樣硬化的診斷和預后生物標志物。研究于2023年3月發表于期刊《J Extracell Vesicles》上,IF:17.337。
技術路線:

主要研究結果:
1、循環血漿EVs的數量隨著暴露劑量的增加而增加
為研究輻射暴露對血漿EVs的影響,作者測定0、0.1和1 Gy全身照射實驗小鼠血漿中EVs的生成量。首先,根據2018年國際細胞外囊泡學會提出的《細胞外囊泡研究的最小信息》指南對分離的EV進行鑒定。通過納米顆粒跟蹤分析(NTA)和透射電鏡(TEM)測得的大多數EVs的粒徑小于200 nm,并通過western blot分析驗證這些EVs的質量和純度(圖1a-c)。流式細胞術檢測到受照小鼠血漿EVs數量增加(圖1d),ImageStreamX分析直觀地證實了血漿EVs的熒光事件(圖1e)。兩種分析方法均用于增加結果的穩健性。接下來,作者擴大照射劑量范圍,考察0、0.1、0.5、1和5 Gy不同劑量輻射的EVs響應(圖1f)。循環內皮EVs水平在暴露后敏感地增加,并呈劑量依賴性,即使在低劑量(0.1 Gy)下也是如此。有趣的是,內皮細胞來源的EVs,如特異性標志物CD105+、CD31+/CD42-和146+的存在,以劑量依賴的方式顯著升高。其他細胞來源的EVs,標記為CD11b +(單核細胞),CD41 +(血小板)和CD45 +(白細胞),也顯著增加。損傷的血管結構進一步通過照射小鼠腸道組織中單核細胞系細胞浸潤增加得到驗證(圖2c),這對應于中性粒細胞和巨噬細胞向小腸固有層的遷移(圖2d)。
為探究輻射暴露對人體血漿EVs的影響,對6名健康獻血者的血液樣本也進行了不同劑量的輻射(0.1 ~ 5 Gy)。在淋巴細胞中,雙著絲粒染色體和γ H2AX焦點的數量,即已知的輻射誘導損傷的基因組標記,在照射后以劑量依賴的方式增加。通過統計輻射特異的雙著絲粒染色體數目,計算得到的輻射實際劑量與估算劑量具有很好的相關性(圖2a)。輻射暴露增加γ H2AX指示的DNA損傷灶數目。在輻射劑量大于0.5 Gy的淋巴細胞中觀察到兩個以上的灶(圖2b)。在線性回歸模型中,以CD31+/CD42-,CD105 +,CD146 +和CD144 +標記的人血漿EVs和內皮EVs水平隨著輻射劑量的增加而增加,在受輻射的小鼠血液樣本中觀察到(圖2c)。除白細胞來源的EVs(CD45 +)外,單核細胞(CD14 + , HLA-DR +)和血小板來源的EVs(CD41 +)也顯著增加。與在小鼠中觀察到的結果類似,輻射劑量與人類EVs產量呈正相關(表1)。總的來說,這些數據表明,輻射引起基因組和細胞損傷后,EVs從人和小鼠的血細胞中敏感地分泌。
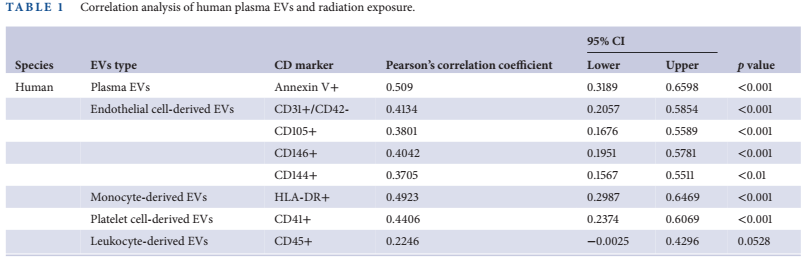

圖1 循環血漿EVs的數量隨著暴露劑量的增加而增加

圖2 在人體血液樣本中,細胞外囊泡( EVs )是由不同類型的細胞響應輻射照射而釋放的
2、在共培養體系中,內皮細胞和單核細胞在輻射暴露后的不同時間點產生EVs
作者利用含有內皮細胞(Huvecs)和單核細胞(Thp-1Cells)的共培養體系來探討輻射誘導的細胞通訊在血管結構中的作用。作者首先檢測了輻射暴露后共培養培養基中的EV水平。內皮EVs(CD105和CD31陽性)在輻射暴露(暴露后4 h)后的早期時間點顯著增加,并在24和48 h消失(圖3a)。單核EVs(CD11b、HLA-DR陽性)的增加在暴露后24 h才被檢測到(圖3b)。這些數據表明,內皮細胞和單核細胞可以通過增加EVs的產生來應對輻射暴露,細胞特異性EVs在照射后的不同時間點達到峰值。單核細胞粘附是炎癥反應的初始步驟,在輻射暴露后24 h,單核細胞粘附被激活(圖3c),單核細胞粘附分子LFA1和Mac1表達升高(圖3d)。相應地,在輻射后24和48 h,內皮細胞黏附分子ICAM-1和ICAM-2的表達也增加(圖3e)。兩種細胞均表現出伴隨EVs產生的多種細胞因子表達增加。具體來說,HUVECs中TNF-α、干擾素(INF)-γ和白細胞介素(IL)-在4 h高表達,但在24 h消失,這與內皮EVs的產生平行(圖3f)。在THP-1細胞中,這些細胞因子在輻射暴露后24 h表達增加,即觀察到粘附活性增強的時間點(圖3g)。這些數據表明,在作者的血管共培養體系中,輻射首先誘導內皮細胞產生促炎信號,導致單核EVs的產生和單核細胞的激活,隨后發生一系列復雜的細胞因子反應。
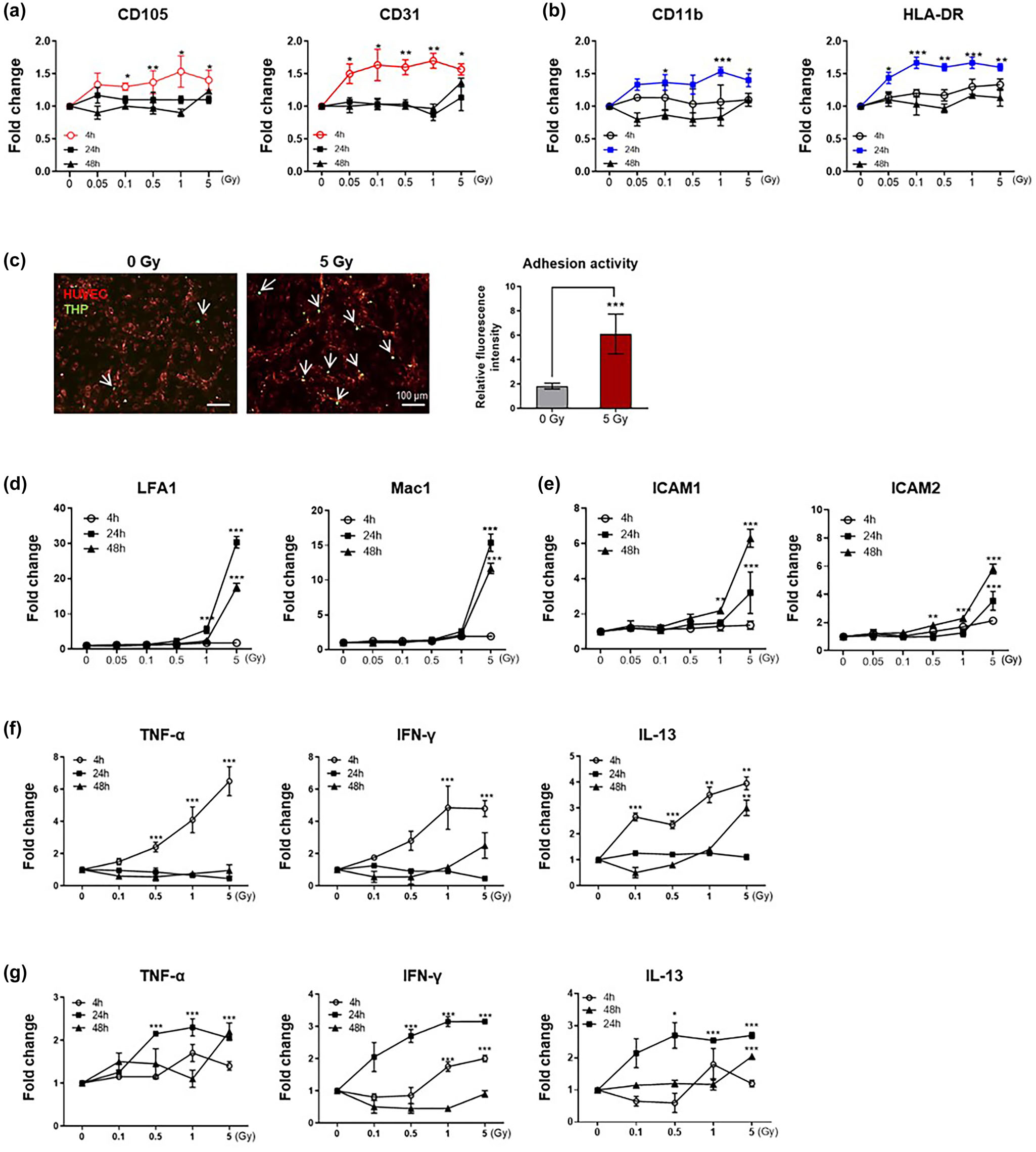
圖3 內皮細胞和單核細胞EVs在輻射暴露后的不同時間點釋放
3、輻射誘導的內皮EVs可促進單核細胞活化,且不依賴于輻射暴露
為檢測輻射后產生的內皮EVs是否可以直接誘導單核細胞活化,在輻射后4 h,用HUVEC-THP-1共培養上清中分離的EVs處理未經輻射的THP-1細胞。輻射暴露顯著增加內皮細胞EVs的數量,但并沒有增加培養液中單核細胞EVs的數量(圖4a)。EVs攝取實驗顯示HUVECs來源的EVs很容易被未照射的THP-1細胞攝取(圖4b)。與內皮細胞EVs共孵育24 h后,觀察受體單核細胞中EVs的產生(圖4c)。相反,當THP-1細胞與EVs耗竭的條件培養基孵育時,單核細胞來源的EVs沒有增加。令人驚訝的是,作者觀察到THP-1細胞經輻射誘導的內皮EVs處理后,其表面粘附分子表達增加,與直接輻射暴露后觀察到的水平相當(圖4d)。值得注意的是,隨著內皮EVs濃度的增加,THP-1細胞表面黏附分子的表達顯著增加(圖4e)。這一發現與輻射誘導的內皮EVs處理的單核細胞表面標志基因表達升高相互印證(圖4f)。總之,這些數據表明輻射誘導的內皮EVs可以直接刺激單核細胞的粘附活性,即使在沒有輻射暴露的情況下。
圖4 來自輻照共培養的內皮EVs在體外誘導非輻照單核細胞的活化
4、輻射誘導的內皮EVs可以在非輻射小鼠中啟動免疫反應
為研究輻射誘導的內皮EVs在小鼠體內的潛在作用,將輻射后24 h的小鼠血漿EVs通過尾靜脈注射到非輻射小鼠體內(圖5a)。與單核細胞EVs相比,內皮細胞EVs在輻射暴露后顯著增加(圖5b-c)。接受輻射誘導的EVs的小鼠在外周血和脾臟中顯示髓系細胞的增加,但在骨髓中沒有,包括中性粒細胞(CD45 + / CD11b + / Ly6G +)和巨噬細胞(CD45 + / CD11b + / F4 / 80 +),已知的急性炎癥免疫細胞(圖5d)。值得注意的是,在血液和脾臟中也檢測到白細胞粘附分子如LFA1和Mac1的表達增加,但在骨髓中沒有檢測到(圖5e)。利用細胞因子芯片,作者發現一些內皮功能障礙相關標志物,包括胱抑素C(CST3),CD105,幾丁質酶3樣蛋白1(CHI3L1)和絲氨酸蛋白酶抑制劑F1(SERPINF1),在輻射誘導的EVs處理的動物淋巴細胞中高表達(圖5f)。此外,中性粒細胞標志物(C1qR1和MPO)和中性粒細胞募集趨化因子(MMP9和CXCL5)的表達在輻射誘導的EVs處理后增加。總的來說,這些結果表明,從受照小鼠體內轉移EVs可以通過急性炎癥細胞的擴增,系統性地啟動受體小鼠的免疫激活。

圖5 輻照小鼠血漿EVs誘導非輻照小鼠產生免疫應答
5、內皮EVs中的miR-126和miR-212傳遞給對輻射暴露有反應的單核細胞
以往的研究表明,EVs中的miRNA能夠在細胞間傳遞炎癥信號。miRNA能夠靶向多個與多種疾病相關的關鍵調控基因。為分析miRNAs,在1Gy照射后從小鼠血漿中分離出內皮EVs,并進行小RNA測序。利用85個在輻射和對照樣品中差異表達的miRNAs(倍數變化閾值為1.5)構建Aheatmap(圖6a)。使用DIANA-mirPath軟件對這些差異表達的miRNA進行通路分析,并使用R編程語言中的DESeq2包測量統計學意義。在顯著變化的29個miRNA(p < 0.05)中,通過對輻射響應相關miRNA的文獻調研,篩選出10個候選miRNA(圖6b和表2)。qRT-PCR驗證候選miRNAs在輻射后4 h共培養的HUVECs和內皮EVs,以及轉移后24 h內皮EVs處理的THP-1細胞中的表達模式。在10個miRNAs中,有6個miRNAs在輻射后內皮EVs中的表達模式發生了顯著變化(圖6c)。其中,miR-126-5p和miR-212-3p在輻射后的HUVECs和內皮EVs以及內皮EVs處理的THP-1細胞中表達顯著增加(圖6d-e)。電離輻射后,少數miRNAs如miR-10a-5p、miR-29b-3p、miR-142-5p和miR-146b-5p在內皮EVs中表達降低,但在HUVECs和THP-1細胞中的表達模式不一致。這些結果表明,當血管細胞受到輻射時,miR-126-5p和miR-212-3p可以通過EVs從內皮細胞傳遞到單核細胞。
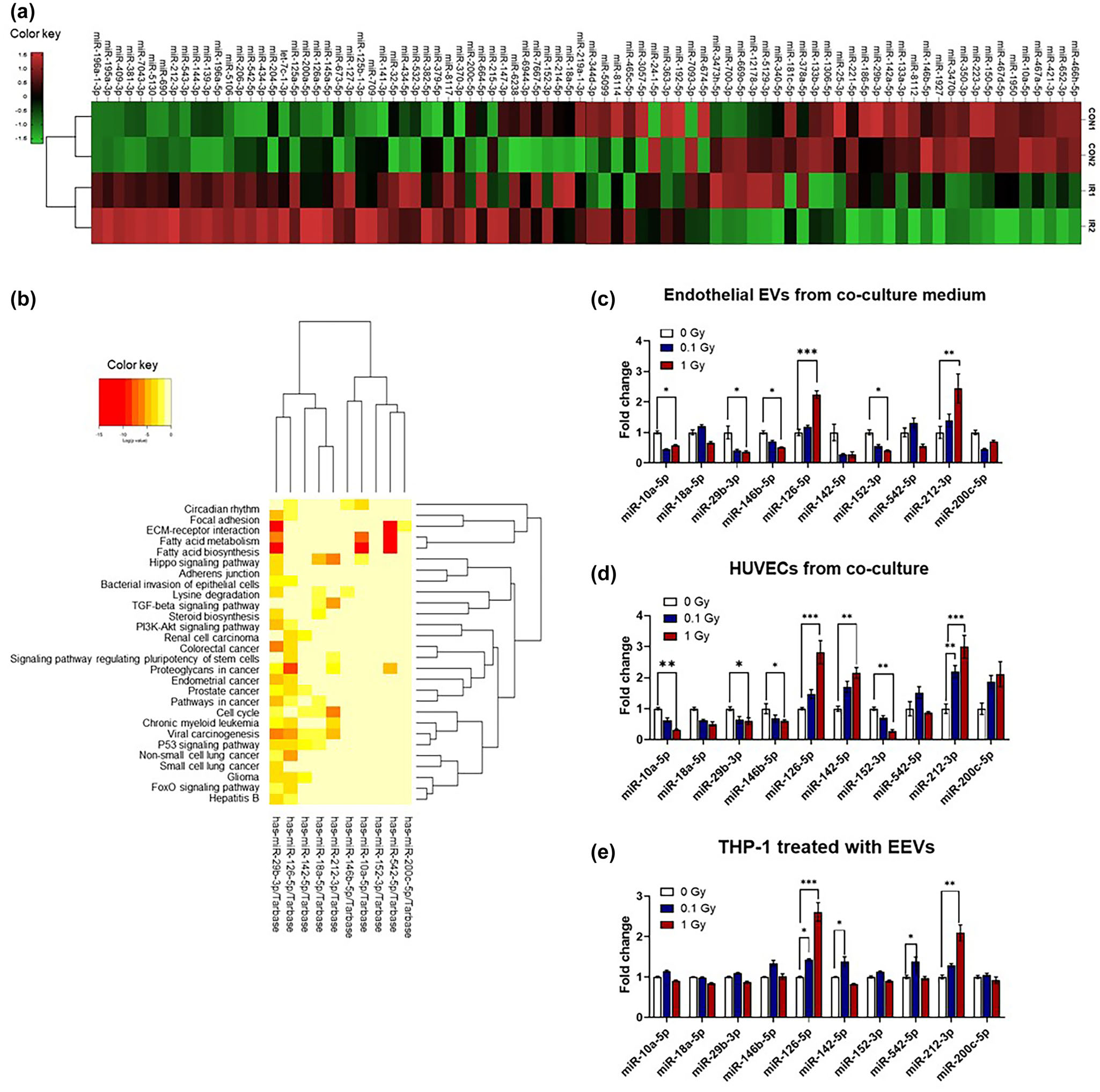
圖6 EVs在血液中響應輻射暴露而釋放
6、miR-126和miR-212促進單核細胞粘附以應對輻射暴露
為證明內皮EVs可以將輻射誘導的損傷信號從內皮細胞傳遞到炎癥細胞,作者使用模擬物和抑制劑來研究miR-126-5p和miR-212-3p的功能。抑制劑處理降低了與THP-1細胞共培養24 h后HUVECs中靶miRNA的表達(圖7a)。此外,HUVECs轉染miR-126-5p和miR-212-3p抑制劑后,共培養的THP-1細胞在輻射后24 h黏附分子的表達降低(圖7b),這與作者之前在THP-1細胞上的實驗結果相反,如圖4d所示。未經輻射照射的共培養THP-1細胞中細胞黏附分子的表達無變化。此外,使用miR-126-5p或miR-212-3p mimic轉染可增強未照射的THP-1細胞表面黏附分子的表達(圖7d)。miR-126-5p和miR-212-3p模擬物轉染THP-1細胞后,即使沒有輻射照射,細胞表面粘附分子的表達也增加,與輻射后的THP-1細胞相似。作者使用雙熒光素酶報告基因實驗證實了這兩個miRNA的直接和特異性調控。熒光素酶報告載體含有與miR-126-5p或miR-212-3p靶基因的結合序列相匹配的序列,可能為antago-miRNA。mi RNAs模擬物轉染THP-1細胞后,與其配對的靶位點熒光素酶活性明顯降低(圖7e)。此外,通過與每個miRNA特異的antago-miRNA構建的熒光素酶報告載體,轉染miR-126-5p或miR-212-3p的模擬物后,粘附分子的表達顯著降低(圖7f)。總之,這些數據表明miR-126-5p和miR-212-3p均介導了輻射后單核細胞通過騎乘內皮細胞的EVs而發揮粘附活性所需的刺激信號。
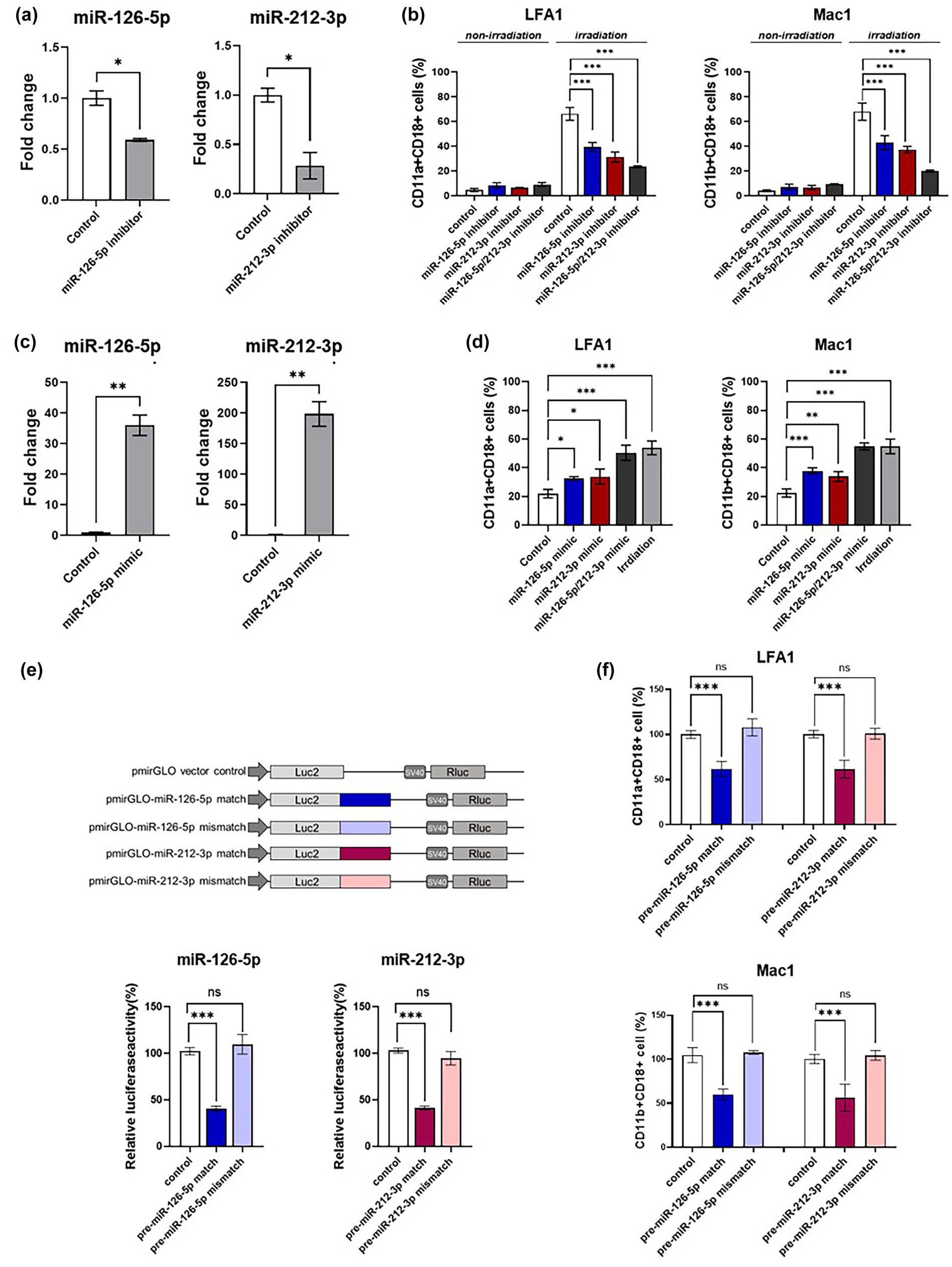
圖7 miR-126-5p和miR-212-3p介導內皮細胞到單核細胞的輻射誘導損傷信號
7、miR-126和miR-212促進THP-1源性巨噬細胞泡沫化
接下來作者研究了miR-126-5p和miR-212-3p對泡沫細胞形成的影響。在與內皮細胞粘附后,循環單核細胞進入內膜區域并分化為巨噬細胞。這些巨噬細胞可以攝取ox-LDL顆粒并在炎癥過程中轉化為泡沫細胞。用miRNA mimics處理THP-1細胞后,PMA誘導的巨噬細胞分化顯著增加(圖8a)。此外,ox-LDL處理THP-1源性巨噬細胞導致細胞內脂滴增多,細胞呈現泡沫細胞形態。用miRNA模擬物處理THP-1細胞后,泡沫細胞中的脂質積累也增加(圖8b-c)。此外,miRNA mimics處理細胞后,細胞內總膽固醇和膽固醇酯的水平也增加(圖8d-e)。與miR-126-5p mimic相比,miR-212-3p mimic處理后巨噬細胞分化和泡沫細胞形成略有增強,但差異無統計學意義。這些結果表明,miR-126-5p和miR-212-3p可以促進單核細胞分化和泡沫細胞形成,而這被認為是與動脈粥樣硬化等慢性炎癥性疾病相關的主要病理特征。
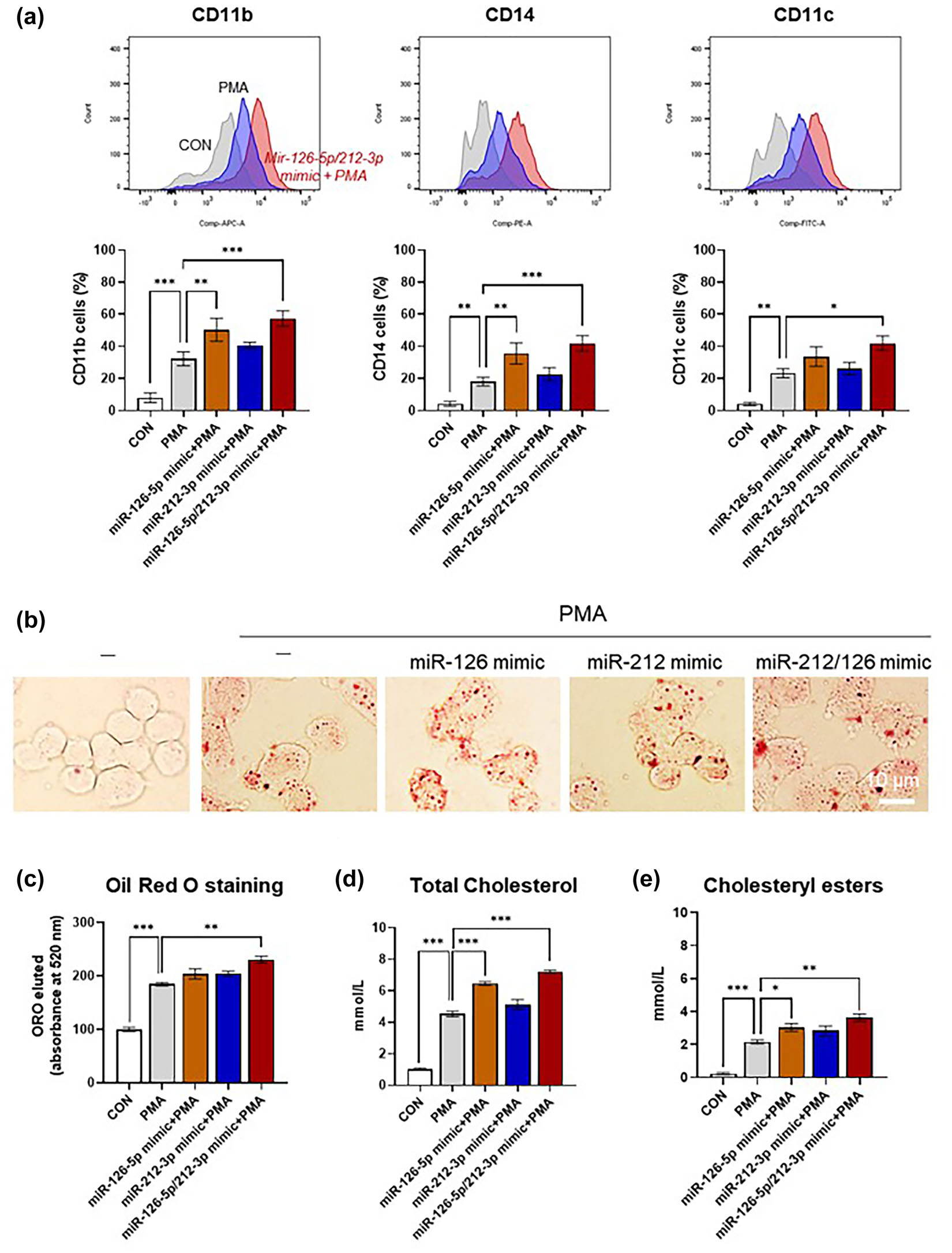
圖8 MiR-126-5p和miR-212-3p促進巨噬細胞分化和ox-LDL攝取
8、輻射誘導的動脈粥樣硬化Ldlr-/-小鼠血漿EVs及其貨物miR-126-5p水平升高
在證實內皮細胞來源的EVs可促進輻射后單核細胞黏附導致炎癥的基礎上,作者接下來評估在具有代表性的輻射誘導炎癥性疾病模型--輻射誘導動脈粥樣硬化小鼠中是否可以檢測到類似的EVs。通過評估輻射暴露Ldlr-/-小鼠主動脈根部脂質斑塊的形成,驗證了輻射誘導的動脈粥樣硬化的成功發展(圖9a)。通過測量輻照小鼠的血脂水平,包括總膽固醇、總甘油三酯和高密度膽固醇來評估冠心病的致動脈粥樣硬化風險指數(圖9b)。輻射后Ldlr-/-小鼠血漿EVs數量與輻射后動脈粥樣硬化發生風險成正比(圖9c)。值得注意的是,作者發現在輻射誘導的動脈粥樣硬化模型小鼠血漿EVs中,miR-126-5p的水平顯著升高,而miR-212-3p的水平沒有顯著變化。此外,Pearson ' s相關分析顯示斑塊形成、EVs分泌和EVs中miR-126-5p表達與放射性動脈粥樣硬化臨床風險指標相關(圖9f-h)。總之,這些數據表明EVs中存在的miR-126-5p可以介導動脈粥樣硬化發展過程中輻射誘導的炎癥信號。此外,血漿EVs及其貨物miR-126-5p可用于評估輻射后較長時間內動脈粥樣硬化發生的風險。
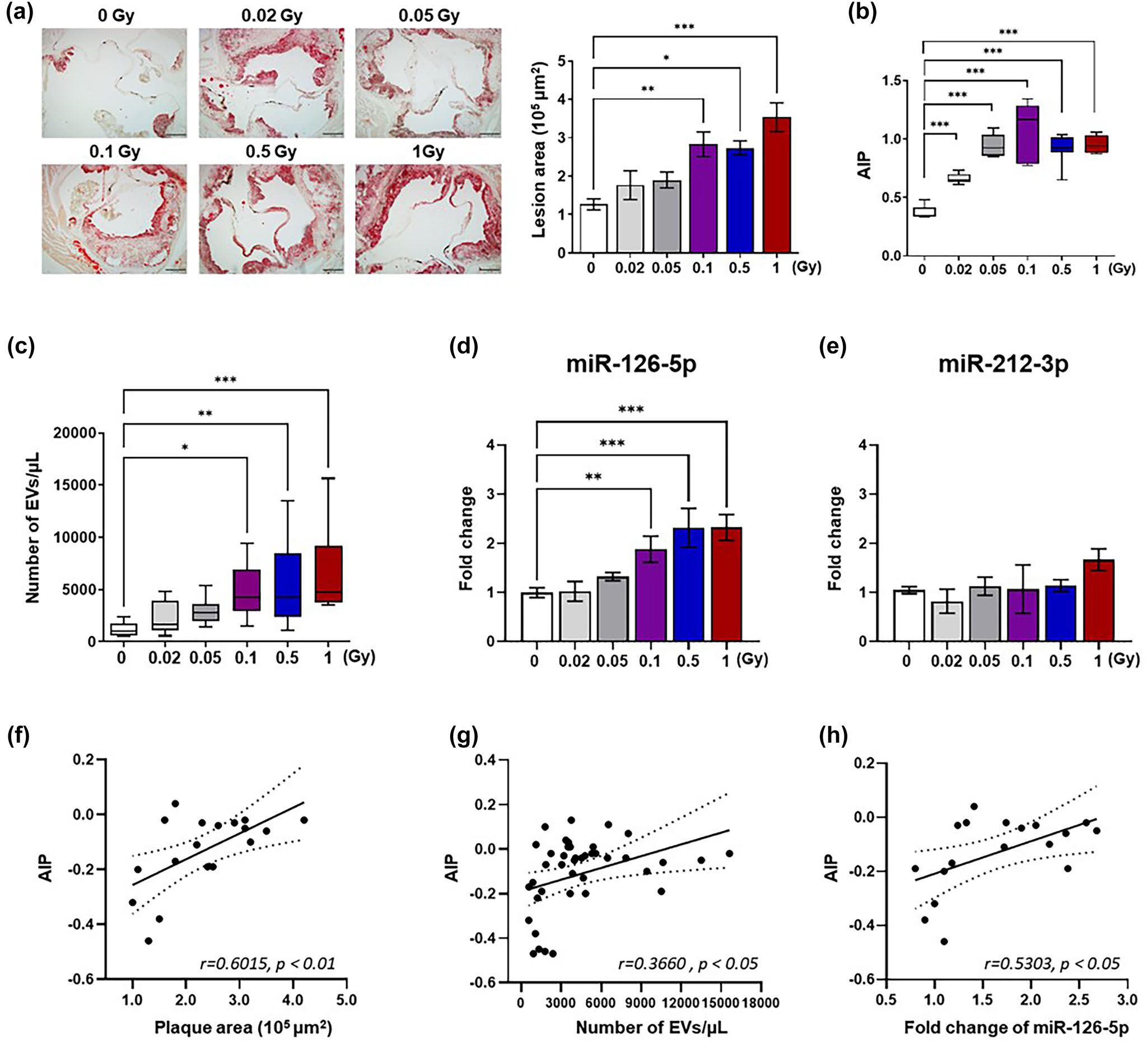
圖9 輻射誘導的動脈粥樣硬化Ldl -/-小鼠血漿內皮細胞及其載貨量增加

圖10 機制圖
參考文獻
Choi, Y. Y., Kim, A., Lee, Y., Lee, Y. H., Park, M., Shin, E., Park, S., Youn, B., & Seong, K. M.(2023). The miR-126-5p and miR-212-3p in the extracellular vesicles activate monocytes in the early stage of radiation-induced vascular inflammation implicated in atherosclerosis. Journal of Extracellular Vesicles, 12, e12325. https://doi.org/10.1002/jev2.12325






