胱胱硫氨酸-裂解酶(Cth)通過ERK1/2誘導巨噬細胞的胞葬作用,調節腸屏障修復
腸缺血再灌注損傷(I/R)引起的炎癥反應與危重患者的感染性并發癥和死亡率密切相關,及時有效清除凋亡細胞是降低炎癥反應的重要組成部分。近日有研究發現胱胱硫氨酸-裂解酶(Cth)可激活ERK1/2信號通路,誘導巨噬細胞的胞葬作用,從而促進腸屏障修復。該研究發表在《Cell Communication and Signaling》,IF:7.525。
技術路線:

主要研究結果:
1. I/R條件下的胞葬發生并在體外和體內產生抗炎修復表型
為了闡明吞噬作用對抗炎修復表型的必要性,我們設計了巨噬細胞和凋亡內皮細胞共培養的體外實驗。在實驗組中,我們分別在缺血和缺氧環境下使用原代培養的小鼠骨髓源巨噬細胞和THP -1細胞誘導的人源巨噬細胞與凋亡的IEC-6和Caco-2細胞系共培養(圖1)。為了確定非特異性巨噬細胞吞噬是否具有相同的效果,我們用羥化珠培養巨噬細胞作為對照。在與凋亡的IEC-6細胞共培養的小鼠源性巨噬細胞和與凋亡的Caco-2細胞共培養的人源性巨噬細胞中,吞噬細胞對凋亡細胞的吞噬能力強于羥酸珠(圖1A)。此外,我們發現,在與凋亡的IAC -6細胞共培養的鼠源性巨噬細胞組和與凋亡的Caco-2細胞共培養的人源性巨噬細胞組中,修復標志物血紅氧合酶-1 (Hmox1)和dectin-1 (Clec7a),特異性促炎癥消退介質(SPMs) RvD1、RvE1和LipoxinA4和抗炎因子IL-10均高于巨噬細胞和羥基化珠共培養組(圖1B-D),而促炎因子CD86和TNF-α低于巨噬細胞和羥化珠共培養組(圖1D)。這些結果表明,胞葬對于產生抗炎和修復表型是必需的。
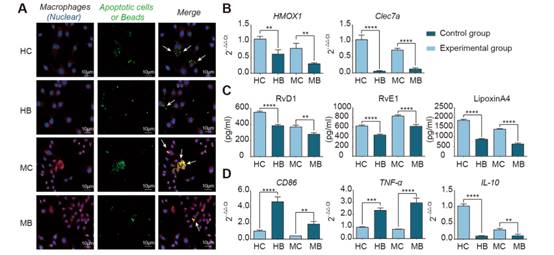
圖1在體外,吞噬凋亡的內皮細胞可以誘導巨噬細胞的修復表型
在體動物模型中,I/R后腸內是否發生胞葬尚不清楚;因此,我們使用了體內腸胞葬檢測技術(圖2A)。我們發現,I/R后巨噬細胞對死亡細胞的吞噬作用逐漸增強(圖2C),胞葬指數逐漸升高(圖2B),隨著I/R后恢復時間的延長,泡騰標志物AXL、CD36和UCP2逐漸升高(圖2D)。這些結果提示,胞葬表型不僅存在于腸道內,而且隨著損傷修復時間的延長,胞葬表型逐漸增加。接下來,我們進一步研究了胞葬促進I/R腸屏障修復的機制。
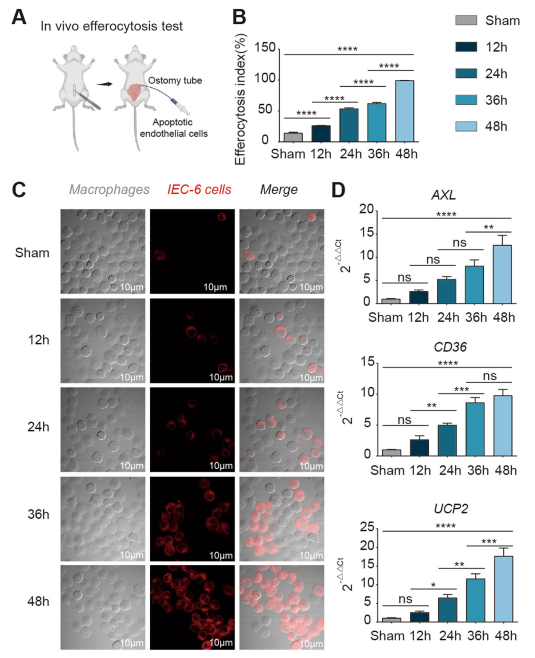
圖2在體內,受損腸管內存在胞葬現象,胞葬水平隨I/R時間延長逐漸升高
I/R誘導的胞葬后,大量基因表達發生改變。為了更好地理解I/R后巨噬細胞的遺傳改變,我們在通過流式細胞術選擇巨噬細胞后的動物模型中進行了轉錄組測序分析(圖3)。主成分分析(PCA)顯示,I/R術后12 h組與24 h、36 h和48 h組的樣本分層良好(圖3A)。然后,我們使用熱圖可視化54個基因在I/R后12 h和24 h的表達變化(圖3B),包括28個隨著I/R時間延長而下調的基因,這些基因主要與細胞周期、細胞增殖標志物Mki67和驅動蛋白家族分子Kif20a、Kif2c和Kif11相關。隨著I/R時間延長,表達上調的基因有26個,這些基因中的許多可以發揮保護作用。因此,我們重點研究了這些隨著I/R時間延長而上調的基因。
為了確定可以驅動巨噬細胞胞葬的差異表達基因(DEGs),比較了I/R后12 h和36 h,以及I/R后12 h和48 h的基因表達,與熱圖分析一樣,我們在兩組比較后發現了許多DEGs(圖3C)。更重要的是,巨噬細胞活化的關鍵增強因子的Cth表達在I/R手術后顯著上調。結合PCA結果和熱圖分析,這些結果提示Cth可能是驅動I/R后巨噬細胞胞葬的關鍵基因。為了驗證這些結果,我們使用PCR和western blotting檢測了24 h后I/R組、48 h后I/R組和假手術組的Cth表達,發現與假手術組相比,后I/R組的基因和蛋白表達有顯著差異,并且隨著I/R時間的增加而增加(圖3D)。這一發現與我們的轉錄組分析結果一致。因此,我們假設Cth可以改變巨噬細胞表型,支持胞葬,在腸屏障損傷修復中具有重要作用。
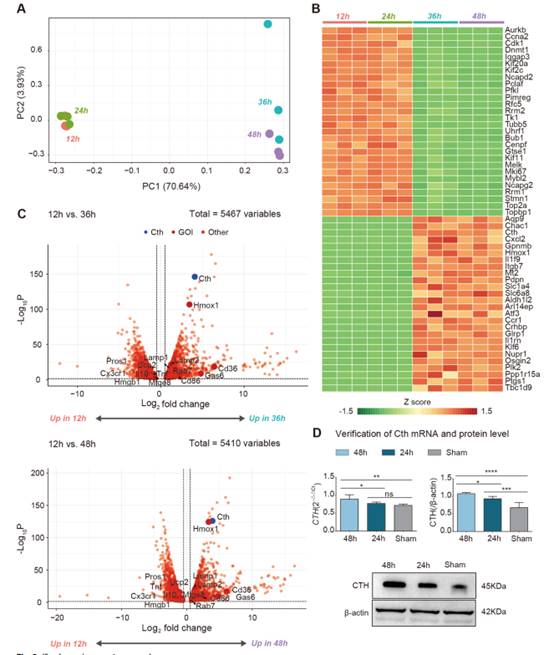
圖3轉錄組測序分析發現,Cth是I/R后胞葬和消退階段的潛在介質之一
2. Cth通過ERK1/2途徑調控腸道炎癥和腸屏障損傷恢復
當小鼠經歷I/R損傷時,腸屏障損傷的功能指標(I-FABP和d -乳酸)較假手術組顯著升高,而當I/R小鼠腹腔注射Cth激動劑MCH時,有下降趨勢;相反,當給予小鼠腹腔注射Cth抑制劑PAG時,I-FABP和d -乳酸升高(圖4A)。同樣,與假手術組相比,Cth激動劑MCH抑制了I/R損傷后促炎標志物IL-6和TNF-α的增加,而Cth抑制劑PAG減緩了這一趨勢。此外,通過IL-10和發揮保護修復作用的RvD1、RvE1、LipoxinA4的變化,也可以驗證Cth影響抗炎因子和修復腸道表型(圖4A)。此外,我們觀察了小鼠腸黏膜的形態學變化,發現I/R后腸黏膜絨毛排列紊亂,中間有團塊狀絨毛,損傷較假手術組嚴重。當給予Cth抑制劑PAG時,絨毛排列更加紊亂,而給予Cth激動劑MCH時,絨毛排列略微規則(圖4B)。這些結果表明,Cth的變化影響腸道的抗炎和腸屏障損傷修復表型。
在I/R模型組給予Cth抑制劑PAG和ERK激動劑PMA腹腔注射后,d -乳酸和I-FABP以及IL-6和TNF-α的升高被逆轉,而抗炎因子IL-10和SPMs 的降低被顯著升高。在I/R模型小鼠腹腔內給予Cth激動劑MCH和ERK抑制劑PD98059后,趨勢相反(圖4A)。同樣,腸黏膜的形態學變化也呈現出類似的趨勢(圖4B)。
這些處理對細胞沒有影響(圖7A),但當共培養體系中過表達Cth的巨噬細胞用PD98059處理時,促炎因子IL-10和SPMs被抑制,而加入PMA后,Cth沉默細胞中IL-10和RvD1、RvE1、LipoxinA4的表達升高(圖7B,C)。這些結果表明,Cth調節腸道炎癥,腸屏障損傷修復依賴于ERK1/2通路。
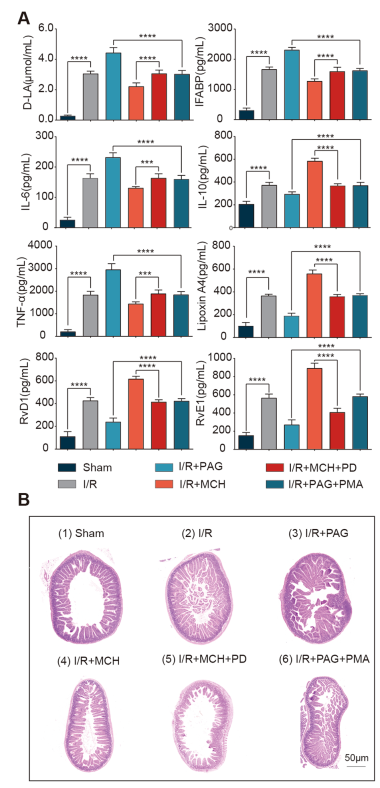
圖4體內Cth變化影響腸屏障修復,其機制依賴于ERK1/2通路
3. Cth依賴的ERK1/2通路調節巨噬細胞,導致胞葬增強
為了闡明Cth調節胞葬的潛在機制,我們首先在活鼠模型中檢測了Cth對ERK1/2通路和胞葬的影響。當給予Cth抑制劑PAG對I/R模型進行干預時,PCR結果顯示,與對照組相比,Cth在基因水平上被顯著抑制,但對ERK1/2無影響,胞葬的生物標志物(Axl、CD36、UCP2)也被顯著抑制(圖5B)。在蛋白水平上,當給予Cth抑制劑時,Cth和胞葬的生物標志物被顯著抑制,但只有ERK1/2磷酸化被抑制(圖5C, D)。腹腔注射PAG和再次給予PMA后,Cth和胞葬的生物標志物的下降在基因和蛋白水平上被逆轉,ERK1/2唯一的變化發生在磷酸化水平(圖5B-D)。為了進一步探討Cth、ERK1/2與巨噬細胞的關系,我們采用熒光原位雜交(FISH)三標記共定位分析,其中Cth被染成綠色,ERK1/2被染成青色,巨噬細胞被染成紅色。很明顯,在給予Cth抑制劑PAG后,綠色(Cth)被顯著抑制,青色(ERK1/2)和紅色(功能性巨噬細胞)也被抑制,而當給予ERK1/2激動劑PMA時,這些因子被顯著增強(圖5A)。
此外,當給予I/R模型小鼠MCH時,與對照組相比,Cth和胞葬的生物標志物的基因和蛋白表達均顯著升高。同樣,只有p-ERK1/2表達顯著增加。在已腹腔注射MCH的I/R模型小鼠中,給予PD98059后,Cth、p-ERK、Axl、CD36和UCP2最初的上升趨勢被逆轉為下降趨勢(圖5B-D)。同樣,FISH結果一致(圖5A)。在活體小鼠模型中,這些結果表明,Cth調節的巨噬細胞胞葬表型依賴于ERK1/2通路。
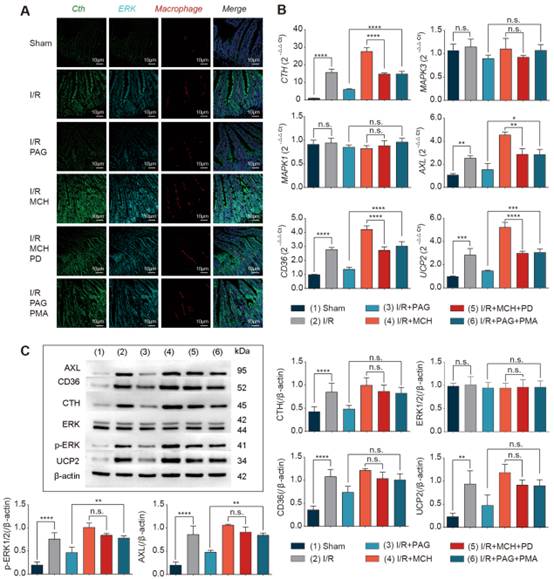
圖5 Cth通過ERK1 /2依賴方式誘導I/R后巨噬細胞胞葬
在腹膜巨噬細胞(RAW 264.7)與凋亡內皮細胞的體外共培養系統中,對細胞的各種處理對細胞活力或凋亡均無影響(圖6A)。然而RAW 264.7的Cth過表達組與對照組相比,在基因和蛋白水平上Axl, CD36和UCP2的表達顯著增加,ERK1/2通路被激活,磷酸化水平顯著增加(圖6B, C)。這些結果表明,Cth介導的胞葬調節依賴于體外ERK1/2的磷酸化。
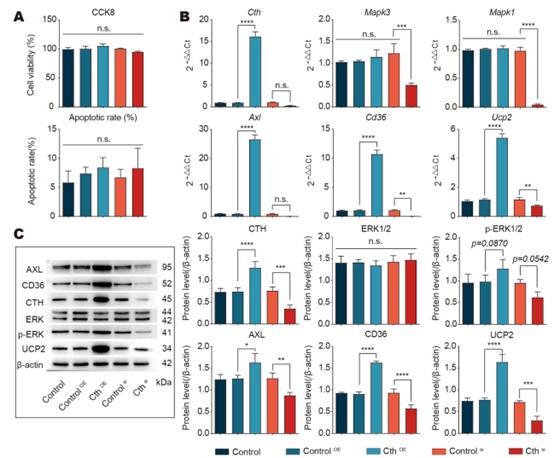
圖6在巨噬細胞中,Cth沉默或過表達導致下游ERK1/2的變化和體外胞葬表型
4. Cth依賴于巨噬細胞的泡騰作用來調節修復表型
在體外共培養實驗中,將細胞松弛素D加入過表達Cth的腹腔巨噬細胞和凋亡的內皮細胞中,在排除其對細胞活力的影響后(圖7A),發現原本高表達的胞葬標志物(AXL, CD36, UCP2)顯著降低(圖7D)。高水平的IL-10和相關修復分子RvD1、RvE1和Lipoxin A4也顯著降低(圖7B、C)。這些結果表明,Cth介導的修復表型調節是胞葬依賴性的。
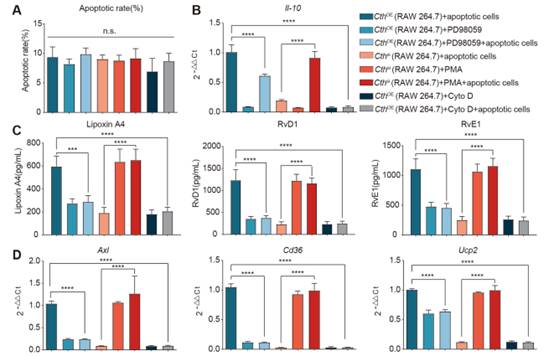
圖7在體外,Cth通過激活ERK1/2通路調節胞葬和修復表型
5. Cth、ERK1/2通路激活和胞葬均經過臨床驗證
在證明Cth依賴于ERK1/2通路來調節胞漿化,并在體內外誘導抗炎和修復表型后,我們對臨床患者進行采樣,以評估我們的結果的轉化相關性,并了解腸黏膜損傷和腸損傷后修復的嚴重程度。分別于術中、術后24、48 h取患者回腸造口處腸黏膜組織,并采集患者血液。隨著患者術后恢復,抗炎因子IL-10和修復相關SPMs的表達水平逐漸升高(圖8A)。此外,腸道黏膜Cth、AXL、CD36、UCP2基因及蛋白表達量隨時間逐漸升高,這與抗炎修復結果相似。并且ERK1/2通路逐漸被激活,磷酸化水平逐漸升高(圖8B, C)。具體來說,腸屏障損傷標志物(D-LA和IFABP)以及促炎分子IL-6和TNF-α隨著時間的推移逐漸增加,這可能是患者腸道損傷和修復的結果。
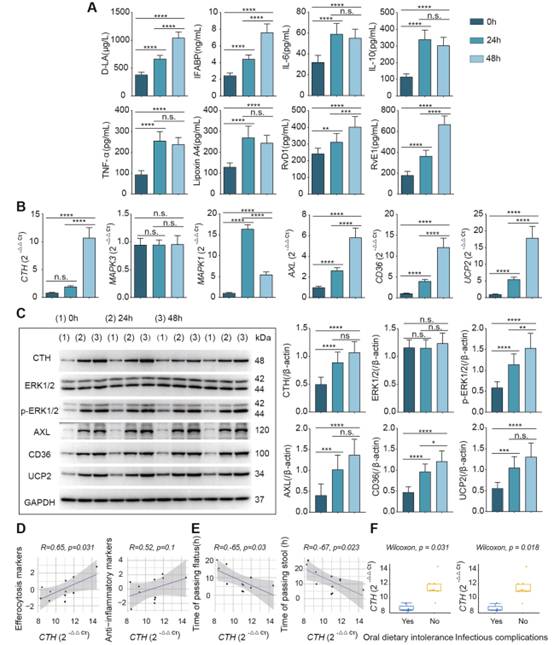
圖8臨床驗證Cth、ERK1/2、胞葬水平變化與腸道功能恢復的相關性
6. Cth與臨床患者胞葬和腸屏障修復相關
除了在臨床患者中驗證我們的發現,我們還檢查了患者的腸道功能恢復結局,包括術后排氣和大便的時間,術后48小時的口服飲食不耐受,以及術后7天的感染并發癥。通過探索性觀察,我們發現術后48 h Cth表達與胞葬標志物呈顯著正相關(R = 0.65, P = 0.031),且Cth表達與抗炎分子呈正相關。此外,我們還發現術后48 h的Cth水平與患者恢復排便的時間(R =?0.65,P = 0.03)和排便次數(R =?0.67,P = 0.023)呈顯著負相關,表明Cth高表達與患者腸道功能的恢復呈正相關。最后,我們發現在術后48 h口服飲食不耐受的患者和術后7 d有感染性并發癥的患者中,Cth的表達水平較低(圖8D-F)。總體而言,患者數據表明,Cth和胞葬與患者腸道炎癥消退和屏障恢復密切相關。
結論:
在本研究中,Cth依賴的ERK1/2通路誘導巨噬細胞胞葬,進而調節腸黏膜損傷修復(圖9)。因此,操縱胞葬促進腸黏膜損傷修復可能是一種有效的策略。此外,本研究結果為進一步闡明影響腸黏膜損傷修復的免疫機制提供了新的線索,對促進I/R患者的恢復具有重要意義。

圖9 Cth可以激活ERK1/2信號通路,誘導巨噬細胞胞葬,促進腸屏障修復






