外泌體circTUBGCP4通過激活A(yù)kt信號通路促進(jìn)血管內(nèi)皮細(xì)胞生成和結(jié)直腸癌轉(zhuǎn)移
結(jié)直腸癌是我國發(fā)病率和死亡率最高的惡性腫瘤之一。轉(zhuǎn)移是結(jié)直腸癌患者高死亡率的主要原因。新生血管形成和血管生成是生理系統(tǒng)中轉(zhuǎn)運(yùn)營養(yǎng)物質(zhì)的穩(wěn)態(tài)過程。然而,穩(wěn)態(tài)在腫瘤組織中被破壞。瘤內(nèi)血管過度生長形成紊亂和不穩(wěn)定的血管網(wǎng),加速了腫瘤的生長、侵襲和轉(zhuǎn)移。近年來,越來越多的研究報道外泌體可以作為細(xì)胞間通訊的良好媒介,改變腫瘤微環(huán)境,導(dǎo)致腫瘤轉(zhuǎn)移。此外,來自癌細(xì)胞或其他細(xì)胞外泌體中的非編碼RNA在血管生成和腫瘤轉(zhuǎn)移中發(fā)揮重要作用。據(jù)報道,circRNA在外泌體中富集且穩(wěn)定,可能是一種有前景的癌癥診斷生物標(biāo)志物。然而,外泌體circRNA在腫瘤血管生成和轉(zhuǎn)移中的作用尚不清楚。該研究發(fā)表在《Journal of Experimental & Clinical Cancer Research》,IF:12.658。
研究路線:

主要研究結(jié)果:
1. CRC-CDEs促進(jìn)HUVECs的遷移、管腔形成和絲狀偽足形成
為了研究CRC-CDEs在血管生成中的作用,作者首先進(jìn)行了外泌體的分離和鑒定。差速離心法分離HCT116細(xì)胞和SW480細(xì)胞上清液來源的外泌體(圖1a)。?蛋白質(zhì)印跡法檢測未裂解的HCT116-Exo和SW480-Exo中外泌體生物標(biāo)志物(CD9、CD63、TSG-101)(圖1b)。透射電鏡結(jié)果顯示,HCT116和SW480的囊泡呈球狀,呈典型的杯狀。此外,HCT116-Exo比SW480-Exo大(圖1c)。NTA結(jié)果顯示HCT116-Exo的平均大小也高于SW480-Exo(圖1d)。然后,將1×107個HCT116細(xì)胞PKH67標(biāo)記的外泌體加入HUVECs(圖1e)。共聚焦成像顯示HCT116-Exo和SW480-Exo在細(xì)胞質(zhì)中聚集,提示外泌體在3h時被HUVECs攝取(圖1f)。為確保HCT116-Exo和SW480-Exo的作用,分別用10μg和30μg外泌體孵育HUVECs。48h后,transwell實驗顯示,與PBS處理相比,不同濃度的HCT116-Exo和SW480-Exo處理顯著增強(qiáng)HUVECs的遷移和管腔形成(圖1g-i)。在SW480-Exo處理組中顯示了類似的趨勢(圖1h-i)。為了確定外泌體對HUVECs遷移的影響是否是由于HUVECs形態(tài)的改變,作者使用鬼筆環(huán)肽標(biāo)記HUVECs中的F-肌動蛋白。有趣的是,共聚焦成像顯示HUVECs吸收HCT116-Exo和SW480-Exo后出現(xiàn)絲狀偽足(黃色點標(biāo)記)(圖1j)。這些結(jié)果表明,CRC細(xì)胞來源的外泌體增強(qiáng)HUVECs的遷移和管形成能力,提示CRC-CDEs可以重塑受體細(xì)胞。
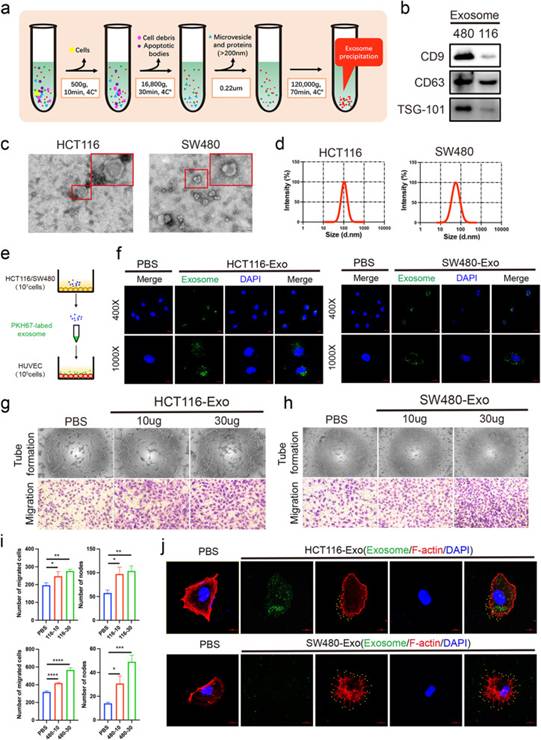
圖1CRC-CDEs促進(jìn)HUVECs的遷移、管腔形成和絲狀偽足形成
2. CRC-CDEs促進(jìn)HUVECs尖端細(xì)胞的形成
基于CRC-CDEs改變HUVECs形態(tài)的結(jié)果,作者推測CRC-CDEs可能誘導(dǎo)芽孢形成和尖端細(xì)胞分化。據(jù)報道,整合素β1和VEGFA參與血管的生長和成熟,對有效的內(nèi)皮芽形成是必需的。作者發(fā)現(xiàn),與PBS處理相比,高HCT116-Exo和SW480-Exo處理導(dǎo)致高整合素β1和VEGFA表達(dá)(圖2a)。CD34是一種公認(rèn)的尖端細(xì)胞標(biāo)記物,顯示出絲狀偽足延伸以促進(jìn)血管生成芽。因此,作者通過免疫熒光和蛋白質(zhì)印跡法檢測CRC-CDEs處理后CD34的表達(dá)。蛋白質(zhì)印跡結(jié)果顯示,與PBS處理相比,HCT116-Exo和SW480-Exo處理后CD34高表達(dá)(圖2a)。免疫熒光圖像顯示,HCT116-Exo組和SW480-Exo組的CD34強(qiáng)度高于PBS組(圖2b)。為了確保CD34在CRC樣本中的表達(dá),作者使用GEO數(shù)據(jù)集進(jìn)行分析。結(jié)果顯示,與正常組織相比,CD34在CRC組織中顯著高表達(dá)(圖2c)。此外,作者發(fā)現(xiàn)CD34在GSE39582中的表達(dá)在N1、N2和N3組中逐漸升高。與M0組相比,M1組的CD34表達(dá)也較高,并且顯示出較差的總生存期和無復(fù)發(fā)生存期(圖2d和e)。這些數(shù)據(jù)表明,CRC-CDEs通過上調(diào)VEGFA,整合素β1和CD34的表達(dá)促進(jìn)尖端細(xì)胞形成,并預(yù)測CRC轉(zhuǎn)移和CRC患者的不良預(yù)后。
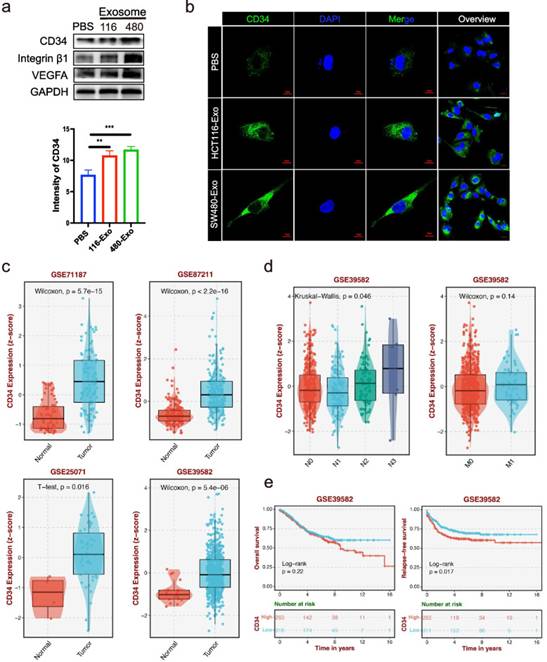
圖2CRC-CDEs促進(jìn)HUVECs尖端細(xì)胞的形成
3. circTUBGCP4的上調(diào)與結(jié)直腸癌的血管生成和轉(zhuǎn)移相關(guān)
為了研究CRC-CDEs來源的circRNA在促進(jìn)血管生成驅(qū)動腫瘤轉(zhuǎn)移中的作用,作者比較了轉(zhuǎn)移和非轉(zhuǎn)移CRC患者血清外泌體中circRNA的表達(dá)水平。與非轉(zhuǎn)移組相比,轉(zhuǎn)移組血清外泌體中有70個circRNA表達(dá)上調(diào),59個circRNA表達(dá)下調(diào)(圖3c)。利用人血外泌體中circRNA、lncRNA和mRNA數(shù)據(jù)庫exoRBase篩選的circRNA。然后通過HCT116-Exo、exoRBase和血清-exo中表達(dá)量最高的前20個circRNA的3個數(shù)據(jù)集選擇外顯子hsa_circRNA_101501和has_circRNA_104109(圖3d)。與HUVECs相比,HCT116和SW480中circ101501表達(dá)量的變化倍數(shù)高于circ104109(圖3e)。因此,作者選擇了circ101501,并將其更名為circTUBGCP4,其父基因為TUBGCP4。
首先,作者通過sanger測序鑒定了circTUBGCP4的環(huán)狀結(jié)構(gòu),通過發(fā)散引物(divergent primer, DP)和收斂引物(convergent primer, CP)進(jìn)行了驗證,并通過放線菌素D實驗進(jìn)行了驗證。sanger序列結(jié)果表明,PCR產(chǎn)物包含使用DP的反剪接序列(圖3f)。以cDNA為PCR模板時,DP可以擴(kuò)增產(chǎn)物,而以gDNA為PCR模板時,DP不能擴(kuò)增產(chǎn)物(圖3g)。放線菌素D實驗表明,circTUBGCP4比TUBGCP4更穩(wěn)定(圖3h)。這些結(jié)果證明了circTUBGCP4是一個環(huán)狀結(jié)構(gòu)。為了探索circTUBGCP4在CRC中的表達(dá)及其與血管生成和轉(zhuǎn)移的關(guān)系,作者使用GEO數(shù)據(jù)集和臨床隊列(n=20對)進(jìn)行分析。GSE126094數(shù)據(jù)顯示,與鄰近正常組織(AN)相比,circTUBGCP4在原發(fā)腫瘤中顯著上調(diào)(圖3i)。在GSE147597中,與非肝轉(zhuǎn)移相比,circTUBGCP4在肝轉(zhuǎn)移中被發(fā)現(xiàn)高表達(dá)(圖3j)。此外,臨床隊列的ISH結(jié)果顯示,有淋巴結(jié)轉(zhuǎn)移的原發(fā)腫瘤中的circTUBGCP4高于鄰近正常組織(圖3k)。此外,作者發(fā)現(xiàn)與低circTUBGCP4組相比,高circTUBGCP4組中CD31和CD34的表達(dá)較高(圖3l)。circTUBGCP4高表達(dá)可能與腫瘤血管生成和轉(zhuǎn)移有關(guān)。
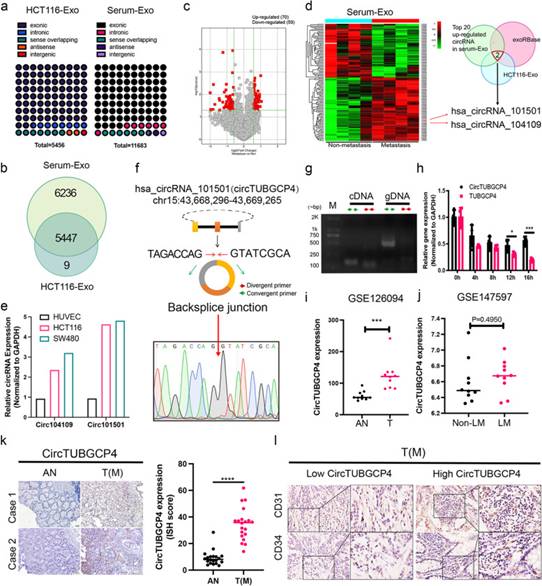
圖3CRC-CDEs中的CircTUBGCP4與CRC的血管生成和轉(zhuǎn)移相關(guān)
4. 沉默外泌體circTUBGCP4可抑制尖端細(xì)胞形成、血管生成和腫瘤轉(zhuǎn)移
為了探究外泌體circTUBGCP4在HUVECs中的生物學(xué)功能,作者首先要確保外泌體circTUBGCP4能夠被HUVECs吸收。作者分離出HCT116-Exo和SW480-Exo來孵育HUVECs 6h和12h。作者發(fā)現(xiàn),與沒有外泌體處理的組相比,circTUBGCP4在HCT116-Exo-6h組和SW480-Exo-6h組中上調(diào)(圖4a)。這些結(jié)果驗證了腫瘤細(xì)胞來源的circTUBGCP4可能通過組裝成外泌體進(jìn)入HUVECs。在HCT116和SW480中構(gòu)建circTUBGCP4敲低的穩(wěn)定細(xì)胞株。結(jié)果顯示,與shNC組相比,circTUBGCP4-01和shcircTUBGCP4-02組中circTUBGCP4顯著下調(diào),而其親本基因無變化(圖4b)。然后,作者從穩(wěn)定細(xì)胞系中提取外泌體,研究其對HUVECs的生物學(xué)效應(yīng)。管形成實驗表明,敲低exo-circTUBGCP4顯著降低了HUVECs中的節(jié)點數(shù)量(圖4c)。Transwell實驗顯示,下調(diào)exo-circTUBGCP4可降低細(xì)胞遷移能力(圖4d)。細(xì)胞劃痕實驗顯示,與shNC組相比,shcircTUBGCP4-01和shTUBGCP4-02組的愈合速度較慢(圖4e-f)。蛋白質(zhì)印跡結(jié)果顯示,在shcircTUBGCP4-Exo處理的HUVECs中,CD34、整合素β1和VEGFA的表達(dá)下調(diào)(圖4f)。此外,免疫熒光結(jié)果顯示,來自HCT116和SW480的Exo-ShCirc-01和ShCirc-01組中CD34低表達(dá)(圖4g)。為了評估外泌體circTUBGCP4對體內(nèi)血管生成和腫瘤轉(zhuǎn)移的潛在貢獻(xiàn),作者首先注射HCT116細(xì)胞,兩周后通過尾靜脈注射來自Sh-NC和Sh-Circ-02組的外泌體(圖5a)。結(jié)果表明,與PBS和HCT116Exo-Sh-Circ-02相比,HCT116Exo-Sh-NC導(dǎo)致肺結(jié)節(jié)增加(圖5b-c)。此外,HCT116Exo-Sh-NC組肺結(jié)節(jié)內(nèi)血管數(shù)量增加,HCT116Exo-Sh-Circ-02組肺結(jié)節(jié)內(nèi)血管數(shù)量減少(圖5d-e)。這些結(jié)果證明外泌體circTUBGCP4可誘導(dǎo)尖端細(xì)胞形成、血管生成和腫瘤轉(zhuǎn)移。
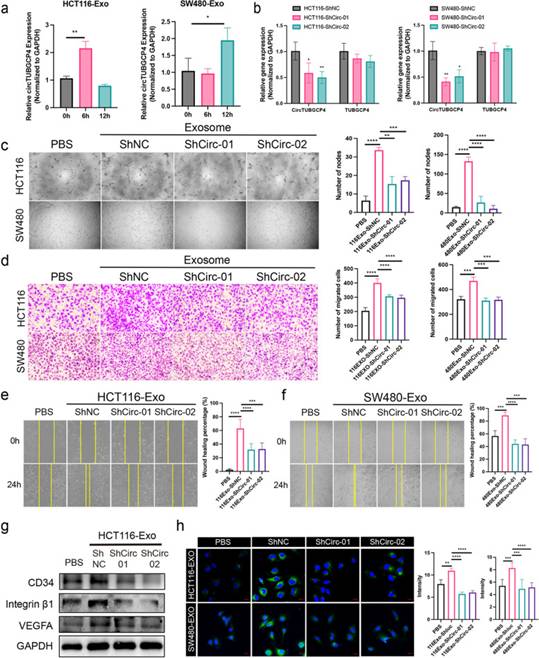
圖4外泌體circTUBGCP4促進(jìn)HUVECs尖端細(xì)胞形成、遷移和管腔形成
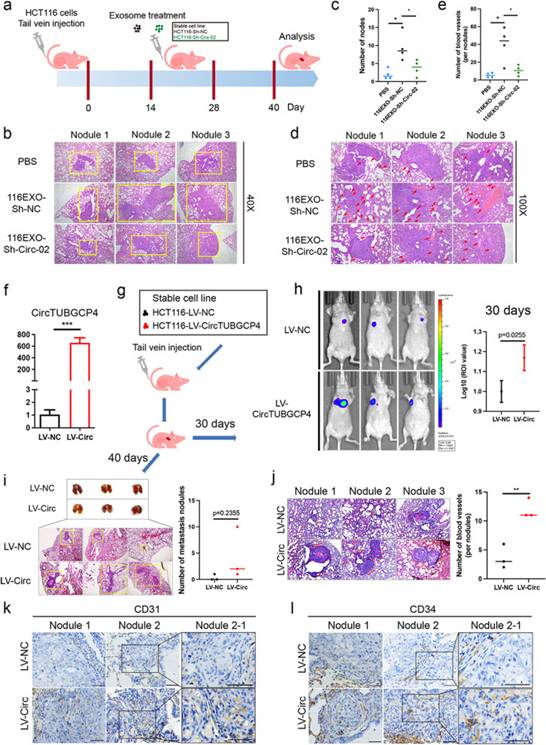
圖5過表達(dá)circTUBGCP4促進(jìn)血管生成和腫瘤轉(zhuǎn)移
5. 過表達(dá)circTUBGCP4促進(jìn)尖端細(xì)胞形成、血管生成和腫瘤轉(zhuǎn)移
為了在體外和體內(nèi)評估circTUBGCP4效應(yīng)的潛在貢獻(xiàn),作者首先構(gòu)建了circTUBGCP4的過表達(dá)質(zhì)粒和慢病毒。接下來,作者驗證了穩(wěn)定細(xì)胞株的過表達(dá)效率,并構(gòu)建了尾靜脈模型(圖5f、g)。體內(nèi)熒光成像結(jié)果顯示,30d后LV-CircTUBGCP4組小鼠肺內(nèi)熒光強(qiáng)于LV-NC組(圖5h)。LV-CircTUBGCP4組肺轉(zhuǎn)移結(jié)節(jié)數(shù)量多于LV-NC組(圖5i)。此外,HE結(jié)果和IHC結(jié)果顯示LV-CircTUBGCP4組比LV-NC組有更多的血管和微血管(圖5j-l)。有趣的是,與LV-NC組相比,LV-CircTUBGCP4組的肺轉(zhuǎn)移結(jié)節(jié)中CD31+和CD34+均較高(圖5k-1)。這些結(jié)果表明,過表達(dá)的circRNA可通過增強(qiáng)血管生成促進(jìn)腫瘤轉(zhuǎn)移。
6. HUVECs中CircTUBGCP4通過靶向miR-146b-3p/PDK2軸激活Akt信號通路
為了探索外泌體circTUBGCP4的潛在調(diào)控,作者考慮了circTUBGCP4是否作為海綿吸附miRNAs。首先,作者使用了癌癥特異性circRNAs數(shù)據(jù)庫在circTUBGCP4中發(fā)現(xiàn)了8個AGO2結(jié)合位點。此外,AGO2-RIP驗證了circTBUGCP4可以結(jié)合AGO2蛋白,這提示了circTUBGCP4結(jié)合miRNA的潛力(圖6a)。然后,作者從作者的環(huán)狀RNA陣列分析和CIRCinteractiome的交集中選擇了miR-146b-3p和miR-873-5p(圖6b)。作者設(shè)計了靶向反向剪接連接的circTUBGCP4生物素探針,并在轉(zhuǎn)染過表達(dá)circTUBGCP4的HUVECs中驗證了良好的下拉效率(圖6c)。circRNA pull-down結(jié)果顯示,在HUVEC裂解緩沖液中,circTUBGCP4探針可以顯著結(jié)合miR-146b-3p,而不是miR-873-5p(圖6d)。此外,當(dāng)HUVECs過表達(dá)circTUBGCP4時,circTUBGCP4探針可以拉出更多的miR-146b-3p(圖6e)。接下來,作者發(fā)現(xiàn)circTUBGCP4有兩個位點來海綿化miR-146b-3p(圖6f)。基于兩個結(jié)合位點,作者構(gòu)建了circTUBGCP4的全突變質(zhì)粒。結(jié)果表明,circTUBGCP4可以基于293 T中的兩個位點與miR-146b-3p結(jié)合(圖6g)。
有研究報道癌細(xì)胞與HUVECs共培養(yǎng)可以通過激活PI3K/Akt信號通路增加內(nèi)皮細(xì)胞的管腔形成和存活。因此,作者想知道外泌體circTUBGCP4是否通過激活Akt通路促進(jìn)內(nèi)皮細(xì)胞管的形成。Western blot結(jié)果顯示,HCT116-Exo和SW480-Exo處理的HUVECs中p-AKT表達(dá)上調(diào),而shcircTUBGCP4-01-Exo和shcircTUBGCP4-02-Exo處理的HUVECs中p-AKT表達(dá)下調(diào)(圖6h和i)。因此,作者篩選了與PI3K/Akt信號通路相關(guān)的miR-146b-3p靶點。巧合的是,在Targetscan和miRDB數(shù)據(jù)庫中篩選出的141個靶基因中,與PI3K/Akt信號通路相關(guān)的基因是PDK2(圖6j)。此外,作者還篩選了與PI3K/Akt信號通路直接相關(guān)的其他初級基因(圖6j)。然后,與NC相比,PDK2是HUVECs過表達(dá)miR-146b-3p中唯一下調(diào)的靶點(圖6k)。此外,PDK2可以被circTUBGCP4上調(diào),而被HCT116和SW480的Exo-Sh-Circ-01和Exo-Sh-Circ-02下調(diào)(圖6l)。為了證明miR-146b-3p靶向PDK2-3'UTR,作者設(shè)計了miR-146b-3p生物素探針來下調(diào)PDK2。結(jié)果顯示,miR-146b-3p探針可以顯著富集PDK2(圖6m)。然后,作者構(gòu)建了攜帶雙熒光素酶報告基因的PDK2-3'UTR質(zhì)粒,并預(yù)測了其在293 T細(xì)胞中PDK2-3'UTR的結(jié)合位點(圖6n)。結(jié)果顯示,在293 T細(xì)胞中,PDK2-3'UTR可以被miR-146b-3p結(jié)合(圖6o)。為了證實circTUBGCP4通過miR-146b-3p激活Akt信號通路,作者在過表達(dá)circTUBGCP4和過表達(dá)miR-146b-3p時對HUVECs進(jìn)行轉(zhuǎn)染。結(jié)果顯示,PDK2在過表達(dá)circTUBGCP4的HUVECs中mRNA水平和蛋白水平均升高。在HUVECs中,miR-146b-3p模擬物抑制miR-146b-3p的增加(圖6p)。綜上所述,這些結(jié)果表明circTUBGCP4可以通過海綿miR-146b-3p促進(jìn)PDK2來激活Akt信號。
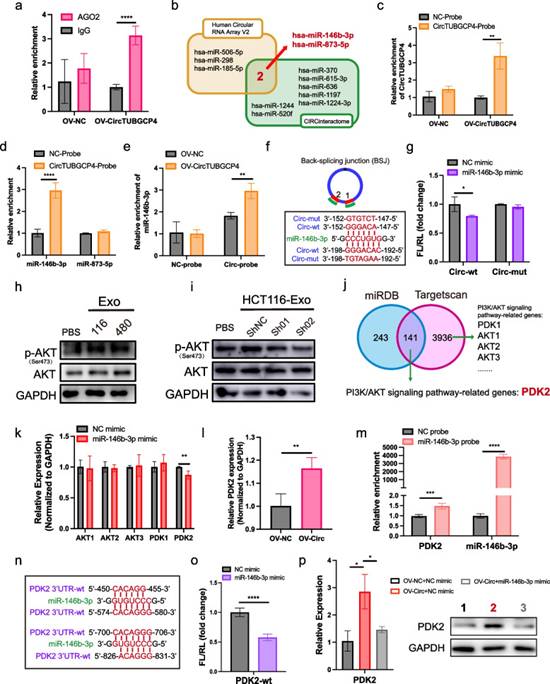
圖6 CircTUBGCP4海綿miR-146b-3p上調(diào)PDK2激活HUVECs中Akt信號通路
7. MiR-146b-3p抑制HUVECs遷移、管腔形成和尖端細(xì)胞形成
接下來,基于上述發(fā)現(xiàn),作者檢測HCT116-Exo和SW480-Exo處理HUVECs 6h、12h、24h后miR-146b-3p的表達(dá)。如圖7a-b所示,HCT116-Exo和SW480-Exo處理HUVECs后miR-146b-3p的表達(dá)逐漸降低。Transwell遷移實驗顯示,過表達(dá)miR-146b-3p顯著抑制HUVECs遷移(圖7c)。此外,劃痕實驗也顯示,與NC模擬物組相比,miR-146b-3p模擬物組HUVECs的傷口閉合速度較慢(圖7d)。此外,過表達(dá)miR-146b-3p顯著抑制HUVECs在4h和6h后的節(jié)點形成(圖7e)。然后,根據(jù)蛋白質(zhì)印跡結(jié)果,作者發(fā)現(xiàn)miR-146b-3p可以顯著抑制CD34的表達(dá),也可以抑制PDK2的表達(dá)和AKT的激活(圖7f)。
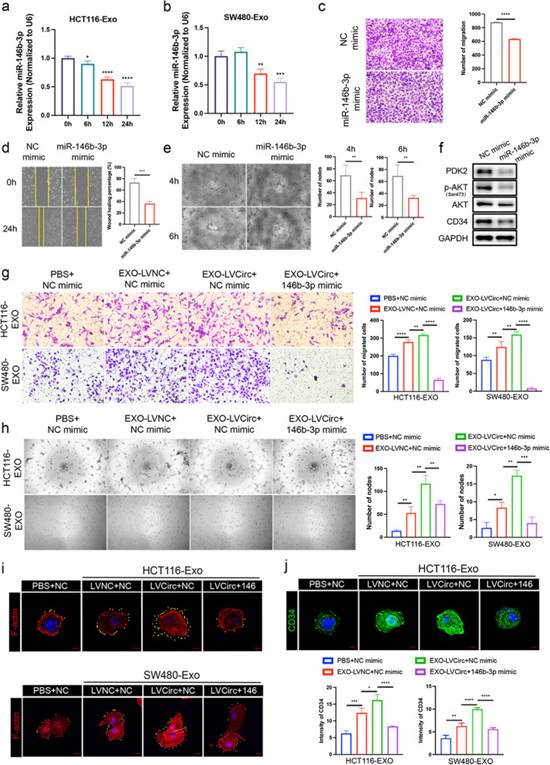
圖7miR-146b-3p在HUVECs中的作用,以及外泌體circTUBGCP4在miR-146b-3p調(diào)控的HUVECs功能障礙中的作用。
8. 外泌體circTUBGCP4通過抑制miR-146b-3p增強(qiáng)HUVECs遷移、管狀細(xì)胞形成和尖端細(xì)胞形成
為了探究miR-146b-3p對circTUBGCP4調(diào)控HUVECs功能的潛在作用,作者使用HCT116-LV-CircTUBGCP4來源的外泌體孵育HUVECs,隨后轉(zhuǎn)染miR-146b-3p模擬物。然后,transwell遷移實驗顯示,與HCT116和SW480的Exo-LVNC相比,Exo-LVcircTUBGCP4處理的HUVECs遷移能力增強(qiáng),然后miR-146b mimic抑制這種增加的趨勢(圖7g)。管形成實驗的類似結(jié)果表明,與HCT116和SW480的Exo-LVNC相比,Exo-LVcircTUBGCP4處理的HUVECs具有更多的節(jié)點,然后被miR-146b模擬物抑制(圖7h)。激光共聚焦圖像顯示,Exo-LVcircTUBGCP4處理的HUVECs比Exo-LVNC處理的HUVECs有更多的絲狀偽足和更高的CD34表達(dá)。然而,miR-146b-3p抑制了這一上升趨勢(圖7i-j)。這些結(jié)果表明,外泌體circTUBGCP4通過吸附miR-146b-3p增強(qiáng)HUVECs的細(xì)胞遷移、管狀細(xì)胞形成和尖端細(xì)胞形成。
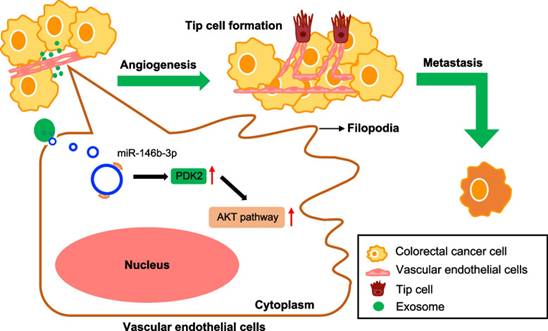
外泌體circTUBGCP4在血管生成和腫瘤轉(zhuǎn)移中的功能示意圖模型
結(jié)論:
該研究結(jié)果證明CRC-CDEs誘導(dǎo)更多的絲狀偽足和血管內(nèi)皮尖細(xì)胞形成,從而促進(jìn)細(xì)胞遷移和管狀形成。此外,該研究鑒定了CRC-CDEs中的circTUBGCP4,它可以被轉(zhuǎn)運(yùn)到血管內(nèi)皮細(xì)胞中,從而促進(jìn)細(xì)胞遷移、管狀細(xì)胞形成和尖端細(xì)胞形成。機(jī)制上,該研究發(fā)現(xiàn)circTUBGCP4可以靶向miR-146b-3p觸發(fā)血管內(nèi)皮細(xì)胞中的Akt信號通路。該研究闡明了一種新的腫瘤誘導(dǎo)血管生成機(jī)制,可能為結(jié)直腸癌的抗血管生成治療提供新的途徑。
參考文獻(xiàn):
Chen C, Liu Y, Liu L, Si C, Xu Y, Wu X, et al. Exosomal circTUBGCP4 promotes vascular endothelial cell tipping and colorectal cancer metastasis by activating Akt signaling pathway. J ExpClin Cancer Res. 2023 Feb 15;42(1):46. doi: 10.1186/s13046-023-02619-y.






