FSTL1通過調節PKM2的細胞內功能,使巨噬細胞功能重新編程,從而促進肝纖維化
卵泡抑素樣蛋白1(FSTL1)是一種分泌糖蛋白,但其在肝纖維化巨噬細胞相關炎癥調節中的作用尚未被證實。我們旨在描述巨噬細胞FSTL1在肝纖維化中的作用。構建髓系特異性FSTL1-敲除(FSTL1M-KO)小鼠,探討巨噬細胞FSTL1在注射四氯化碳、膽管結扎或缺甲硫氨酸和缺膽堿飲食誘導的3種小鼠肝纖維化模型中的功能和機制。FSTL1在人和小鼠纖維化肝臟巨噬細胞中的表達均顯著升高。髓系特異性FSTL1缺失可有效減緩肝纖維化的進展。在FSTL1M-KO小鼠中,在肝纖維化過程中形成的微環境表現出相對較少的炎癥,這可通過單核/巨噬細胞和中性粒細胞浸潤減弱以及促炎因子表達減少來證明。在體內和體外實驗中,FSTL1M-KO巨噬細胞表現出抑制的促炎M1極化和核因子κB通路激活。通過其FK結構域,FSTL1直接結合到丙酮酸激酶M2 (PKM2)。FSTL1促進PKM2磷酸化和核易位,減少PKM2泛素化以增強PKM2依賴的糖酵解,并增加M1極化。PKM2的藥理激活(DASA-58)部分對抗FSTL1介導的糖酵解和炎癥。巨噬細胞FSTL1通過誘導M1極化和炎癥促進肝纖維化的進展,其機制是基于巨噬細胞胞內PKM2重編程功能。本文于2022年12月發表于Gut(IF=31.793)上。
技術路線:

主要研究結果:
(1) 纖維化肝組織巨噬細胞中FSTL1表達增加
為確定FSTL1在纖維化肝臟樣本中的表達,我們收集了51份人類肝臟樣本,包括正常和纖維化肝組織。與正常對照肝臟相比,纖維化肝臟中FSTL1的mRNA和蛋白表達明顯升高(圖1A,B)。接下來,我們確定FSTL1的表達是否主要在肝臟巨噬細胞中升高。雙免疫熒光染色顯示FSTL1主要表達于人纖維化肝臟的巨噬細胞上(圖1C)。通過重新分析已發表的數據集,我們發現FSTL1表達在HCV誘導或NASH誘導的肝纖維化中顯著升高(圖1D)。
我們探索了FSTL1在三種被廣泛認可的肝纖維化動物模型中的表達,即CCl4注射誘導、BDL誘導和MCD飲食誘導的肝纖維化。所有模型的肝組織中FSTL1的表達均顯著增加(圖1E,F)。然后,我們從小鼠纖維化肝臟中分離肝臟巨噬細胞。從纖維化肝臟分離的巨噬細胞中,FSTL1 mRNA表達水平明顯升高(圖1G)。雙免疫熒光染色進一步顯示,纖維化肝臟中FSTL1+CD68+巨噬細胞明顯多于對照肝臟(圖1H)。在肝纖維化組織中,FSTL1在巨噬細胞上高表達,在HSCs上低表達,在肝細胞上不表達(補充圖未展示)。綜上所述,FSTL1在肝組織,尤其是纖維化肝臟巨噬細胞中的表達顯著增加。
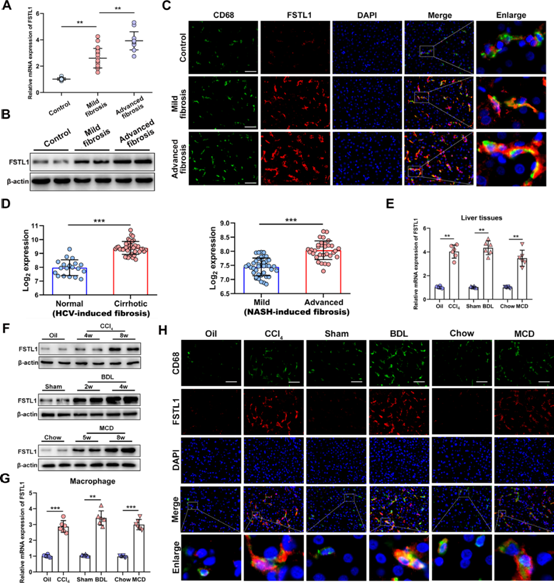
圖1:肝纖維化組織巨噬細胞卵泡抑素樣蛋白1 (FSTL1)表達增加
(2) 髓系FSTL1缺失可緩解肝纖維化
為了檢測FSTL1+巨噬細胞在肝纖維化中的作用,我們使用Cre-LoxP系統構建了髓系特異性FSTL1-缺陷(FSTL1M-KO)小鼠。然后,用CCl4注射、BDL或MCD飲食誘導FSTL1FL/FL和FSTL1M-KO小鼠肝纖維化。圖2A顯示,與FSTL1FL/FL小鼠相比,FSTL1M-KO小鼠的肝纖維化明顯較低,如Masson’s、Sirius Red和α-平滑肌肌動蛋白(α-SMA)染色所示。此外,攻毒后FSTL1M-KO小鼠血清丙氨酸轉氨酶和天門冬氨酸轉氨酶水平降低(圖2B)。此外,FSTLM-KO小鼠肝組織中TGF-β、TIMP-1和I型膠原蛋白的表達明顯低于同窩對照組(圖2C)。Western blot (WB)分析進一步顯示,與對照組相比,FSTL1缺失降低了纖維化肝組織中I型膠原、α-SMA和TIMP-1的表達(圖2D)。我們的研究結果表明,骨髓性FSTL1缺失可以減弱小鼠的肝纖維化。
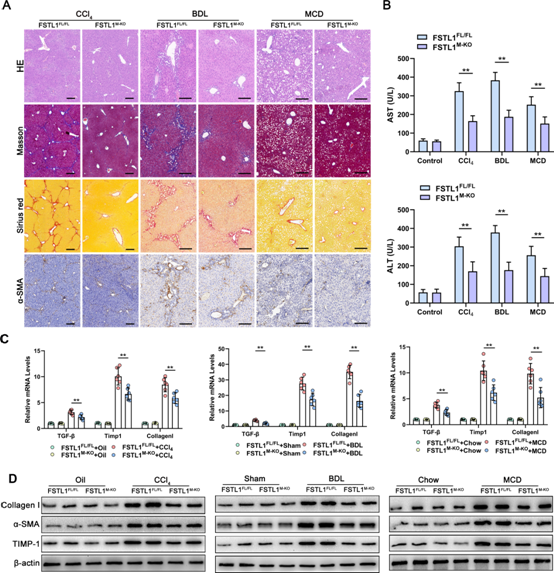
圖2:骨髓卵泡抑素樣蛋白1 (FSTL1)缺乏可減輕小鼠肝纖維化
(3) 髓系FSTL1缺失可減弱纖維化肝臟中的炎癥和巨噬細胞/中性粒細胞募集
我們研究了FSTL1+巨噬細胞對纖維化肝組織局部炎癥的影響。圖3A顯示,FSTL1M-KO小鼠的纖維化肝臟中腫瘤壞死因子(TNF)-α和白細胞介素(IL)-1β的表達低于對照組,IL-10的表達高于對照組。與同窩小鼠相比,FSTL1M-KO小鼠的血清TNF-α和IL-1β水平始終較低,而IL-10水平較高(圖3B)。我們通過在纖維化肝組織中染色F4/80和CD11b(巨噬細胞標記物)和Ly6G(中性粒細胞標記物)來評估肝臟炎癥細胞的積累。與FSTL1FL/FL小鼠相比,骨髓特異性FSTL1缺失顯著減少了纖維化肝組織中巨噬細胞和中性粒細胞的浸潤(圖3C-E)。

圖3:骨髓卵泡抑素樣蛋白1 (FSTL1)缺乏可減輕小鼠纖維化肝臟的炎癥
(4) 骨髓性FSTL1缺陷抑制纖維化肝臟中M1極化和NF-κB通路激活
髓系特異性FSTL1缺失可緩解肝臟炎癥,這表明FSTL1可能促進M1極化。我們分析了肝臟切片中M1巨噬細胞的定量。與FSTL1FL/FL小鼠相比,FSTL1M-KO小鼠中iNOS+CD68+巨噬細胞更少(圖4A)。在FSTL1M-KO小鼠的纖維化肝臟中,誘導型一氧化氮合酶(iNOS)的mRNA表達下調,而Arg1表達上調(圖4B)。WB分析顯示,與對照組相比,骨髓性FSTL1缺陷小鼠纖維化肝臟中iNOS和p-STAT1表達降低,p-STAT6表達增加(圖4C)。TLR-4/NF-κB通路是巨噬細胞介導的急性/慢性肝炎癥的重要調控通路。對纖維化肝臟的免疫染色和WB分析也顯示,FSTL1M-KO小鼠TLR-4/NF-κB通路激活降低(圖4D,E)。

圖4:髓系卵泡抑素樣蛋白1(FSTL1)缺乏抑制小鼠纖維化肝臟M1極化和核因子κB (NF-κB)通路激活
(5) FSTL1直接與PKM2結合,增強PKM2在巨噬細胞中的穩定性
為了進一步研究巨噬細胞FSTL1在肝纖維化過程中的調控機制,采用免疫沉淀(IP)和LC-MS/MS篩選方法探討FSTL1與巨噬細胞中潛在蛋白的結合。我們要確定PKM2在巨噬細胞中是否直接與FSTL1相互作用(圖5A,B)。FSTL1在巨噬細胞中與PKM2結合(圖5C)。共聚焦免疫熒光分析顯示,FSTL1與PKM2在細胞質和細胞核中共定位(圖5D)。構建編碼4個帶有血凝素(HA)標記的FSTL1截斷片段和3個帶有FLAG標記的PKM2截斷片段的質粒,轉染293個T細胞(圖5E)。FSTL1的FK結構域對于與PKM2的N-端或C-端相互作用至關重要(圖5F)。這些結果表明,FSTL1通過FSTL1的FK結構域和PKM2的N-端或C-端直接與PKM2相互作用。環己亞胺chase實驗的結果表明,在FSTL1下調的細胞中,PKM2的半衰期較短,而在FSTL1過表達的細胞中,PKM2的半衰期比對照細胞長得多(圖5G)。這些結果表明FSTL1可能通過抑制蛋白酶體降解來調節PKM2的穩定性。通過向FSTL1M-KO和FSTL1o/e骨髓來源的巨噬細胞(BMDMs)培養中添加MG-132,PKM2蛋白水平的降低伴隨FSTL1的下調得以恢復(圖5H)。FSTL1的下調增加了FSTL1M-KO BMDMs中PKM2蛋白的泛素化水平。泛素介導的PKM2降解作用在過表達FSTL1的BMDMs中被顯著取消(圖5I)。PKM2泛素化是PKM2磷酸化和核易位的關鍵步驟。
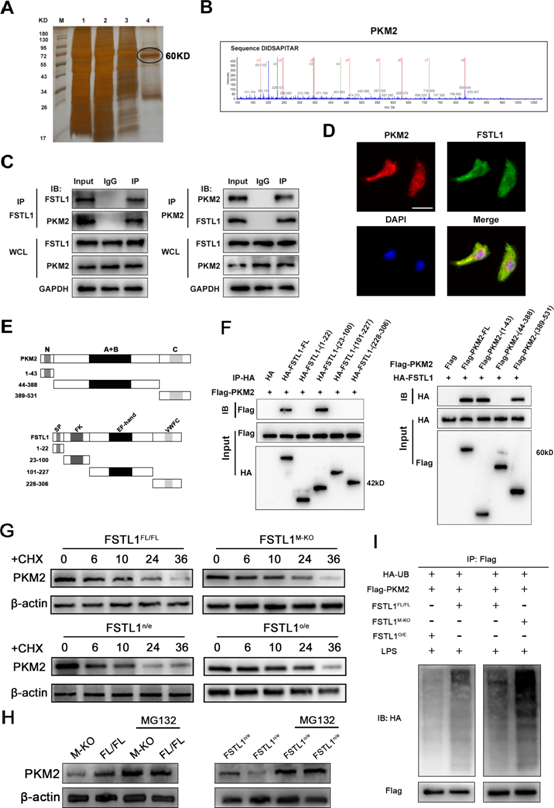
圖5:卵泡抑素樣蛋白1 (FSTL1)直接與丙酮酸激酶M2 (PKM2)結合,增強PKM2在巨噬細胞中的穩定性
(6) FSTL1促進PKM2磷酸化和纖維化肝組織巨噬細胞的核易位
為了探討PKM2在FSTL1介導的巨噬細胞促炎表型轉換中的作用,我們研究了PKM2在纖維化肝臟巨噬細胞中的表達是否發生改變。免疫熒光染色顯示,與對照組相比,纖維化肝臟有更多的FSTL1+巨噬細胞(圖6A,上面板)和PKM2+巨噬細胞(圖6A,下面板)。PKM2和FSTL1在纖維化肝組織的細胞質和細胞核中的表達均明顯增加(圖6B)。免疫熒光染色顯示,與對照組肝臟相比,患者肝臟巨噬細胞中PKM2和FSTL1的核易位明顯增加(圖6A,紫色區域)。相反,與FSTL1FL/FL小鼠相比,髓系FSTL1的破壞明顯減少了PKM2+巨噬細胞,并阻礙了PKM2在肝臟巨噬細胞中的核輸入(圖6C)。我們分析了分離的肝巨噬細胞細胞質中總PKM2和p-PKM2以及細胞核中總PKM2的蛋白表達情況。圖6D顯示,與FSTL1FL/FL對照相比,FSTL1缺失降低了細胞質中總PKM2和p-PKM2的表達,進而降低了細胞核中總PKM2的表達。綜上所述,巨噬細胞FSTL1促進PKM2的核轉位。
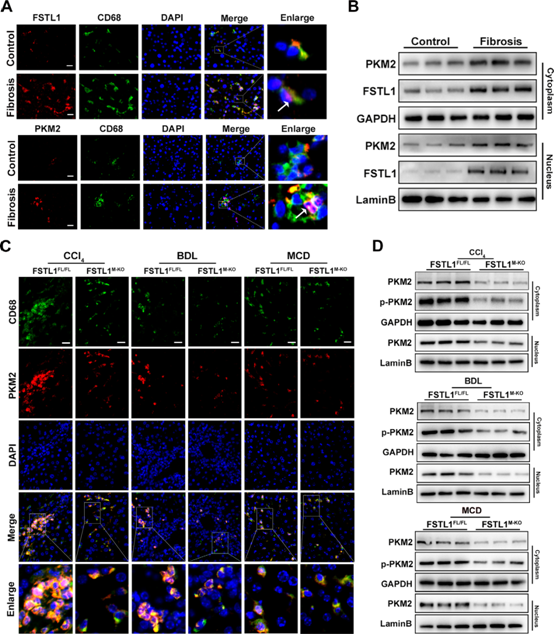
圖6:卵泡抑素樣蛋白1(FSTL1)促進纖維化肝組織巨噬細胞的丙酮酸激酶M2 (PKM2)磷酸化和核易位
(7) FSTL1缺失減弱巨噬細胞的炎癥反應、M1極化和糖酵解
為了進一步分析FSTL1在體外如何調節巨噬細胞功能,從FSTL1FL/FL或FSTL1M-KO小鼠細胞中分化出BMDMs,并對其進行脂多糖(LPS)刺激。FSTL1M-KO巨噬細胞TNF-α和IL-1β表達降低,IL-10表達升高(圖7A,B)。FSTL1缺失減弱了M1極化,并降低了LPS處理后BMDMs中的TLR-4/NF-κB通路激活(圖7C-G)。FSTL1M-KOBMDMs中PKM2表達及其核易位減弱(圖7C,D)。為了探索FSTL1是否也調節糖酵解,我們檢測了這些巨噬細胞的細胞外酸化率(ECAR)和相對乳酸釋放水平。與FSTL1FL/FL BMDMs相比,LPS刺激后FSTL1M-KO BMDMs的ECAR和乳酸顯著降低(圖7H,I)。使用糖酵解抑制劑2-脫氧-D-葡萄糖(2-DG)阻斷葡萄糖供應,FSTL1M-KO BMDMs中IL-1β和iNOS表達的下降被抑制(圖7J)。在LPS誘導的炎癥環境中與BMDMs共培養HSCs。缺乏FSTL1的BMDMs顯著降低α-SMA的表達,并減弱了造血干細胞的激活(補充圖未展示)。
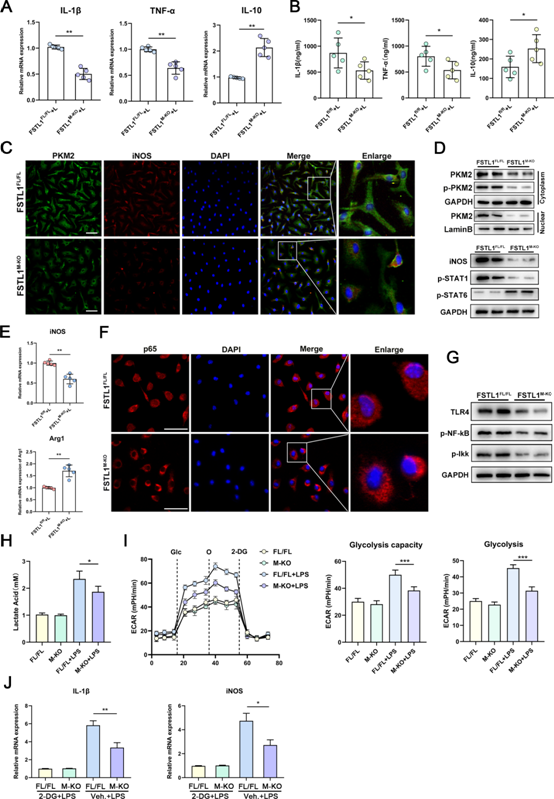
圖7:卵泡抑素樣蛋白1 (FSTL1)缺乏減弱巨噬細胞的炎癥和糖酵解
(8) PKM2激活劑抑制巨噬細胞中FSTL1介導的M1極化和糖酵解
為了進一步確定PKM2對FSTL1誘導的巨噬細胞極化和糖酵解的影響,用小分子PKM2激活劑DASA-58。處理FSTL1過表達(FSTL1o/e)的BMDMs, DASA-58減輕FSTL1o/e誘導的TNF-α和IL-1β,同時增加IL-10水平(圖8A,B)。PKM2、iNOS和p65的免疫熒光染色表明,抑制PKM2核轉位逆轉了FSTL1誘導的巨噬細胞M1極化和NF-κB激活(圖8C,D)。這些結果通過BMDMs中PKM2、p-PKM2、iNOS、p-STAT1、p-STAT6、TLR-4、p-Ikk和p-p65表達的WB分析得到證實(圖8E-G)。為了進一步驗證PKM2在FSTL1介導的糖酵解中的作用,我們檢測了ECAR和相對乳酸釋放水平。與FSTL1n/e BMDMs相比,FSTL1o/e BMDMs中的ECAR和乳酸顯著升高,DASA-58有效逆轉了FSTL1o/e誘導的糖酵解增加(圖8H,I)。FSTL1o/e相關的促炎介質(IL-1β和iNOS)被2-DG中和(圖8J)。這些結果證實PKM2的核和細胞質功能對FSTL1誘導的M1極化、糖酵解和炎癥至關重要。

圖8:丙酮酸激酶M2 (PKM2)激活劑抑制巨噬細胞中卵泡抑素樣蛋白1(FSTL1)介導的炎癥和糖酵解
結論:
綜上所述,我們揭示了巨噬細胞FSTL1在肝纖維化中的作用。FSTL1通過與PKM2結合,促進PKM2磷酸化和抑制PKM2泛素化在巨噬細胞中促進M1極化、糖酵解和炎癥反應。通過識別FSTL1介導肝臟炎癥的分子途徑,我們的發現為改善巨噬細胞介導的肝臟炎癥和纖維化的新治療方法提供了基礎。
參考文獻:
Rao, J., Wang, H., Ni, M., Wang, Z., Wang, Z., Wei, S., Liu, M., Wang, P., Qiu, J., Zhang, L., Wu, C., Shen, H., Wang, X., Cheng, F., & Lu, L. (2022). FSTL1 promotes liver fibrosis by reprogramming macrophage function through modulating the intracellular function of PKM2. Gut, 71(12), 2539–2550. https://doi.org/10.1136/gutjnl-2021-325150.






