蛋白質組學比較分析鑒定了胰腺癌相關星狀細胞小細胞外囊泡中差異表達的蛋白質
人胰腺星狀細胞(HPSC)是胰腺導管腺癌(PDAC)進展的重要基質成分和介質。小細胞外囊泡(sEV)是參與細胞間通訊的膜封閉納米顆粒,并從PDAC內的基質細胞釋放。來自正常胰腺星狀細胞(HPaStec)和PDAC相關星狀細胞(HPSC)的sEV的詳細比較仍然是研究者目前關于星狀細胞和PDAC的知識中的一個空白。探索PDAC腫瘤周圍活化HPSC的機制作用對于提高研究者對涉及基質和腫瘤細胞的細胞間通訊的理解至關重要。該研究發表于《Molecular & Cellular Proteomics》,IF:7.381。
研究路線:
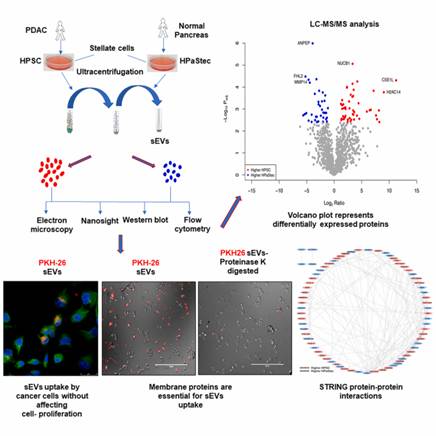
圖形摘要:
主要研究結果:
1. 星狀細胞分泌的sEV的分離和物理表征
HPSCs類似于肝星狀細胞,是肝纖維化中的重要效應細胞,對vimentin,desmin和α-SMA染色呈陽性。使用差分UC步驟從HPSC和HPaStec-CM中分離sEV并稍作修改(圖1A)。然后對sEV的蛋白質含量進行定量。為了分析形狀和尺寸分布,用戊二醛固定10 μgsEV,并用乙酸鈾酰染色并使用TEM成像。HPSC和HPaStec sEV的透明,圓形或橢圓形顆粒的代表性電子顯微照可見,并使用TEM捕獲,如圖1B所示。盡管這兩個類別中的大多數sEV的尺寸范圍都在50 nm至200 nm之間,但與HPaStec sEV相比,大多數較小尺寸的HPSC sEV在電子顯微照片中被捕獲(圖1B)。
接下來,為了確認大小分布并確定兩種細胞類型釋放的sEV濃度,研究者使用NanoSight NS300對適當稀釋的sEV樣品進行了NTA。HPSC(六種獨立制劑)和HPaStec sEV(五種獨立制劑)的平均粒徑分別為182.2至220.9 nm和154.4至191 nm(圖1C)。

圖1sEV的隔離和物理表征
為了進一步表征這些sEV的差異,研究者進行了蛋白質印跡分析以檢測sEV中已建立的外泌體表面標志蛋白(Alix,CD63,TSG101,EGFR和CSE1L)和任何細胞骨架(肌動蛋白)或內質網(Calnexin)污染的表達。這些表面標志物存在于sEV中,并且提取物沒有細胞骨架/內質網污染(圖2A)。研究者使用與Java 1.8.0_172軟件捆綁在一起的ImageJ對蛋白質印跡進行了定量分析(圖2B)。與HPaStec sEV相比,HPSC sEV中大多數外泌體標志物的富集度顯著更高(圖2B)。接下來,在HPaStec(圖2C)和HPSC-sEV(圖2D)結合的磁珠中進行流式細胞術分析,以分析CD63的表達,CD63是四跨蛋白外泌體標志物之一。圖2C和2D中具有適當同種型控制的代表性直方圖和圖2E中的平均條形圖顯示,HPSC中CD63的中位熒光強度明顯比HPaStec sEV高2倍。
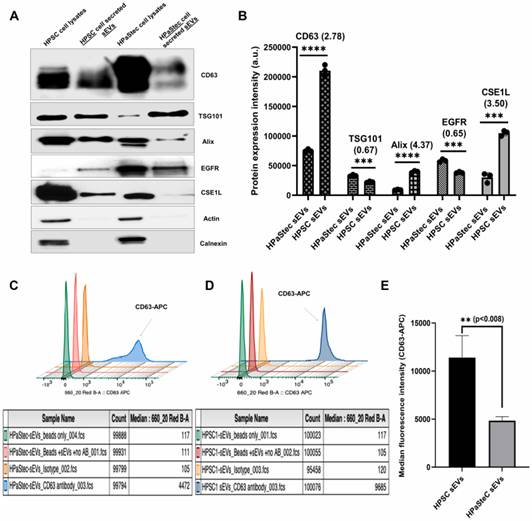
圖2星狀細胞分泌的sEV和外泌體標志物的表征和定量
2. sEV與正常HPaStec細胞共培養調節α-SMA表達
為了探索在HPSC和HPaStec sEV存在下正常星狀細胞的活化,將兩種sEV與正常HPaStecs以20μg/ml的濃度共培養72小時,然后進行α-SMA染色。有趣的是,根據研究者的數據,通過sEVs處理,兩種類型的EV相對于通過免疫熒光和蛋白質印跡檢測到的未處理對照顯著降低了α-SMA表達(圖3A-C)。
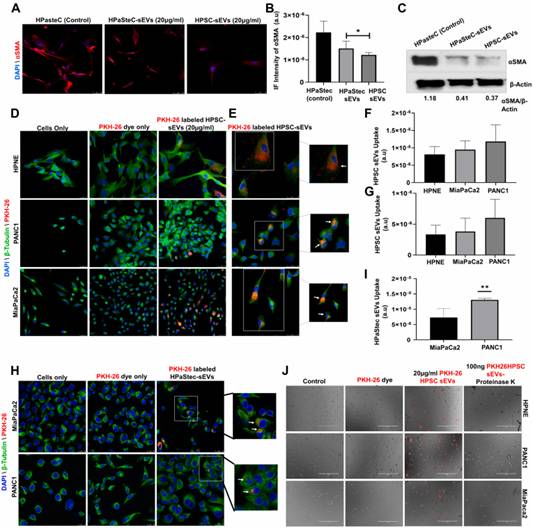
圖3sEVs對正常星狀細胞的影響以及正常上皮細胞和癌細胞對PKH-26標記的sEV的攝取
3. 正常上皮細胞和PDAC細胞系對sEV的攝取
接下來,為了研究正常和癌細胞系對HPSC和HPaStec sEV的攝取,研究者用紅色熒光染料(PKH-26)標記sEV,該染料具有長脂肪族尾巴,并入脂質膜。接下來,將20μg/ml的PKH-26標記的sEV與正常上皮細胞,HPNE和PDAC細胞系Miapaca2和Panc1孵育24小時。用甲醇固定細胞并證明sEV的定位,用代表單個細胞的細胞骨架結構的β-微管蛋白染色細胞,DAPI對細胞核進行復染。使用共聚焦顯微鏡的免疫熒光成像確定了PKH-26標記的HPSC sEV在正常和胰腺癌細胞中的總體攝取(圖3D和E)以及panc1和Miapaca2細胞中HPaStec sEV的攝取(圖3H)。圖像的更高放大倍率(1890X)顯示大多數sEV積聚在細胞的細胞膜上(圖3E和H)。細胞系之間的HPSC sEV攝取沒有顯著差異(圖3F和G)。Panc1細胞對HPaStec sEV的攝取明顯高于Miapaca2細胞(圖3I)。
4. sEV上的膜蛋白對于正常細胞系和癌細胞系中更好地攝取sEV可能至關重要
為了確定富含膜蛋白的HPSC衍生的sEV對于正常或癌細胞更好地攝取sEV是否至關重要,未消化的PKH-27標記的HPSC sEV(20μg/ml)或100ng蛋白酶K消化的PKH-26標記的HPSC sEV被HPNE,Panc1和Miapaca2細胞處理6小時。活細胞對sEV的攝取通過EVOS FL自動顯微鏡的實時成像可視化(圖3J)。與正常(HPNE)和癌細胞(Panc1和Miapaca2)對未消化的sEV的更高水平攝取相比,用蛋白酶K消化外泌體表面蛋白顯著減少了sEVs進入HPNE,PANC1和Miapaca2細胞(圖3J)。
5. 蛋白質組學確定了正常和癌癥相關人胰腺星狀細胞sEV之間的差異
PDAC相關的HPSC細胞比HPaStec分泌更多的外泌體sEV,并且含有完整膜蛋白的sEV更容易被癌細胞吸收。因此,為了測試HPSC和HPaStec細胞的sEV中的膜蛋白表達水平是否不同,將兩種細胞以生物一式三份生長。使用LC-MS/MS蛋白質組學收獲和分析sEV。使用MaxQuant處理后進行定量和質量控制,研究者鑒定了1481個蛋白質組進行進一步分析。與外泌體富集一致,ExoCarta數據庫中列出了1239個蛋白質組和1088個ExoCarta蛋白在兩種細胞類型的外泌體中鑒定(圖4A)。分別在HPSC或HPaStec sEV中獨家鑒定了60或91種ExoCarta蛋白(圖4A)。
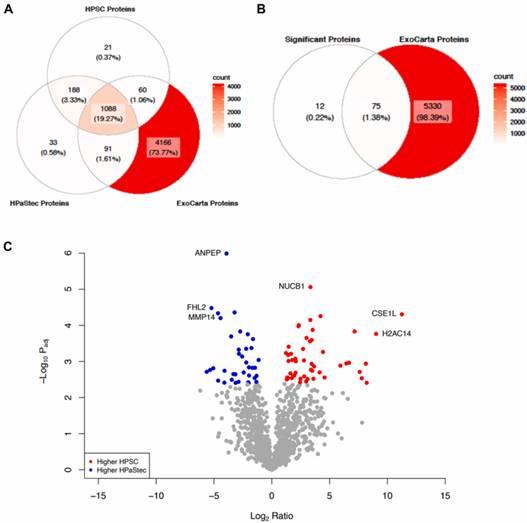
圖4HPSC和HPastec sEVs的差異蛋白表達水平的維恩圖和火山圖
研究者進行了Welch的t檢驗,并使用Benjamini-Hochberg方法調整了p值來測試HPSC和HPaStec sEV之間的蛋白質含量差異。研究者確定了87個差異表達的蛋白質組(圖4B和圖4C)。在HPSC sEV中升高的前10種蛋白質中,CSE1L顯著更高。
接下來,研究者使用Enrichr R包對87個差異表達的蛋白質組進行了途徑富集分析。基于基因本體:生物過程(GO:BP)的頂級顯著富集途徑與外泌體富集一致,包括細胞外基質組織、多泡體組裝和細胞-基質粘附。使用基因本體的頂級顯著富集途徑:細胞成分還包括細胞外或細胞膜途徑,如局灶粘附,絲狀肢和吞噬細胞囊泡。GO:BP通路分析顯示,HPSC sEVs中轉運(ESCRT)復合物拆卸和多泡體組織和組裝所需的內體分選復合物,而HPaStec sEVs具有升高的細胞粘附和細胞外組織途徑。ESCRT途徑含有泛素化和促進多泡內體內sEV內化的膜蛋白。HPSC sEVs的GO:BP分析確定了與溶酶體相關的大量差異表達蛋白,溶酶體是細胞中蛋白質更新的主要部分。
通路富集的一個已知缺點是它不考慮通路成員之間的相互作用。因此,研究者假設基于交互的方法將捕獲超越途徑富集發現的其他關系。為了驗證這一前提,研究者使用STRING蛋白-蛋白質相互作用數據庫查詢了87個差異表達的蛋白質組。如果存在多個蛋白質,研究者使用蛋白質組中的第一個蛋白質,并且研究者至少需要中等置信度的相互作用。所得網絡的相互作用明顯多于預期,由此,研究者發現69個蛋白質節點在一個大型子網中共享邊緣(圖5),ITGB1 具有最高的連接度數或連接數。這些結果表明差異表達的蛋白質組之間存在共性,并可能指向驅動HPSC-HPaStec差異的更深層次的生物學過程。
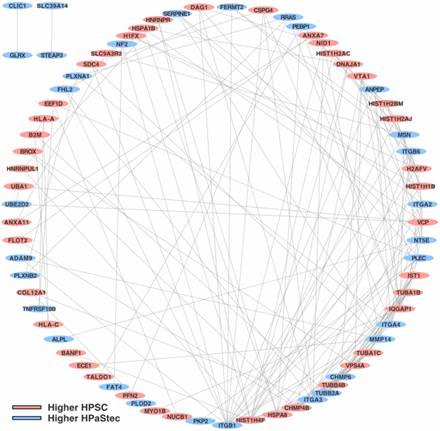
圖5 STRING蛋白-蛋白相互作用
6. CSE1L在PDAC相關的胰腺星狀細胞sEV中表達,與生存率低有關
研究者已經確定了在HPSC sEV中高度升高的特定蛋白質標記物,其中CSE1L是CSE1的人類同系物,是一種酵母染色體分離蛋白,優先在HPSC sEV中積累。CSE1L在HPSC sEV中顯著增加。CSE1L/XPO2_HUMAN由肽AADEEAFEDNSEEYIRR鑒定,質量數測量精度為4.36 ppm。為了驗證,使用完整肽同位素的提取離子色譜圖進行相對定量以及每個樣品中所有已鑒定的CSE1L蛋白肽的歸一化信號強度之和顯示,與HPaStec sEV相比,HPSC sEV的強度增加(圖6A-C)。HPSC sEV組分中的CSE1L表達也顯著高于HPaStec sEVs(圖2A)通過蛋白質印跡分析。鑒于HPSC中CSE1L的急劇增加,研究者假設其發現可能與PDAC患者的結局有關。因此,研究者通過CSE1L基因表達測量和臨床結局數據從癌癥基因組圖譜(TCGA)中確定了174例PDAC患者,并通過中位CSE1L表達對這些患者進行分層。Kaplan-Meier生存分析顯示,較高的CSE1L表達與生存率顯著降低有關。
7. HPSC sEVs處理后Panc1細胞中的CSE1L表達和ERK信號傳導
接下來,為了研究HPSC sEVs和HPaStec sEVs對CSE1L表達的影響,在使用CSE1L,CD63和β-肌動蛋白進行蛋白質印跡分析之前,將HPSC sEVs(20μg/ ml)與Panc1或Miapaca2細胞共培養72小時。此外,為了確定sEVs對細胞的處理是否誘導細胞存活信號傳導,研究者評估了sEVs處理后的磷酸化ERK信號傳導。蛋白質印跡顯示,在使用HPSC sEV處理后,Panc1細胞中的CSE1L表達升高和ERK信號傳導增加(圖6D),但在Miapaca2細胞中沒有。相反,原代HPaStec sEV不調節任何癌細胞中CSE1L或ERK信號傳導的表達(圖6D)。
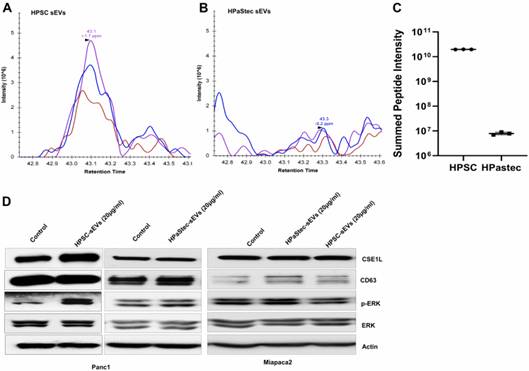
圖6CSE1/XPO2的LC-MS/MS鑒定
結論:
該研究成功鑒定了從PDAC相關星狀細胞分離的HPSC sEV和從正常胰腺分離的sEV中差異表達的蛋白質。該研究結果表明,HPSC sEVs在生物學上與HPaStec sEVs不同,可能為胰腺癌細胞提供有利的微環境,并可能成為將藥物或其他生物材料安全輸送到癌細胞的貨運載體。需要進一步的研究來闡明癌癥相關的星狀細胞sEVs在PDAC進展中的作用,這將為針對腫瘤基質的治療干預開辟道路。
參考文獻:
Sarcar B, Fang B, Izumi V, O Nunez Lopez Y, Tassielli A, Pratley R, et al. A comparative Proteomics Analysis Identified Differentially Expressed Proteins in Pancreatic Cancer-Associated Stellate Cell Small Extracellular Vesicles. Mol Cell Proteomics. 2022 Dec;21(12):100438. doi: 10.1016/j.mcpro.2022.100438.






