LncRNA CEBPA-DT通過與hnRNPC相互作用激活DDR2/β-catenin從而促進(jìn)肝癌轉(zhuǎn)移
原發(fā)性肝癌(PLC)是第六大最常見的人類癌癥類型,在全球癌癥死亡率中排名第三。肝細(xì)胞癌(HCC)是肝癌的主要組織學(xué)類型,約占PLC的90%。盡管在檢測(cè)和治療方面不斷改善,但由于肝細(xì)胞癌患者進(jìn)展迅速,術(shù)后腫瘤復(fù)發(fā)和轉(zhuǎn)移的患病率高,HCC患者的遠(yuǎn)期結(jié)局仍然較差,5年總生存率低于30%。因此,闡明HCC生長(zhǎng)和進(jìn)展的分子機(jī)制以確定新的治療靶點(diǎn)至關(guān)重要。長(zhǎng)非編碼RNA CEBPA-DT是CCAAT增強(qiáng)子結(jié)合蛋白α(CEBPA)基因的不同轉(zhuǎn)錄本,已被證明參與多種腫瘤進(jìn)展。然而,還沒有研究在HCC中建立其促癌機(jī)制。該研究發(fā)表于《Journal of Experimental & Clinical Cancer Research》,IF: 12.658。
技術(shù)路線:

主要研究結(jié)果:
1. CEBPA-DT在肝細(xì)胞癌組織中上調(diào),與患者預(yù)后相關(guān)
為了篩選與肝細(xì)胞癌轉(zhuǎn)移相關(guān)的lncRNA,采用RNA-seq分析術(shù)后肝外轉(zhuǎn)移患者的11個(gè)HCC組織和未發(fā)生轉(zhuǎn)移或復(fù)發(fā)的患者的11個(gè)HCC組織之間的差異表達(dá)基因,鑒定出320個(gè)顯著改變的lncRNA(圖1A)。6個(gè)lncRNA(CEBPA-DT,編號(hào):AL136372,MEG3,DBH-AS1,TUG1,PSMA3-AS1)在肝外轉(zhuǎn)移患者的11個(gè)HCC組織中具有最高的豐度(平均FPKM > 5)。CEBPA-DT被選為進(jìn)一步研究的候選lncRNA,因?yàn)樗窃谇懊嫣岬降?/span>6個(gè)候選lncRNA中(圖1B,C)最顯著的上調(diào)靶標(biāo)(log2(倍數(shù)變化)= 5.753,P = 0.013)。此外,研究者檢查了CEBPA-DT在54個(gè)具有相應(yīng)正常肝組織的肝細(xì)胞組織中的表達(dá)水平。RT-qPCR分析表明,肝癌組織中CEBPA-DT的表達(dá)顯著高于配對(duì)正常肝組織中的表達(dá)(圖1D)。在TCGA LIHC數(shù)據(jù)中的50對(duì)肝細(xì)胞癌和正常組織中也觀察到了類似的結(jié)果(圖1F)。
為了進(jìn)一步評(píng)估HCC患者中CEBPA-DT表達(dá)水平的預(yù)后價(jià)值,在88個(gè)HCC組織中測(cè)量了CEBPA-DT的表達(dá)水平。患者分為高CEBPA-DT組(n=44)和低CEBPA-DT組(n=44),符合CEBPA-DT在HCC組織中的表達(dá)。較高的CEBPA-DT表達(dá)水平與血清甲胎蛋白(AFP)水平升高、腫瘤體積較大、腫瘤分化差和微血管浸潤(rùn)(MVI)顯著相關(guān),提示CEBPA-DT表達(dá)較高與肝細(xì)胞癌生長(zhǎng)和轉(zhuǎn)移有關(guān)。Kaplan-Meier生存曲線表明,高CEBPA-DT水平組的HCC患者與低水平CEBPA-DT患者的總生存期(OS)和無復(fù)發(fā)生存期(RFS)顯著相關(guān)(圖1E)。一致地,從TCGA LIHC隊(duì)列中獲得相同的結(jié)果(圖1G)。在單因素分析中,HBsAg陽(yáng)性狀態(tài),腫瘤分化差,腫瘤大小>5cm,存在MVI,AFP>400ng/μL,遠(yuǎn)處轉(zhuǎn)移和高CEBPA-DT表達(dá)被確定為與HCC患者OS和RFS陰暗相關(guān)的潛在危險(xiǎn)因素。這些變量進(jìn)一步包含在多元回歸模型中。結(jié)果顯示,MVI和高CEBPA-DT表達(dá)是OS和RFS的獨(dú)立危險(xiǎn)因素。

圖1 CEBPA-DT 在伴有肝外轉(zhuǎn)移的肝細(xì)胞癌中上調(diào),并與患者預(yù)后相關(guān)
2. CEBPA-DT促進(jìn)肝癌細(xì)胞在體外和體內(nèi)的增殖和轉(zhuǎn)移
選取7個(gè)人肝癌細(xì)胞系,采用RT-qPCR檢測(cè)CEBPA-DT的表達(dá)水平,結(jié)果表明,HCCLM9、SNU-449和SK-Hep1的CEBPA-DT表達(dá)水平高于Huh7、Hep3B和PLC/PRF/5。體外功能研究表明,沉默CEBPA-DT顯著抑制HCCLM9和SNU-449細(xì)胞的細(xì)胞增殖(圖2A,B)。同時(shí),跨孔遷移、侵襲和傷口愈合遷移試驗(yàn)表明,肝癌細(xì)胞中CEBPA-DT下調(diào)后,細(xì)胞運(yùn)動(dòng)受到顯著抑制(圖2C-F)。此外,采用流式細(xì)胞術(shù)研究了細(xì)胞凋亡和細(xì)胞周期分布,結(jié)果表明,CEBPA-DT的耗竭顯著提高了肝癌細(xì)胞的凋亡速率(圖2G,H)。同時(shí),在沉默CEBPA-DT后,觀察到G0/G1期肝癌細(xì)胞百分比增加,S期肝癌細(xì)胞百分比降低(圖2I,J)。接下來,通過Huh7,Hep3B和SK-Hep1細(xì)胞中的慢病毒感染構(gòu)建過表達(dá)CEBPA-DT的穩(wěn)定肝癌細(xì)胞系。CEBPA-DT的過表達(dá)顯著提高了Hep3B和Huh7細(xì)胞的生長(zhǎng)能力(圖3A,B)。在過表達(dá)肝癌細(xì)胞的CEBPA-DT中觀察到細(xì)胞運(yùn)動(dòng)的顯著增強(qiáng)(圖3C-F)。細(xì)胞凋亡試驗(yàn)表明,CEBPA-DT過表達(dá)降低了Huh7和Hep3B細(xì)胞的凋亡率(圖3G,H)。細(xì)胞周期分析顯示,CEBPA-DT過表達(dá)增加了S級(jí)分,降低了G0/G1級(jí)分(圖3I,J)。

圖2 CEBPA-DT的沉默在體外抑制肝癌細(xì)胞的腫瘤生長(zhǎng)和轉(zhuǎn)移

圖3 CEBPA-DT在體外促進(jìn)肝癌細(xì)胞的腫瘤生長(zhǎng)和轉(zhuǎn)移
研究者進(jìn)一步確定了CEBPA-DT對(duì)體內(nèi)致瘤性的影響。建立CEBPA-DT沉默HCCLM9細(xì)胞和CEBPA-DT過表達(dá)SK-Hep1細(xì)胞,并皮下注射到裸鼠體內(nèi)。當(dāng)CEBPA-DT被敲低時(shí),觀察到腫瘤體積和重量顯著降低,當(dāng)CEBPA-DT過表達(dá)時(shí),獲得相反的結(jié)果(圖4A,B),表明CEBPA-DT促進(jìn)體內(nèi)腫瘤生長(zhǎng)。為進(jìn)一步評(píng)價(jià)CEBPA-DT對(duì)體內(nèi)腫瘤轉(zhuǎn)移的影響,建立了肝原位植入模型和肺轉(zhuǎn)移模型。6周后,在肝臟中,CEBPA-DT沉默組觀察到的GFP熒光強(qiáng)度低于對(duì)照組(圖4C),當(dāng)CEBPA-DT過表達(dá)時(shí)表現(xiàn)出相反的結(jié)果(圖4D)。IVIS拍攝結(jié)果表明,CEBPA-DT敲低組與比對(duì)照組更弱的肺部生物發(fā)光信號(hào)強(qiáng)度相關(guān)(圖4G);同時(shí),與空載體組相比,CEBPA-DT過表達(dá)增強(qiáng)了肺部的生物發(fā)光活性(圖4H)。蘇木精和伊紅(HE)染色結(jié)果顯示,CEBPA-DT沉默組的轉(zhuǎn)移灶數(shù)量均在肝臟中減少(圖4E)。相比之下,與對(duì)照組相比,CEBPA-DT過表達(dá)組的肝肺轉(zhuǎn)移灶數(shù)量增加(圖4F,J)。綜上所述,CEBPA-DT是一種促癌lncRNA,可促進(jìn)肝癌細(xì)胞在體外和體內(nèi)的增殖和轉(zhuǎn)移。

圖4 CEBPA-DT促進(jìn)體內(nèi)腫瘤生長(zhǎng)和轉(zhuǎn)移
3. CEBPA-DT與RNA結(jié)合蛋白hnRNPC相互作用
為了驗(yàn)證CEBPA-DT是否充當(dāng)“miRNA海綿”,研究者進(jìn)行了生物信息學(xué)分析,以使用Starbase評(píng)估CEBPA-DT的潛在結(jié)合miRNA。結(jié)果表明,has-miR-532-3p是最具約束力的靶標(biāo)。研究者接下來建立了CEBPA-DT野生型和突變熒光素酶質(zhì)粒;通過野生型/突變的CEBPA-DT與NC模擬物/ miR-532-3p的共轉(zhuǎn)染,通過Rluc/Fluc測(cè)量相對(duì)熒光素酶活性。為了驗(yàn)證CEBPA-DT是否通過與蛋白質(zhì)結(jié)合來調(diào)節(jié)腫瘤生長(zhǎng)和轉(zhuǎn)移,研究者接下來進(jìn)行了生物素標(biāo)記的RNA pull-down和質(zhì)譜(MS)以篩選與肝癌細(xì)胞中CEBPA-DT相互作用的蛋白質(zhì)。由于RNA FISH和先前進(jìn)行的亞細(xì)胞RNA分級(jí)分離測(cè)定證明CEBPA-DT主要位于細(xì)胞核中(圖5A),僅使用核提取物進(jìn)行RNA pull-down測(cè)定。銀染在近40 kD處鑒定出特定的蛋白質(zhì)條帶,隨后通過MS檢測(cè)(圖5B)。共鑒定出177種蛋白質(zhì)作為CEBPA-DT相互作用靶標(biāo)。其中,RNA結(jié)合蛋白異質(zhì)核糖核蛋白C(hnRNPC)得分最高(圖5B)。
為了驗(yàn)證CEBPA-DT與hnRNPC之間的相互作用,研究者確定了hnRNPC的亞細(xì)胞位置。接下來,生物素標(biāo)記的RNA pull-down和RIP測(cè)定進(jìn)一步證實(shí)了CEBPA-DT可以與hnRNPC相互作用(圖5C,D)。為了進(jìn)一步驗(yàn)證CEBPA-DT和hnRNPC之間的特異性相互作用位點(diǎn),研究者構(gòu)建了三個(gè)CEBPA-DT截短片段(1-750nt,751-1500nt和1501-2252nt)(圖5E),以及基于RNA識(shí)別基序(RRM,16-87aa)的截短hnRNPC片段(圖5G)。RNA pull-down測(cè)定顯示,751-1500個(gè)核苷酸負(fù)責(zé)CEBPA-DT與hnRNPC的RNA識(shí)別基序之間的相互作用(圖5F,H)。先前的一項(xiàng)研究證明,hnRNPC通過與c-myc相互作用,從細(xì)胞核部分地重新定位到細(xì)胞質(zhì)。研究者假設(shè)CEBPA-DT和hnRNPC之間的相互作用可以激活hnRNPC的亞細(xì)胞重定位。亞細(xì)胞蛋白分離測(cè)定顯示,CEBPA-DT的過表達(dá)上調(diào)了細(xì)胞質(zhì)中hnRNPC的蛋白水平,同時(shí)降低了細(xì)胞核中的hnRNPC水平(圖5I)。通過RNA FISH結(jié)合IF測(cè)定獲得了類似的觀察結(jié)果(圖5J)。綜上所述,這些數(shù)據(jù)表明CEBPA-DT可能在物理上結(jié)合hnRNPC并誘導(dǎo)hnRNPC從肝癌細(xì)胞的細(xì)胞核到細(xì)胞質(zhì)的轉(zhuǎn)定位。

圖5 CEBPA-DT與RNA結(jié)合蛋白hnRNPC相互作用
4. CEBPA-DT通過hnRNPC-DDR2軸促進(jìn)肝癌細(xì)胞的轉(zhuǎn)移
更深入地了解CEBPA-DT在肝癌細(xì)胞中的致瘤作用。進(jìn)行RNA測(cè)序以分析受CEBPA-DT沉默影響的轉(zhuǎn)錄組變化。聚類分析顯示,CEBPA-DT沉默HCCLM9細(xì)胞中共有2040個(gè)下調(diào)基因。不同數(shù)據(jù)庫(kù)中的進(jìn)一步富集分析表明,細(xì)胞外基質(zhì)相關(guān)途徑和基因表現(xiàn)出最顯著的改變(圖6A)。這些分析的交集揭示了8個(gè)下調(diào)基因,這些基因受到RT-qPCR的影響,結(jié)果表明,沉默CEBPA-DT后,DDR2的mRNA水平下調(diào)最顯著(圖6B)。
作為普遍表達(dá)的異質(zhì)核糖核蛋白(hnRNPs)家族的成員,hnRNPC作為RBP結(jié)合核RNA,對(duì)于許多mRNA的穩(wěn)定和翻譯至關(guān)重要,通常與靶mRNA的3' UTR區(qū)域相互作用。考慮到CEBPA-DT誘導(dǎo)hnRNPC從細(xì)胞核向細(xì)胞質(zhì)的重新定位,以及CEBPA-DT調(diào)控DDR2 mRNA水平,研究者假設(shè)CEBPA-DT可能增強(qiáng)DDR2 mRNA的穩(wěn)定性,從而通過增加hnRNPC的細(xì)胞質(zhì)表達(dá)來促進(jìn)翻譯。為了驗(yàn)證這一猜想,研究者測(cè)量了用siRNA沉默hnRNPC后DDR2的mRNA和蛋白質(zhì)水平。結(jié)果表明,DDR2 mRNA和蛋白質(zhì)水平顯著下調(diào)(圖6C,D)。更關(guān)鍵的是,在CEBPA-DT上調(diào)后,hnRNPC與DDR2 mRNA之間的相互作用明顯增強(qiáng)(圖6E)。總之,這些結(jié)果表明DDR2是CEBPA-DT-hnRNPC復(fù)合物的下游靶標(biāo)。
研究者相繼研究了CEBPA-DT-hnRNPC軸對(duì)DDR2下調(diào)的影響機(jī)制。通過放線菌素D處理肝癌細(xì)胞,研究者發(fā)現(xiàn)CEBPA-DT的過表達(dá)降低了DDR2 mRNA的降解,延長(zhǎng)了其半衰期,從而增加了DDR2 mRNA的表達(dá),同時(shí)hnRNPC的缺失顯著抑制了這種促進(jìn),提高了DDR2 mRNA水平(圖6G)。一致地,在CEBPA-DT上調(diào)和hnRNPC沉默后,蛋白質(zhì)水平表現(xiàn)出相同的變化趨勢(shì)(圖6F)。
先前的一項(xiàng)研究闡明DDR2有助于HCC侵襲和轉(zhuǎn)移。研究者的體外功能研究表明,在沉默DDR2的mRNA和蛋白質(zhì)水平后,肝癌細(xì)胞的運(yùn)動(dòng)性受到顯著抑制。在功能上,傷口愈合和Transwell測(cè)定表明,CEBPA-DT的過表達(dá)可以增強(qiáng)肝癌細(xì)胞的運(yùn)動(dòng)性,而DDR2的缺失可以阻止這種增強(qiáng)。裸鼠肺轉(zhuǎn)移模型也獲得了類似的結(jié)果(圖6H)。此外,通過在50個(gè)HCC樣品中應(yīng)用IHC和RT-qPCR,研究者發(fā)現(xiàn)與正常組織相比,HCC組織中DDR2的蛋白質(zhì)和mRNA水平明顯增加(圖6I)。此外,DDR2的表達(dá)與HCC組織中CEBPA-DT的表達(dá)呈正相關(guān)(圖6J)。綜上所述,上述數(shù)據(jù)表明CEBPA-DT可以通過hnRNPC-DDR2軸促進(jìn)HCC的轉(zhuǎn)移。

圖6 CEBPA-DT通過hnRNPC-DDR2軸促進(jìn)肝癌細(xì)胞的轉(zhuǎn)移
5. CEBPA-DT誘導(dǎo)肝癌細(xì)胞中的EMT
先前的研究表明,CEBPA-DT下調(diào)改變了EMT相關(guān)基因的表達(dá);然而,CEBPA-DT參與EMT過程的分子機(jī)制尚不清楚。本研究首先采用RT-qPCR篩選了幾種EMT標(biāo)志物,包括上皮標(biāo)志物E-鈣粘蛋白(CDH1)、間充質(zhì)標(biāo)志物N-鈣粘蛋白(CDH2)、Vimentin(VIM)、SNAIL1、SNAIL2、ZEB1、TWIST1和FOXC1,結(jié)果表明,敲低CEBPA-DT誘導(dǎo)上皮標(biāo)志物CDH1的表達(dá),同時(shí)抑制間充質(zhì)標(biāo)志物(CDH2、VIM、SNAIL1)的表達(dá)。同時(shí),CEBPA-DT的過表達(dá)表現(xiàn)出相反的結(jié)果。在ZEB1,SNAIL2,TWIST1和FOXC1中沒有觀察到顯著的變化(圖7A)。為了檢查EMT轉(zhuǎn)錄因子Snail1是否被CEBPA-DT激活,將Snail1啟動(dòng)子熒光素酶報(bào)告質(zhì)粒轉(zhuǎn)染到肝癌細(xì)胞中。結(jié)果表明,CEBPA-DT沉默顯著降低了Snail1啟動(dòng)子的活性,而上調(diào)的CEBPA-DT顯著誘導(dǎo)了啟動(dòng)子活性(圖7B)。蛋白質(zhì)印跡實(shí)驗(yàn)證實(shí),CEBPA-DT過表達(dá)抑制了E-鈣粘蛋白的蛋白表達(dá),誘導(dǎo)了肝癌細(xì)胞中N-鈣粘蛋白、Vimentin、Snail和DDR2的表達(dá),而CEBPA-DT下調(diào)的結(jié)果相反(圖7C)。根據(jù)蛋白質(zhì)印跡測(cè)定,IF實(shí)驗(yàn)表明,CEBPA-DT的消耗顯著增加了E-鈣粘蛋白的表達(dá),并降低了Vimentin和Snail的表達(dá)(圖7D)。為了進(jìn)一步驗(yàn)證EMT過程是通過CEBPA-DT激活Snail1誘導(dǎo)的,研究者在Huh7細(xì)胞中敲低了Snail1。CEBPA-DT上調(diào)促進(jìn)間充質(zhì)標(biāo)志物的表達(dá)因沉默蝸牛1而減弱;在上皮標(biāo)志物E-鈣粘蛋白的表達(dá)中觀察到相反的趨勢(shì)(圖7E)。綜上所述,這些數(shù)據(jù)表明CEBPA-DT通過Snail1的轉(zhuǎn)錄激活誘導(dǎo)肝癌細(xì)胞中的EMT。

圖7 CEBPA-DT在肝癌細(xì)胞中誘導(dǎo)EMT
6. CEBPA-DT通過DDR2和β-連環(huán)蛋白之間的相互作用促進(jìn)EMT過程
作為Wnt/β-連環(huán)蛋白通路的核心成分,β-連環(huán)蛋白被發(fā)現(xiàn)在HCC轉(zhuǎn)移中被定期激活,并與EMT過程密切相關(guān)。因此,研究者假設(shè)β-連環(huán)蛋白參與了CEBPA-DT調(diào)節(jié)的EMT過程。首先,亞細(xì)胞蛋白分級(jí)分離顯示,細(xì)胞核組分中的β-連環(huán)蛋白表達(dá)在CEBPA-DT過表達(dá)肝癌細(xì)胞中顯著上調(diào),在CEBPA-DT沉默細(xì)胞中下調(diào),而細(xì)胞質(zhì)部分β-連環(huán)蛋白的表達(dá)保持不變(圖8A)。接下來,免疫熒光測(cè)定表明,在CEBPA-DT沉默時(shí),核β-連環(huán)蛋白顯著重新定位到肝癌細(xì)胞的細(xì)胞質(zhì)中。相反,CEBPA-DT上調(diào)后促進(jìn)了β連環(huán)蛋白的核易位(圖8B)。為了探索Wnt/β-連環(huán)蛋白信號(hào)傳導(dǎo)的轉(zhuǎn)錄活性,進(jìn)行了TOP/FOP-Flash熒光素酶報(bào)告測(cè)定,結(jié)果表明,在HCCLM9載體細(xì)胞和β連環(huán)蛋白過表達(dá)細(xì)胞中敲低CEBPA-DT降低了轉(zhuǎn)錄活性(圖8E)。
為了評(píng)價(jià)β連環(huán)蛋白對(duì)蝸牛1啟動(dòng)子活性的調(diào)控能力,研究者進(jìn)行了生物信息學(xué)分析,預(yù)測(cè)了β-連環(huán)蛋白在蝸牛1啟動(dòng)子區(qū)域的結(jié)合位點(diǎn)(圖8C)。進(jìn)一步的 ChIP-qPCR 測(cè)定表明 Snial1 啟動(dòng)子區(qū)域的結(jié)合位點(diǎn) 1 上β-連環(huán)蛋白顯著富集;同時(shí),CEBPA-DT沉默可以明顯抑制這種富集(圖8D)。
早期的一項(xiàng)研究已經(jīng)證明了DDR2在EMT過程中的調(diào)節(jié)作用。研究者的數(shù)據(jù)證實(shí)DDR2受CEBPA-DT監(jiān)管。因此,研究者推測(cè)DDR2和β-連環(huán)蛋白之間存在相互作用,這種相互作用是CEBPA-DT調(diào)控EMT過程所必需的。首先,使用針對(duì)DDR2的特異性抗體進(jìn)行免疫共沉淀測(cè)定,結(jié)果表明DDR2確實(shí)可以與β-連環(huán)蛋白相互作用,并且在CEBPA-DT沉默后相互作用減弱,并在CEBPA-DT過表達(dá)后得到加強(qiáng)(圖8F)。接下來,使用一種特異性抑制劑DDR2-IN-1來抑制DDR2。隨著DDR2-IN-1的存在,由CEBPA-DT過表達(dá)調(diào)節(jié)的β-連環(huán)蛋白的核易位增加顯著耗盡(圖8G)。最后,蛋白質(zhì)印跡試驗(yàn)顯示DDR2抑制可能導(dǎo)致CEBPA-DT誘導(dǎo)EMT過程的抑制;β-連環(huán)蛋白的過表達(dá)挽救了這種抑制(圖8H)。綜上所述,CEBPA-DT通過DDR2與β-連環(huán)蛋白的相互作用促進(jìn)了EMT過程。
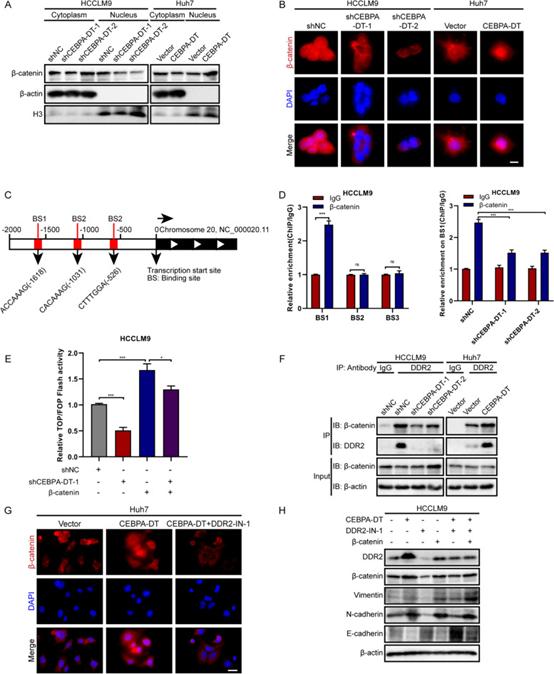
圖8 CEBPA-DT通過DDR2和β-catenin之間的相互作用促進(jìn)EMT過程
結(jié)論:
綜上所述,該研究將CEBPA-DT確定為HCC轉(zhuǎn)移的效應(yīng)物。此外,研究者發(fā)現(xiàn)CEBPA-DT通過與hnPNPC相互作用激活DDR2/β-連環(huán)蛋白軸來促進(jìn)HCC的進(jìn)展和轉(zhuǎn)移。重要的是,該研究結(jié)果為lncRNA參與HCC轉(zhuǎn)移的潛在分子機(jī)制提供了新的見解,并為進(jìn)一步的CEBPA-DT靶向HCC治療方法奠定了基礎(chǔ)。
示意圖:
說明CEBPA-DT在肝癌轉(zhuǎn)移中的作用

參考文獻(xiàn):
Cai Y, Lyu T, Li H, Liu C, Xie K, Xu L, et al. LncRNA CEBPA-DT promotes liver cancer metastasis through DDR2/β-catenin activation via interacting with hnRNPC. J Exp Clin Cancer Res. 2022 Dec 6;41(1):335. doi: 10.1186/s13046-022-02544-6.






