一項多組學研究描述了食管鱗狀細胞癌的新分子特征和治療靶點
食管鱗狀細胞癌(ESCC)是食管癌的主要組織學亞型,預后較差。有研究對未經治療的食管鱗癌和配對正常癌旁組織進行了全面的轉錄組學、蛋白質組學、磷酸化蛋白質組學和代謝組學特征分析,以識別食管鱗癌新的分子弱點和潛在的治療靶點。該研究發表在《Clinical and Translational Medicine》,IF:8.554。
實驗方法:轉錄組學、蛋白質組學、磷酸化蛋白質組學和代謝組
技術路線:

主要研究結果:
1. 多層組學分析ESCC的分子圖譜
我們納入了24例食管鱗癌患者(初治病例)作為隊列1,并收集了配對的腫瘤和NAT樣本。我們對每個樣本進行了RNA-seq、基于數據獨立采集(DIA)的蛋白質組學和非靶向代謝組學研究(圖1A)。由于組織樣本的限制,我們只選擇了3對腫瘤和NAT組織進行基于質譜的同位素標記相對和絕對定量(iTRAQ)的磷酸化蛋白質組學分析。此外,我們收集了對照小鼠和由致癌物4-NQO誘導的ESCC小鼠的食管組織,用于RNA-seq和非靶向代謝組學調查,以驗證ESCC分子特征在不同物種之間的保守性(圖1A)。圖1B總結了ESCC患者隊列1的臨床特征。
mRNA的選擇性剪接(AS)允許多種RNA亞型的表達,并有助于蛋白質組的復雜性。因此,我們從RNA-seq數據中檢測了包括其各自亞型在內的基因表達。我們利用多層組學數據進行了無監督層次聚類和主成分分析(PCA)以確定人類食管鱗癌的分子特征。與NAT相比,ESCC組織在基因、基因亞型、蛋白、磷蛋白和代謝物水平顯示出不同的標簽(圖1C)。由于磷酸化蛋白質組學研究只在三對樣本中進行,因此磷酸化蛋白質組學數據被排除在后續的多變量分析中。接下來,我們使用cluster算法對RNA-seq、蛋白質組學和代謝組學數據進行了整合聚類,結果清楚地區分了ESCC和NAT樣本(圖1D)。最后,我們使用DIABLO算法35從所有患者樣本的組學數據中提取分子譜,從而可以計算任意兩個分子譜之間的相關性。結果顯示了任意兩個組學特征之間的強相關性(圖1E),表明ESCC和NAT樣本在不同的分子層之間存在一致的差異。

圖1 ES的多層組學分析
2. 轉錄組和蛋白質組之間的不一致揭示了活躍的轉錄后和翻譯后調控
下一步是確定ESCC和NAT樣本的mRNA-蛋白關系差異。首先,我們進行了基因相關分析。盡管在兩組樣本中,mRNA和蛋白的表達水平存在顯著差異,食管鱗癌組織的中位相關值為0.06,而NAT的中位相關值為0,但腫瘤組織的相關值相對于NAT的分布出現右移 (圖2A),表明在腫瘤組織中有較強的正相關性。食管鱗癌和NAT組織的中位相關值分別為0.20和0.15。與NAT相比,食管鱗癌組織顯示出明顯的相關值分布右移 (圖2B),表明在腫瘤組織中有較強的正相關性。發現腫瘤組織中大部分蛋白不僅在相應mRNA增加時上調,而且在相應mRNA不受干擾或減少時也上調(圖2C)。然而,無論相應mRNA的表達模式如何,NAT組織中的大多數蛋白均下調(圖2C)。此外,與NAT相比,在ESCC腫瘤中觀察到更多上調的mRNA (圖2C)。總之,這些結果表明,mRNA轉錄和翻譯在食管鱗癌組織中增強,并且轉錄后調節過度活躍。
因此,假設在食管鱗癌腫瘤中,那些在mRNA和蛋白水平上表達增加的基因(即具有高轉錄和翻譯活性)作為核心上游信號,導致了在食管鱗癌和NAT組織中觀察到的轉錄后調節的差異。為了驗證假設,我們納入了在腫瘤組織中mRNA豐度增加,并且在所有組織中mRNA和相應蛋白呈正相關的基因進行分析。GO分析顯示,RNA加工、RNA切片和基因表達的活性在食管鱗癌腫瘤中顯著增強(圖2D)。在這480個基因中,在ESCC組織中產生極高水平蛋白的基因包括SRSF10、SF3A2、CSTF2和RIF1(圖2E)。在我們的ESCC腫瘤蛋白質組學數據中,SRSF10、SF3A2和CSTF2與增殖標志物Ki-67和/或PCNA呈正相關(圖2F)。此外,SRSF10和SF3A2與分化標志物S100A14呈負相關(圖2F)。SRSF10、SF3A2和CSTF2可能參與了食管鱗癌的發生發展。
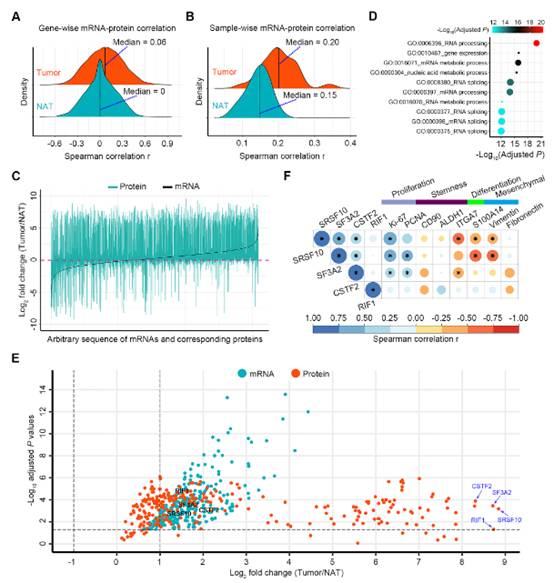
圖2轉錄組和蛋白之間的相關性
然后,我們假設上述的蛋白質活性參與上游信號傳導,并通過改變蛋白質組影響轉錄后控制。因此,我們使用參與轉錄后和翻譯后水平控制的所有蛋白質和選擇的基因集進行了GSEA。正如預期的那樣,在轉錄和翻譯相關功能方面,腫瘤的富集程度顯著高于NAT(圖3A)。然后,我們提取了轉錄后和翻譯后調節的關鍵蛋白,包括RNA轉錄成員、調節大量細胞RNA豐度的無義介導的mRNA衰變(NMD)途徑、蛋白質翻譯的關鍵真核起始因子(EIF)復合體和蛋白質降解的關鍵蛋白泛素-蛋白酶體系統(UPS)。其中,大多數在食管鱗癌和NAT組織中差異表達的蛋白質在腫瘤中表達上調(圖3B-E),這與食管鱗癌組織中RNA轉錄、RNA衰變、蛋白質翻譯和蛋白質水解的速度加快一致。
已知AS是一個關鍵的轉錄后過程,為了提供更多關于ESCC中活躍的轉錄后調控的證據,我們使用SpliceSeq工具分析了我們RNA-seq數據中7種常見的AS事件,包括替代受體位點(AA)、替代供體位點(AD)、替代啟動子(AP)、替代終止子(AT)、外顯子跳躍(ES)、互斥外顯子(ME)和保留內含子(RI)。我們計算了RNA轉錄本的剪接百分比(PSI)值,該值揭示了這些序列在特定AS事件中剪接成轉錄本的效率39ESCC腫瘤和NAT之間有3883個PSI值有統計學差異的RNA轉錄本,在腫瘤中觀察到更多的AA、AD、AT、ES和RI事件(圖3F)。這與之前的研究一致,即與NAT組織相比,乳腺癌和結直腸癌組織中的AS事件增加。

圖3轉錄、轉錄后、翻譯和翻譯后的機制研究
3. 分子途徑和代謝特征的綜合說明
由于mRNA和蛋白質之間的高度不一致性,我們使用蛋白質組學數據結合磷酸化蛋白質組學和代謝組學數據來描繪人食管鱗癌的多層分子改變。首先,我們利用蛋白質組學數據分析了食管鱗癌中失調的通路。食管鱗癌組織中有2890個DEPs (圖S10A)。然后,我們構建了proteomaps,根據KEGG通路注釋將DEPs聚類,并觀察到ESCC腫瘤和NAT之間存在顯著差異(圖4A)。食管鱗癌腫瘤組織中剪接體、組蛋白和核糖體相關蛋白水平較高,細胞骨架蛋白水平較低。隨后,我們使用這些DEPs進行了GSVA18,以量化通路激活。共有157條通路在ESCC腫瘤中被發現顯著干擾 (圖4B)。磷酸化蛋白質組學顯示,這些磷酸鹽的相應蛋白參與RNA轉錄、加工和代謝的通路在人食管鱗癌腫瘤中被激活 (圖4C)。
隨后,我們利用代謝組學數據分析了人類食管鱗癌的代謝特征。有56.50%(113/200)的代謝物在食管鱗癌組織中存在差異表達。在這些差異表達代謝物DEMs中,83.19%(94/113)表達上調(圖4D),表明ESCC腫瘤具有活躍的代謝特征。然后,我們使用這113個腫瘤標志物進行MSEA,并在食管鱗癌腫瘤中觀察到總共17條代謝通路有顯著擾動 (圖4E)。其中58.82%(10/17)的通路與氨基酸代謝有關,表明氨基酸代謝紊亂在食管鱗癌中占主導地位。
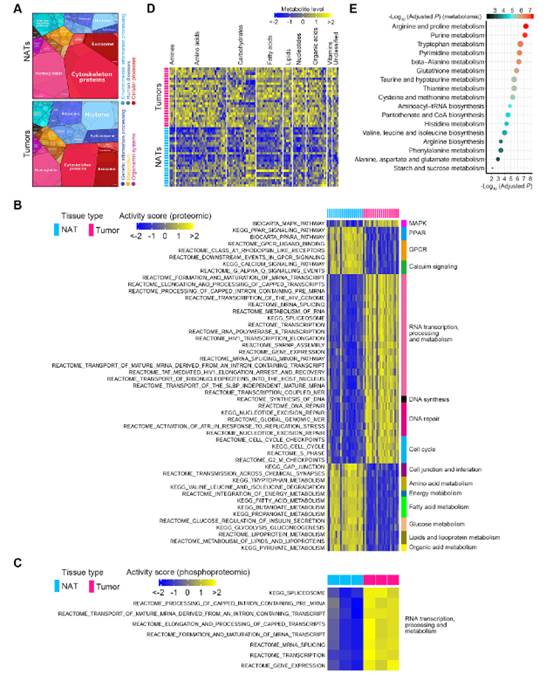
圖4 ESCC分子特征的多組學分析
蛋白質組學和磷酸化蛋白質組學數據表明,與RNA轉錄、加工和代謝相關的通路活性增加,表明這些通路對食管鱗癌的病理生物學至關重要。下一節將詳細分析這些途徑。然后,我們利用代謝組學和蛋白質組學數據,對食管鱗癌中最受干擾的代謝通路精氨酸和脯氨酸代謝進行了綜合分析。該網絡強調指出,ESCC腫瘤選擇性地表達了幾種代謝酶,從而加快了氨基酸的生成(圖5A)。鑒于代謝物在細胞表型確定中的重要性,我們對代表ESCC關鍵細胞表型的DEMs和DEPs進行了相關性分析(圖5B)。這些代謝物包括5個氨基酸(半胱氨酸、谷氨酰胺、氨基丙二酸、甲基半胱氨酸和3-亞砜-丙氨酸)、2個碳水化合物(山梨醇和阿拉伯糖醇)、1個核苷酸(胞苷)、2個有機酸(蘋果酸和脫氫抗壞血酸)、1個維生素(吡哆醇)和2個未分類的代謝物(組胺和2-羥基吡啶)。這些結果表明,改變的代謝物可能參與影響食管鱗癌的干性。
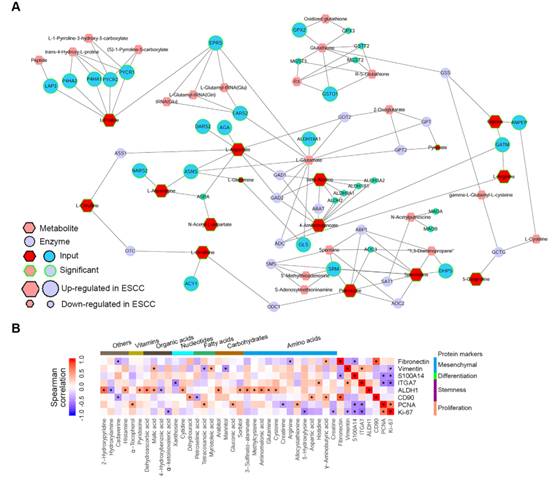
圖5利用蛋白質組學和代謝組學數據綜合分析ESCC的分子特征
4. 通過蛋白質組學和磷蛋白質組學分析,RNA轉錄、加工和代謝的刺激途徑被揭示
如上所述,蛋白質組學和磷酸化蛋白質組學數據確定了參與RNA轉錄、加工和代謝的通路(圖4B,C),因此提示了這些通路在ESCC惡性程度中的重要性。因此,這些通路的特征被徹底解剖。各通路中顯著上調的蛋白占全部富集蛋白和差異蛋白的百分比分別為:剪接體(KEGG) 97.75%、含內含子的pre-mRNA的加工100.00%、mRNA轉錄形成和成熟100.00%、mRNA剪接100.00%、來自含內含子轉錄本的成熟mRNA的轉運100.00%、延伸和處理封頂轉錄物100.00%和轉錄100.00% (圖6)。而食管鱗癌腫瘤中顯著增強的磷酸化位點占各通路中完全富集和差異磷酸化位點的百分比值分別為87.50%、96.15%、100.00%、95.83%、95.00%(19/20)、93.75%、100.00% (圖6)。綜上所述,這些發現表明這些分子通路在食管鱗癌腫瘤中受到異常刺激。

圖6 通過蛋白質組學和磷蛋白質組學數據的綜合分析,確定了ESCC的基本途徑
5. 具有預后潛力的蛋白質標記物的鑒定
對于患者隊列1的食管鱗癌組織中的DEPs,我們試圖鑒定那些與患者生存密切相關并可能參與食管鱗癌進展的蛋白質。采用單因素Cox模型分析各蛋白與患者生存期的關系,共鑒定出118個具有預后潛力的蛋白。在這些蛋白質中,66個與疾病復發或死亡風險呈正相關(圖7A)。KEGG通路分析顯示,這118個預后蛋白主要富集在吞噬體、補體和凝血級聯通路、p53信號通路、果糖和甘露糖代謝通路 (圖7B)。
分析66個與HR正相關的預后蛋白在食管鱗癌患者組織中蛋白及相應mRNA水平的變化。其中23個蛋白與其對應的mRNA表現出一致的表達方向,表明這些蛋白在轉錄水平受到調節(圖7C)。其中14個基因包括HACD2、RBM3、MRPL14、PCNP、XPNPEP3、TBC1D5、BPTF、CEP170B、PTPN13、NAA50)、SNRPF、NUP43、FBL和CHCHD2的蛋白和mRNA水平均顯著上調(圖7C)。在4-NQO誘導的ESCC小鼠中檢測這些基因的mRNA轉錄水平。結果顯示,與對照小鼠相比,其中RBM3、BPTF和FBL在ESCC小鼠的食管組織中顯著增加(圖7D),表明這三個基因在ESCC中的上調在不同物種中是保守的。接下來,我們選擇了5個在ESCC腫瘤中上調最多的蛋白質,包括HACD2, RBM3, MRPL14, PCNP和XPNPEP3,以及BPTF和FBL進行進一步研究。
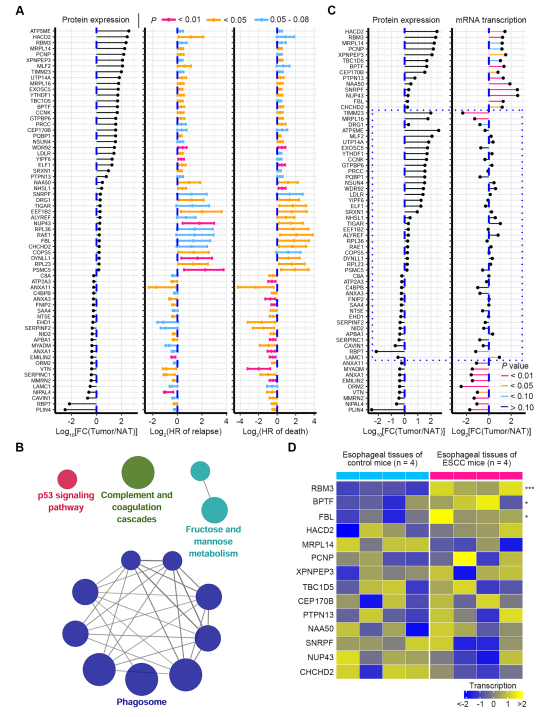
圖7 有預后價值的蛋白質標記物的發現
6. 驗證和功能分析強調FBL是一個新的不利預后的生物標志物
隨后,我們納入了食管鱗癌患者隊列2 (n = 41),并進行了Western blot檢測,以驗證上述7種具有預后潛力的蛋白在食管鱗癌組織中的表達。結果顯示,FBL, XPNPEP3和BPTF在ESCC腫瘤中相對于配對NAT顯著增加(圖8A)。然后我們探討了FBL、BPTF和XPNPEP3對ESCC細胞惡性腫瘤的影響。利用兩種人ESCC細胞系KYSE150和Eca109分別刪除FBL、BPTF和XPNPEP3,通過對每個基因使用兩個不同的引導RNA。體外研究顯示,FBL的去除顯著下調了細胞增殖標志物PCNA的表達,并顯著抑制了ESCC細胞的生長(圖8B)。體內研究顯示,FBL缺失顯著損害KYSE150異種移植瘤的腫瘤生長(圖8C,D)。最后,我們納入了一個ESCC患者隊列3 (n = 100),對FBL進行了免疫組化染色研究,結果證實了FBL在ESCC腫瘤中的表達相對于NAT上調,以及其作為預后生物標志物的有用性(圖8E)。重要的是,FBL高表達預示著ESCC患者較差的總生存期和無復發生存期(圖8F)。
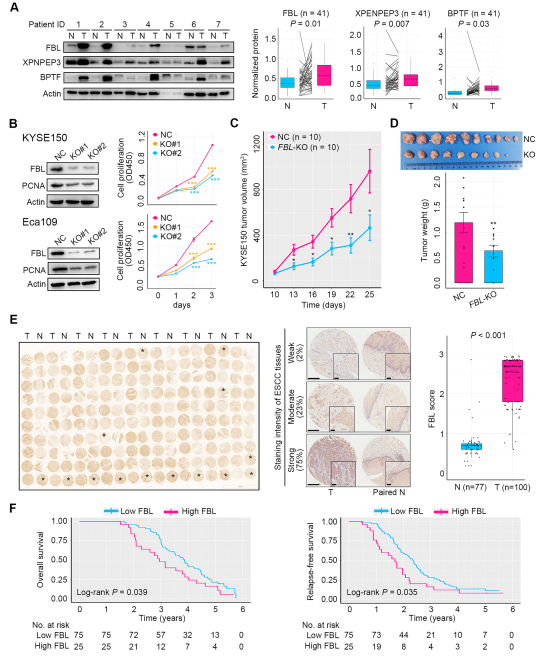
圖8預后蛋白標記物的驗證和功能分析
7. 參與ESCC發育的關鍵分子事件綜述
如上所述,FBL在體外和體內對ESCC細胞的生長至關重要。FBL是一種核仁甲基轉移酶,主要作用于rRNA和組蛋白H2A的位點特異性甲基化,從而促進核糖體組裝和早期胚胎發育。因此,它在腫瘤中增加的存在表明,表觀遺傳調節和核糖體中的mRNA翻譯可能參與了ESCC的發展。其次,作為一個重要的轉錄后過程,AS在ESCC腫瘤中是活躍的(圖3F)。此外,在ESCC腫瘤中刺激了與RNA轉錄、加工和代謝相關的通路(圖6)。總之,這些結果表明轉錄后和翻譯后調控參與了食管鱗癌的發展。最后,一系列代謝物和代謝通路在食管鱗癌腫瘤中上調(圖4D,E),這意味著激活的代謝是維持食管鱗癌惡性所必需的。綜上所述,我們推斷表觀遺傳、轉錄后、翻譯后和代謝層的分子事件密切合作,促進了ESCC的發生和進展(圖9)。
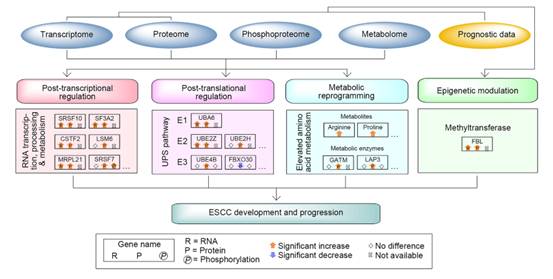
圖9 通過多層研究描述ESCC發育過程中的分子事件的模型
8. 腫瘤抗原和潛在癌癥驅動因素和關鍵激酶的藥物注釋
包括CT抗原在內的新腫瘤抗原的鑒定將為癌癥免疫治療疫苗的開發提供更多的機會通過蛋白質組學數據,我們發現四種已知的CT抗原MAGEB2、MAGEA4、MAGEA8和SPAG9在ESCC腫瘤中明顯升高,與NATs相比,FC范圍為1.84至223.50 (圖10A)。此外,識別改變的潛在癌癥驅動因子和激酶將提高我們對癌癥生物學的理解,并產生新的治療靶點。我們使用我們的蛋白質組學數據進行了研究。通過將我們的數據與之前描述的潛在癌癥驅動因素列表進行比較21,我們確定了32個在ESCC組織中增加4倍以上的潛在驅動因素 (圖10B)。此外,通過與PhosphoSitePlus和NetworKIN的激酶列表進行數據比較,我們發現29種已知激酶在ESCC組織中增加了4倍以上 (圖10C)隨后,我們利用兩個藥物數據庫DrugBank和PKIDB 對這些在食管鱗癌中升高的潛在癌癥驅動因子和激酶進行了藥物注釋。結果顯示,21.88%(7/32)的癌癥驅動因子和86.21%(25/29)的激酶具有靶向抑制劑(圖10B,C)。這些抑制劑可作為食管鱗癌的新療法。

圖10 ESCC中腫瘤抗原的鑒定及潛在腫瘤驅動因子和關鍵激酶的藥物注釋
結論
通過使用多組學方法,我們破譯了與食管鱗癌發生和發展有關的新分子事件,包括甲基轉移酶的異常表達,轉錄后和翻譯后過度活躍的調節,以及重塑的代謝。這些發現加深了我們對食管鱗癌病理生物學的理解,并為食管鱗癌患者的危險分層提供了新的預后生物標志物。這些發現為食管鱗癌的治療提供了新的靶點和策略。






