SNORD88C促進(jìn)非小細(xì)胞肺癌的生長和轉(zhuǎn)移
核仁小RNA (snoRNAs)已被證明在癌癥發(fā)展中發(fā)揮關(guān)鍵的調(diào)節(jié)作用。通過數(shù)據(jù)庫和snoRNA測序篩選到長度為97 nt的SNORD88C。我們首次證實(shí)這種snoRNA在組織和血漿中上調(diào),并可作為一種非侵入性診斷生物標(biāo)志物。在體外和體內(nèi)實(shí)驗(yàn)中證實(shí)SNORD88C促進(jìn)NSCLC的增殖和轉(zhuǎn)移。在機(jī)制上,SNORD88C促進(jìn)了28S rRNA上C3680位點(diǎn)的2’- O-甲基化修飾,進(jìn)而增強(qiáng)了下游SCD1的翻譯,為SNORD88C在NSCLC中的調(diào)控提供了新的見解。本文于2022年11月發(fā)表于“Cell Death & Differentiation”(IF=12.067)上。
技術(shù)路線

結(jié)果
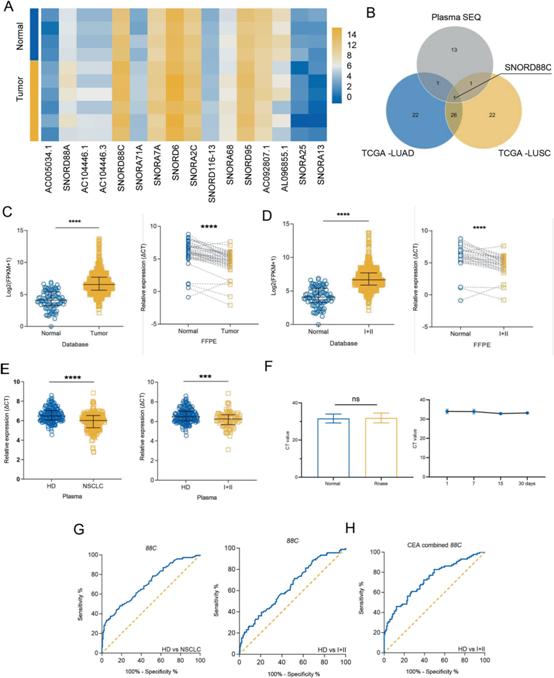
1)SNORD88C在NSCLC中上調(diào),并作為一種非侵入性診斷生物標(biāo)志物
為了識別NSCLC中異常表達(dá)的snoRNA,我們分析了TCGA SNORic數(shù)據(jù)庫中腫瘤組織(包括肺腺癌(LUAD)和肺鱗癌(LUSC))和癌旁組織中snoRNA的表達(dá)差異(圖S1A, B)。接下來,對4名健康供體和6名NSCLC患者的血漿進(jìn)行snoRNA測序,篩選出了12個(gè)上調(diào)snoRNA和4個(gè)下調(diào)snoRNA(圖1A)。最后對上述差異snoRNA進(jìn)行VENN分析(圖1B),只有SNORD88C重疊,被選為研究對象。我們進(jìn)一步驗(yàn)證了SNORD88C在NSCLC中的表達(dá)上調(diào)。如圖1C所示,無論是TCGA數(shù)據(jù)還是FFPE檢測,腫瘤組織中SNORD88C均明顯升高。TCGA數(shù)據(jù)和FFPE檢測結(jié)果均顯示,早期NSCLC (I + II)中SNORD88C表達(dá)較正常組織上調(diào)(圖1D),提示其在NSCLC的發(fā)生發(fā)展中發(fā)揮作用。進(jìn)一步驗(yàn)證178例健康捐贈(zèng)者和224例NSCLC患者血漿中SNORD88C水平,發(fā)現(xiàn)其在NSCLC和早期NSCLC中上調(diào)(圖1E)。SNORD88C主要在無囊泡的血漿中表達(dá),并且在血漿中穩(wěn)定(圖1F)。同時(shí)對診斷效果進(jìn)行ROC曲線分析,NSCLC和早期NSCLC的曲線下面積(AUC)分別為0.7097和0.6406(圖1G)。癌胚抗原(CEA)是臨床上公認(rèn)的傳統(tǒng)生物標(biāo)志物,但對早期NSCLC的臨床診斷效率較低。然而,聯(lián)合SNORD88C時(shí),早期NSCLC CEA的AUC從0.6650顯著升高至0.7279(圖1H)。綜上所述,SNORD88C在NSCLC中上調(diào),并作為一種非侵入性診斷生物標(biāo)志物。
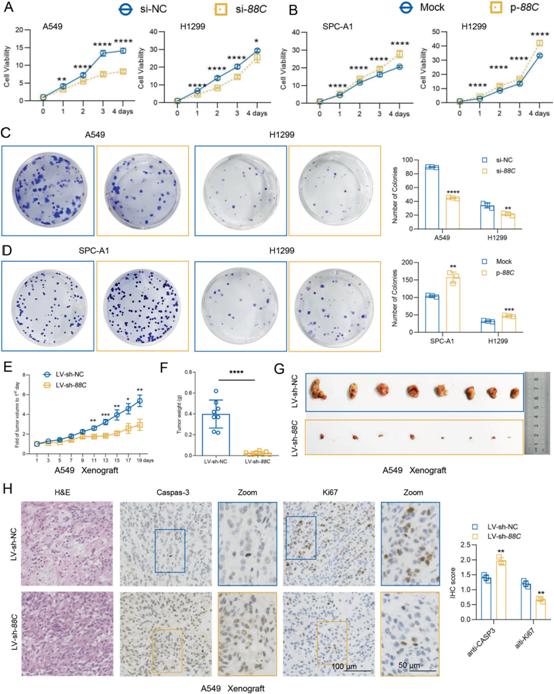
2)在體外和體內(nèi),SNORD88C促進(jìn)NSCLC增殖
為了闡明SNORD88C在NSCLC進(jìn)展中的作用,我們在三種NSCLC細(xì)胞系(A549、H1299和SPC-A1)中過表達(dá)或下調(diào)SNORD88C。通過CCK-8和集落形成分析來確定SNORD88C對細(xì)胞增殖的影響。如圖2A所示,敲低SNORD88C顯著抑制A549和H1299細(xì)胞的細(xì)胞活力;相反,強(qiáng)制表達(dá)SNORD88C可促進(jìn)SPC-A1和H1299細(xì)胞的生長(圖2B)。一致地,沉默SNORD88C的A549和H1299細(xì)胞集落形成暫停,而過表達(dá)SNORD88C導(dǎo)致SPC-A1和H1299細(xì)胞集落形成能力明顯增強(qiáng)(圖2C, D)。為了確定SNORD88C在體內(nèi)對NSCLC增殖的影響,我們使用SNORD88C穩(wěn)定敲除(LV-sh-SNORD88C)或?qū)φ?/span>(LV-sh-NC)的A549細(xì)胞建立異種移植裸鼠模型。正如預(yù)期的那樣,與對照組相比,LV-sh-SNORD88C組的異種移植生長明顯放緩(圖2E),腫瘤重量和體積明顯減小(圖2F, G)。Caspase-3和Ki67免疫組化染色顯示,LV-sh-SNORD88C促進(jìn)A549異種移植細(xì)胞凋亡,但抑制增殖(圖2H)。綜上所述,在體外和體內(nèi)NSCLC中,SNORD88C是一種增殖調(diào)節(jié)劑。
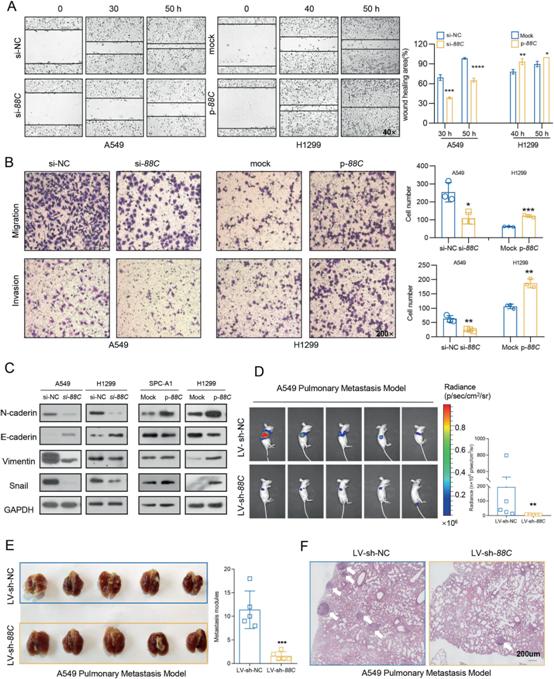
3)SNORD88C促進(jìn)NSCLC在體外和體內(nèi)的遷移和侵襲
我們接下來確定SNORD88C在遷移和侵襲中的作用。傷口愈合實(shí)驗(yàn)顯示,在A549和H1299細(xì)胞中,SNORD88C的下調(diào)顯著抑制了其遷移能力,而在H1299和SPC-A1細(xì)胞中,過表達(dá)則促進(jìn)了其遷移能力(圖3A)。此外,沉默SNORD88C表達(dá)后,A549和H1299細(xì)胞的遷移和侵襲能力明顯下降,但過表達(dá)SNORD88C顯著刺激了這些能力(圖3B)。考慮到EMT在侵襲和遷移中的重要作用,我們檢測了SNORD88C對EMT相關(guān)蛋白表達(dá)的影響。如圖3C所示,在A549和H1299細(xì)胞中,敲低SNORD88C會(huì)增加E-cadherin,抑制N-cadherin, Vimentin和Snail,而在SPC-A1和H1299細(xì)胞中,過表達(dá)SNORD88C則相反。體內(nèi)生物發(fā)光成像(BLI)顯示LV-sh-SNORD88C組熒光素酶信號強(qiáng)度顯著低于對照組(圖3D)。與對照組相比,LV-sh-SNORD88C組小鼠肺部發(fā)生的轉(zhuǎn)移位點(diǎn)更少(圖3E)。此外,H&E染色顯示LV-sh-NC組有部分轉(zhuǎn)移位點(diǎn)侵犯肺包膜,而LV-sh-SNORD88C組未觀察到(圖3F)。這些結(jié)果表明,SNORD88C促進(jìn)了NSCLC在體外和體內(nèi)的遷移和侵襲。
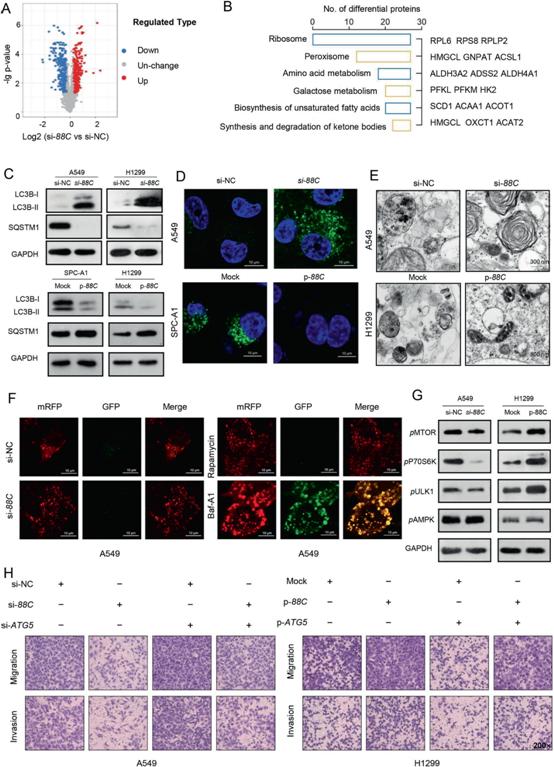
4)SNORD88C減弱的自噬是促進(jìn)其遷移和侵襲所必需的
為了探索SNORD88C的下游靶基因,采用LC-MS/ MS為基礎(chǔ)的TMT標(biāo)記定量蛋白質(zhì)組學(xué)方法對沉默SNORD88C或陰性對照的H1299進(jìn)行研究。如圖4A所示,共出現(xiàn)384個(gè)上調(diào)蛋白和369個(gè)下調(diào)蛋白,其中大部分富集在代謝相關(guān)通路(圖4B)。由于自噬允許細(xì)胞在營養(yǎng)應(yīng)激條件下保持代謝充足并存活,并且可以通過多種代謝途徑進(jìn)行調(diào)節(jié)。因此,我們進(jìn)一步檢測了SNORD88C對自噬的影響。如圖4C所示,在A549和H1299細(xì)胞中,敲低SNORD88C均能激活自噬,而過表達(dá)SNORD88C則對SPC-A1和H1299細(xì)胞的自噬有抑制作用。相應(yīng)地,免疫熒光也驗(yàn)證了SNORD88C敲低后自噬體數(shù)量增加,而SNORD88C過表達(dá)后自噬體數(shù)量減少(圖4D)。接下來,透射電子顯微鏡(TEM)進(jìn)一步證實(shí)了這一現(xiàn)象。超微結(jié)構(gòu)上,敲低SNORD88C顯著增加,過表達(dá)SNORD88C減少自噬液泡數(shù)量(圖4E)。在SNORD88C沉默或過表達(dá)的細(xì)胞中,與雷帕霉素處理的細(xì)胞一樣,大部分斑點(diǎn)失去了GFP信號,保留了mRFP信號,但與Baf-A1處理的細(xì)胞不同,GFP的猝滅明顯減弱(圖4F),說明SNORD88C對自噬通量影響不大。接下來,我們研究了mTOR/ULK1信號通路是否有助于SNORD88C減弱的自噬。如圖4G所示,敲低SNORD88C導(dǎo)致A549中MTOR及其下游蛋白P70S6K和ULK1的磷酸化下調(diào),而在H1299中過表達(dá)SNORD88C后,這些蛋白的磷酸化上調(diào)。值得注意的是,AMPK磷酸化不受SNORD88C的影響,這表明SNORD88C調(diào)控mTOR/ULK1信號不依賴于AMPK(圖4G)。為了提供SNORD88C減弱的自噬與其誘導(dǎo)的肺癌細(xì)胞遷移和侵襲之間的直接聯(lián)系,用ATG5 siRNA (si-ATG5)和質(zhì)粒(p-ATG5)轉(zhuǎn)染NSCLC細(xì)胞(圖4H),同時(shí)用3-甲基腺嘌呤(3-MA)或雷帕霉素處理,然后進(jìn)行遷移和侵襲檢測。si-ATG5和3-MA可消除SNORD88C沉默對A549細(xì)胞遷移和侵襲的抑制作用,而過表達(dá)SNORD88C增強(qiáng)的H1299細(xì)胞轉(zhuǎn)移作用可通過添加p-ATG5或雷帕霉素部分逆轉(zhuǎn)。總之,這些結(jié)果支持SNORD88C抑制自噬,進(jìn)而促進(jìn)NSCLC細(xì)胞的遷移和侵襲。
5)SNORD88C通過上調(diào)SCD1蛋白表達(dá)抑制自噬
由于上述LC-MS/MS為基礎(chǔ)TMT標(biāo)記的定量蛋白質(zhì)組學(xué)富集了不飽和脂肪酸生物合成通路,因此我們對SNORD88C敲除的H1299細(xì)胞進(jìn)行了以脂肪酸為目標(biāo)的GC-MS代謝組學(xué)研究,以確定SNORD88C減弱自噬的代謝產(chǎn)物。如圖5A所示,與對照組相比,SNORD88C敲除的細(xì)胞中多種不飽和脂肪酸均有降低,其中單不飽和脂肪酸(MUFA)油酸(OA)的下降更為明顯,說明SNORD88C在脂質(zhì)積累和過氧化過程中起著至關(guān)重要的作用。因此,采用C11-bodipy染色,流式細(xì)胞術(shù)分析顯示沉默SNORD88C促進(jìn)脂質(zhì)過氧化,過表達(dá)SNORD88C抑制脂質(zhì)過氧化(圖5B)。
SCD1是合成MUFA的中心脂肪生成酶,在沉默SNORD88C后,其在上述LC-定量蛋白質(zhì)組學(xué)中也表現(xiàn)出最顯著的變化。重要的是,western blot檢測成功驗(yàn)證了SNORD88C正調(diào)控SCD1蛋白水平,在A549和H1299細(xì)胞中,SNORD88C下調(diào)后SCD1蛋白水平下降,但在H1299和SPC-A1細(xì)胞中,過表達(dá)SNORD88C后SCD1蛋白水平顯著升高(圖5C)。流式細(xì)胞儀分析顯示,SCD1的過表達(dá)和敲低分別能成功逆轉(zhuǎn)沉默SNORD88C以及過表達(dá)SNORD88C對脂質(zhì)過氧化的促進(jìn)和抑制作用(圖5D),提示SNORD88C通過上調(diào)SCD1蛋白表達(dá)抑制脂質(zhì)過氧化。此外,我們還探討了SCD1在SNORD88C減弱的自噬中的作用。如圖5E所示,過表達(dá)SCD1可以通過下調(diào)SNORD88C恢復(fù)A549細(xì)胞的自噬激活。一致地,SCD1沉默緩解了SNORD88C過表達(dá)對自噬的抑制。此外,我們還觀察了SNORD88C和SCD1對mTOR通路的影響。正如預(yù)期的那樣,SCD1消除了SNORD88C對mTOR通路相關(guān)蛋白的作用,包括pMTOR、pP70S6K、pULK1(圖5F)。最后,我們研究了SNORD88C/SCD1軸與肺癌細(xì)胞遷移和侵襲之間的直接聯(lián)系。如圖5G和5H所示,SCD1過表達(dá)逆轉(zhuǎn)了SNORD88C沉默對A549和H1299細(xì)胞遷移和侵襲的抑制作用,而SCD1下調(diào)則取消了SPC-A1和H1299細(xì)胞中SNORD88C過表達(dá)對肺癌細(xì)胞轉(zhuǎn)移的促進(jìn)作用。綜上所述,SCD1是SNORD88C的下游調(diào)控蛋白,通過抑制自噬促進(jìn)NSCLC細(xì)胞的遷移和侵襲。

6)SNORD88C通過引導(dǎo)28S rRNA的2’-O-me調(diào)控SCD1的翻譯活性
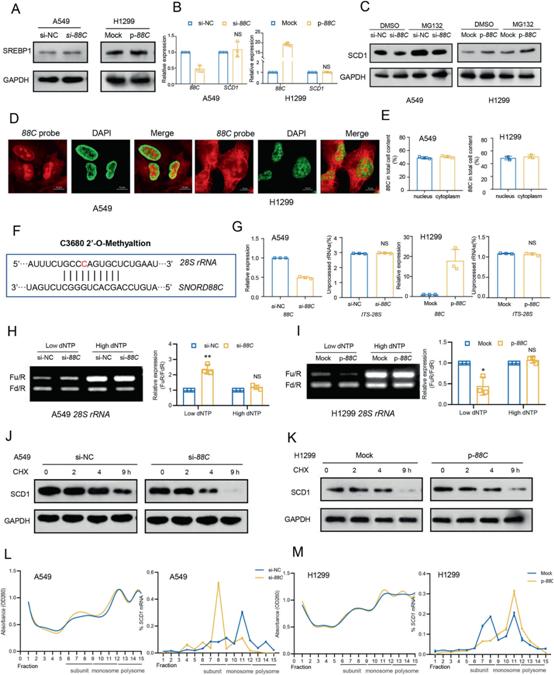
為了探索SNORD88C/ SCD1軸相關(guān)的潛在機(jī)制,我們首先檢測了SNORD88C對SREBP1的影響,SREBP1是調(diào)控SCD1表達(dá)的重要轉(zhuǎn)錄因子。出乎意料的是,SNORD88C對SREBP1的表達(dá)沒有明顯的影響(圖6A),說明SNORD88C沒有調(diào)節(jié)SCD1的轉(zhuǎn)錄,這也被另一個(gè)觀察結(jié)果證實(shí),即SNORD88C不影響SCD1的mRNA水平(圖6B)。由此,我們推測SNORD88C在轉(zhuǎn)錄后水平調(diào)控SCD1的表達(dá)。接下來,使用蛋白酶體抑制劑MG132阻斷蛋白酶體降解。然而,MG132處理明顯增加了SCD1蛋白水平,但未能逆轉(zhuǎn)SNORD88C對SCD1的調(diào)控(圖6C),這表明涉及一種蛋白降解無關(guān)的方式。
先前的研究表明,box C/D snoRNAs在rRNA生物發(fā)生中起著重要作用,因?yàn)樗鼈儏⑴c核仁中2 '-O-me的引導(dǎo),進(jìn)而調(diào)節(jié)細(xì)胞質(zhì)中蛋白質(zhì)的翻譯。首先,我們使用cy3標(biāo)記的探針靶向SNORD88C進(jìn)行熒光原位雜交(FISH)檢測細(xì)胞分布。如圖6D所示,SNORD88C主要位于細(xì)胞核和細(xì)胞質(zhì)中。通過細(xì)胞質(zhì)/核分離的q-PCR進(jìn)一步驗(yàn)證了這一結(jié)果(圖6E),表明SNORD88C具有直接調(diào)節(jié)rRNA生物學(xué)特性的潛力。此外,我們基于生物信息學(xué)通過snoPY數(shù)據(jù)庫預(yù)測了SNORD88C靶向的rRNA,發(fā)現(xiàn)只有28S rRNA含有與SNORD88C高度互補(bǔ)的序列,更重要的是c3680的2 '-O-me的潛在位點(diǎn)(圖6F)。然后,使用能夠區(qū)分前體(ITS-28S)和總28S rRNA的引物進(jìn)行量化,然而,無論是在敲除SNORD88C的A549細(xì)胞中,還是在過表達(dá)SNORD88C的H1299細(xì)胞中,成熟28S rRNA均未觀察到明顯變化(圖6G)。接下來,采用RTL-P實(shí)驗(yàn)確認(rèn)SNORD88C引導(dǎo)的28S rRNA的2’-O-me。在A549細(xì)胞中,低濃度dNTPs時(shí),敲低SNORD88C可顯著降低C3680位點(diǎn)28S rRNA的2'-O-me活性,而高濃度dNTPs時(shí)則不會(huì)(圖6H)。同時(shí),過表達(dá)SNORD88C可提高低濃度dNTPs時(shí)2'-O-me活性(圖6I)。已有研究表明2'-O-me可提高rRNA誘導(dǎo)的翻譯準(zhǔn)確性,進(jìn)而延長蛋白質(zhì)半衰期。因此,通過添加環(huán)己亞胺(CHX)來進(jìn)行體外翻譯試驗(yàn)。當(dāng)用CHX處理SNORD88C敲除的A549細(xì)胞時(shí),SCD1蛋白的半衰期縮短(圖6J),而在過表達(dá)SNORD88C的H1299細(xì)胞中,SCD1蛋白的半衰期延長(圖6K)。最后,為了確定SNORD88C直接影響翻譯的可能性,對其進(jìn)行了多核糖體分析。如圖6L, M所示,SNORD88C沉默或過表達(dá)不影響核糖體部分的分布輪廓,表明SNORD88C不影響全局翻譯。然而,SNORD88C沉默顯著降低了SCD1 mRNA在單體和多體部分的富集,使其分布從較重的核糖體部分向較輕的核糖體部分分布,而SNORD88C過表達(dá)則相反,更直接地證明了SNORD88C通過影響翻譯水平調(diào)控SCD1的表達(dá)。
結(jié)論:
我們發(fā)現(xiàn)SNORD88C是NSCLC中一種新的致癌snoRNA。我們證明了SNORD88C在組織和血漿中上調(diào),并可作為一種非侵入性診斷生物標(biāo)志物;在體外和體內(nèi)均證實(shí)其促進(jìn)NSCLC的增殖和轉(zhuǎn)移。重要的是,SNORD88C引導(dǎo)28S rRNA甲基化,顯著提高下游靶基因SCD1的翻譯活性。SCD1作為MUFA合成的限速酶,抑制自噬進(jìn)一步促進(jìn)轉(zhuǎn)移,為SNORD88C在NSCLC中的調(diào)控提供了新的視角。
參考文獻(xiàn):
Wang K, Wang S, Zhang Y, Xie L, Song X, Song X. SNORD88C guided 2'-O-methylation of 28S rRNA regulates SCD1 translation to inhibit autophagy and promote growth and metastasis in non-small cell lung cancer. Cell Death Differ. 2022 Nov 14. doi: 10.1038/s41418-022-01087-9.






