LncRNA ELF3-AS1通過與SNAI2形成負反饋環路抑制胃癌,并通過與ILF2/ILF3復合物相互作用調節ELF3 mRNA的穩定性
胃癌(GC)是癌癥相關死亡的第三大常見原因。盡管GC的治療已得到極大改善,但由于無法在早期診斷該癌癥,生存率仍然很低。約1/3的GC患者被診斷為晚期轉移,4-14%的患者有肝臟轉移性疾病。由于GC轉移通常以多發性和彌漫性分布為特征,絕大多數患者此時已失去手術治療的機會。因此,迫切需要解開腫瘤轉移的分子機制。越來越多的證據表明,SNAI2通過轉錄調節下游靶基因在驅動腫瘤轉移中起關鍵作用,揭示SNAI家族的靶基因對于更好地了解腫瘤轉移至關重要。ELF3-AS1是一種細胞周期相關的lncRNA,據報道lncRNA ELF3-AS1在肺癌中作為癌基因起作用。然而,ELF3-AS1在GC中的生物學功能尚不清楚。該研究發表于《Journal of Experimental & Clinical Cancer Research》,IF: 12.658。
技術路線:

主要研究結果:
1. GC中轉錄阻遏因子SNAI2調控lncRNA的探索
為了探索SNAI2的靶基因,RNA測序研究(GSE161551)在過表達SNAI2的GC細胞系(SGC7901)中進行。共有318個編碼基因,其中70個lncRNA被SNAI2強烈抑制,55個編碼基因和53個lncRNA被SNAI2大幅上調。如圖1A所示,IGFBP1/3、ITGB4、CLDN1/4、TJP3、EFNA1、KRT80、ELF3等的表達受到SNAI2的強烈抑制,而CYR61、CTGF、IL11、ID2/3、RBM3、THBS1等的表達受到SNAI2的強烈上調。類似地,大約123個lncRNA,包括linc01315,MIR210HG,FZD10-DT,linc00963,HOXB-AS3,LUCAT1,ITPR1-DT,PDCD4-AS1,ZNF197-AS1等,在過表達SNAI2后極大地改變了它們的表達。有趣的是,反義lncRNA ELF3-AS1及其鄰近基因ELF3都被SNAI2強烈抑制(圖1B)。
為了進一步確認ELF3-AS1和ELF3是否可能受到SNAI2的負調節,在兩個GC細胞系中進行了關于SNAI2的功能喪失和功能獲得研究。正如預期的那樣,ELF3-AS1和ELF3在SNAI2過表達細胞系中顯著下調,但在SNAI2去除細胞系中顯著上調(圖1C-E)。這些結果表明,在GC中,SNAI2對ELF3-AS1和ELF3均呈負調控。
ELF3-AS1是上皮腫瘤抑制基因ELF3的反義lncRNA。啟動子分析顯示,ELF3-AS1啟動子含有一個序列“GGTACAGGTGGGT”,預測被SNAI2和SNAI1識別。該序列位于ELF3-AS1轉錄起點上游829 bp,這也是ELF3基因外顯子2和內含子2之間的連接點(圖1F)。因此,作者推測ELF3-AS1和ELF3可能受到SNAI2和SNAI1的轉錄調控。
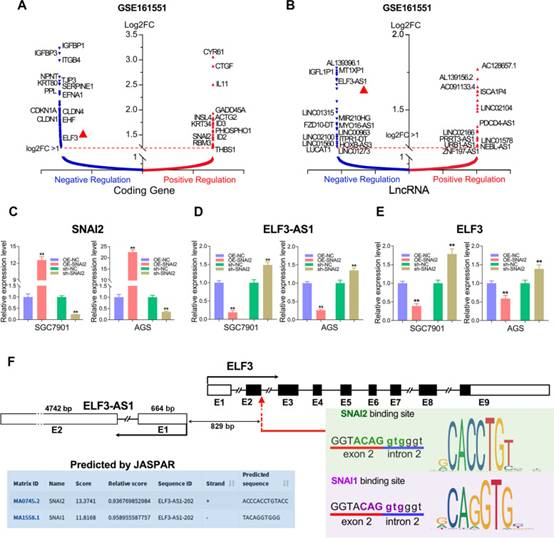
圖1 通過RNA-seq鑒定GC中SNAI2調控的lncRNA
2. ELF3-AS1和ELF3被SNAI2和SNAI1轉錄抑制
LncRNA ELF3-AS1在人體細胞中含量豐富,在RNA測序時可被磁珠有效捕獲。為了使作者的結果更具說服力,作者使用RNA-seq研究來可視化ELF3-AS1和ELF3的表達。正如預期的那樣,RNA-seq分析和qRT-PCR測定共同表明ELF3-AS1和ELF3被SNAI2 / SNAI1過表達下調(圖2A-F)。此外,SNAI2對ELF3和ELF3-AS1表達的抑制強度遠大于SNAI1(圖2B,E)。
此外,為了確定SNAI2/SNAI1是否在轉錄水平上抑制ELF3 / ELF3-AS1,在SNAI1和SNAI2過表達細胞系中進行雙熒光素酶和CHIP測定。如圖2G所示,當SNAI1/2結合序列發生突變時,SNAI1/2過表達對熒光素酶表達的強烈抑制部分恢復,提示該序列是SNAI1/SNAI2抑制ELF3/ELF3-AS1表達所必需的。另一方面,CHIP測定表明SNAI1和SNAI2可以直接與ELF3-AS1啟動子結合(圖2H-J)。綜上所述,SNAI2和SNAI1都參與了GC中ELF3和ELF3-AS1的轉錄調控。
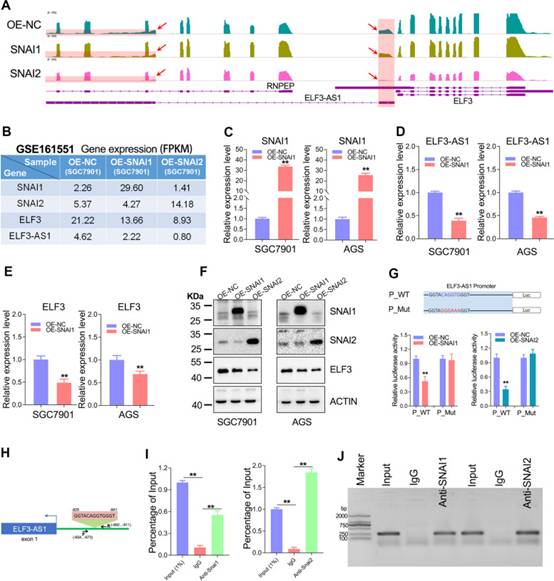
圖2 ELF3-AS1和ELF3在GC中被SNAI2和SNAI1轉錄抑制
3. ELF3-AS1和ELF3表達降低預示GC預后不良
由于ELF3和ELF3-AS1被EMT相關轉錄因子SNAI1/2抑制,作者進一步進行了ELF3/ELF3-AS1與EMT生物標志物的基因表達相關性分析。正如預期的那樣,ELF3和ELF3-AS1都與上皮生物標志物高度共表達(圖3A)。
此外,對30對GC組織中ELF3-AS1表達的分析表明,與相應的正常樣品相比,ELF3-AS1在超過80%的GC樣品中下調(圖3B)。另一方面,作者分析了癌癥基因組圖譜(TCGA,n = 375)數據庫中GC樣本中ELF3-AS1下調的臨床意義。LncRNA ELF3-AS1在彌漫性和低分化的GC組織中表達低(圖3C和D)。總生存期分析表明,ELF3-AS1表達水平較低的GC患者總生存時間較短(圖3E,p=0.029)。
作者之前的研究暗示ELF3在GC中起腫瘤抑制作用。在此,作者進一步確認了ELF3在GC中的表達顯著下調(圖3F,G)。此外,與腸道GC相比,在彌漫性GC中觀察到ELF3的表達較低(圖3H)。3ELF3的低表達與GC的惡性進展呈正相關(圖3I,J)。ELF3表達較低的GC患者總生存時間和無病生存時間較差GSE62254GC隊列(圖3K)。臨床分析與作者的發現非常吻合,即ELF3-AS1和ELF3在GC中被SNAI2和SNAI1轉錄抑制。
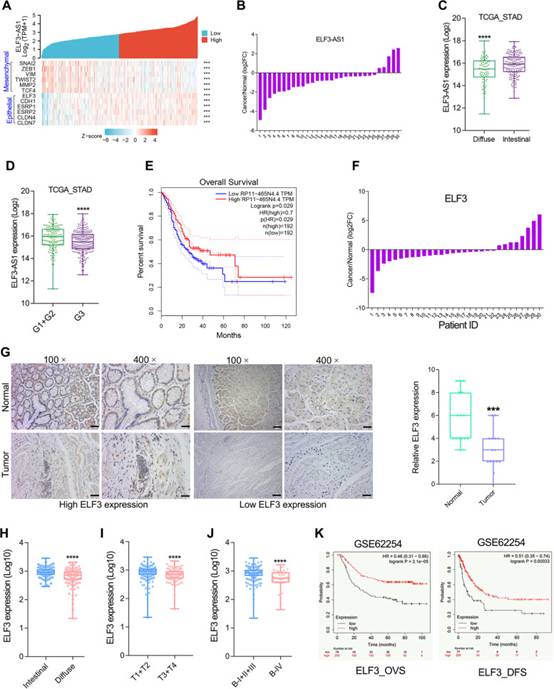
圖3 ELF3-AS1和ELF3表達降低與GC預后不良相關
4. 上皮轉錄因子ELF3在GC中發揮腫瘤抑制作用
反義lncRNA通常與其相鄰的蛋白質編碼基因高度共表達。同樣,作者還觀察到ELF3-AS1和ELF3在正常胃組織,GC細胞系和泛組織中存在高共表達(圖4A-E)。有趣的是,當ELF3-AS1在GC細胞系中被有效敲低時,ELF3 mRNA及其蛋白質顯著降低至約60-70%(圖4F-I)。然而,目前尚不清楚ELF3-AS1如何影響GC中的ELF3表達。
此外,對30對GC組織中ELF3-AS1表達的分析表明,與相應的正常樣品相比,ELF3-AS1在超過80%的GC樣品中下調(圖3B)。另一方面,作者分析了癌癥基因組圖譜(TCGA,n = 375)數據庫中GC樣本中ELF3-AS1下調的臨床意義。LncRNA ELF3-AS1在彌漫性和低分化的GC組織中表達低(圖3C和D)。總生存期分析表明,ELF3-AS1表達水平較低的GC患者總生存時間較短(圖3E,p=0.029)。
作者之前的研究暗示ELF3在GC中起腫瘤抑制作用。在此,作者進一步確認了ELF3在GC中的表達顯著下調(圖3F,G)。此外,與腸道GC相比,在彌漫性GC中觀察到ELF3的表達較低(圖3H)。ELF3的低表達與GC的惡性進展呈正相關(圖3I,J)。ELF3表達較低的GC患者總生存時間和無病生存時間較差GSE62254GC隊列(圖3K)。臨床分析與作者的發現非常吻合,即ELF3-AS1和ELF3在GC中被SNAI2和SNAI1轉錄抑制。
5. 上皮轉錄因子ELF3在GC中發揮腫瘤抑制作用
反義lncRNA通常與其相鄰的蛋白質編碼基因高度共表達。同樣,作者還觀察到ELF3-AS1和ELF3在正常胃組織,GC細胞系和泛組織中存在高共表達(圖4A-E)。有趣的是,當ELF3-AS1在GC細胞系中被有效敲低時,ELF3 mRNA及其蛋白質顯著降低至約60-70%(圖4F-I)。然而,目前尚不清楚ELF3-AS1如何影響GC中的ELF3表達。
鑒于ELF3屬于ETS轉錄因子家族,作者最初假設ELF3-AS1和ELF3的共表達可能是由于ELF3調節ELF3-AS1的表達。為了驗證這種可能性,在兩個GC細胞系中進行了關于ELF3的功能喪失和功能獲得研究。然而,在GC中敲低或過表達ELF3后,ELF3-AS1的表達沒有顯著改變(圖4J和K)。盡管轉錄因子ELF3不能調節ELF3-AS1的表達,但劃痕傷口愈合測定和Transwell測定證實ELF3在GC細胞遷移和侵襲中具有腫瘤抑制作用(圖4L和M)。
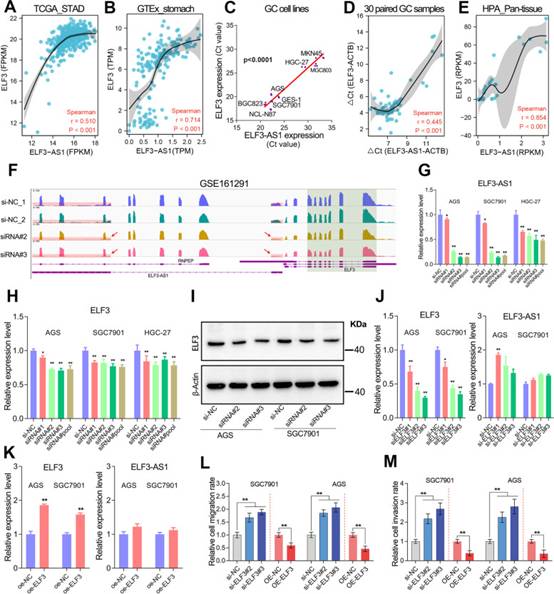
圖4 ELF3負調節細胞轉移,但不能調節GC中ELF3-AS1的表達
6. ELF3-AS1主要通過抑制SNAI2信號傳導抑制GC轉移
作者通過miRNA測序分析了ELF3-AS1敲低后差異表達的miRNA(圖5A)。令人驚訝的是,在ELF3-AS1耗竭大幅下調的前10種miRNA中,miR-33a,miR-33b和miR-203a是眾所周知的靶向SNAI2的miRNA(圖5B)。為了確認miRNA測序的可靠性,作者檢查了ELF3-AS1去除細胞系中miR-33a,miR-33b和miR-203a的表達水平。結果表明,ELF3-AS1敲低確實能顯著降低miR-33a、miR-33b和miR-203a的表達(圖5C-E)。相應地,ELF3-AS1的耗竭導致SNAI2 mRNA和蛋白質的顯著上調(圖5F-H)。一致地,分析來自另一項獨立研究的RNA-seq數據(GSE92250)還表明ELF3-AS1敲低導致A549和Hela細胞系中的SNAI2 mRNA上調(圖5I),表明ELF3-AS1對SNAI2表達的負調控可能在癌癥中廣泛存在。
基于上述發現,作者推測ELF3-AS1可能通過抑制SNAI2信號傳導來抑制GC進展。為了驗證這種可能性,在體內和體外進行了救援測定。敲低SNAI2表達挽救了ELF3-AS1去除的GC細胞系的致瘤特性(圖5J和K)。這些數據強烈表明,ELF3-AS1主要通過抑制SNAI2信號傳導來抑制GC細胞的遷移和侵襲。
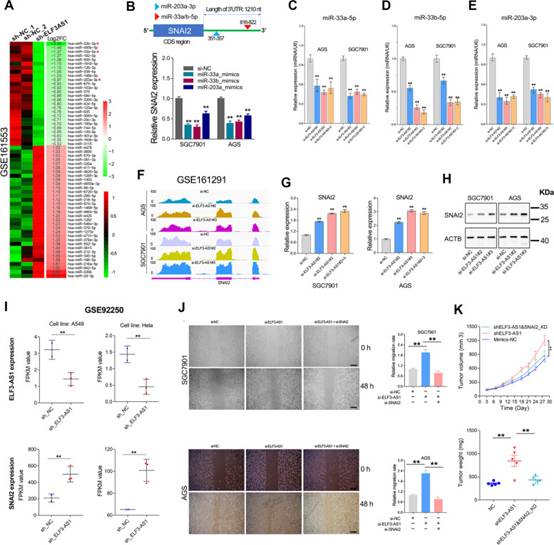
圖5ELF3-AS1主要通過抑制SNAI2信號傳導來抑制GC轉移
7. 核定位的lncRNA ELF3-AS1在細胞周期進程中起關鍵作用。
lncRNA的生物學功能與其亞細胞位置密切相關。ELF3-AS1是GC中的核定位lncRNA(圖6A和B)。之前的一項研究報道,ELF3-AS1是一種細胞周期相關的lncRNA。作者的研究還表明,lncRNA ELF3-AS1在細胞周期進程中起著至關重要的作用。ELF3-AS1敲低顯著加速了GC中細胞周期的G1/S轉變(圖6C和D)。有趣的是,RNA-seq分析表明,敲低ELF3-AS1導致幾乎所有組蛋白編碼基因的顯著上調超過2倍(圖6E和F)。眾所周知,組蛋白的合成發生在細胞周期的S期,與DNA復制同步。這些結果表明,ELF3-AS1通過影響G1/S轉換和組蛋白合成來負調節GC細胞的細胞周期進程。
為了更好地理解ELF3-AS1調控細胞周期過程的分子機制,作者分析了ELF3-AS1敲低后細胞周期相關基因的表達變化。結果表明,敲低ELF3-AS1增加了GC中CDK6和CASP7的表達,但降低了CDKN1A(也稱為p21)的表達(圖6G和H)。p21蛋白作為G1/S轉變的細胞周期檢查點。CDK6/CCND1蛋白復合物對細胞周期G1相進展和G1/S轉變非常重要。因此,ELF3-AS1敲低引起的G1/S轉變的促進可能是由于P21的下調和CDK6的上調.
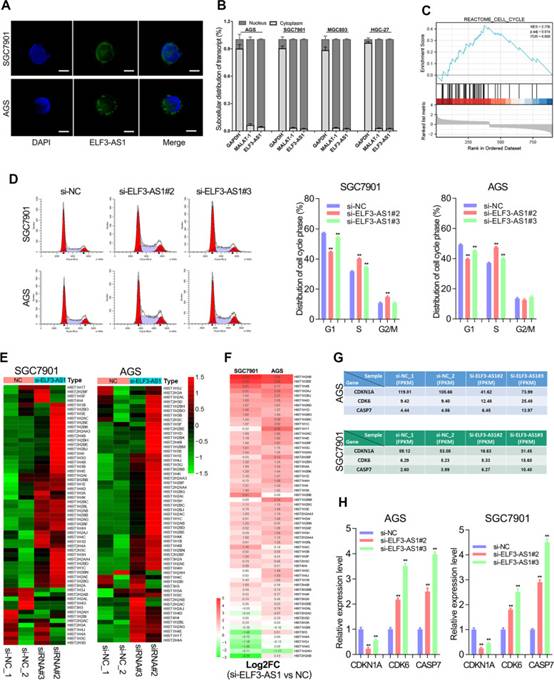
圖6 核定位的lncRNA ELF3-AS1通過影響G1 / S過渡和組蛋白合成來調節細胞周期進程
8. ILF2/ILF3復合物可直接調節ELF3-AS1/ELF3 RNA雙鏈體的穩定性
通過RNA下拉分析鑒定了與lncRNA ELF3-AS1相互作用的潛在蛋白質。根據位于45道爾頓處的差分帶的質譜(MS)分析(圖7A),有7種蛋白質匹配覆蓋率大于20%。在這些蛋白質中,RINI,ILF2(也稱為NF45)和TARBP2是雙鏈RNA(dsRNA)結合蛋白(圖7B)。有趣的是,另一種名為ILF3的蛋白質(也稱為NF90 / NF110)也出現在該條帶的MS結果中(圖7C)。作者隨后的蛋白質印跡測定進一步驗證了ILF2,ILF3和TARBP2可以與外源性lncRNA ELF3-AS1結合(圖7D)。此外,CHIRP下拉試驗證實內源性ELF3-AS1也與ILF2和ILF3蛋白結合(圖7E和F)。維恩圖顯示,在三個MS結果的交點處顯示了大約22種蛋白質,包括ILF2,ILF3,RINI等(圖7F)。為了弄清楚ELF3-AS1轉錄本的哪個區域可以與ILF2和ILF3相互作用,作者截斷了不同長度的ELF3-AS1轉錄本。在通過蛋白質印跡分析了不同長度的ELF3-AS1轉錄本拉下的蛋白質后,作者發現第一個外顯子區域對于ELF3-AS1轉錄本與ILF2 / ILF3復合物之間的相互作用是必需的(圖7G)。此外,作者在轉染不同長度的ELF3-AS1轉錄本的GC細胞中檢測到ELF3表達。結果表明,僅過表達含有外顯子1的ELF3-AS1轉錄本上調ELF3表達(圖7H)。RNA免疫沉淀測定顯示,與ILF2和ILF3蛋白結合的ELF3-AS1轉錄本比對照IgG組高數千倍(圖7I,J)。
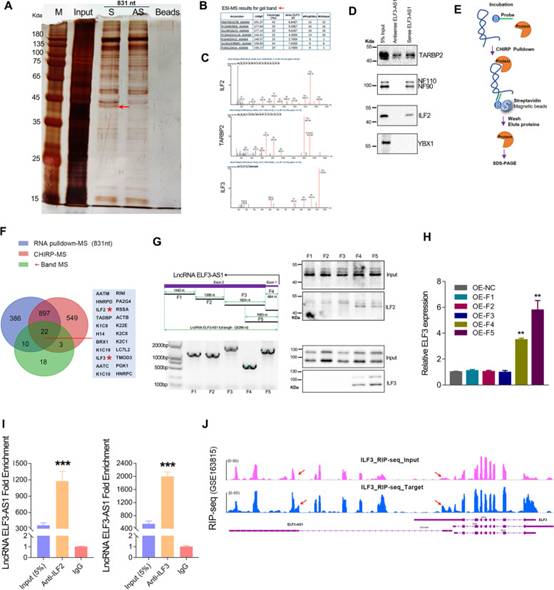
圖7 ELF3-AS1直接與ILF2 / ILF3蛋白復合物相互作用
由于選擇性剪接,ELF3基因具有不同的轉錄本。在這些不同類型的ELF3轉錄本中,ELF3-201,ELF3-202和ELF3-203可以編碼全長ELF3蛋白。ELF3-201轉錄本和ELF3-AS1轉錄本重疊約664個核苷酸(圖8A)。換句話說,ELF3-AS1可以與ELF3-201的第一外顯子區結合形成雙鏈RNA分子。另一方面,RNA-seq分析表明,與ELF3-203或任何其他ELF3轉錄本水平相比,ELF3-AS1的敲低對ELF3-201表達的影響更深遠(圖8B)。這些數據暗示ILF2 / ILF3復合物可能與ELF3-AS1和ELF3-201形成的dsRNA結合。為了進一步驗證這種可能性,作者還檢查了ILF2 / ILF3的RIP測定中的ELF3-201轉錄本水平。與ILF2和ILF3結合的ELF3-201轉錄本遠高于對照IgG組(圖8C,D),表明ILF2 / ILF3復合物可以與ELF3-AS1和ELF3-201形成的dsRNA結合。
據報道,ILF2/ILF3復合物在調節mRNA穩定性中起重要作用。RNA-seq數據和qPCR檢測表明,ILF3的敲低顯著降低了ELF3-AS1和ELF3-201的mRNA水平,而ILF2的敲低顯著提高了ELF3-AS1和ELF3-201的mRNA水平(圖8E-G)。這些結果表明,ILF2和ILF3蛋白對ELF3-AS1轉錄本的穩定性具有相反的影響。先前的一項研究報道,NF45在ILF2/ILF3復合物中作為調節亞基起作用。有趣的是,作者還注意到ILF2的敲低可能會影響ILF3基因的選擇性剪接(圖8H)。因此,推測ILF2可能通過影響ILF3基因的選擇性剪接來調控ELF3-AS1和ELF3-201的表達。

圖8 ILF2/ILF3與ELF3-AS1/ELF3 RNA雙鏈體相互作用,影響RNA雙鏈體的穩定性
結論:
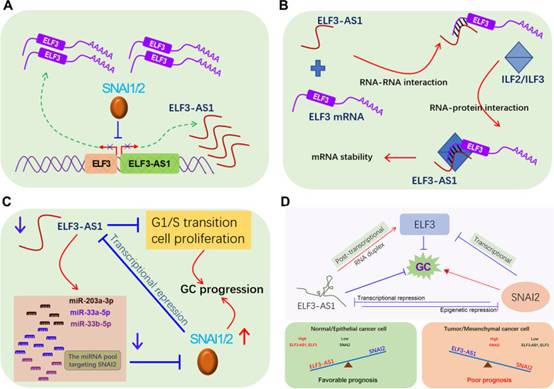
綜上所述,在GC中發現了SNAI2和lncRNA ELF3-AS1之間新的雙負反饋環。SNAI2-ELF3-AS1反饋環通過連續激活SNAI2信號傳導并在轉錄和轉錄后水平調節ELF3表達來驅動GC轉移。在GC中,SNAI2過表達,導致ELF3和ELF3-AS1的表達水平降低。反過來,ELF3-AS1下調通過持續激活SNAI2信號傳導和促進細胞增殖進一步推動腫瘤進展,從而導致GC預后不良。
參考文獻:
Li D, Shen L, Zhang X, Chen Z, Huang P, Huang C, Qin S. LncRNA ELF3-AS1 inhibits gastric cancer by forming a negative feedback loop with SNAI2 and regulates ELF3 mRNA stability via interacting with ILF2/ILF3 complex. J Exp Clin Cancer Res. 2022 Dec 2;41(1):332. doi: 10.1186/s13046-022-02541-9.






