想讓文章也在10分以上,那就這樣聊靶向
PD-1及其配體PD-L1幫助腫瘤細胞逃避免疫監視,被認為是抗腫瘤免疫治療的重要靶點。PD-L1的翻譯后修飾在免疫抑制中具有潛在價值。在這里,作者鑒定泛素特異性蛋白酶8(USP8)去泛素化PD-L1。臨床上,在多個胰腺癌患者來源的隊列中,USP8的表達與腫瘤-淋巴結-轉移階段顯著相關。本研究強調了靶向USP8的重要性,它可以提高PD-L1靶向胰腺癌對免疫治療的敏感性,并可能成為未來治療胰腺癌的一種新治療策略。本研究于2022年12月20日發表于《Cell Death & Differentiation》期刊上,IF:10.46。
技術路線:
主要研究對象:
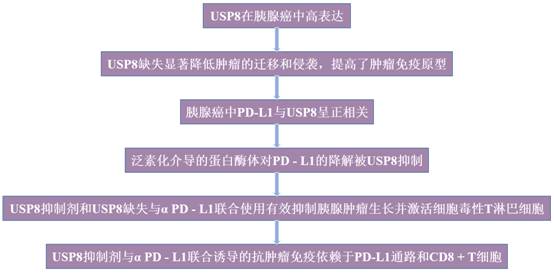
研究利用TCGA數據庫中腫瘤樣本和正常組織的mRNA表達數據對USP8進行生物信息學分析(圖1a)。分析發現,與配對的正常組織相比,胰腺癌樣本中USP8高表達(圖1b)。為進一步驗證USP8的差異表達,使用IHC染色比較了患者胰腺腫瘤組織樣本中的USP8水平,結果顯示PDAC(胰腺導管癌)組織中的USP8水平顯著高于正常組織(圖1c-d)。與正常小鼠胰腺組織相比,IHC也顯示KPC(Kras LSL-G12D;Trp53 LSL-R172H;Pdx1-Cre)腫瘤組織中USP8表達升高,在PanIN1病變中USP8被初步激活(圖1e-f)。WB證實臨床胰腺腫瘤組織中USP8蛋白水平顯著高于配對癌旁組織(圖1g-h)。此外,WB用于評估胰腺癌細胞系中USP8的水平。正如預期的那樣,在人胰腺癌細胞系(BxPC - 3、CFPAC - 1、T3M4、MIA PaCa - 2、SW1990和PANC - 1)和小鼠胰腺癌細胞系(KPC)中檢測到高水平的USP8,但在Panc02中沒有檢測到;在HPNE細胞(正常胰腺導管細胞)中未檢測到USP8(圖1i)。這些結果表明,與正常組織相比,USP8在胰腺癌中高表達。
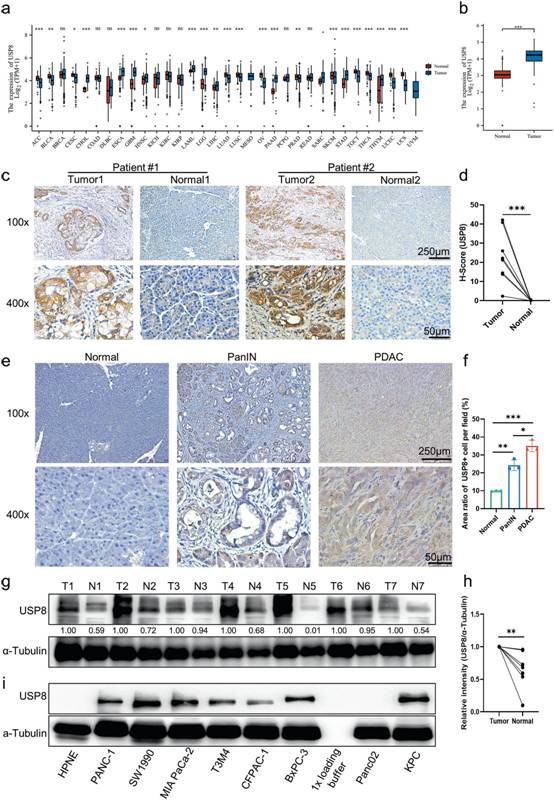
圖1 USP8在胰腺癌中高表達
2、USP8缺失顯著降低腫瘤的遷移和侵襲,提高了腫瘤免疫原型
作者利用shRNA慢病毒構建了穩定敲低Usp8 ( KD )的KPC細胞系,以確定USP8缺失是否以及如何提高抗腫瘤免疫原性。在免疫正常的C57Bl / 6J小鼠中,USP8 KD細胞形成的腫瘤相對于親本KPC細胞形成的腫瘤體積和重量減小;然而,當使用Nude(免疫缺陷)小鼠重復實驗時,沒有觀察到這種效應(圖2a-f )。流式細胞術分析顯示Usp8 KD細胞來源的腫瘤中腫瘤浸潤的活化T細胞數量和功能增加(圖2g-h)。同樣,IHC染色顯示USP8 KD細胞來源的腫瘤中CD8 +細胞、粒酶B +細胞、被切割的鈣蛋白酶I+細胞顯著增加,Ki67 +細胞顯著減少。同時,USP8 KD細胞來源的腫瘤中額外的IHC染色也顯示USP8表達和PD - L1表達降低(圖2i-j)。接下來,用DMSO或USP8特異性抑制劑預處理(1μM , 24 h)的胰腺癌細胞分別注射免疫正常小鼠和免疫缺陷小鼠皮下,進一步評估抑制USP8對胰腺癌發生發展的影響(圖2k)。USP8抑制劑預處理在免疫正常小鼠中導致腫瘤形成減少(圖2l),但在裸鼠中未見腫瘤形成(圖2m)。此外,將親本和USP8 KD KPC細胞分別注射到免疫缺陷和免疫正常小鼠體內(圖2n)。根據記錄的死亡時間,與注射KPC細胞的親本小鼠相比,免疫正常的USP8 KD腫瘤小鼠的生存期延長(圖2o);然而,免疫缺陷小鼠并未獲得這種生存獲益(圖2p)。總的來說,USP8與胰腺腫瘤的促進、遷移和侵襲有關。USP8缺失可以以免疫依賴的方式發揮抗腫瘤作用,USP8抑制可以在不同分子亞型的胰腺癌中發揮類似的腫瘤抑制作用。
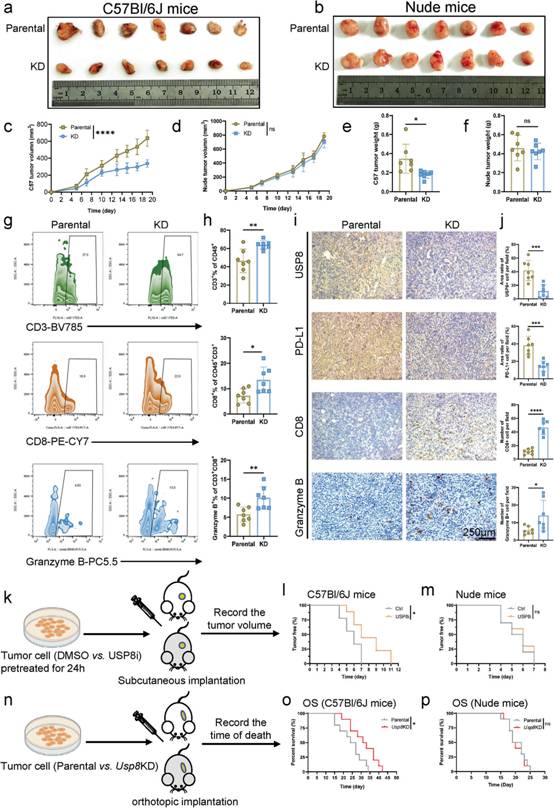
圖2 USP8缺失顯著降低腫瘤的遷移和侵襲,提高了腫瘤免疫原型
3、胰腺癌中PD-L1與USP8呈正相關
PD-1 / PD - L1抑制信號是抗腫瘤免疫治療的重要靶點。因此,作者進一步評估USP8是否與PD - L1相互作用。通過TCGA數據庫的生物信息學分析,我們觀察到胰腺癌樣本中USP8和PDL1 mRNA表達之間存在顯著相關性(圖3a)。此外,使用胰腺腫瘤組織芯片的分析顯示它們在蛋白質水平上的相關性(圖3b-d)。此外,在胰腺癌細胞系(KPC、BxPC - 3、SW1990)中觀察到內源性USP8與內源性PD - L1存在相互作用(圖3e-g)。此外,通過GST pull - down實驗在體外證明了USP8與PD - L1的直接結合(圖3h)。同樣,免疫熒光分析和熒光強度圖顯示KPC細胞、Bx PC - 3細胞、KPC小鼠胰腺腫瘤組織和人胰腺腫瘤組織中存在明顯的USP8 / PD - L1共定位(USP8:紅色;PD-L1:綠色)(圖3i-l);這些結果說明胰腺癌中PD-L1與USP8有一個正相關作用。
圖3胰腺癌中PD-L1與USP8呈正相關
4、泛素化介導的蛋白酶體對PD - L1的降解被USP8抑制
考慮到USP8與PD - L1呈正相關,兩者之間可能存在調控機制。WB分析發現,經濃度梯度和時間梯度的USP8抑制劑處理以及Usp8敲低后,胰腺癌細胞系中PD - L1蛋白水平下調(圖4a-c)。同樣,根據流式細胞術分析,使用USP8抑制劑和Usp8敲低處理下調胰腺癌細胞系中PD - L1的表達(圖4d-e)。免疫熒光染色發現,與親本KPC細胞相比,Usp8缺失的KPC細胞中USP8 (紅色)和PD - L1 (綠色)水平下調(圖4f-g)。此外,與親代KPC腫瘤相比,PD - L1在Usp8 KD胰腺腫瘤中的表達顯著下調(圖4h-k)。然而,根據qRT-PCR結果,USP8抑制劑或Usp8敲低處理后,PDL1 mRNA水平無明顯變化,說明USP8對PD - L1的調控發生在翻譯后水平而非轉錄水平(圖4l)。因此,作者推測在胰腺癌中,USP8通過PTM調節PD-L1水平。有趣的是,在胰腺癌細胞中,用蛋白酶體抑制劑MG132處理后,USP8抑制或耗竭介導的PD - L1下調得到恢復,提示USP8通過蛋白酶體途徑調節PD - L1(圖4m-n)。為驗證USP8調控PD - L1穩定性,半衰期分析結果顯示PD - L1的半衰期縮短,在USP8抑制和耗竭的細胞中PD - L1迅速降解,這種降解可以被MG132挽救(圖4o-r)。隨后,作者評估USP8抑制和缺失對PD - L1泛素化的影響。結果表明,與對照細胞相比,USP8抑制和缺失細胞中PD - L1泛素化水平顯著升高(圖4s-t)。因此,USP8可以通過降低PD - L1的泛素化水平來減少PD - L1的降解。總之,這些發現表明USP8通過泛素-蛋白酶體途徑抑制PD - L1的降解來穩定胰腺癌細胞中PD - L1的水平。
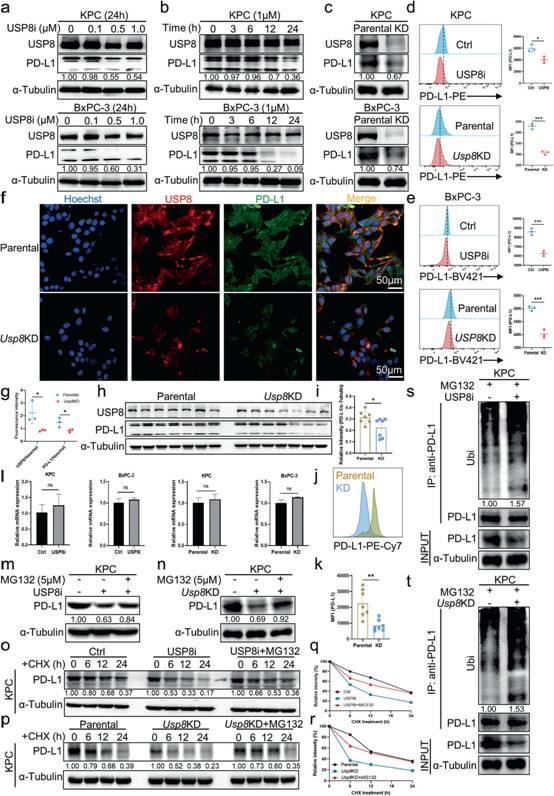
圖4泛素化介導的蛋白酶體對PD - L1的降解被USP8抑制
5、USP8抑制劑和USP8缺失與α PD - L1聯合使用有效抑制胰腺腫瘤生長并激活細胞毒性T淋巴細胞
為探究USP8抑制劑通過體內調節PD - L1水平的抗腫瘤作用,作者構建腫瘤模型,并將USP8抑制劑單獨或聯合αPD - L1給KPC來源的皮下腫瘤的小鼠(圖5a)。觀察到,在USP8抑制劑組中,與對照組相比,腫瘤大小、腫瘤體積和腫瘤重量顯著降低,并且這些降低在聯合組更加顯著(圖5b-d)。與對照組相比,WB和流式細胞術分析顯示USP8抑制劑顯著降低PD - L1水平(圖5e-h)。此外,流式細胞分析和IHC染色顯示,αPD - L1共處理顯著增加了小鼠腫瘤浸潤的細胞毒性CD8 + T細胞的數量和活化(圖5i-l)。以上結果提示,USP8抑制劑聯合PDL1阻斷可增強抗腫瘤免疫,抑制胰腺腫瘤的生長。
為進一步研究USP8在胰腺癌免疫反應中的作用,作者構建親代和Usp8 KD KPC細胞結合α PD - L1的原位荷瘤小鼠(圖6a)。Usp8 KD聯合α PD - L1抑癌效果最佳(圖6b-c)。流式細胞術檢測發現,USP8缺失降低PD - L1表達,增加MHC - 1表達,體外實驗也證實了這一點(圖6d-g)。
為驗證USP8抑制劑聯合αPD - L1的免疫治療機制,作者構建了原位KPC - Luci細胞荷瘤小鼠(圖7a)。正如預期的那樣,與對照組相比,在聯合給藥組中觀察到最明顯的腫瘤大小和重量的下降(圖7b-c)。通過對比活體成像中腫瘤發光強度的變化和最后一天的相對發光強度變化,我們發現隨著給藥時間的延長,腫瘤逐漸縮小,其中聯合用藥組的縮小最為明顯(圖7d-e)。此外,流式細胞術分析(圖7h-i)發現,USP8抑制劑的應用增加了MHC - 1的表達。同時,其他實驗結果與皮下給予USP8抑制劑和αPD - L1的模型結果相似(圖7f-m);因此,聯合使用USP8抑制劑和αPD - L1可以減少腫瘤在體內的遷移。以上結果驗證抑制USP8通過調節PD - L1穩定性激活細胞毒性T淋巴細胞。
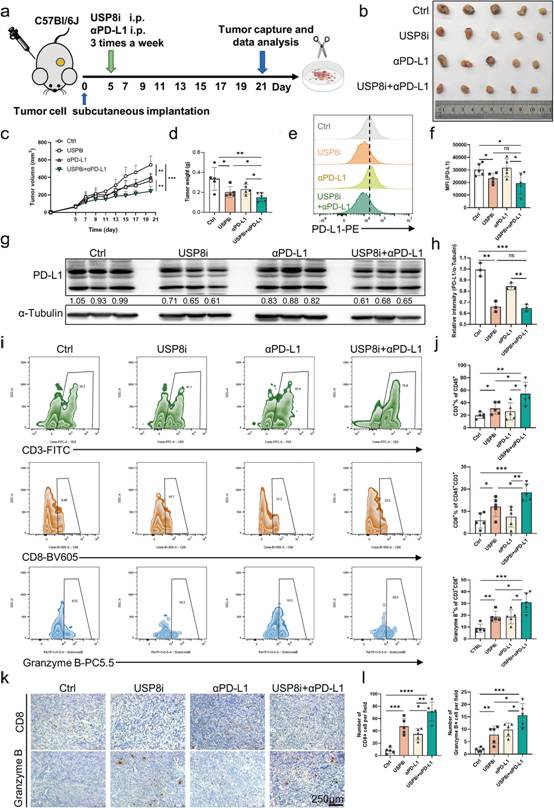
圖5 USP8抑制劑聯合αPD-L1可有效抑制胰腺腫瘤在體內的生長
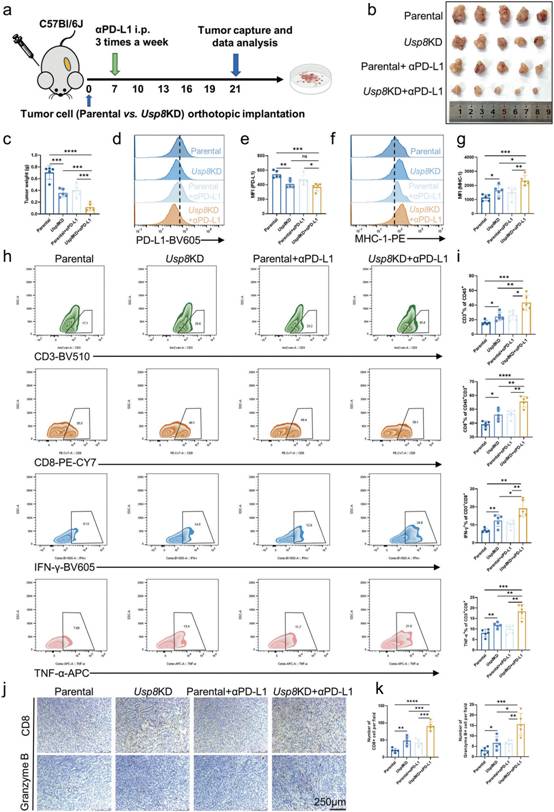
圖6 USP8缺失聯合αPD-L1促進抗腫瘤免疫

圖7 USP8抑制劑使胰腺癌對PD-L1免疫治療增敏
6、USP8抑制劑與α PD - L1聯合誘導的抗腫瘤免疫依賴于PD-L1通路和CD8 + T細胞
為進一步確定PD - L1在USP8抑制劑和αPD - L1聯合治療效果中的作用,利用CRISPR / Cas9 KO質粒構建了Cd274敲除的KPC細胞系,并通過WB分析和流式細胞術驗證(圖8a-b)。作者構建原位親代和Cd274 KO KPC細胞荷瘤小鼠,并給予聯合治療(圖8c)。作者觀察到與親本組相比,使用聯合治療的Cd274 KO組腫瘤大小和重量沒有明顯減少(圖8d-e)。此外,在研究中各組小鼠的平均體重無顯著差異(圖8f)。此外,為進一步證實CD8 + T細胞是抗腫瘤免疫的介質,在接種KPC細胞之前去除CD8 + T細胞,并聯合USP8抑制劑和αPD - L1處理(圖8g)。CD8耗竭抗體處理KPC腫瘤小鼠后,ctrl組與聯合治療組的腫瘤負荷差異消失(圖8h-i)。給藥組動物未見體重下降(圖8j)。流式細胞術證實小鼠脾臟中CD8 + T細胞的耗竭(圖8k-l)。總之,上述結果驗證了聯合治療引起的抗腫瘤免疫依賴于PD-L1通路和CD8 + T細胞。
綜上所述,在胰腺癌細胞中,USP8通過泛素-蛋白酶體途徑抑制PD - L1的降解來穩定PD - L1。由USP8抑制劑和αPD-L1組成的聯合治療通過調節PD - L1的穩定性抑制胰腺腫瘤生長并激活細胞毒性T淋巴細胞(圖8m)。

圖8 USP8抑制劑與αPD - L1聯合誘導的抗腫瘤免疫依賴于PD-L1通路和CD8 + T細胞
結論
綜上所述,我們發現USP8是一種新型的PD - L1去泛素化酶,通過抑制泛素化調節的蛋白酶體降解途徑上調PD - L1水平,從而通過免疫逃逸促進胰腺腫瘤生長。USP8抑制劑與α PD - L1聯合治療下調PD - L1蛋白水平,導致細胞毒性T細胞活化。總之,靶向USP8聯合其他抗腫瘤藥物可能是癌癥免疫治療中改善患者預后的潛在策略。
參考文獻
Yang H, Zhang X, Lao M, Sun K, He L, Xu J, Duan Y, Chen Y, Ying H, Li M, Guo C, Lu Q, Wang S, Su W, Liang T, Bai X. (2022) Targeting ubiquitin-specific protease 8 sensitizes anti-programmed death-ligand 1 immunotherapy of pancreatic cancer. Cell Death Differ. doi: 10.1038/s41418-022-01102-z.






