乳酸-NAD+軸通過下調p62激活腫瘤相關成纖維細胞
p62水平降低與癌癥相關成纖維細胞(CAF)表型的誘導相關,CAF表型通過炎癥和代謝重編程在體內外促進腫瘤發生。然而,腫瘤細胞如何下調基質成纖維細胞中的p62來驅動CAF激活是該領域尚未解決的核心問題。近日,有研究發現腫瘤分泌的乳酸下調了間質成纖維細胞中的p62;乳酸降低NAD+水平和PARP-1活性,從而下調間質p62;AP-1對乳酸誘導的間質成纖維細胞p62損失至關重要;PARP-1抑制劑(奧拉帕利)通過p62促進間質成纖維細胞的結締組織反應。該研究探究了癌細胞促進前致瘤性CAF表型的分子機制,為抑制CAF活性提供新的治療策略。該研究于2022年5月發表在《CELL REPORTS》,IF:9.995。
技術路線:

主要研究結果:
1. 前列腺癌細胞分泌一種可溶性因子,可降低基質成纖維細胞中p62的表達
為了研究p62在腫瘤間質中表達下調的機制,作者建立了小鼠GFP標記的前列腺基質細胞(mPSCs)與TRAMPC2前列腺癌(PCa)上皮細胞混合的體外細胞系統。與腫瘤細胞孵育時,基質細胞中Sqstm1(編碼p62) mRNA水平降低,這也與真正CAF標志物(如Tgfb1和Sdf-1)的增加相關(圖1A)。為了驗證p62的下調是否需要腫瘤細胞和基質細胞之間的細胞接觸,將人前列腺基質成纖維細胞(WPMY-1)與不同的PCa細胞系在雙腔環境中共培養。在這些條件下,基質細胞中p62的蛋白和mRNA水平也下調(圖1B和圖1C),表明由PCa上皮細胞分泌的可溶性因子足以下調基質細胞中的p62。來自PCa細胞的條件培養基(CM)孵育基質細胞有效降低了基質細胞中的p62蛋白和mRNA水平,而正常前列腺上皮細胞(PrEC或RWEP1)的CM沒有任何影響(圖1D和1E)。為了確定SQSTM1 mRNA的減少是否是由于轉錄活性的抑制,使用了SQSTM1啟動子控制下的熒光素酶報告基因。PCa CM降低了熒光素酶報告的活性(圖1F),表明基質p62的下調是通過腫瘤細胞分泌的可溶性因子抑制SQSTM1啟動子介導的。為了鑒定這種假定的腫瘤來源的可溶性因子,對PC3細胞的CM進行了大小分級。在成纖維細胞中,未分割的腫瘤CM和<3-kDa片段均在蛋白和mRNA水平上下調p62(圖1G和1H),以及SQSTM1啟動子驅動的熒光素酶報告基因的活性(圖1I)。然而,>3-kDa部分在這些試驗中完全不活躍(圖1G-1I)。活性可溶性因子具有熱穩定性(圖1J-1L),提示其可能為代謝物。

圖1 PCa細胞分泌一種可溶性因子,可降低基質細胞中p62的表達
2. 乳酸下調間質成纖維細胞中的p62
由于癌細胞分泌大量的乳酸,并且由于Warburg效應在TME中積累,推測乳酸可能是導致p62下調的代謝物。正如預期的那樣,PCa細胞系分泌的乳酸量高于正常前列腺上皮細胞(圖2A)。由于乳酸的細胞攝取是由不同的單羧酸轉運蛋白(MCT1、MCT2、MCT3和MCT4)介導的,接下來測試了阻斷這些轉運蛋白是否可以損害乳酸誘導的p62下調。MCT1在WPMY-1細胞中控制乳酸的細胞輸入,敲低MCT1導致PC3細胞的CM誘導的p62下調受到抑制(圖2B-2D)。同樣,當PC3細胞中控制乳酸輸出的MCT4被敲低時,WPMY-1細胞中p62的下調也被消除(圖2E-2G和S1B)。MCT1抑制劑AZD3965處理PC3 CM處理的WPMY-1細胞后,p62下調受損(圖2H-2J)。這些結果表明,PCa細胞分泌乳酸和基質細胞攝取乳酸是基質p62下調的關鍵步驟。為了證明乳酸足以下調成纖維細胞中的p62,將WPMY-1細胞與不同濃度的乳酸孵育24或48小時,這導致p62以時間和劑量依賴的方式下調(圖2K-2N)。在基質細胞中下調p62所需的乳酸量(圖2M和2N)與PCa細胞分泌的乳酸量(圖2A)相似,也與體內腫瘤的乳酸量相似。然而,簡單的培養基酸化不足以下調p62(圖2O)。這些結果表明,上皮PCa細胞分泌的乳酸在轉錄水平上損害了基質細胞中p62的表達。
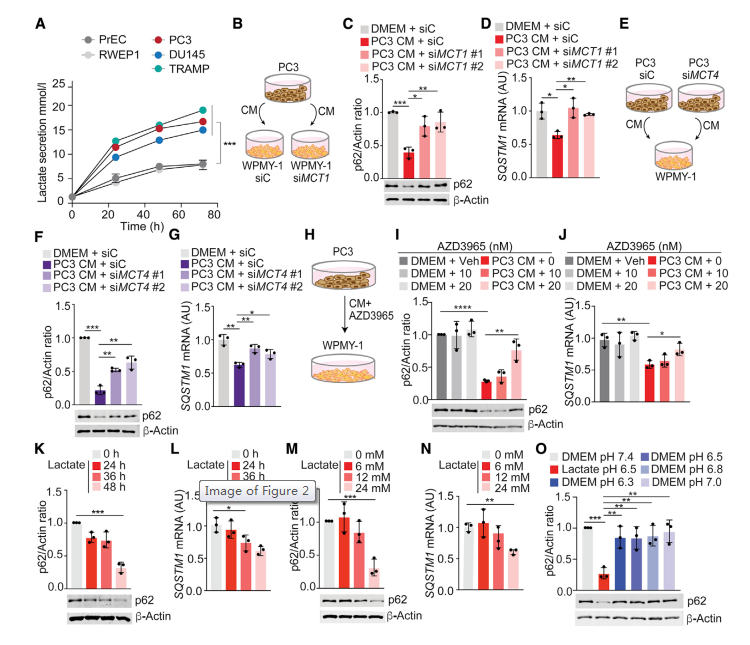
圖2 乳酸下調p62
3. AP-1通過乳酸抑制p62下調
為了闡明乳酸下調基質p62的機制,下一步通過轉座酶可及染色質測序全基因組分析(ATAC-seq)研究了乳酸處理的成纖維細胞的染色質可及性。這項分析顯示,在乳酸處理的細胞中,染色質可及性普遍降低(圖3A)。HOMER(基序富集的超幾何優化)分析表明,在乳酸處理的細胞的封閉染色質區域中,AP-1轉錄因子顯著富集(圖3B)。對SQSTM1啟動子的分析表明存在三個AP-1調節位點,這些位點也表明在乳酸處理的條件下染色質可及性降低(圖3C)。與此一致,乳酸抑制了AP-1驅動的熒光素酶報告基因(圖3D),這共同表明SQSTM1啟動子中AP-1位點的抑制可以解釋乳酸對基質p62表達的影響。
為了確定AP-1位點在SQSTM1啟動子中的作用,分別突變了這些位點(AP-1A, AP-1B和AP-1C),并確定這些突變對SQSTM1啟動子活性的影響。AP-1A的突變使SQSTM1啟動子完全失活,達到與乳酸產生的水平相當的水平,而AP-1B或AP-1C的突變沒有影響(圖3E),這表明AP-1A是SQSTM1啟動子中介導乳酸抑制的關鍵增強子元件。為了驗證這一假設,通過CRISPR-Cas9編輯選擇性地刪除內源性SQSTM1啟動子中的AP-1A元件,從而產生4種獨立的WPMY-1細胞培養物(sgAP-1A),這導致p62 mRNA和蛋白表達受到抑制(圖3F-3H)。這些結果確立了AP-1A在基質細胞中調節p62表達的相關性。與這一觀點一致, ChIP分析表明,乳酸顯著減少了c-FOS和c-JUN募集到AP-1A調節位點,但沒有減少FOSB或JUNB的募集,且未檢測到與AP-1B或AP-1C位點的結合發生變化(圖3I)。下調c-FOS、c-JUN和JNK,或者用JNK的兩種藥理抑制劑抑制c-JUN磷酸化,在蛋白和mRNA水平上模擬了乳酸對p62表達的影響(圖3J-3M)。這些數據表明,c-JUN/c-FOS AP-1轉錄復合物募集受損在乳酸誘導的基質p62下調中起關鍵作用。
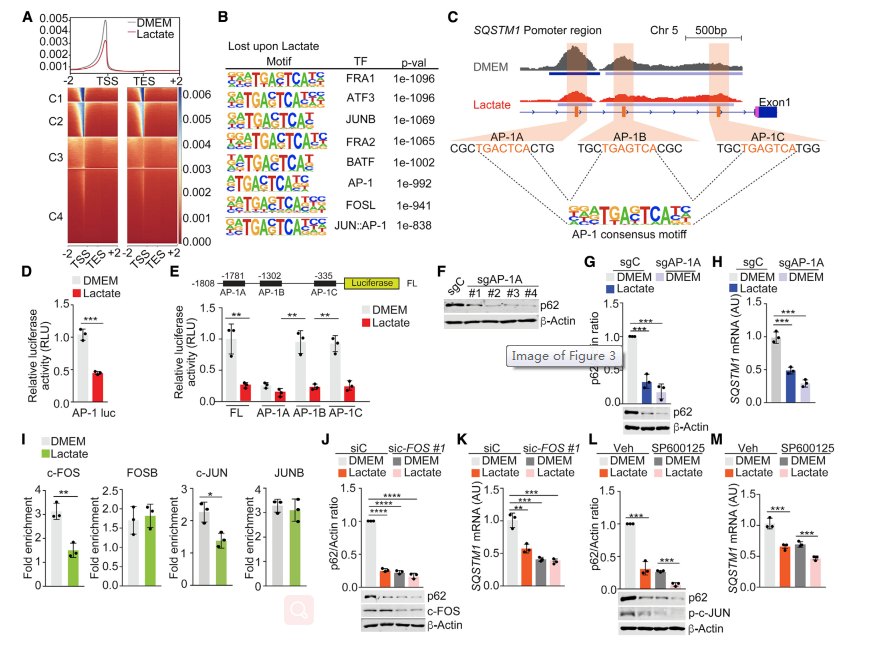
圖3 AP-1通過乳酸抑制p62的下調
4. 乳酸代謝降低NAD+水平介導p62下調
研究成纖維細胞中細胞外乳酸的命運。應用2H和13C同位素示蹤和質譜方法來量化細胞外乳酸對NADH和中心碳代謝的貢獻。細胞外乳酸通過LDH活性代謝,將氫原子貢獻到NADH池并再生胞質煙酰胺腺嘌呤二核苷酸(NAD+)池(圖4A和4B)。接下來,發現大約20%的[13C]乳酸示蹤劑在三羧酸(TCA)循環中間產物上,這表明細胞外乳酸被代謝為促進線粒體TCA循環代謝的碳源(圖4A和圖4C)。測定在10 mM外源[13C]乳酸存在下的乳酸攝取和分泌通量的實驗表明,WPMY-1細胞在分泌未標記的乳酸的同時攝取標記的乳酸(圖4A和圖4D)。這些結果與以下事實一致:乳酸可以可逆性地轉化為丙酮酸鹽,隨后NAD+水平減少,有利于NADH的生成。增加培養基中丙酮酸的水平,使這一反應向相反的方向發生,顯然損害了乳酸下調p62的能力(圖4E和圖4F)。因此,NAD+/NADH比率的變化可能有助于乳酸調節p62水平的作用機制。與這一假設一致,乳酸處理的基質成纖維細胞中的NAD+水平低于未處理的細胞(圖4G)。使用NAD+或NAD+前體煙酰胺核苷(NR)治療完全挽救了乳酸誘導的p62減少,且獨立于自噬(圖4H-4K)。
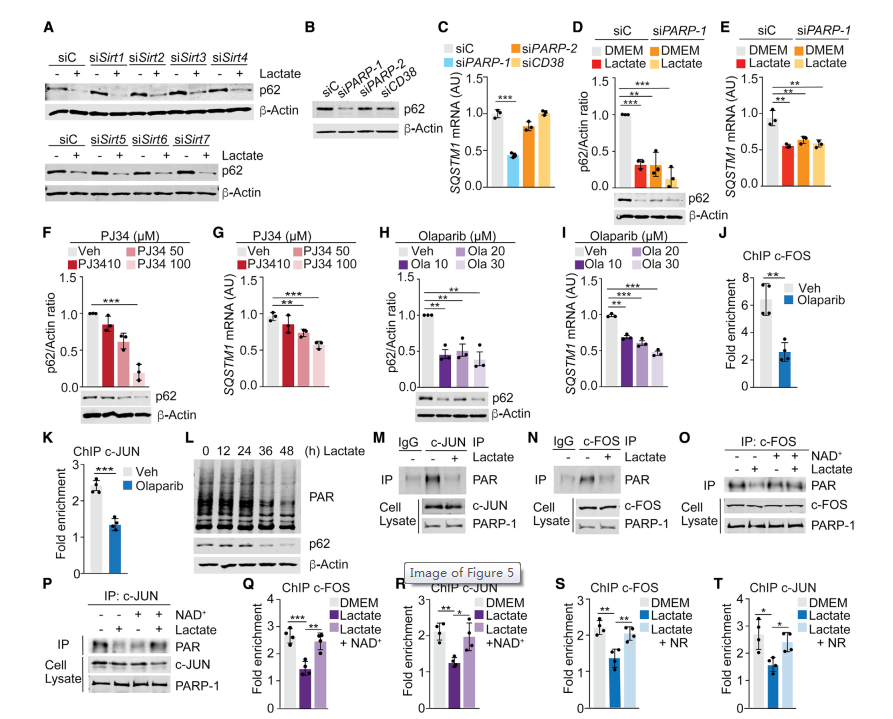
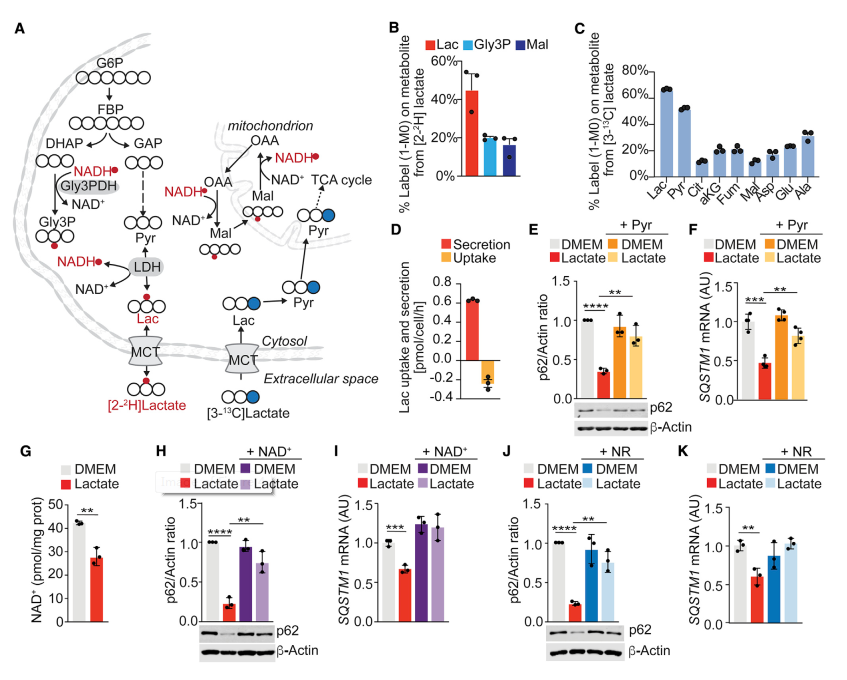
圖4 乳酸改變NAD+/NADH水平介導p62下調
5. 乳酸抑制PARP-1可下調間質細胞p62
NAD+是三種轉錄和翻譯后調節因子的輔因子,包括sirtuins (SIRT1到SIRT7)、cyclic ADP-核糖合酶(CD38和CD157)和PARPs (PARP-1/2)。其中,只有PARP-1的敲低或CRISPR-Cas9缺失完全模擬了乳酸對p62表達的影響(圖5A -5E)。此外,PARP-1抑制劑PJ34或奧拉帕利也以劑量依賴性方式降低了p62的表達(圖5F-5I)。PARP-1除了在DNA損傷修復(DNA damage repair, DDR)中發揮眾所周知的作用外,還控制許多其他的生物過程,包括轉錄。此外,奧拉帕利抑制了c-FOS和c-JUN向SQSTM1啟動子中AP-1A結合位點的募集(圖5J和圖5K)。這些結果表明,基質細胞中乳酸代謝觸發的NAD+水平的變化對PARP-1活性的調節是p62下調的工具。因此,我們假設乳酸可以影響PARP-1的活化,從而影響c-JUN和c-FOS的聚腺苷二磷酸核糖基化。乳酸處理的細胞總poly(ADP-ribosyl)ation水平降低,c-JUN和c-FOS的poly(ADP-ribosyl)ation受損(圖5L-5N)。在乳酸處理的細胞中添加NAD+可恢復這兩種轉錄因子的poly(ADP-ribosyl)ation (圖5O和5P),以及它們向SQSTM1啟動子中AP-1調節位點的募集(圖5Q和5R)。這些數據表明,乳酸代謝導致的NAD+耗損以及隨后c-FOS和c-JUN的poly(ADP-ribosyl)ation受損是乳酸下調基質成纖維細胞中p62的機制基礎。

圖5 抑制PARP-1可下調間質細胞p62水平
6. AP-1在p62缺失驅動的CAF激活中至關重要
p62缺失可驅動基質細胞中的CAF表型,從而促進腫瘤進展。由于PCa細胞的乳酸分泌對于下調基質中的p62是必要和充分的,因此下一步確定乳酸是否驅動CAF表型。乳酸處理成纖維細胞增加了CAF活化的真正標志物的表達,如ACTA2和TGF-β,這些標志物的表達被添加NAD+逆轉(圖6A和6B)。對乳酸處理的細胞中差異表達基因的基因集富集分析(GSEA)顯示,來自人類基質PCa數據集(GEO: GSE34312)的CAF signatures富集(圖6C)。此外,SQSTM1啟動子內源性失活的sgAP-1A成纖維細胞也顯示出CAF標志物表達增加(圖6D)。同樣,在雙腔共培養系統中,成纖維細胞sgAP-1A促進PC3細胞的遷移和侵襲,而sgC沒有作用(圖6E-6G)。PC3細胞與sgC和sgAP-1A成纖維細胞共培養表明,與sgC細胞相比,sgAP-1A細胞增強了PCa上皮細胞的侵襲和增殖指數(圖6H和6I)。此外,與sgC成纖維細胞共植入相比,PC3細胞與sgAP-1A成纖維細胞共植入皮下異種移植導致腫瘤生長增加(圖6J-6L)。由sgAP-1A成纖維細胞生成的腫瘤顯示基質活化標志物增加,如膠原沉積、透明質酸(HA)和α-平滑肌肌動蛋白(α-SMA)(圖6M)。這些結果證實SQSTM1啟動子中的AP-1調節位點是乳酸驅動信號的靶點,并且在基質細胞內源性p62水平的控制中具有關鍵作用,對CAF表型的誘導至關重要。
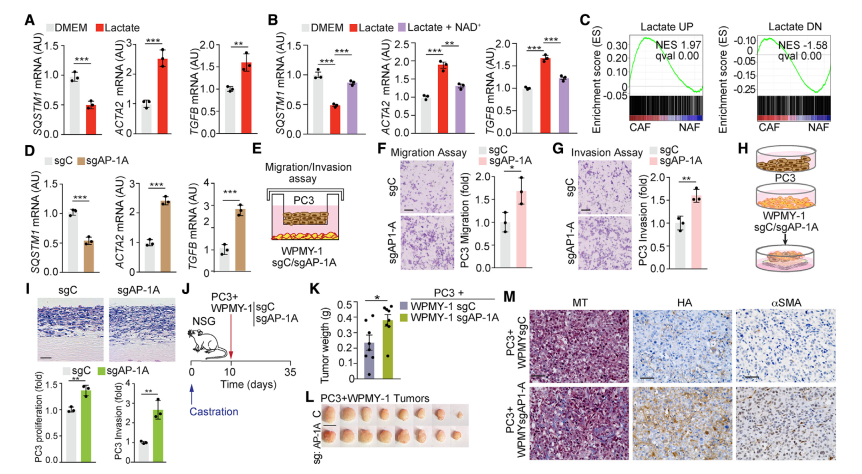
圖6 AP-1控制基質細胞中SQSTM1啟動子對PCa腫瘤的生長和侵襲至關重要
7. PARP-1抑制劑通過p62促進間質成纖維細胞的結締組織反應
根據作者的模型,乳酸通過抑制PARP-1觸發基質成纖維細胞中p62的下調。同樣,通過CRISPR-Cas9敲除PARP-1模擬了乳酸的作用,并誘導了ACTA2和TGF-β等CAF活化標志物(圖7A)。因此,假設PARP-1抑制劑(如奧拉帕利)足以誘導基質激活。奧拉帕利降低了SQSTM1 mRNA,并上調了ACTA2、SFRP1、TGF-β、MMP9和HA合酶等CAF標志物(圖7B)。此外,對奧拉帕利處理的細胞進行的ATAC-seq分析表明,與乳酸處理相似,整個基因組中,在AP-1轉錄因子(包括SQSTM1啟動子)的共有基序區域,染色質可及性顯著降低(圖7C)。PC3細胞與奧拉帕利預處理的WPMY-1細胞共培養導致PCa細胞在基礎條件下的遷移和侵襲增加,這一情況在雄激素剝奪(ADT)下更為明顯(圖7D-7F)。此外,奧拉帕利處理的WPMY-1 CM導致PC3增殖增加(圖7G和7H)。根據這些觀察結果,假設奧拉帕利治療后基質激活可能會抑制其抗腫瘤活性。為了檢驗這一假設,在基礎或ADT條件下將GFP標記的PC3細胞(PC3GFP)與WPMY-1細胞(共培養)或不與WPMY-1細胞(單獨培養)共培養,并且使用或不使用奧拉帕利治療10日(圖7I)。與單獨培養條件下的處理相比,與WPMY-1細胞共培養使PC3GFP細胞對奧拉帕利具有更高的耐藥性(圖7J)。這一效應在ADT條件下更加明顯(圖7J)。為了研究奧拉帕利的體內前CAF表型,下一步在NOD scid γ (NSG)小鼠中共植入PC3和WPMY-1細胞,并使用溶劑或奧拉帕利對它們進行處理(圖7K)。體內奧拉帕利治療有效降低了腫瘤生長(圖7L-7M),但也產生了強烈的促結締組織增生反應,其特征是膠原和HA沉積增強以及αSMA增加(圖7N)。在內源性TRAMP小鼠模型中發現了類似的奧拉帕利誘導的促結締組織增生性應答(圖7O和7P)。為了檢驗這些發現與人類的相關性,將分析擴展到兩個人類PCa異種移植物(VCAP和H660)和之前報告的對奧拉帕利治療有應答的PDX模型。與小鼠數據一致,奧拉帕利在所有人類PCa模型中均誘導了強基質激活(圖S6F)。

圖7 奧拉帕尼治療模擬p62的乳酸損失,促進基質激活
總結
腫瘤細胞分泌的乳酸在轉錄水平下調p62,從而誘導基質激活。乳酸導致NAD+/NADH比值降低,從而損害poly(ADP-ribose)polymerase 1 (PARP-1)活性。臨床上使用的PARP-1抑制劑(如奧拉帕利)在下調p62和促進CAF活性方面模擬了乳酸的作用,這一事實揭示了基于PARP-1抑制劑的療法的一個出乎意料的潛在弱點,并提示奧拉帕利與抗基質靶向療法的聯合治療將提高奧拉帕利的療效。






