長鏈非編碼RNA TLNC1通過抑制p53信號促進肝癌的生長和轉移
肝癌是全球第六大常見惡性腫瘤和第三大癌癥死亡原因。肝癌的高死亡率已被認為是由轉移和術后復發直接引起的。然而,目前臨床上可用于預防肝癌復發和轉移的方法非常有限。為了更有效地治療肝癌的復發轉移,研究肝癌復發轉移的分子機制,尋找潛在的治療靶點具有重要意義。該研究發表于《Molecular Cancer》,IF: 41.444。
技術路線:
主要研究結果:
1. TLNC1在肝癌組織中高表達并與患者預后相關
為了找到與肝癌的發展和進展相關的lncRNA,作者對11對肝癌和鄰近的正常肝組織進行了RNA-seq,并確定了328個顯著改變的lncRNA(圖1a)。為了縮小候選lncRNA的范圍,作者首先利用了TCGA LIHC隊列(50對)的RNA-seq數據,并確定了658個顯著改變的lncRNA(圖1b)。通過WCH 和TCGA隊列的交叉,確定了101個顯著改變的lncRNA,隨后根據TCGA LIHC隊列的總生存期 (OS) 和無病生存期(DFS)數據對其進行生存分析。經過生存分析,作者成功鑒定出5個候選lncRNA,它們在腫瘤和正常組織之間存在顯著差異表達,并且與肝癌患者的OS和DFS均顯著相關(圖1c)。接下來,通過qRT-PCR對20對組織樣本驗證了這些候選lncRNA的表達水平。基于表達水平數據,TLNC1被選為候選lncRNA進行進一步研究,因為它是上述5個候選lncRNA中最豐富的lncRNA(圖1d)。此外,作者擴大了樣本量(n=72)以確認TLNC1在肝癌組織中顯著高表達(圖1e)。一致地,在TCGA LIHC隊列中也觀察到了類似的結果(圖1f, g)。這些發現表明TLNC1是一種豐富的lncRNA,在肝癌中顯著上調并與患者預后相關。
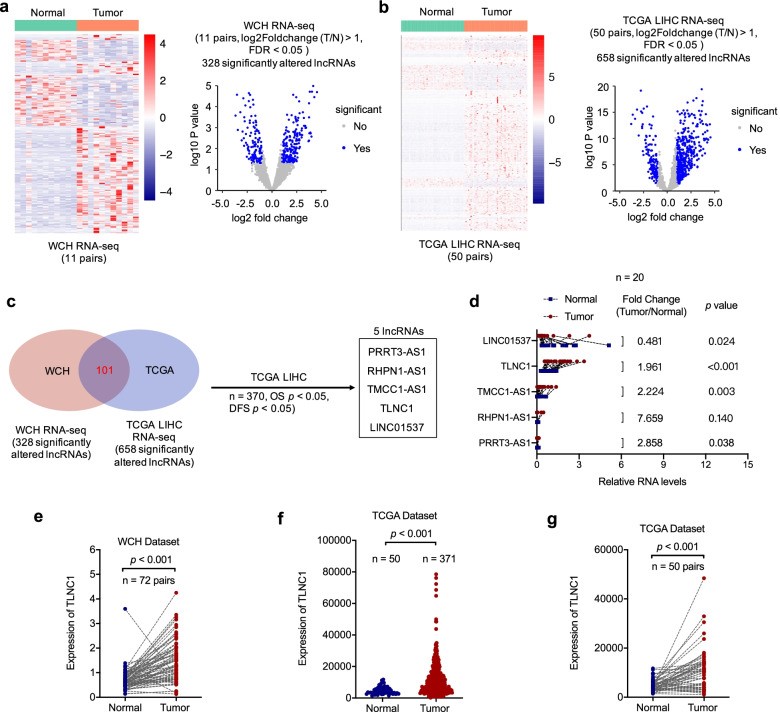
圖1 TLNC1在肝癌組織中上調
2. TLNC1的過表達促進體外和體內肝癌細胞的生長和轉移
為了確定TLNC1是否作為致瘤性lncRNA發揮作用,作者構建了兩個TLNC1過表達肝癌細胞系SNU449和HCCLM3細胞(圖2a)。CCK-8和EdU測定顯示TLNC1的過表達顯著提高了SNU449和HCCLM3細胞的細胞增殖(圖2b, c)。此外,作者證明與指定的對照相比,TLNC1過表達的肝癌細胞中的細胞運動性增加(圖2d-g)。為了在體內驗證TLNC1的致癌功能,作者首先構建了皮下異種移植肝癌小鼠模型,發現TLNC1的強制表達顯著增加了異種移植腫瘤的體積和重量(圖2h)。此外,建立肝原位移植模型和肺轉移模型,以評估TLNC1過表達對腫瘤轉移的影響。體內成像系統(IVIS)成像結果表明,TLNC1過表達組在肝臟中表現出更強的生物發光信號強度。同時,TLNC1的過表達顯著促進了肝癌細胞的肝臟定植(圖2i)。一致地,TLNC1-過表達組在肺轉移模型中顯示出更多的肺轉移灶(圖2j)。綜上所述,這些數據表明TLNC1過表達促進了肝癌的細胞增殖和轉移。
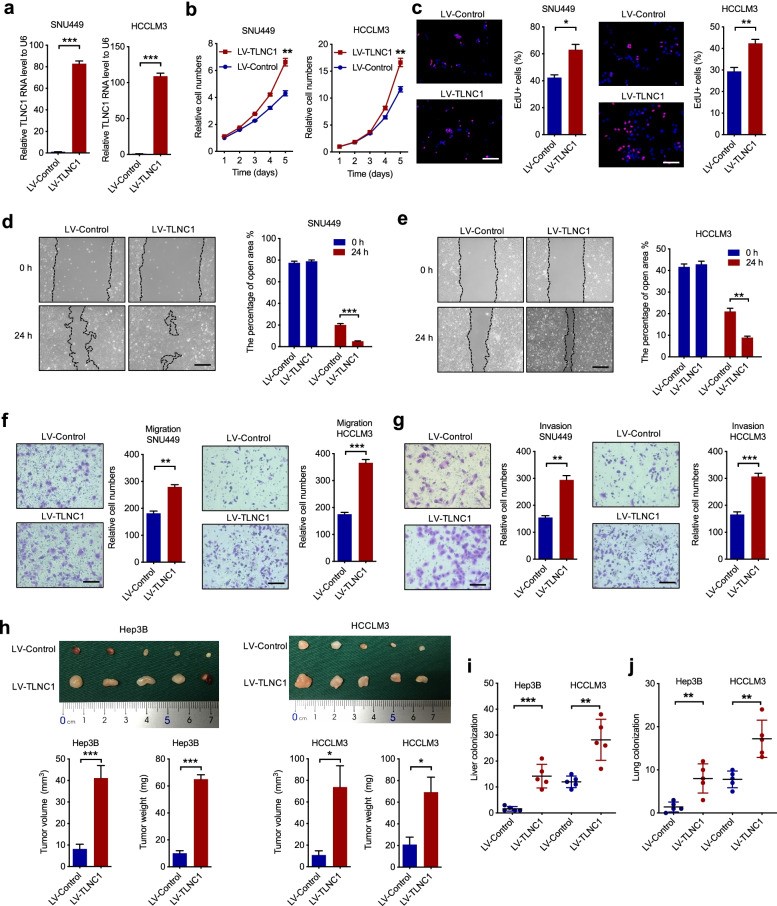
圖2 TLNC1促進肝癌細胞的腫瘤生長和轉移
3. TLNC1對肝癌的腫瘤進展和轉移至關重要
為了證實TLNC1在肝癌腫瘤進展和轉移中的功能,作者在SNU449和HCCLM3細胞中使用3個獨立的短發夾RNA (shRNA) 使TLNC1沉默(圖3a)并選擇2個具有更好敲低功效的shRNA用于后續實驗。結果表明,TLNC1的沉默抑制了SNU449和HCCLM3細胞的細胞生長(圖3b, c)。同時,與指定的對照相比,TLNC1敲低的肝癌細胞系中的細胞運動性顯著下調(圖3d-f)。為了確定TLNC1是否是體內肝癌生長和轉移所必需的,作者首先構建了皮下異種移植肝癌小鼠模型,并表明TLNC1的沉默降低了異種移植腫瘤的體積和重量(圖3g)。此外,肝原位移植模型和肺轉移模型被用來驗證TLNC1沉默對腫瘤轉移的作用。IVIS成像結果表明TLNC1敲低組在肝臟中顯示出較弱的生物發光信號強度。同時,TLNC1的敲低顯著抑制肝癌細胞的肝臟定植(圖3h)。一致地,TLNC1敲低組在肺轉移模型中顯示出較少的肺轉移灶(圖3i)。總之,作者的結果表明TLNC1是肝癌細胞生長和轉移所必需的。
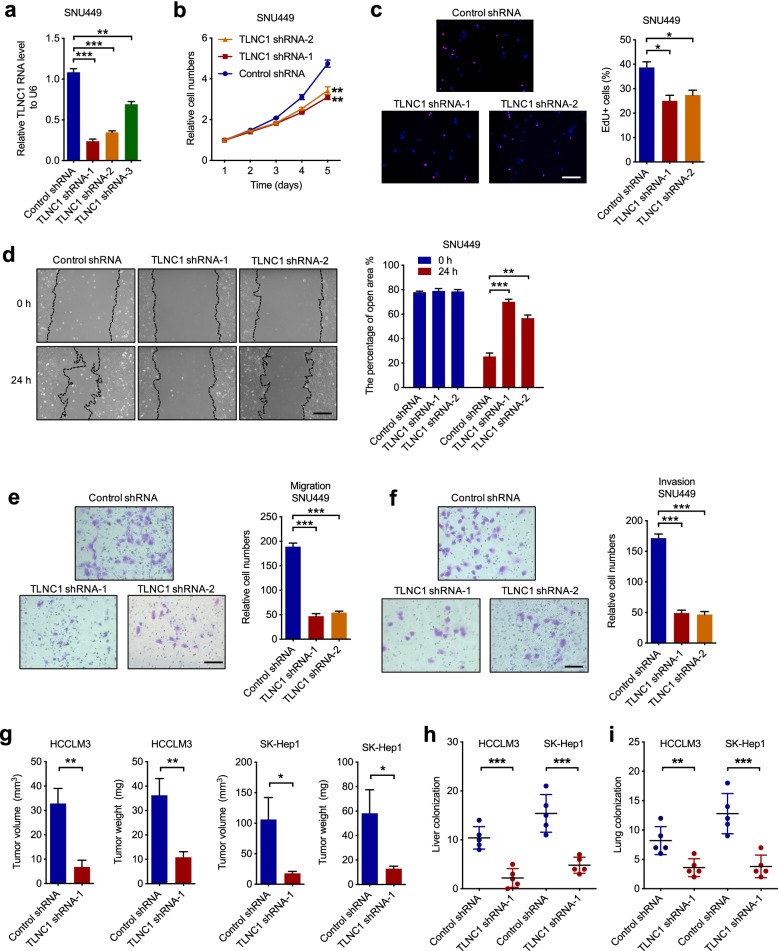
圖3 TLNC1的敲低抑制了肝癌細胞的腫瘤生長和轉移
4. TLNC1調節與細胞生長和轉移相關的多種信號通路
為了探索TLNC1介導的肝癌腫瘤進展和轉移的潛在機制,作者進行了RNA-seq以鑒定受TLNC1敲低調節的基因,并?在與對照相比,TLNC1敲低的HCCLM3細胞(圖4a)。京都基因和基因組百科全書(KEGG)通路分析表明,p53信號通路和細胞周期是最顯著的富集通路之一。基因本體論(GO)分析表明,TLNC1可以調節一系列與腫瘤進展相關的生物學過程,如細胞粘附、粘著斑和有絲分裂細胞周期的調節(圖4b)。之后,分別在p53信號通路、細胞周期和粘著斑基因組中鑒定出倍數變化最顯著的前10個基因(圖4c)。為了驗證RNA-seq的數據,作者使用qRT-PCR檢查了每個基因組中5個基因的mRNA水平。如圖4d和e所示,TLNC1的調節確實調節了與腫瘤生長和轉移相關的基因的表達水平。
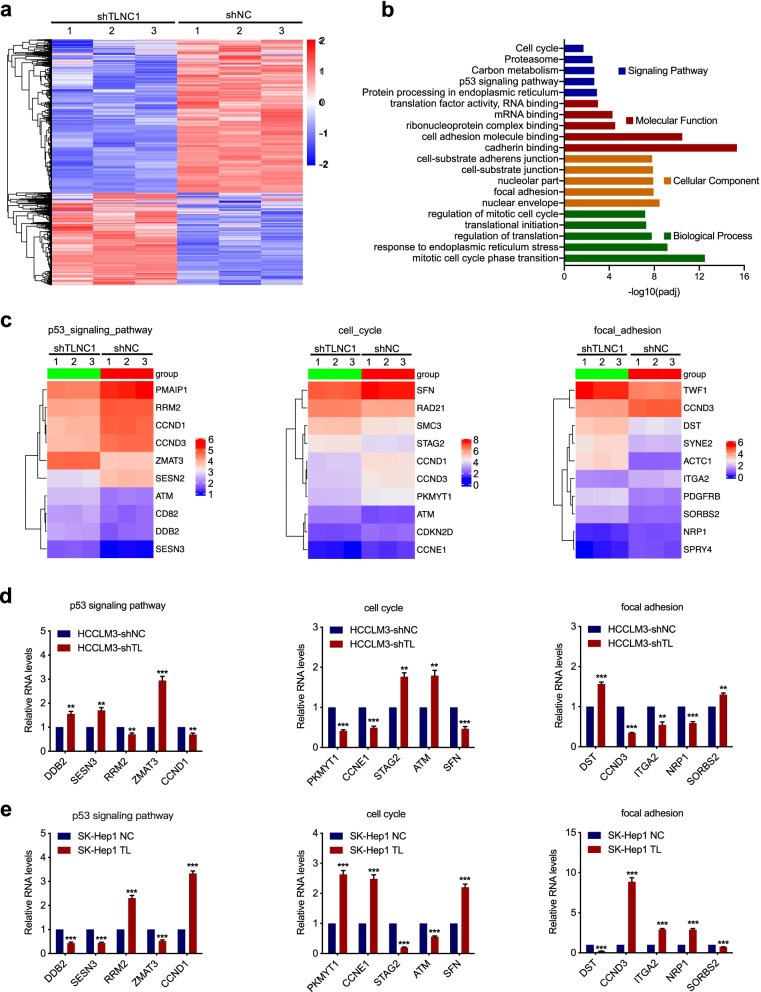
圖4 TLNC1誘導肝癌細胞中參與細胞增殖和轉移的基因的失調
5. TLNC1與TPR相互作用調節p53信號通路
為了進一步了解TLNC1調節的腫瘤生長和轉移的詳細機制,作者隨后使用生物素標記的RNA pull-down和質譜 (MS) 來鑒定與肝癌細胞中TLNC1相互作用的蛋白質。由于作者已經證明TLNC1主要定位于細胞核,作者只提取核蛋白用于RNA pull-down。共有393種蛋白質被鑒定為TLNC1相互作用蛋白。基于RNA-seq和MS數據的交集,作者假設TLNC1可能通過與TPR相互作用來調節p53信號通路。為了驗證這一假設,作者首先驗證了TLNC1和TPR之間的相互作用。
接下來,作者試圖確定TLNC1和TPR之間的相互作用位點。根據RNA二級結構預測軟件RNAfold,作者提出了3個可能與TPR相互作用的潛在部分。基于預測,作者構建了3個截短的TLNC1片段,并表明TLNC1和TPR之間的相互作用需要1-653個核苷酸(圖5a)。之后,作者進行了RNA pull-down和RIP分析,以表明TPR的775-1700個氨基酸是TPR與TLNC1相互作用的原因(圖5b, c)。
為了確定TLNC1是否能夠調節p53信號通路,作者使用含有p21啟動子的載體進行了雙熒光素酶報告基因檢測,p21啟動子是眾所周知的p53轉錄靶標。結果表明TLNC1 過表達顯著下調p53在肝癌細胞中的轉錄活性(圖5d)。一致地,p53靶基因的mRNA水平,如 p21、波形蛋白、MMP2、Bax 和 Maspin,可以被TLNC1調節(圖5e)。為了進一步確定TLNC1通過TPR調節p53信號通路,作者在TLNC1過表達肝癌細胞中用siRNA敲低TPR(圖5f)。如圖5g-i所示,TPR的敲低阻斷了TLNC1過表達介導的p21下調,以及TLNC1的致瘤功能。
這些結果表明TLNC1可以通過與TPR相互作用來調節p53信號通路。
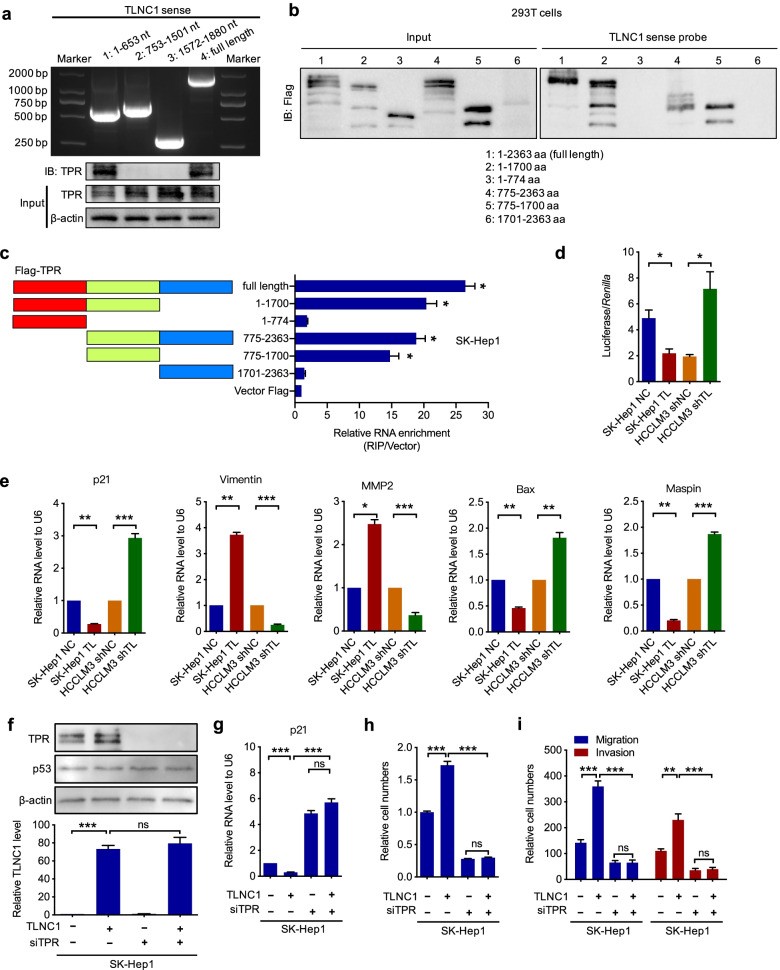
圖5 TLNC1與TPR相互作用并抑制p53的轉錄活性
6. TLNC1通過與TPR相互作用促進p53胞質易位
為了發揮轉錄因子的功能,p53必須從細胞質轉移到細胞核。為了了解TLNC1如何調節p53信號通路的機制,作者檢測了p53在TLNC1過表達或敲低時的亞細胞定位。如圖6a所示,TLNC1過表達極大地刺激了p53的細胞質易位。免疫印跡進一步證實了這一觀察結果,盡管p53的總蛋白水平在TLNC1過表達后保持不變,但細胞核中p53的量顯著降低(圖6b, c)。
根據以往的研究,TPR可以與染色體維持區1 (CRM1) 形成復合物,介導p53的核輸出。為了確定TLNC1是否通過調節TPR-CRM1-p53復合物促進p53的核輸出,作者檢查了TPR、CRM1和p53與co-IP之間的相互作用。如圖6d所示,TPR可以與野生型肝癌細胞中的CRM1和p53相互作用。有趣的是,TLNC1的過表達增強了TPR-CRM1-p53復合物的相互作用,而TLNC1的敲低抑制了TPR-CRM1-p53復合物的相互作用(圖6e)。為了進一步發現TLNC1如何促進復合物的形成,作者首先檢查了蛋白質與純化重組蛋白的相互作用,以排除細胞裂解物中其他蛋白質的干擾。如圖6f所示,TPR顯示直接與CRM1結合,CRM1可以直接與p53結合;然而,TPR不能直接與p53結合。接下來,表面等離子共振分析顯示,在存在 TLNC1 的情況下,TPR和CRM1之間的親和力顯著增加(圖6g)。
這些數據表明TLNC1通過與TPR的相互作用誘導p53的核輸出并上調TPR和CRM1 之間的親和力。
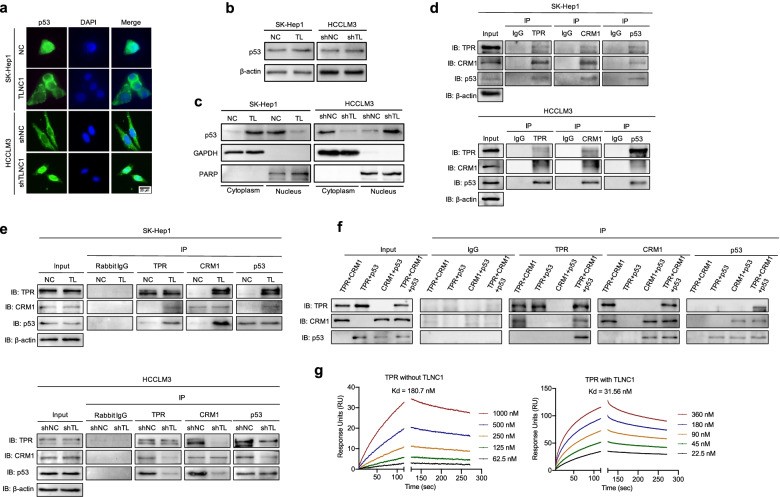
圖6 TLNC1通過與TPR的相互作用抑制p53的核轉位
7. TLNC1的上調預測肝癌患者的不良生存率
為進一步探討TLNC1在肝癌中表達的臨床意義,將72例肝癌患者根據TLNC1的表達水平分為2組:TLNC1高表達組(n=36)和TLNC1低表達組(n=36)。相關分析顯示,TLNC1 表達與肝硬化顯著相關(p= 0.026)。單變量分析顯示,TLNC1高表達組的OS(風險比(HR),2.28;95%置信區間(CI),0.92~5.63)和TLNC1高表達組的DFS(HR,1.06;95%CI,0.59至1.93)比低 TLNC1 表達組差(p<0.05)。同樣,華西醫院(WCH)和TCGA 數據集的生存曲線顯示TLNC1表達與患者預后呈負相關(圖7a-d)。
為了驗證TLNC1可以調節人肝癌中p53信號通路,作者檢測了p21 mRNA的表達水平,發現p21的mRNA水平與TLNC1的表達水平呈負相關(r=- 0.6249,p<0.0001)。這些數據證明TLNC1可以誘導p53的核輸出并抑制p21的轉錄。為了評估TLNC1-p53軸的臨床潛力,作者隨后分析了TLNC1和p21組合的預后潛力。引人注目的是,TLNC1低表達和p21高表達的患者預后最好。相反,TLNC1高表達而p21低表達的患者預后最差(圖7e, f)。總之,這些數據表明TLNC1和p21的組合可用作肝癌患者的預后因素。
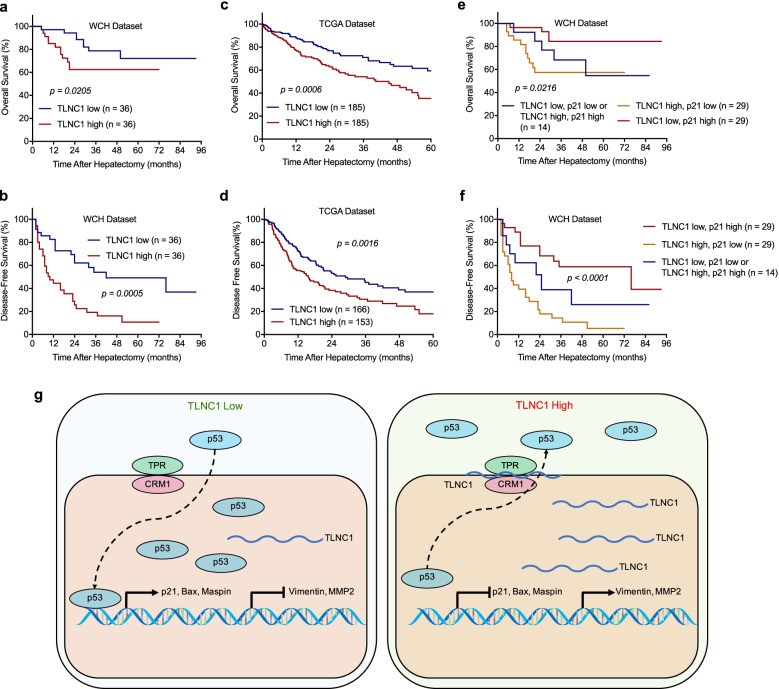
圖7 高水平的TLNC1與低水平的p21與肝癌患者預后不良有關
結論:
該研究表明,TLNC1能夠在體外和體內促進肝癌的腫瘤生長和轉移。機制上,該研究證明TLNC1可以與TPR相互作用以加強TPR和CRM1之間的相互作用,從而促進p53的核輸出,導致一系列腫瘤抑制基因的下調和許多癌基因的上調,最終有助于誘導肝癌的腫瘤生長和轉移。此外,該研究證明TLNC1與肝癌患者的OS和DFS密切相關,TLNC1和p53 靶基因p21的組合可以作為肝癌患者的預后生物標志物。
參考文獻:
Yuan K, Lan J, Xu L, Feng X, Liao H, Xie K, Wu H, Zeng Y. Long noncoding RNA TLNC1 promotes the growth and metastasis of liver cancer via inhibition of p53 signaling. Mol Cancer. 2022;21(1):105. doi: 10.1186/s12943-022-01578-w.






