神經損傷特異性長鏈非編碼RNA通過增加Ccl2表達促進神經性疼痛
背根神經節(DRGs)中神經損傷相關基因的適應性改變是神經性疼痛發生的關鍵。新的證據支持長鏈非編碼RNA(lncRNAs)在調節基因轉錄中的作用。在這里,作者鑒定了一種保守的lncRNA,命名為神經損傷特異性lncRNA(NIS-lncRNA),NIS-lncRNA可能通過促進FUS觸發的DRG Ccl2表達參與神經性疼痛,可能是神經性疼痛管理的一個潛在靶點。該研究于2022年7月發表在《The Journal of Clinical investigaton》,IF:11.864。
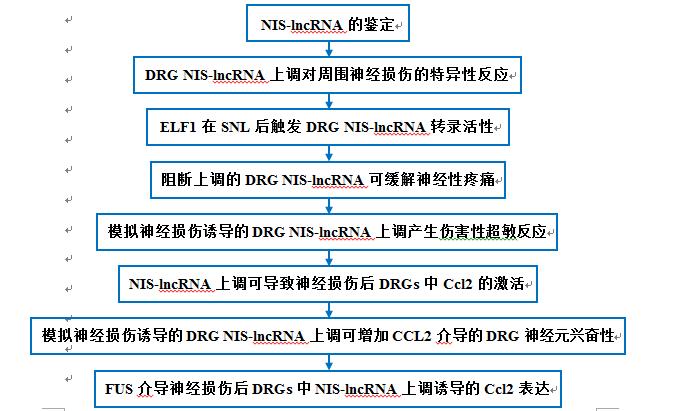
技術路線:
主要研究結果:
1. NIS-lncRNA的鑒定
首先通過RNA測序數據庫的分析確定了NIS-lncRNA。使用鏈特異性引物進行逆轉錄,并在小鼠、大鼠和人類的DRG中鑒定出NIS-lncRNA轉錄物(圖1A)。利用快速擴增cDNA末端對5'端和3'端及逆轉錄酶進行定向測序PCR(RT-PCR)檢測發現,在小鼠體內,NIS-lncRNA有NIS V1和NIS V2共2個變體(圖1B)。使用Northern blot分析,SNL后7天,損傷小鼠DRGs中NIS V1和V2的大小與預期一致(圖1C)。兩種變體的轉錄本也在未發育的小鼠的脊髓、不同的大腦區域和其他身體器官中表達(圖1D)。對DRG提取物的核/細胞質RNA的定量分析表明,兩種變體在細胞核中的富集程度高于在細胞質中的含量(圖1E)。此外,這兩種變體的體外翻譯沒有產生蛋白質(圖1F)。核糖體分析顯示NIS-lncRNA無/極少量核糖體(圖1G)。這些證據表明NIS-lncRNA是一種非編碼RNA。
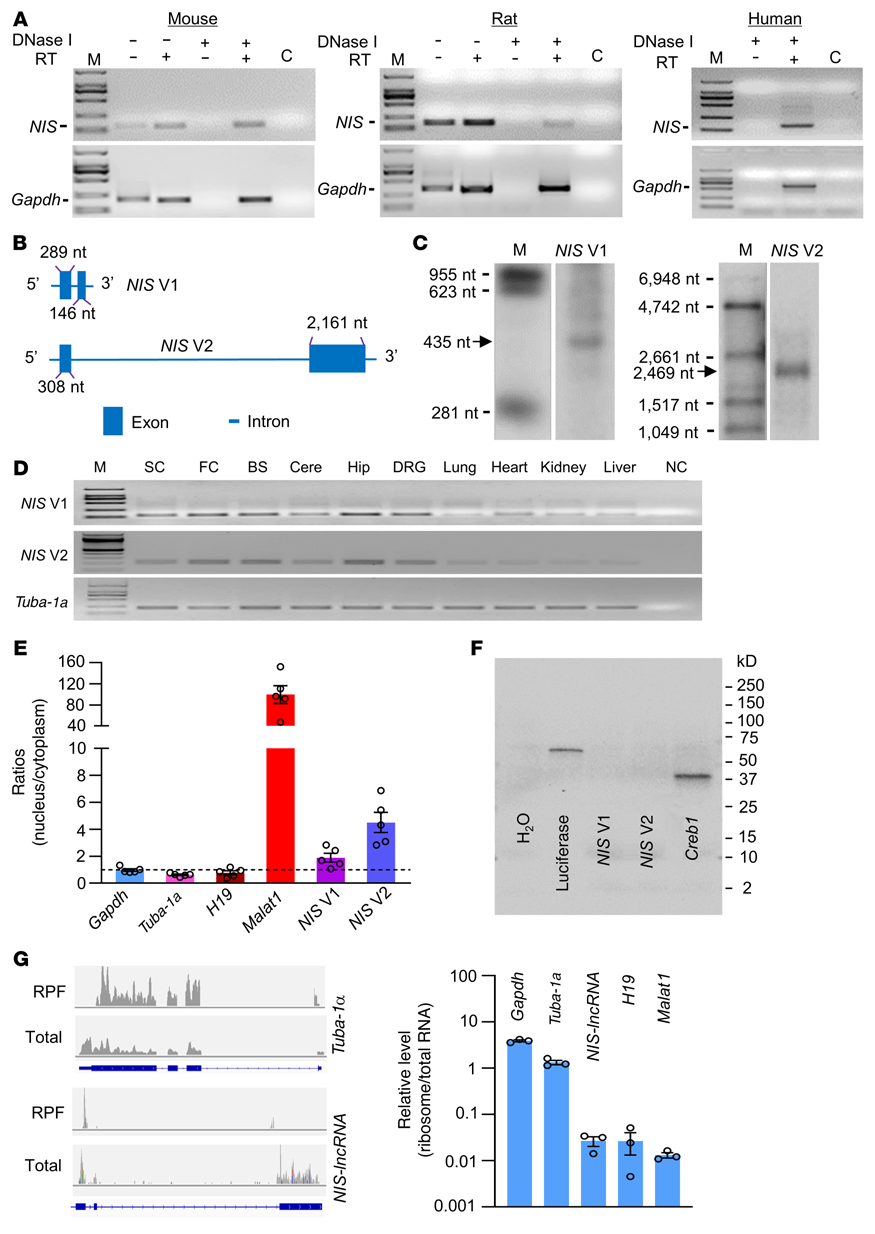
圖1. DRGs中NIS-lncRNA的鑒定
2. DRG NIS-lncRNA上調對周圍神經損傷的特異性反應
接下來,作者進行了定量RT-PCR分析和增加樣本模板策略,來檢測周圍神經損傷后,NIS-lncRNA在2個疼痛相關區域DRGs和脊髓的表達。SNL,而非Sham(假手術),在同側L4 DRG中NIS V1和V2在術后第3天至第28天均有時間依賴性上調(圖2A)。SNL和Sham均未改變這2個變體在對側L4 DRG,同側完整的L3 DRG和同側L4脊髓中的基礎表達(圖2B-D)。在另一種由單側坐骨神經慢性縮窄性損傷(CCI)引起的神經性疼痛動物模型中,結果相似(圖2E和F)。有趣的是,在單側后爪足底注射完全弗氏佐劑引起的慢性炎性疼痛動物模型(圖2G)、單側膝關節關節內注射單碘乙酸鈉引起的慢性炎性疼痛動物模型(圖2H)和單側后爪足底切開引起的術后疼痛動物模型(圖2I)中,觀察期間同側的L3/4 DRGs中NIS V1和V2水平均未發生明顯變化。
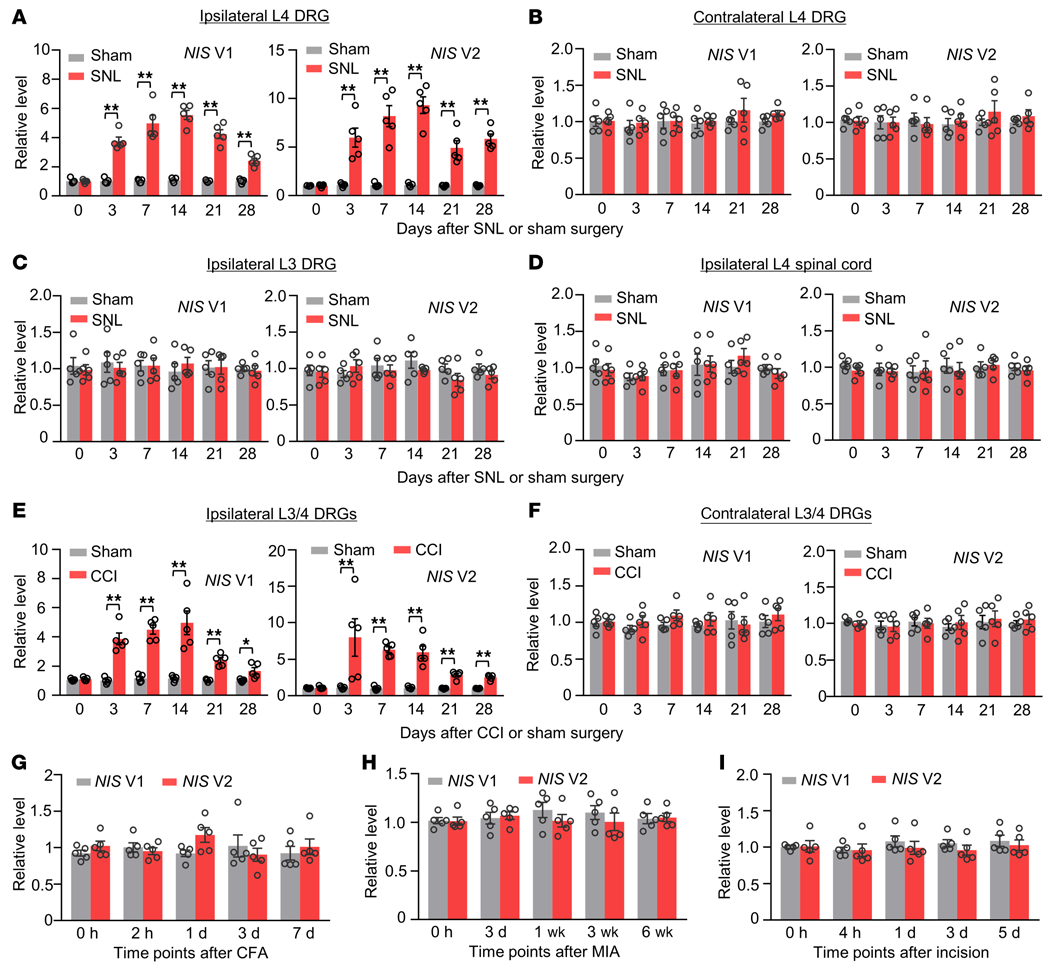
圖2. 雄性小鼠周圍神經損傷后DRGs中NIS V1和V2表達上調
通過RNAscope原位雜交(ISH)和不同細胞標志物的免疫組化分析,觀察NIS-lncRNA在DRG中的細胞分布模式。在SNL后大量檢測到NIS V1或V2標記的信號粒子(圖3A)。在受損DRGs的單個細胞中,兩種變體均與β-微管蛋白III(一種特異性神經元標志物)共表達,但不與谷氨酰胺合成酶(一種衛星膠質細胞標志物)和CD68(一種巨噬細胞和單核細胞標志物)共表達(圖3A和B)。定量分析顯示在SNL后第3、7和14天,同側L4 DRG中NIS V1或V2標記的神經元數量顯著高于對側L4 DRG(圖3C-F)。重要的是,SNL后上述天數,損傷DRGs神經元中NIS V1或V2標記的信號顆粒(≥3)在細胞核中的富集程度高于細胞質(圖3C-F)。神經元胞體的橫截面積分析表明,這些變化主要發生在SNL小鼠的中型和大型DRG神經元中(圖3G和H)。綜上所述,這些證據表明神經損傷誘導DRG神經元中的NIS-lncRNA表達上調可能在神經性疼痛中起功能性作用。

圖3. SNL后雄性小鼠DRGs中NIS V1或V2標記神經元數量顯著增加
3. ELF1在SNL后觸發DRG NIS-lncRNA轉錄活性
接下來,作者研究DRG NIS-lncRNA在神經損傷后是如何上調的。利用數據庫JASPAR確定了NIS-lncRNA啟動子區域中E74樣ETS轉錄因子1(ELF1)的共有結合基序(–227TGGGGAGGAAGTT–215)。在偽核片段中,可以從ELF1抗體免疫沉淀復合物中擴增出含有該結合基序的NIS-lncRNA啟動子片段(圖4A)。SNL后同側L4 DRG的結合活性增加2.4倍(圖4A),ELF1 mRNA和ELF1蛋白水平升高(圖4B和C),表明SNL增加了ELF1與NIS-lncRNA啟動子的結合。
在體外培養的DRG神經元中,進一步觀察到過表達ELF1誘導NIS-lncRNA增加(圖4D和E)。熒光素酶測定顯示,共轉染全長Elf1載體顯著增加了體外CAD細胞中NIS-lncRNA啟動子的活性(圖4F)。在手術前3天通過DRG微注射Elf1 siRNA來阻斷SNL誘導的DRG ELF1增加,同時減弱了SNL誘導的同側L4 DRG中NIS V1和V2水平的增加(圖4G和H)。此外,在siRNA微注射前35天,在亂序siRNA微注射的小鼠中,DRG微注射AAV5-Elf1而不是AAV5-Gfp,在siRNA微注射后第7天增加了注射的L3/4 DRGs中NIS V1和V2的量,在siRNA微注射后第5天和第7天,雄性小鼠對同側機械、熱和冷刺激的反應增強(圖4I和J)。研究結果表明神經損傷誘導的NIS-lncRNA上調至少部分歸因于ELF1在受傷的DRGs中的高表達。
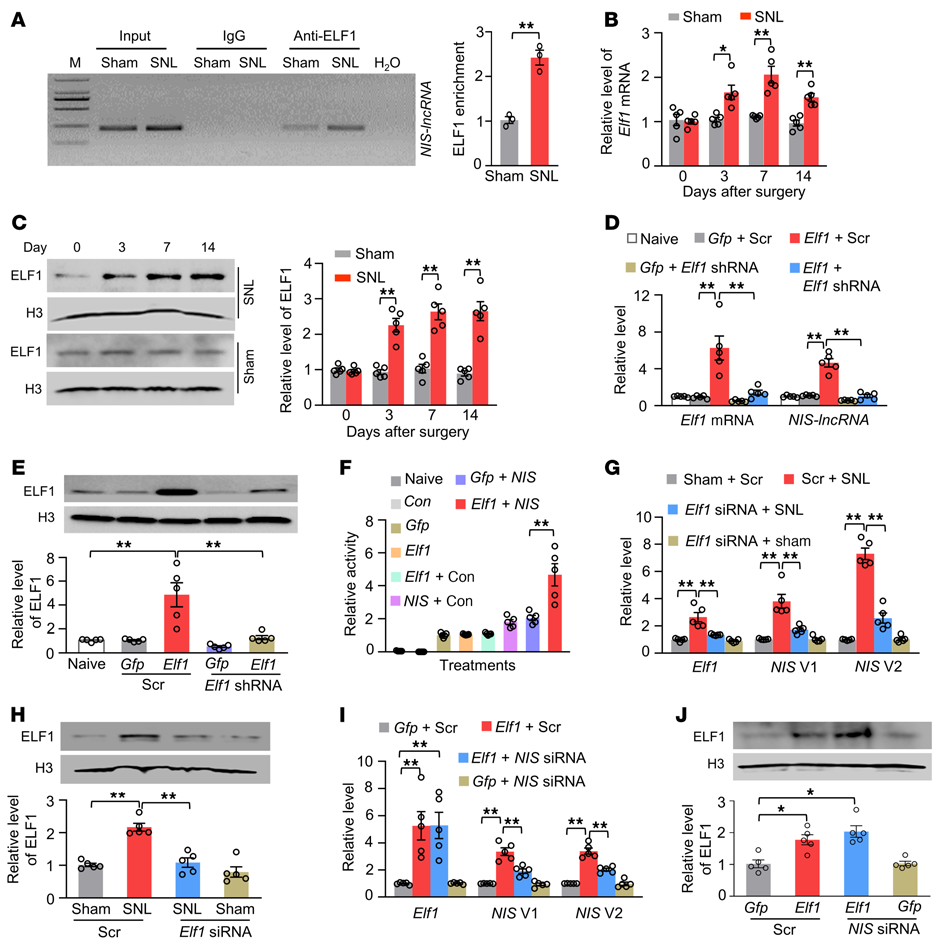
圖4. ELF1在SNL后觸發受損DRG中的NIS-lncRNA上調
4. 阻斷上調的DRG NIS-lncRNA可緩解神經性疼痛
在雄性小鼠的CCI或Sham前4天,將在體外培養的DRG神經元中顯著敲低NIS-lncRNA及其2個變體的NIS-lncRNA siRNA微注射到單側L3/4 DRGs 中。這種微注射不僅阻斷了CCI誘導的同側L3/4 DRGs在CCI后第5天NIS V1和V2水平的升高(圖5A)。也改善了CCI后第3天和第5天CCI引起的同側機械、熱和冷傷害性超敏反應(圖5B-D)。
作者生成了NIS-lncRNAfl/fl小鼠,并發現手術前35天將AAV5-Cre而不是AAV5-Gfp微注射到同側L3/4 DRGs的雄性小鼠,在CCI后14天阻斷了CCI誘導的同側L3/4 DRGs中NIS V1和V2水平的增加(圖5E)。同時也減輕了CCI后第3天至第14天CCI引起的同側機械、熱和冷傷害性超敏反應的發展(圖5F-I)。在CCI后第7天,在AAV5-Cre微注射的NIS-lncRNAfl/fl小鼠中,同側的機械、熱和冷傷害性超敏反應完全發生(圖5J-M)。從CCI后的第14天到第28天,這些傷害性超敏反應顯著減弱(圖5J-M)。此外,在CCI后28天,與刺激無關的自發持續疼痛在AAV5-Cre微注射的NIS-lncRNAfl/fl小鼠中也顯著減少(圖5N)。
綜上所述,作者的研究結果強烈表明,在受損DRGs中上調NIS-lncRNA對神經性疼痛的發生和維持是必需的。
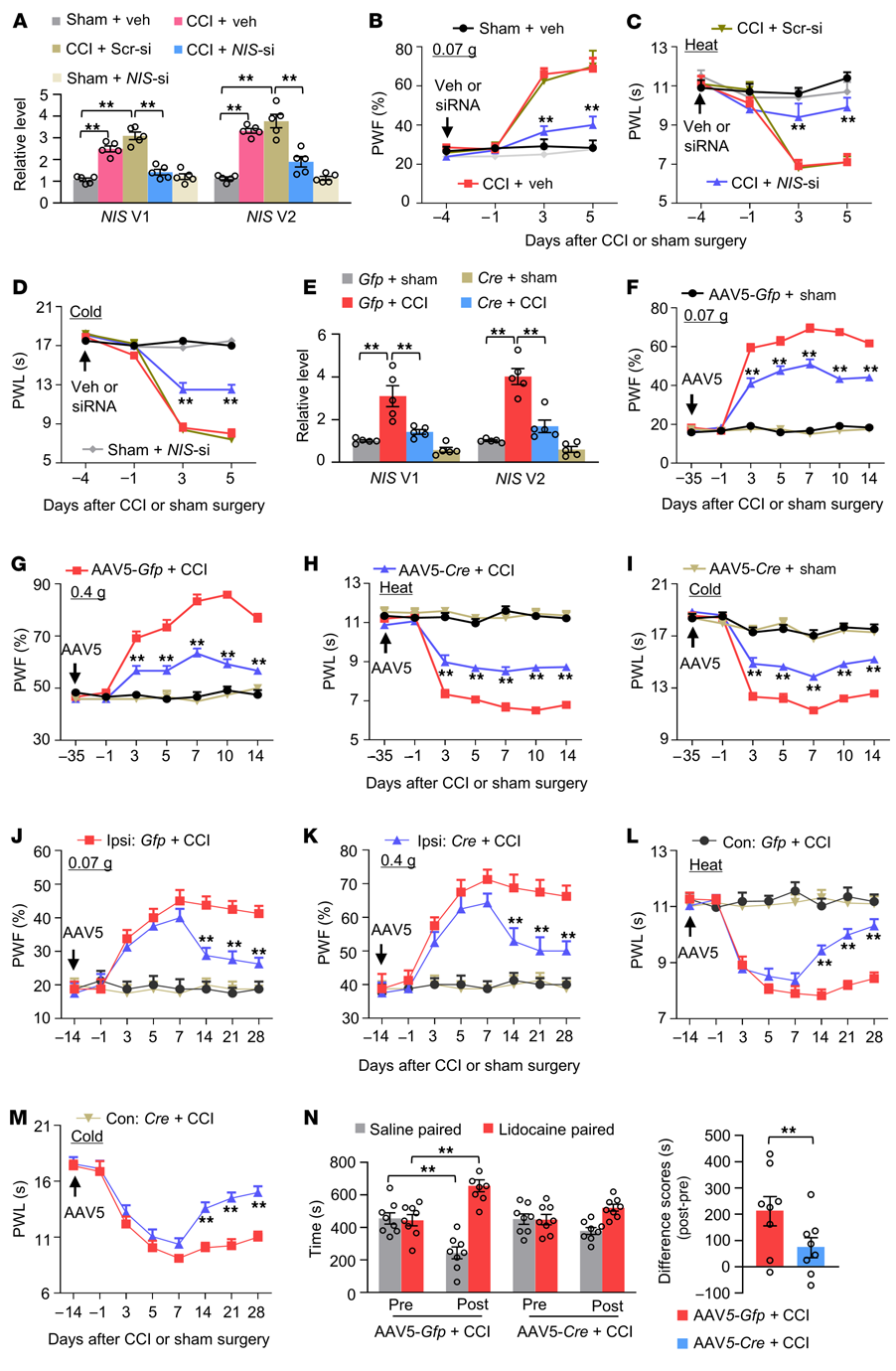
圖5. 阻斷DRG NIS-lncRNA上調可減輕雄性小鼠神經性疼痛的發生和維持
5. 模擬神經損傷誘導的DRG NIS-lncRNA上調產生傷害性超敏反應
將表達全長NIS V1(AAV5-V1)或V2(AAV5-V2)的AAV5微注射到天然雄性小鼠的單側L3/4 DRGs中,AAV5-Gfp用作對照。在病毒微注射8周后,注射的DRGs中NIS V1和V2的水平顯著增加(圖6A)。AAV5-V1或AAV5-V2的DRG微注射導致響應機械刺激的縮爪頻率增加和響應注射側的熱或冷刺激的縮爪潛伏期降低(圖6B-E)。這些行為變化發生在微注射后2到4周之間,并持續至少8周(圖6B-E)。DRG微注射AAV5-V1或AAV5-V2均可在微注射8周后產生獨立的自發持續疼痛(圖6F和G)。微注射后8周,在同側L3/4背角也檢測到了p-ERK1/2和GFAP水平的顯著增加,表明神經元和星形膠質細胞過度活躍(圖6H)。這些發現表明,在沒有神經損傷的情況下,DRG NIS-lncRNA上調可能會產生神經性疼痛樣癥狀。
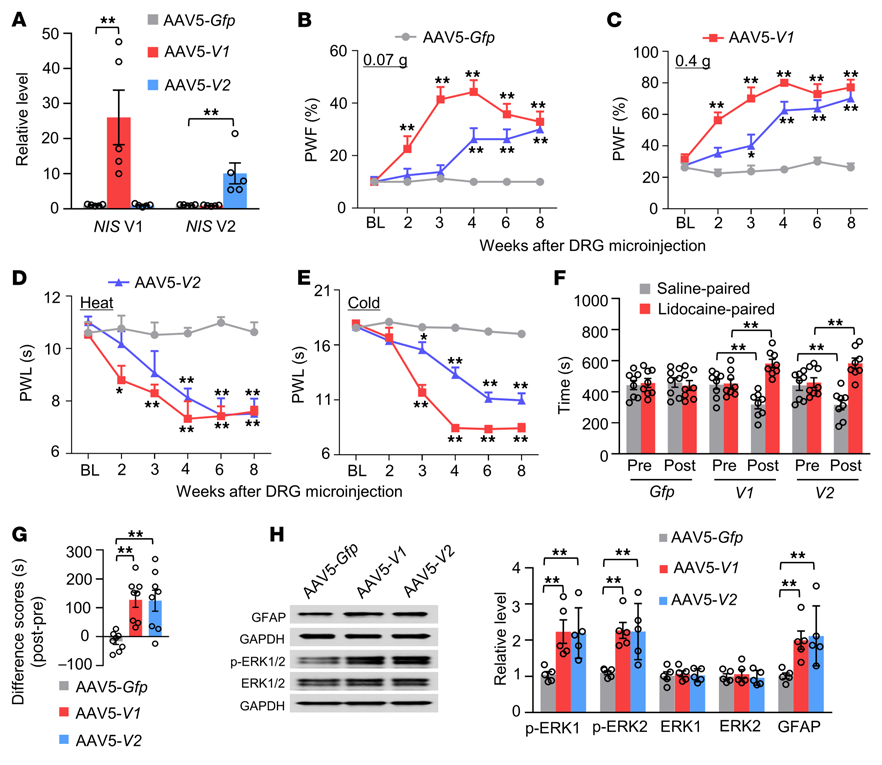
圖6. DRG過表達NIS-lncRNA在未發病雄性小鼠中產生神經性疼痛樣癥狀
6. NIS-lncRNA上調可導致神經損傷后DRGs中Ccl2的激活
為闡明DRG NIS-lncRNA上調參與神經性疼痛的機制,進行了高通量RNA測序,以確定雄性小鼠受傷DRGs中NIS-lncRNA調節的下游靶點。趨化因子Ccl2 mRNA是重疊基因中最引人注目的一個基因,是神經性疼痛的關鍵因素。分別將AAV5-V1和AAV5-V2轉導到培養的DRG神經元中,NIS V1和V2的過表達顯著增加了Ccl2 mRNA的表達水平(圖7A)。SNL在SNL后3至14天增加了雄性小鼠同側L4 DRG中Ccl2 mRNA和CCL2蛋白的量(圖7B和C)。DRG微注射AAV5-Cre而不是AAV5-Gfp時,SNL或CCI誘導的Ccl2 mRNA和CCL2蛋白的增加在雄性或雌性NIS-lncRNAfl/fl小鼠的同側L4 DRG中被顯著阻斷(圖7D和E)。相反,通過將AAV5-V1微注射到用對照干擾siRNA處理的雄性小鼠單側L3/4 DRG中,DRG過表達NIS V1不僅使同側(非對側)對機械、熱和冷刺激產生了更強的爪子退縮反應(圖8A-D)。但也升高了同側L3/4 DRG中Ccl2 mRNA和CCL2蛋白的水平(圖7F和G)。在AAV5-V1微注射后第35天,在DRG微注射Ccl2 siRNA或腹膜內微注射CCR2拮抗劑CCR2-RA-[R]可阻斷這些增強的行為反應(圖7F和G,圖8A-H)。通過DRG微注射AAV5-Elf1過表達ELF1也增加了用對照亂序siRNA處理的雄性小鼠注射的DRG中Ccl2 mRNA和CCL2蛋白的量(圖7H和I)。在AAV5-Elf1微注射35天后,通過DRG微注射NIS-lncRNA siRNA,這些增加顯著減弱(圖7H和I)。總之,這些證據表明上調的NIS-lncRNA可能參與神經損傷誘導的受損DRG中Ccl2基因的轉錄激活。

圖7. 上調的NIS lncRNA是SNL誘導的雄性小鼠受損DRG中CCL2增加所必需的

圖8. 通過藥理抑制或基因敲除DRG CCL2可減輕雄性小鼠DRG NIS V1過表達引起的傷害性超敏反應
7. 模擬神經損傷誘導的DRG NIS-lncRNA上調可增加CCL2介導的DRG神經元興奮性
在單獨微注射AAV5-Gfp(Gfp)或AAV5-NIS-lncRNA V1和AAV5-Gfp(NIS)的混合病毒溶液后4-5周,在同側L3/4 DRG的急性分離神經元中進行全細胞電流鉗記錄。Gfp(NIS)進入野生型(WT)或Ccl2-敲除(KO)雄性小鼠的單側L3/4 DRGs(圖9A和B)。NIS微注射的WT小鼠對機械、熱和冷刺激的反應增強在NIS微注射的Ccl2-KO小鼠中受損(圖8I-L)。與Gfp微注射的WT小鼠相比,NIS微注射的WT小鼠的小型、中型和大型DRG神經元靜息膜電位去極化率分別為5.1、4.5和3.6 mV(圖9C),而rheobase電位分別降低了49%、43%和36%(圖9D)。此外,與注射Gfp的WT小鼠相比,注射NIS的WT小鼠的小型、中型和大型DRG神經元也表現出由注射電流誘發的動作電位數量增加(圖9E-H)。在來自NIS微注射的WT小鼠的小型和中型但不是大型的DRG神經元中觀察到自發活動的頻率顯著增加(圖9I和J)。綜上所述,這些發現表明CCL2可能介導NIS-lncRNA上調誘導的DRG神經元興奮性增加。
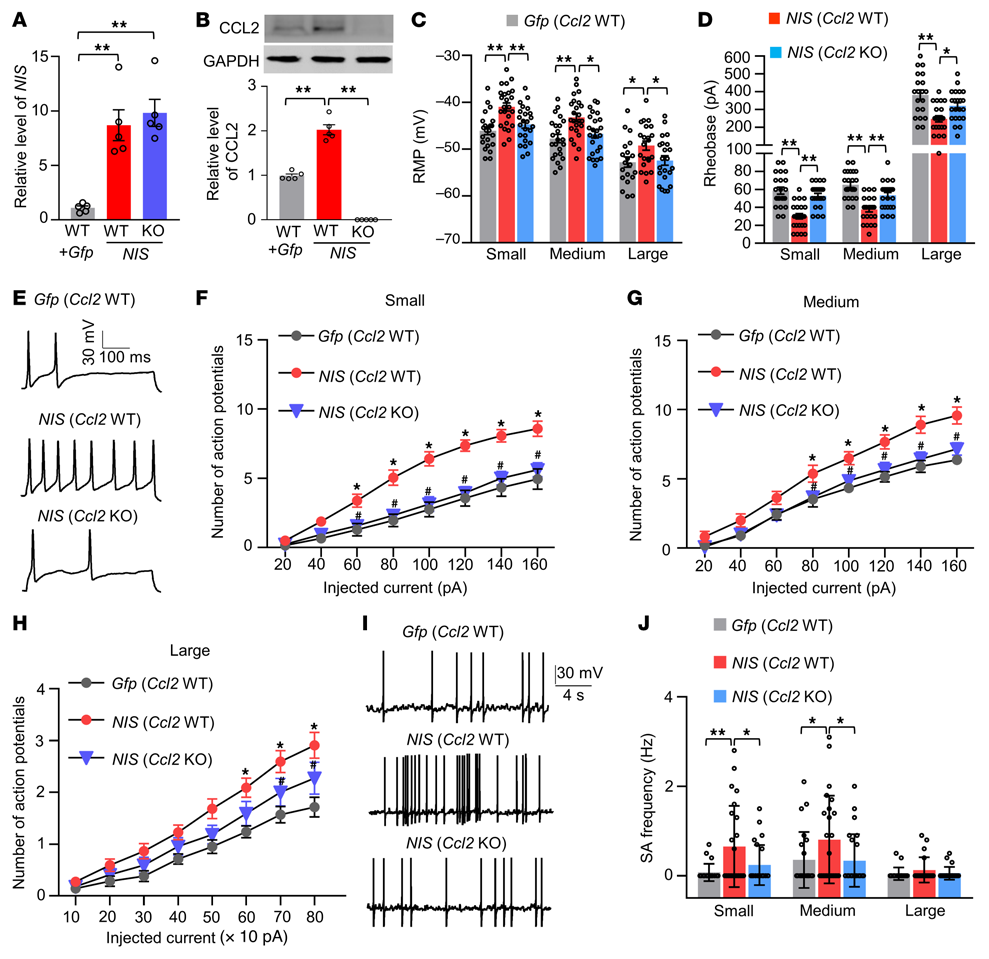
圖9. DRG過表達NIS-lncRNA增加CCL2介導的DRG神經元興奮性
8. FUS介導神經損傷后DRGs中NIS-lncRNA上調誘導的Ccl2表達
在體外培養的DRG神經元中,特定的NIS V1和V2感測RNA探針可以分別拉低FUS,而相應的陰性對照反義RNA探針則不能(圖10A)。NIS V1和V2片段均在雄性小鼠的體內假DRGs中被抗FUS抗體(但不是正常純化的IgG)免疫沉淀(圖10B)。與Sham組相比,SNL后第7天損傷DRGs中這兩種免疫沉淀活性分別顯著增加3.2倍和3倍(圖10B)。研究結果表明,在周圍神經損傷后,NIS-lncRNA與受損DRG中FUS結合的能力增加。
此外,通過DRG Fus siRNA微注射防止CCI誘導的FUS水平升高,在CCI后第5天阻斷了受損DRGs中CCL2量的增加(圖10C)。通過DRG微注射AAV5-Fus(而不是AAV5-Gfp),過表達FUS顯著提高了NIS-lncRNAfl/fl雄性小鼠微注射DRG中Ccl2 mRNA和CCL2蛋白的水平(圖10D和E)。與Sham組相比,在 SNL后第7天,來自AAV5-Gfp微注射的NIS-lncRNAfl/fl小鼠的損傷DRGs的R7和R8中的結合活性分別增加了5.4倍和3倍(圖10F和G)。熒光素酶測定表明,在體外共轉染全長Fus載體加對照亂序siRNA的CAD細胞中,Ccl2基因啟動子被顯著激活,但在全長Fus載體加NIS-lncRNA siRNA共轉染時沒有被激活(圖10H)。總之,作者的數據表明FUS介導NIS-lncRNA促進外周神經損傷后受損DRGs中Ccl2表達的增加。

圖10. NIS-lncRNA是FUS觸發的受傷DRGs中CCL2表達所必需的
結論:
綜上所述,作者證明了NIS-lncRNA觸發的機制,通過該機制,Ccl2在神經性疼痛條件下選擇性地在受損的DRGs中被轉錄激活。考慮到NIS-lncRNA僅在受損的DRG神經元對外周神經損傷的特異性反應中上調,而阻止這種上調可阻斷神經性疼痛的發展并逆轉其維持,而不影響基礎/急性疼痛和運動功能。因此,NIS-lncRNA可能是緩解神經性疼痛的潛在治療靶點。






