circCRKL是一種來源于CRKL的環狀RNA,通過海綿化miR-877-5p調控BCR-ABL,促進慢性髓系白血病細胞增殖
BCR-ABL融合蛋白是導致慢性粒細胞白血病(CML)發生的關鍵因素。伊馬替尼(IM)是一種靶向BCR-ABL抑制劑,可達到完全緩解。然而,緩解失敗是由于繼發性BCR-ABL突變引起的獲得性耐藥,這強調了對新型BCR-ABL靶向策略的需求。近年來研究發現,來源于腫瘤相關基因的環狀RNA (circRNA)可能是相關腫瘤的治療靶點,但在CML中,這類circRNA的作用尚不清楚。目前有研究揭示了circCRKL在BCR-ABL+細胞中特異表達并通過誘變miR-877-5p調控BCR-ABL表達水平,這表明靶向circCRKL聯合IM治療可作為一種潛在的CML患者治療策略。該研究發表在《Journal of Translational Medicine》,IF: 8.44。
技術路線:

主要研究結果:
1. circCRKL在CML細胞系和臨床樣本中的特征
為揭示circCRKL在CML中的潛在作用,采用RT-qPCR檢測6例CML患者和3例正常供體BMMCs中circCRKL的表達。相對于正常供體,circCRKL在CML患者中大量表達(圖1 A)。BCR-ABL+細胞系(K562、K562/G01、KCL22和SupB15)與BCRABL -細胞系(TK6和THP-1)進行比較時,circCRKL在BCR-ABL+細胞系中的表達顯著增高(圖1B)。這些結果提示circCRKL與BCR-ABL之間可能存在聯系。生信信息學分析,發現circCRKL是一個466 nt的circRNA,由pre-CRKL的2外顯子反向剪接,采用Sanger測序確定環化位點(圖1C)。RT-qPCR和RNA分離檢測結果發現,CML細胞中circCRKL在細胞質中的表達水平高于細胞核中的表達水平(圖1D, E),熒光原位雜交(FISH)進一步證實了這一結果(圖1F)。RNase R分析顯示線性CRKL的表達顯著減少,而circCRKL沒有變化,表明circCRKL在CML細胞中是穩定的(圖1G, H)。放線菌素D處理,確定了circCRKL和線性CRKL的半衰期,發現circCRKL的半衰期比線性CRKL的半衰期更長(圖1I, J)。circCRKL是一種穩定的circRNA,定位于CML細胞的細胞質并呈高表達,提示circCRKL在CML中具有潛在作用。

圖1在BCR-ABL+細胞系和CML樣品中識別和表征circCRKL
2. circCRKL促進體外BCR-ABL+細胞增殖
通過功能缺失試驗探討circCRKL在CML中的生物學作用。構建circCRKL敲低CML細胞,CML細胞中的circCRKL表達明顯受到抑制,而線性CRKL表達不受影響(圖2A, B)。CCK-8和集落形成實驗發現,抑制circCRKL顯著降低了CML細胞生長(圖2C?F)。流式細胞術檢測顯示,circCRKL沉默減少了S期細胞的數量(圖2G, H)。綜上所述,在BCR-ABL+細胞中,circCRKL是特異性需要的,抑制circCRKL可抑制增殖。
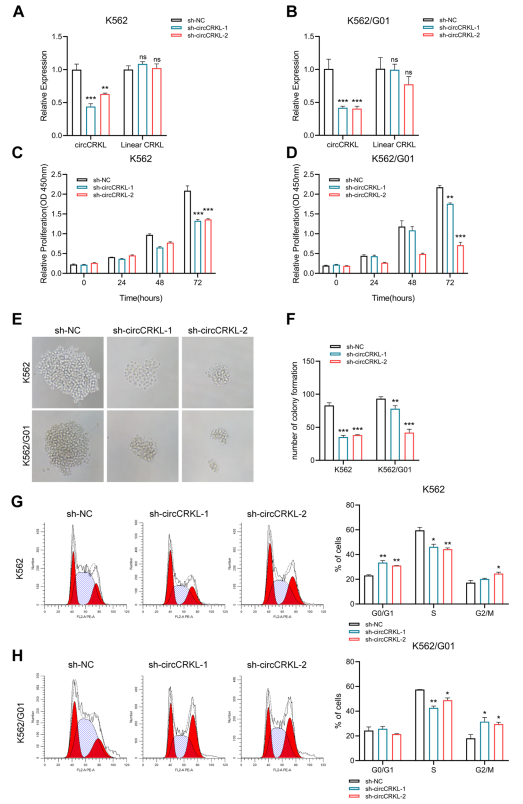
圖2 circCRKL體外促進CML細胞增殖
3. circCRKL沉默可在體內損傷CML細胞的腫瘤發生
將Sh-NC或sh-circCRKL慢病毒感染的K562/G01細胞分別靜脈注射到免疫缺陷NOD/SCID小鼠體內,建立了CML小鼠模型。與預期的一樣,對照組小鼠的白細胞計數比敲低組小鼠增加更多,但沒有明顯的差異(p=0.0586)(圖3)。此外,與sh-NC組小鼠相比,敲低circCRKL減輕了脾腫大,但肝臟重量沒有明顯缺陷(圖3B, C)。為評估白血病細胞的浸潤,在小鼠骨髓、肝臟和脾臟中進行瑞氏染色。結果顯示,sh-NC組異種移植模型中有更嚴重的浸潤(圖3D),蘇木精/伊紅(HE)染色也證實了這一點(圖3E)。免疫熒光顯示circCRKL沉默小鼠中BCR-ABL的水平要低得多(圖3F)。綜上所述,circCRKL在體內可以促進CML的惡性進展。
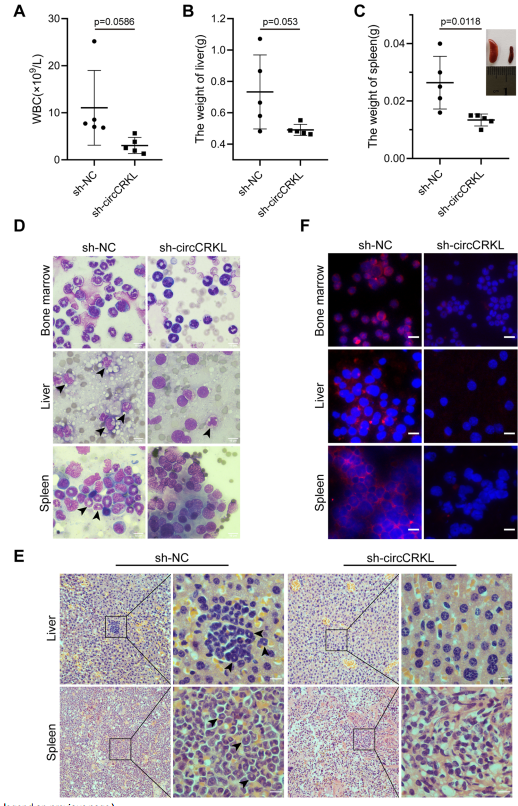
圖3 circCRKL在體內促進CML細胞增殖
4. circCRKL調控BCR-ABL的表達,miR-877- 5p是circCRKL和BCR-ABL的靶點
western blot顯示抑制circCRKL的細胞中BCR-ABL和c-ABL蛋白水平降低(圖4A)。免疫熒光法的結果與上述結果一致(圖4B)。RT-qPCR表明,敲低circCRKL降低了BCR-ABL mRNA的表達(圖4C),表明circCRKL可能在mRNA水平調控BCR-ABL。然而,circCRKL控制BCR-ABL的機制尚不清楚。
circCRKL主要存在于CML細胞的細胞質中,這是circCRKL發揮miRNA海綿功能的關鍵前提。因此,從三個數據庫(circInteractome、circBank和ENCORI)中篩選了circCRKL的下游miRNA(圖4D)。ENCORI,TargetScan和miRwalk數據庫預測與ABL結合的miRNAs。然后將circCRKL和ABL的miRNAs進行重疊(圖4E)。在候選miRNA中,miR-877-5p是一種獨特的包含circCRKL和ABL-3'UTR結合位點的miRNA(圖4F),這是通過雙熒光素酶報告基因檢測證實的。當miR-877-5p異位表達時,野生型circCRKL報告基因的熒光素酶活性顯著降低,但突變型報告基因的活性未受影響,這表明circCRKL可能與miR-877-5p在特定位點發生相互作用(圖4G),miR-877-5p和ABL之間也觀察到類似的結果(圖4H)。RNA pull-down實驗進一步驗證circCRKL與miR-877-5p的結合。RT-qPCR顯示miR-877-5p在K562/G01細胞中被circCRKL探針特異性富集(圖4I)。此外,先前的研究已經注意到AGO2對于circRNA充當miRNA海綿的重要性。在此,進行了anti-AGO2 RNA免疫沉淀,發現circCRKL和miR-877-5p都可以相互作用,這意味著circCRKL可能充當miR-877-5p的海綿(圖4J)。
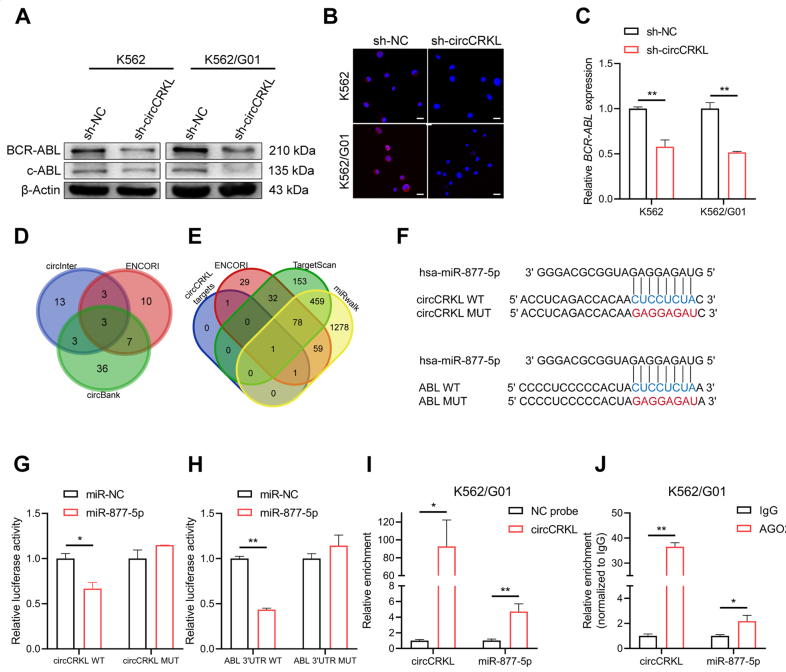
圖4 circCRKL沉默CML細胞中BCR-ABL水平下調
5. miR-877-5p通過調節抑制CML細胞增殖BCR-ABL
為了明確miR-877-5p在CML中的生物學相關性以及BCR-ABL是否受miR-877-5p的調控,測定了CML患者BMMCs中miR-877-5p的表達水平(圖5A),然后分別使用抑制劑或模擬物敲低或過表達miR-877-5p。通過RT-qPCR檢測抑制劑或模擬物對CML細胞中miR-877-5p的影響(圖5B, C)。抑制miR-877-5p后,BCR-ABL mRNA表達顯著上調,而過表達miR-877-5p后,BCR-ABL mRNA表達顯著降低(圖5D)。同樣,western blot顯示抑制miR-877-5p可增強BCR-ABL蛋白水平,而過表達miR-877-5p則表現出相反的作用(圖5E)。CCK-8(圖5F, G)和集落形成實驗(圖5H, I)顯示,抑制miR-877-5p刺激CML細胞增殖,而miR-877-5p過表達則相反。綜上所述,這些發現揭示了miR-877-5p是BCR-ABL的負調控因子。

圖5 miR-877-5p調控BCR-ABL表達
6. circCRKL通過海綿狀miR-877-5p調控BCR - ABL促進CML細胞增殖
共轉染shcircCRKL和miR-877-5p抑制劑進行挽救實驗:CCK-8和集落形成實驗顯示,敲低miR-877-5p明顯恢復了在CML細胞中抑制circCRKL引起的生長抑制(圖6A-D),改善了circCRKL抑制導致的BCR-ABL水平降低(圖6E)。共轉染sh-circCRKL和miR-mimic的CML細胞中BCR-ABL蛋白水平低于sh-circCRKL+mimic-NC細胞(圖6F)。綜上所述,這些結果證明了circCRKL通過調控miR-877-5p介導的BCR-ABL促進CML細胞增殖。

圖6 circCRKL吸收miR-877-5p增強BCR-ABL,加速CML細胞增殖
7. 當circCRKL被敲除時,K562/G01細胞對伊馬替尼更敏感
考慮到伊馬替尼耐藥細胞株K562/G01的circCRKL表達水平高于K562細胞,推測circCRKL與伊馬替尼耐藥性之間可能存在聯系。CCK-8法測定K562或K562/G01細胞對伊馬替尼的半最大抑制濃度值(IC-50)(圖S2A)。隨后,檢測穩定敲低circCRKL和circCRKL野生型K562/G01細胞經伊馬替尼處理48 h后的細胞活力并計算IC-50值。數據表明,circCRKL沉默顯著降低了細胞活力,并且IC-50值同時降低(圖S2B)。流式細胞儀顯示,敲低circCRKL可促進伊馬替尼處理的K562/G01細胞的凋亡(圖S2C)。抑制或過表達miR-877-5p對K562/G01細胞IC-50值沒有明顯影響(圖S2D)。之前的研究已經將Wnt通路與伊馬替尼耐藥聯系在一起,相應的,相關標志物包括CTNNB1和c-Myc也通過western blot檢測。數據表明,在circCRKL敲低的K562/G01細胞中,CTNNB1和c-Myc均有明顯缺失(圖S2E)。綜上所示,circCRKL可能通過介導Wnt/β-catenin信號通路調控K562/G01細胞對伊馬替尼的敏感性。
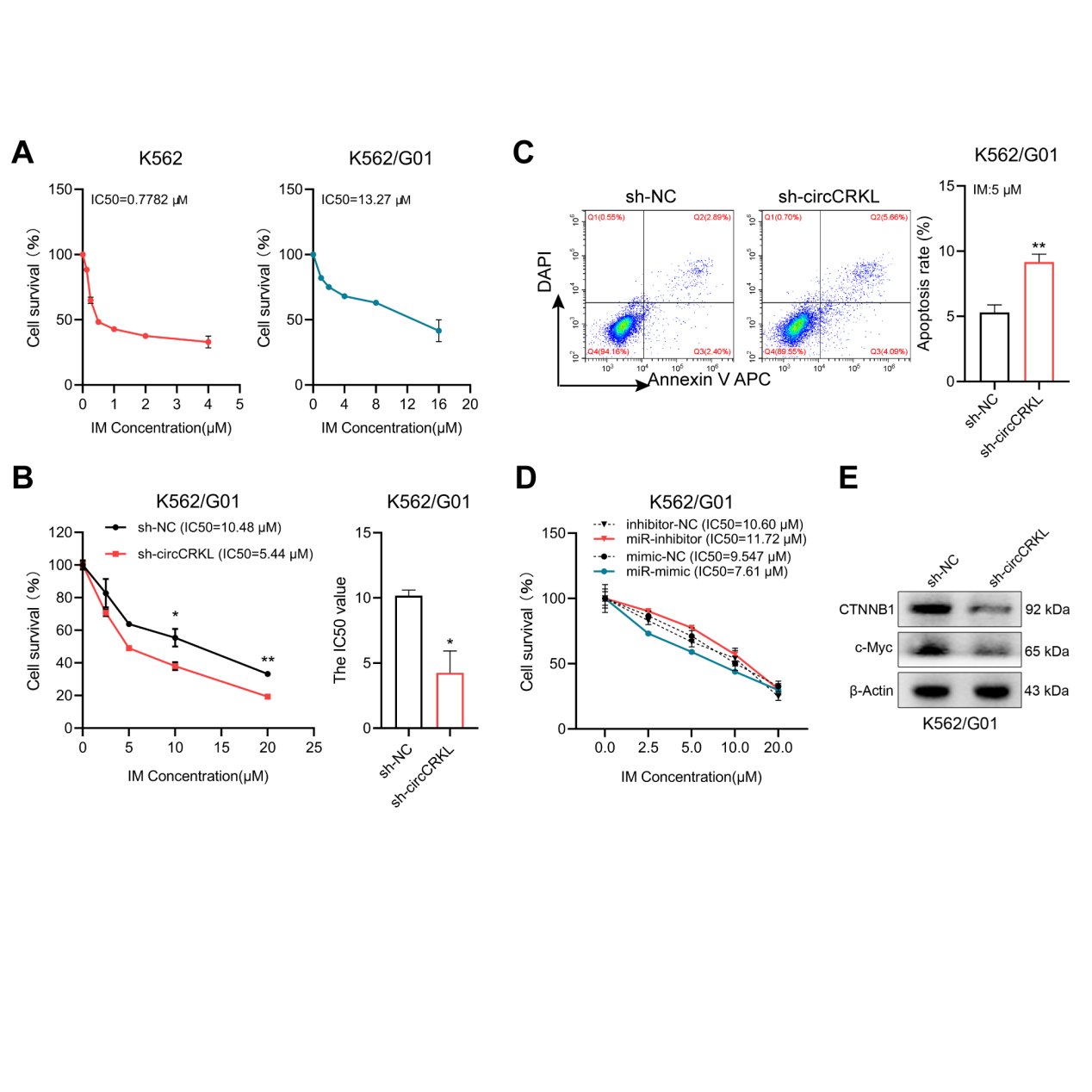
圖S2 circCRKL敲低可改善伊馬替尼耐藥細胞株K562/G01的敏感性
結論:
該研究揭示了由CML相關基因CRKL生成的circCRKL通過吸附miR-877-5p來維持BCR-ABL的表達水平,從而促進CML細胞增殖(圖6G),揭示了circCRKL在伊馬替尼耐藥細胞中發揮關鍵作用(圖S2),這為緩解CML患者的耐藥提供了一個新的視角。然而,circCRKL參與伊馬替尼耐藥的分子基礎仍需進一步研究。總之,circCRKL可以引領CML治療靶點的進展。






