鼠乳桿菌減輕腸道缺血/再灌注損傷
腸道缺血/再灌注(I/R)損傷具有較高的發(fā)病率和死亡率。腸道微生物群是影響腸道I/R損傷的潛在關(guān)鍵因素。不同人群對腸道I/R損傷表現(xiàn)出不同的敏感性。然而,這種種群間的差異是否與腸道微生物群的變異有關(guān)尚不清楚。在本文中,腸I/R敏感(Sen)和腸I/R耐受(Res)小鼠首先根據(jù)腸I/R小鼠的不同生存結(jié)局進(jìn)行定義。結(jié)果表明,腸缺血前Sen和Res小鼠糞便微生物群落組成和多樣性存在差異。鼠乳桿菌(Lactobacillus murinus, L. murinus)在物種水平上的相對豐度在Res組顯著高于Sen組。臨床上,體外循環(huán)手術(shù)患者術(shù)前糞便中鼠乳桿菌的豐度與術(shù)后腸道I/R損傷程度密切相關(guān)。L. murinus治療顯著預(yù)防了腸道I/R誘導(dǎo)的腸道損傷,提高了小鼠的生存,這依賴于巨噬細(xì)胞的參與。此外,體外實驗表明,通過TLR2促進(jìn)巨噬細(xì)胞釋放IL-10可能是鼠乳桿菌減輕腸道I/R損傷的潛在機(jī)制。本研究揭示了腸道I/R損傷的新機(jī)制,為臨床實踐提供了新的治療策略。本文于2022年3月發(fā)表于“Microbiome”(IF=14.652)雜志上。
技術(shù)路線

結(jié)果:
1)Sen和Res小鼠腸道組織損傷及腸道菌群特征
觀察小鼠腸I/R損傷后的存活率,發(fā)現(xiàn)小鼠對腸I/R損傷的易感性有明顯差異。再灌注后1小時內(nèi)死亡的小鼠被定義為“Sen小鼠”,而存活5天的小鼠被定義為“Res小鼠”(圖1a)。與Res小鼠相比,Sen小鼠回腸、肝、肺、腎組織病理損傷和組織學(xué)評分明顯加重,Il-1β、Il-6、Tnf-α mRNA表達(dá)上調(diào)。(圖1b、c)。此外,與Sen小鼠相比,Res小鼠回腸腸道緊密連接標(biāo)記物mRNA水平顯著升高,血漿內(nèi)毒素水平降低(圖1d, e)。16S DNA測序結(jié)果顯示,Sen和Res小鼠糞便樣本中的細(xì)菌組成在細(xì)菌門和細(xì)菌綱上均有顯著差異(圖1f)。Alpha多樣性分析和主坐標(biāo)分析(PCoA)表明,Sen和Res小鼠的腸道微生物群落整體結(jié)構(gòu)存在顯著差異(圖1g, h)。LEfSe分析顯示,在屬水平上,Res小鼠的Coprostanolignes-group和Ruminococcaceae-UCG-010的相對豐度高于Sen小鼠 (圖1i)。此外,在物種水平上,鼠乳桿菌在Res的相對豐度是Sen小鼠的4倍,變化最大(圖1j)。鼠乳桿菌的相對豐度與腸道I/R損傷的炎癥因子呈負(fù)相關(guān)(圖1k)。

2)Res小鼠腸道菌群可獨立減輕I/R誘導(dǎo)的組織損傷
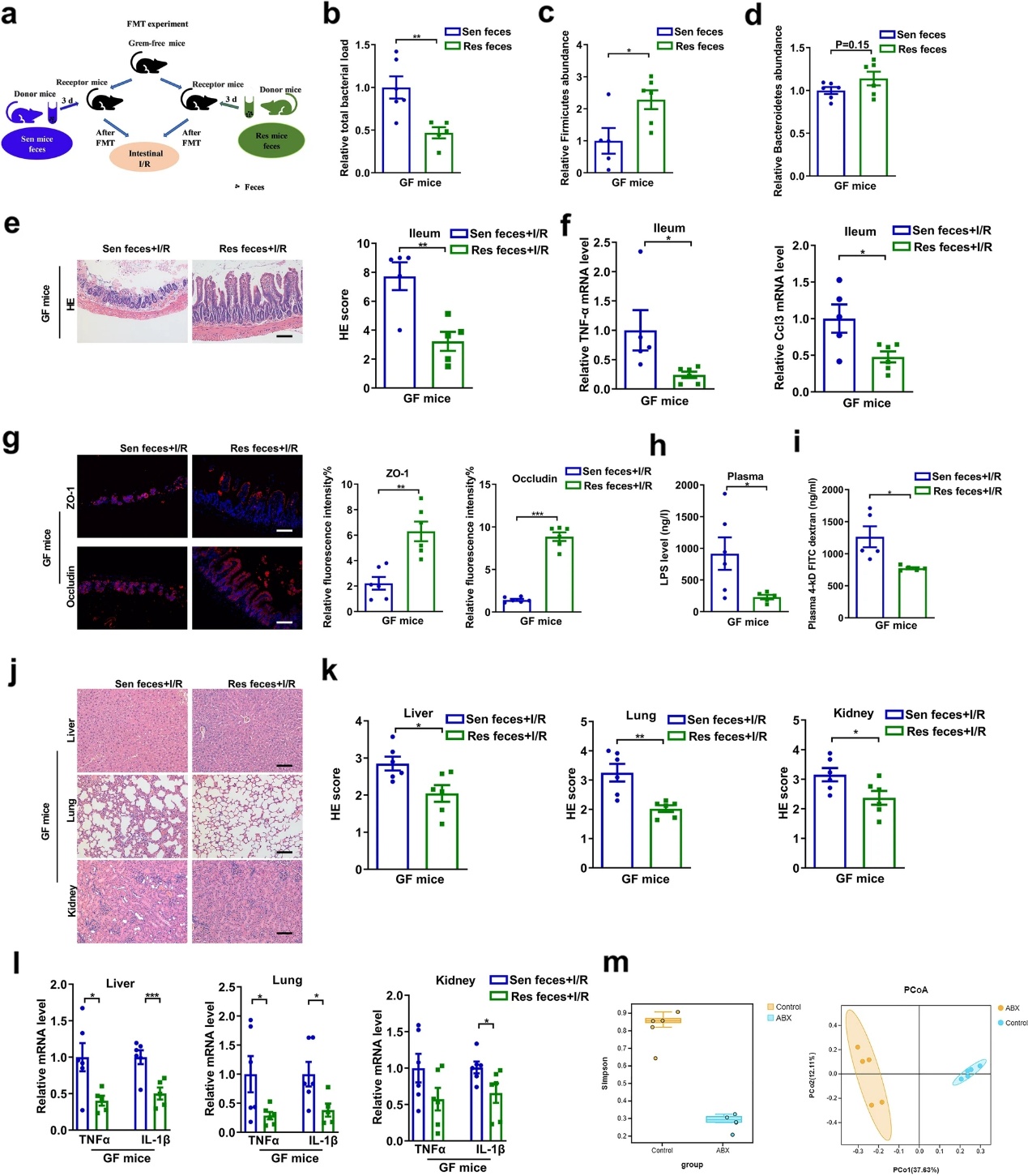
通過FMT實驗進(jìn)一步證明腸道菌群在腸道I/R損傷中發(fā)揮重要作用(圖2a)。于FMT后第三天收集受體小鼠糞便。接收Sen小鼠糞便的GF小鼠(Sen糞便組)與接收Res小鼠糞便的GF小鼠(Res糞便組)相比,厚壁菌門水平顯著下降,相對總細(xì)菌載量增加(圖2b-d)。上述結(jié)果表明,FMT實驗是成功的。FMT 3天后進(jìn)行腸I/R。與Sen糞便+I/R組相比,Res糞便+ I/R組腸組織病理損傷、Chiu評分及回腸Tnf-α、Ccl3 mRNA水平均顯著降低(圖2e, f)。如圖2g-i所示,Res糞便+ I/R組回腸ZO-1和occludin mRNA和蛋白水平高于Sen糞便+ I/R組,血漿LPS水平和FD-4通透性較低。此外,與Sen糞便+ I/R組相比,Res糞便+I/R組肝、肺、腎組織病理損傷和炎癥因子mRNA水平均降低(圖2j-l)。此外,α和β多樣性分析顯示,ABX處理的小鼠腸道微生物多樣性顯著低于對照組小鼠,且可以完全聚類(圖2m)。FMT實驗證實,腸道缺血前的腸道菌群與腸道I/R術(shù)后的結(jié)局密切相關(guān)。
3)鼠乳桿菌可減輕腸道I/R引起的腸道損傷
16S rRNA基因測序分析發(fā)現(xiàn),鼠乳桿菌在Res小鼠中的相對豐度是Sen小鼠的4倍(圖1j)。此外,腸道I/R后,該物種的相對豐度顯著下降 (圖3a)。這一結(jié)果促使我們研究口服鼠乳桿菌是否可以改善腸道I R引起的腸道損傷。與I/R小鼠相比,鼠乳桿菌處理顯著增加了盲腸中鼠乳桿菌的相對豐度,提高了存活率,減少了組織病理學(xué)損傷(圖3a-c)。與I/R小鼠相比,I/R+鼠乳桿菌和假手術(shù)小鼠ZO-1和occludin mRNA和蛋白水平顯著升高,FD-4通透性降低(圖3d-g)。為了進(jìn)一步證明單株鼠乳桿菌在腸道I/R中的作用,在I/R之前,GF小鼠灌胃鼠乳桿菌3天(圖3h)。RT-PCR結(jié)果顯示,鼠乳桿菌處理的GF小鼠糞便中鼠乳桿菌的相對豐度高于MRS培養(yǎng)基處理的GF小鼠(圖3i)。如圖3j-m所示,鼠乳桿菌可減輕GF小鼠I/R后腸道病理損傷,回腸ZO-1和occludin mRNA和蛋白水平升高。上述結(jié)果表明,鼠乳桿菌能減輕GF小鼠腸道I/R誘導(dǎo)的腸道損傷。

4)鼠乳桿菌與體外循環(huán)術(shù)后腸道損傷的關(guān)系
在接受心臟手術(shù)的患者中,體外循環(huán)可能會導(dǎo)致腸道缺血和損傷;因此,本研究將其作為腸I/R的臨床模型。首先,將體外循環(huán)手術(shù)患者術(shù)前糞便中血乳桿菌的相對豐度分為低(小于0.1)和高(大于0.1)兩類(圖4a,b)。兩組血漿瓜氨酸和IFABP濃度均被測量為人體吸收腸上皮細(xì)胞量和腸衰竭的標(biāo)記物。如圖4c-f所示,體外循環(huán)手術(shù)患者術(shù)前糞便中鼠乳桿菌的豐度與術(shù)后6 h IFABP濃度變化呈負(fù)相關(guān),與瓜氨酸濃度變化呈正相關(guān)。術(shù)后7天進(jìn)一步評估患者胃腸功能,低鼠乳桿菌豐度組患者胃腸損傷發(fā)生率為60%。相比之下,高鼠乳桿菌豐度組患者在臨床上無胃腸道并發(fā)癥發(fā)生(圖4g)。為了進(jìn)一步證明鼠乳桿菌在改善腸道損傷中的作用,進(jìn)行了一項FMT實驗,將術(shù)前從鼠乳桿菌高豐度組和鼠乳桿菌低豐度組收集的糞便細(xì)菌分別移植到小鼠體內(nèi),并相應(yīng)地分為鼠乳桿菌高豐度組和鼠乳桿菌低豐度組。RT-PCR顯示,FMT后,高鼠乳桿菌糞便組中鼠乳桿菌的相對豐度顯著高于低鼠乳桿菌糞便組(圖4h)。與低濃度鼠乳桿菌糞便組相比,高濃度鼠乳桿菌糞便組顯著降低了I/R誘導(dǎo)的腸道病理損傷和通過血漿FD-4水平測定的腸道通透性,并增加了回腸中ZO-1和occludin的mRNA和蛋白質(zhì)水平(圖4i–m)。

5)小鼠腸道I/R損傷的改善依賴于巨噬細(xì)胞的參與
上述動物和臨床實驗結(jié)果證實,鼠乳桿菌對腸內(nèi)I/R損傷有保護(hù)作用;然而,其機(jī)制尚未闡明。鼠乳桿菌影響免疫反應(yīng);然而,它是否調(diào)節(jié)腸道I/R中的巨噬細(xì)胞尚不清楚。流式細(xì)胞術(shù)結(jié)果顯示,腸道I/R誘導(dǎo)巨噬細(xì)胞數(shù)量顯著增加(F4/80+CD45+),這種效應(yīng)被鼠乳桿菌治療逆轉(zhuǎn)(圖5a)。為了進(jìn)一步驗證小鼠乳桿菌的保護(hù)作用是否與巨噬細(xì)胞有關(guān),在I/R前2天,給小鼠腹腔注射氯膦酸二鈉脂質(zhì)體以消耗巨噬細(xì)胞。與I/R小鼠和PBS Lipo+I/R組相比,氯膦酸二鈉脂質(zhì)體+I/R組的巨噬細(xì)胞數(shù)量減少(圖5b),I/R引發(fā)的組織病理學(xué)損傷減少,ZO-1和occludin的mRNA和蛋白質(zhì)水平上調(diào)(圖5c-f),以及血漿FD-4水平測定的腸道通透性降低(圖5g),但與氯膦酸二鈉脂質(zhì)體+鼠乳桿菌+I/R組相比,無統(tǒng)計學(xué)差異。建立小腸類器官的H/R模型以進(jìn)一步證實小鼠的結(jié)果。如圖5h,i所示,在H/R后,在巨噬細(xì)胞和類器官共培養(yǎng)體系中,鼠乳桿菌降低了腸道形態(tài)損傷和LDH水平,并增加了ZO-1和occludin的mRNA水平(圖5j),但在單獨培養(yǎng)的類器官中對這些因子沒有明顯影響。與體內(nèi)實驗結(jié)果一致,鼠乳桿菌對腸道I/R損傷的保護(hù)作用可能依賴于巨噬細(xì)胞的參與。

6)鼠乳桿菌可通過TLR2信號途徑促進(jìn)巨噬細(xì)胞釋放IL-10,從而減輕類器官H/R損傷
我們已經(jīng)證實小鼠乳桿菌對腸I/R損傷的保護(hù)作用可能依賴于巨噬細(xì)胞的參與;因此,我們探索了巨噬細(xì)胞在小腸類器官中的具體機(jī)制。建立從TLR2-/-、IL-10- /-或WT小鼠中提取的巨噬細(xì)胞與WT小鼠中提取的類器官的transwell共培養(yǎng)體系。我們發(fā)現(xiàn),在WT-MΦ和WT-Org共培養(yǎng)體系中,鼠乳桿菌處理增加了H/R后M2巨噬細(xì)胞的比例,增加了M2巨噬細(xì)胞表面TLR2的表達(dá),增加了Myd88 mRNA的水平(圖6a-c)。在WT-MΦ和WT-Org共培養(yǎng)系統(tǒng)中,鼠乳桿菌降低了類器官病理損傷和LDH水平,同時增加了ZO-1和occludin的mRNA和蛋白質(zhì)水平(圖6d-g)。此外,流式細(xì)胞術(shù)結(jié)果顯示,鼠乳桿菌抑制了WT-MΦ和WT-Org的transwell共培養(yǎng)系統(tǒng)中H/R誘導(dǎo)的IL-10+M2巨噬細(xì)胞/總M2巨噬細(xì)胞比例的下降(圖7a)。在H/R后,WT-MΦ和WT-Org共培養(yǎng)系統(tǒng)中,鼠乳桿菌降低了類器官病理損傷和LDH水平,同時增加了ZO-1和occludin的mRNA和蛋白質(zhì)水平(圖7b-e)。上述結(jié)果表明,小鼠乳桿菌可能通過TLR2信號途徑促進(jìn)M2巨噬細(xì)胞釋放IL-10,從而減輕巨噬細(xì)胞和類器官共培養(yǎng)系統(tǒng)中類器官H/R損傷。


結(jié)論:腸道微生物群參與了腸I/R術(shù)后的結(jié)局。鼠乳桿菌通過巨噬細(xì)胞減輕腸I/R損傷,通過TLR2促進(jìn)巨噬細(xì)胞釋放IL-10可能是鼠乳桿菌在體外改善類器官H/R損傷的潛在機(jī)制。這項研究揭示了腸道I/R損傷的一種新機(jī)制,并表明通過靶向微生物的治療是預(yù)防腸道I/R損傷的一種有希望的策略。
參考文獻(xiàn):
Hu J, Deng F, Zhao B, Lin Z, Sun Q, Yang X, Wu M, Qiu S, Chen Y, Yan Z, Luo S, Zhao J, Liu W, Li C, Liu KX. Lactobacillus murinus alleviate intestinal ischemia/reperfusion injury through promoting the release of interleukin-10 from M2 macrophages via Toll-like receptor 2 signaling. Microbiome. 2022 Mar 3;10(1):38. doi: 10.1186/s40168-022-01227-w.






