DNMT1-PAS1-PH20軸驅動乳腺癌生長和轉移
PH20是人類透明質酸酶家族的成員,可降解細胞外基質中的透明質酸并控制腫瘤進展。抑制DNA甲基轉移酶(DNMTs)導致透明質酸水平升高。然而,DNMT抑制劑是否能控制PH20仍不清楚。在這里,我們報道DNMT1抑制劑地西他濱通過激活lncRNA PHACTR2-AS1 (PAS1)來抑制PH20的表達。PAS1與RNA結合蛋白vigilin和組蛋白甲基轉移酶SUV39H1形成一個三部復合體。PAS1與vigilin的相互作用維持了PAS1的穩定性。同時,PAS1招募SUV39H1觸發PH20的H3K9甲基化,導致其沉默。在功能上,PAS1通過抑制PH20,至少部分抑制乳腺癌的生長和轉移。地西他濱與直接結合SUV39H1的PAS1-30nt-RNA聯合治療可有效阻斷小鼠乳腺癌生長和轉移。總之,DNMT1、PAS1和PH20組成了一個控制乳腺癌生長和轉移的調控軸。這些發現表明DNMT1-PAS1-PH20軸是乳腺癌潛在的治療靶點。本文于2022年3月發表于Signal Transduction and Targeted Therapy(IF= 18.187)上。
技術路線
結果
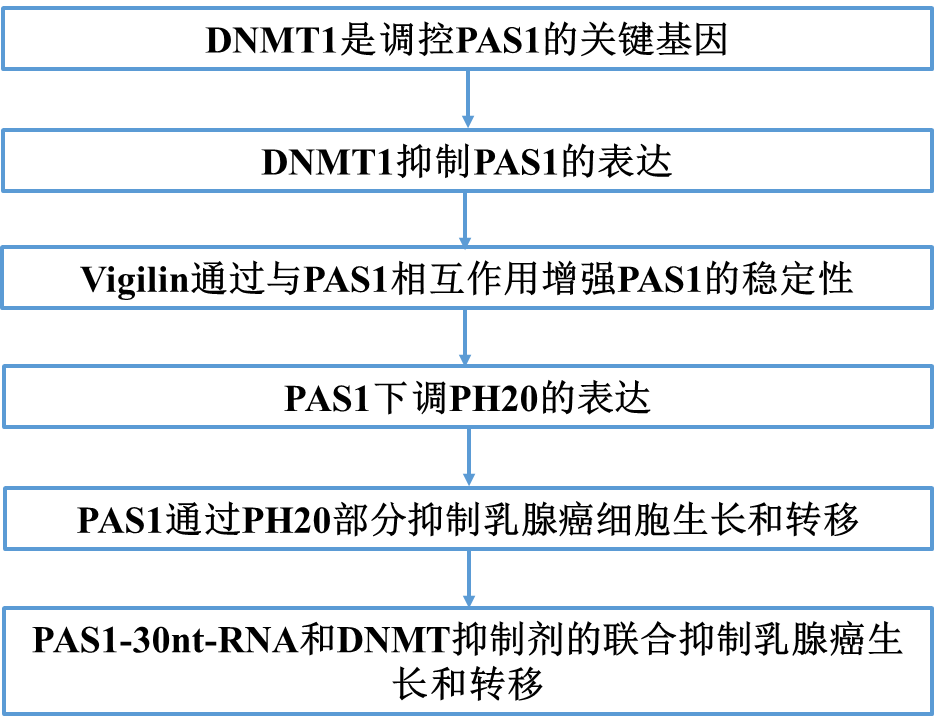
1)DNMT1是調控PAS1的關鍵基因
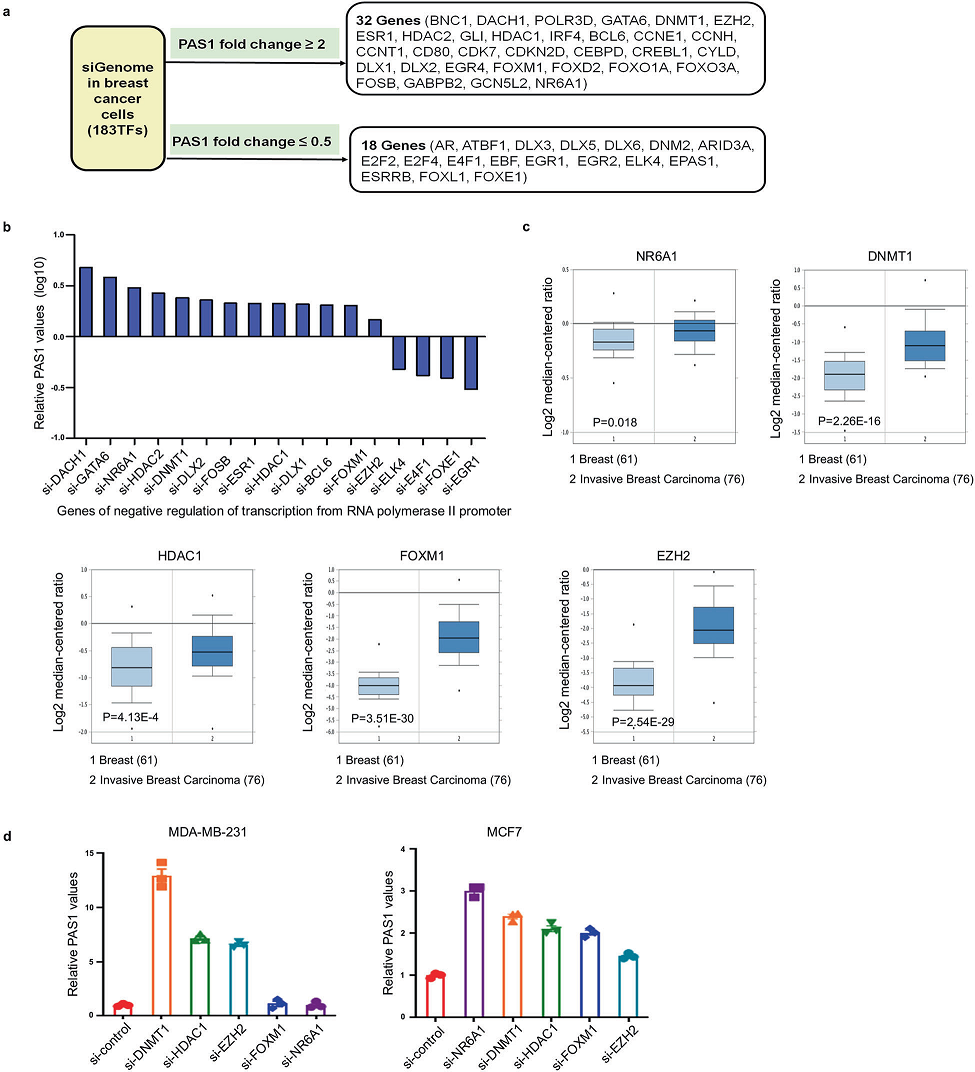
為了了解PAS1的轉錄調控,將靶向183個轉錄因子的siRNAs轉染到MCF7細胞中,通過RT-PCR檢測PAS1的倍數變化。我們發現,32個TF siRNA導致PAS1的激活,而18個TF siRNA導致PAS1的抑制(圖1a)。鑒于PAS1在乳腺癌中的抑制作用,我們重點研究了17個參與RNA聚合酶II啟動子轉錄負調控的基因。在這些基因中,發現13個siRNA上調PAS1,這13個基因可以抑制PAS1的轉錄(圖1b)。此外,oncomine數據集分析顯示,乳腺癌組織中13個基因中有5個基因的mRNA表達高于正常乳腺組織,包括NR6A1、DNMT1、HDAC1、FOXM1和EZH2(圖1c)。我們通過RT-qPCR驗證了它們在乳腺癌細胞株中的mRNA水平,發現DNMT1基因下調后PAS1明顯上調(圖1d)。因此,我們認為DNMT1是調控PAS1的關鍵基因。
2)DNMT1抑制PAS1的表達
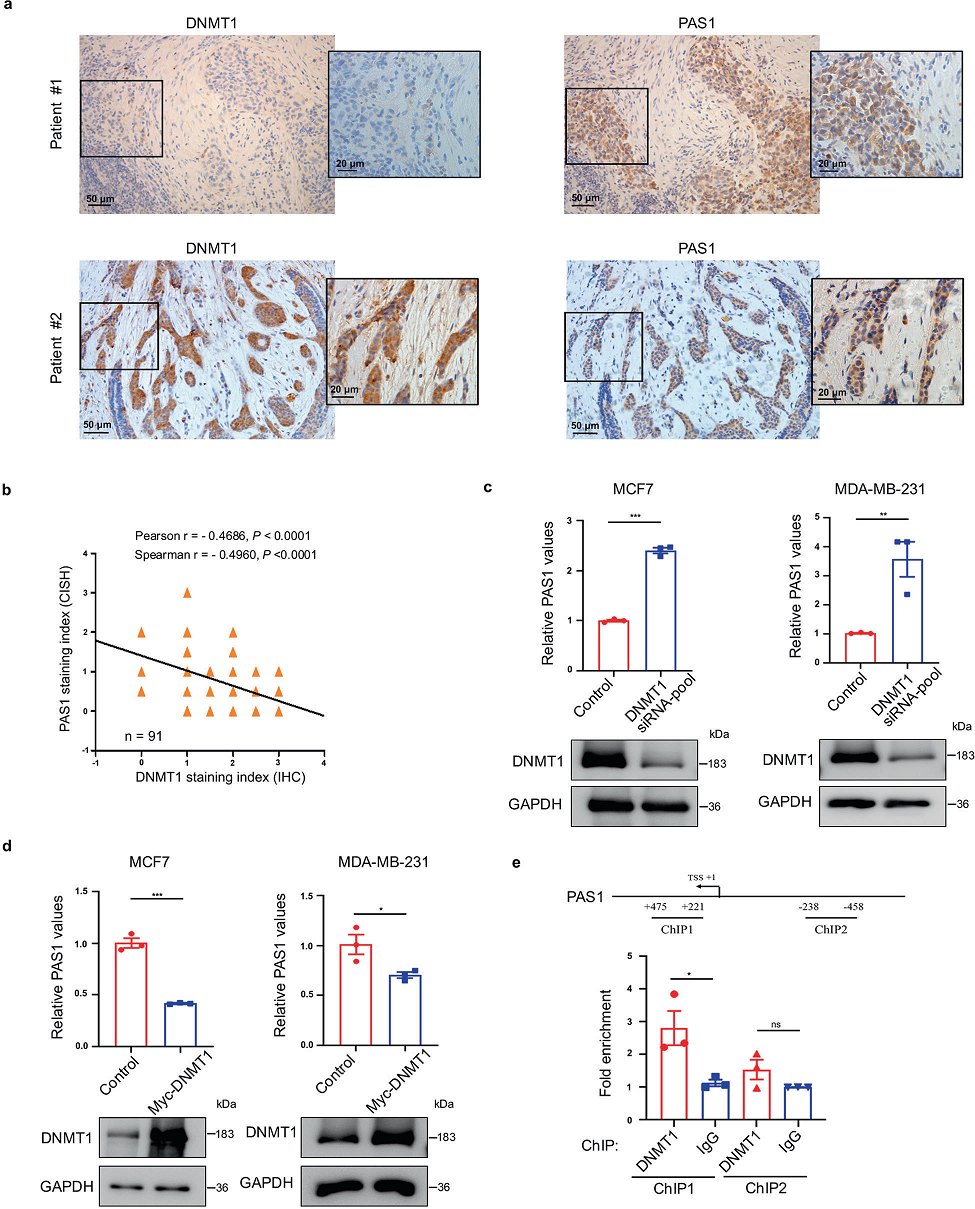
為了探討DNMT1與PAS1表達的關系,我們首先通過RNA原位雜交檢測PAS1 RNA水平,并通過免疫組化染色檢測人乳腺癌組織陣列DNMT1蛋白水平。DNMT1的表達與PAS1的表達呈負相關(圖2a, b)。為了驗證DNMT1對PAS1的調控作用,我們檢測了DNMT1敲低或過表達時PAS1的水平。DNMT1敲低導致PAS1表達上調(圖2c),而DNMT1過表達導致PAS1 RNA水平降低(圖2d)。為了進一步了解DNMT1對PAS1的調控作用,我們觀察了DNMT1在PAS1啟動子上的占據情況,發現DNMT1可以與PAS1啟動子結合(圖2e)。綜上所述, PAS1的轉錄受到DNMT1的負調控。
3)Vigilin通過與PAS1相互作用增強PAS1的穩定性
為了確定PAS1的相互作用體,我們采用RNA拉下結合質譜的方法。發現了四種候選蛋白,包括vigilin,matrin-3,SFPQ和hnRPQ(圖3a)。為了驗證這些候選蛋白,我們進行了RNA pull-down結合western blot分析。結果顯示,最明顯和特異性的PAS1互作蛋白是vigilin (圖3b)。然后,我們構建了三個PAS1截斷突變體,發現從1301到2134的核苷酸C末端足以與vigilin結合(圖3c)。然后使用RIP在體內檢測PAS1和vigilin之間的相互作用。如預期的那樣,抗vigilin抗體在MCF7細胞中沉淀內源性PAS1(圖3d)。此外,我們通過RNA FISH和免疫熒光染色觀察到PAS1和vigilin在Hs578T細胞的細胞核和細胞質中共定位(圖3e)。鑒于vigilin在維持mRNA穩定性方面的作用,我們推測vigilin影響PAS1的穩定性。為了證實這一點,我們首先檢測了vigilin對PAS1水平的影響,發現vigilin的過表達導致了細胞核和細胞質中PAS1的增加(圖3f)。然后用轉錄抑制劑ActD處理Hs578T細胞,檢測PAS1的半衰期。結果表明,PAS1在對照細胞中的半衰期約為4 h。vigilin過表達后,PAS1的半衰期延長至8 h(圖3g)。這些數據表明,PAS1與vigilin相互作用,維持其穩定性。

4)PAS1下調PH20的表達
為了探索PAS1的靶基因,我們對PAS1進行了共表達分析。我們從GEO數據集中下載了100個包含PAS1 Affy-probe的基因表達譜。P值最小的前10個基因如圖4a所示。在這10個基因中,SPAM1(又稱PH-20)具有水解酶活性。PH20的異常表達已在多種癌癥中被發現,并與癌癥轉移有關。因此,我們選擇PH20作為PAS1的候選靶點。我們首先估計了有或沒有PAS1過表達的PH20水平。結果表明,過表達PAS1抑制了PH20的表達(圖4b)。而PAS1敲除恢復了PH20的表達,表明PAS1對PH20的負調控(圖4c)。考慮到DNMT1對PAS1的抑制作用,我們進一步估計DNMT1對PH20水平的影響。DNMT1敲低導致PH20表達下降(圖4d)。
由于PAS1直接與組蛋白甲基轉移酶SUV39H1結合,而組蛋白甲基轉移酶SUV39H1也與vigilin相互作用,這三個分子可能形成復合物。為了測試這個想法,我們進行了RIP和Co-IP檢測,發現SUV39H1可以免疫沉淀PAS1和vigilin (圖4 e, f)。接下來,RNA下拉顯示生物素標記的PAS1 RNA可以同時與SUV39H1和vigilin結合(圖4 g)。由于SUV39H1催化的H3K9二甲基化和三甲基化(H3K9me2和H3K9me3)介導基因沉默,SUV39H1可能參與抑制PAS1對PH20的作用。事實上,SUV39H1基因敲除增強了PH20的表達(圖4h)。H3K9me2和H3K9me3都富集在PH20啟動子中(圖4i)。PAS1的過表達顯著促進了H3K9me3的占據(圖4j),提示H3K9me3參與了PAS1對PH20的抑制。這些數據表明,PAS1通過與SUV39H1相互作用,促進了H3K9me3在PH20啟動子上的占據,導致了PH20的抑制。

5)PAS1通過PH20部分抑制乳腺癌細胞生長和轉移
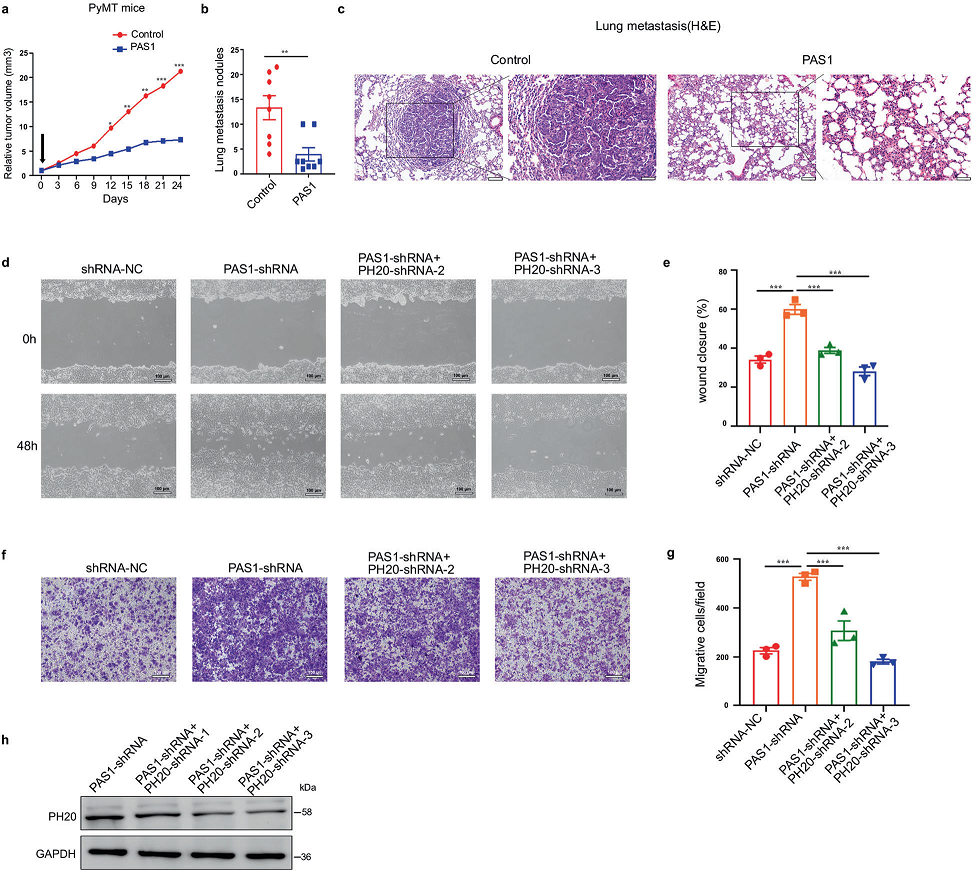
攜帶PAS1的慢病毒降低了患有多發性腫瘤的PyMT小鼠的腫瘤體積,并減少了肺轉移結節的數量(圖5a, b)。通過組織學染色證實了肺轉移(圖5c)。接下來,通過傷口愈合和細胞遷移實驗證實了PAS1抑制癌細胞遷移的作用。抑制PAS1可促進乳腺癌細胞遷移。但同時敲除PH20后,創面愈合速度和細胞遷移速度恢復到對照組細胞的水平(圖5d-h),說明PH20參與了PAS1對癌細胞遷移的抑制。
6)PAS1-30nt-RNA和DNMT抑制劑的聯合抑制乳腺癌生長和轉移
DNMT是很有前途的治療靶點,一些DNMT抑制劑,如地西他濱,已被用于治療癌癥。基于上述DNMT1敲除對PAS1和PH20的影響,我們評估了地西他濱在乳腺癌細胞中的作用。一致地,地西他濱可導致PAS1水平升高,PH20水平降低(圖6a, b)。一些研究已經證實,DNMT抑制劑與其他藥物聯合使用似乎比單一藥物更有效。PAS1-30nt-RNA是一個合成的PAS1片段,用于體內RNA傳遞。因此,我們用異種移植小鼠觀察單獨地西他濱、單獨PAS1-30nt-RNA或聯合PAS1-30nt-RNA在體內是否可以抑制腫瘤生長。PAS1-30nt-RNA與地西他濱聯合抑制腫瘤生長的效果優于單獨地西他濱或單獨使用PAS1-30nt-RNA(圖6c, d)。接下來,我們觀察地西他濱和PAS1-30nt-RNA對轉移性小鼠模型的治療效果。正如預期的那樣,聯合組的轉移信號比單獨地西他濱或單獨PAS1-30nt-RNA組的轉移信號要少(圖6e, f)。這些結果提示地西他濱聯合PAS1-30ntRNA對抑制乳腺癌生長和轉移有一定的治療價值。
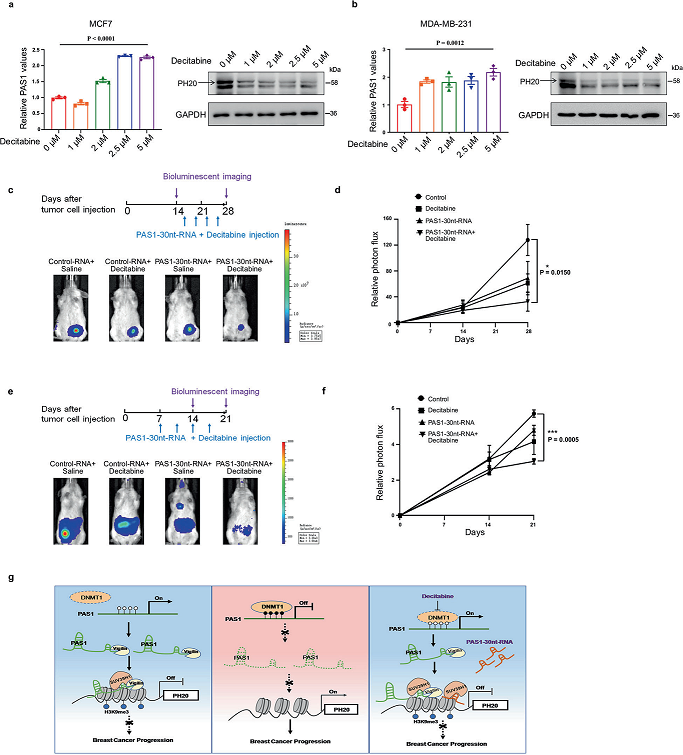
結論:我們報道DNMT1抑制劑通過激活PAS1來控制PH20的表達。DNMT抑制劑地西他濱與PAS1-30nt-RNA聯合治療可有效阻斷乳腺腫瘤生長和轉移。
參考文獻:
Fu Y, Zhang X, Liu X, Wang P, Chu W, Zhao W, Wang Y, Zhou G, Yu Y, Zhang H. The DNMT1-PAS1-PH20 axis drives breast cancer growth and metastasis. Signal Transduct Target Ther. 2022 Mar 21;7(1):81. doi: 10.1038/s41392-022-00896-1. PMID: 35307730; PMCID: PMC8934873.






