小鼠間充質干細胞源性外泌體miR-466f-3p參與放射性肺損傷的EMT過程
放射性肺纖維化(RILF)是胸部放療的常見并發癥。肺泡上皮細胞通過上皮-間質轉化(EMT)在肺纖維化中發揮關鍵作用。來源于間充質干細胞的外泌體具有修復和再生受損組織的特性,但其潛在機制尚不清楚。我們的研究結果表明,來自于mMSCs的外泌體miR-466f-3p可能具有抗纖維化特性,并通過c-MET抑制AKT/GSK3β來防止放療誘導的EMT,為放療誘導的肺纖維化提供了一種有前途的治療方式。本文于2022年4月發表于“Journal of Experimental & Clinical Cancer Research”(IF=11.161)上。
技術路線

結果
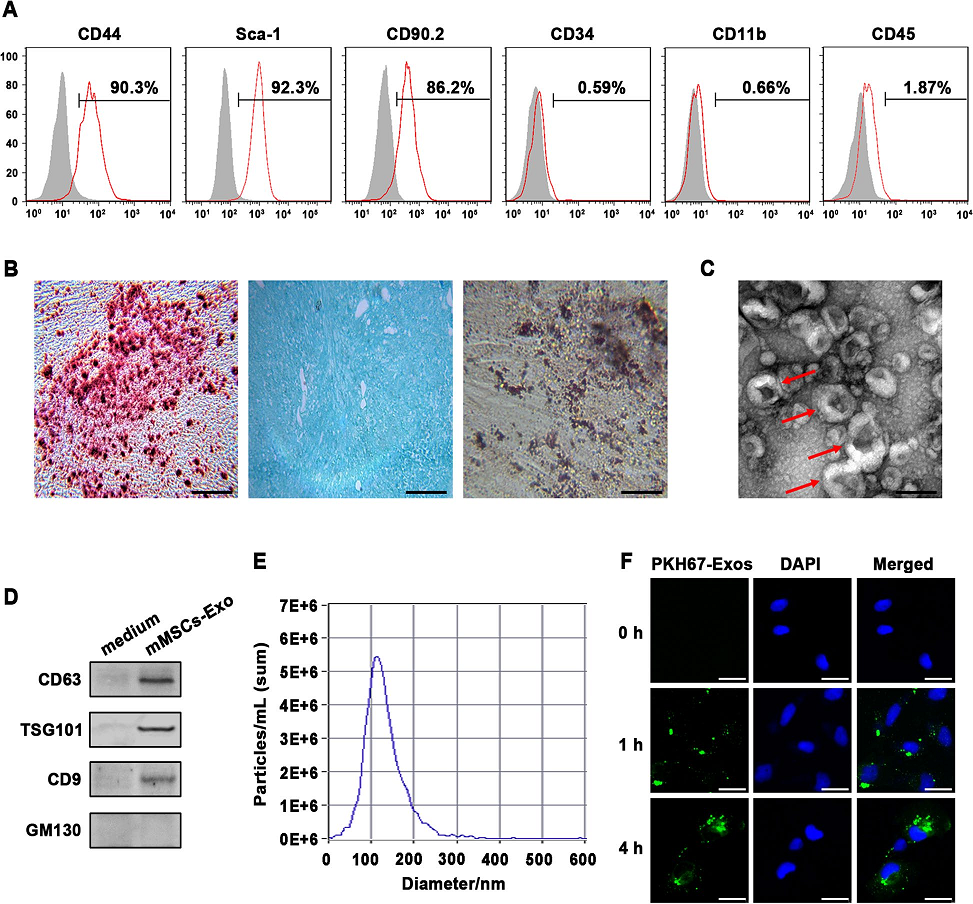
1)小鼠間充質干細胞及其外泌體的特征
培養3周后,通過流式細胞術分析從骨髓中純化的小鼠間充質干細胞(mMSCs),其典型的MSC標志物CD44、CD90.2和Sca-1陽性表達。而造血標志物如CD34、CD11b和CD45呈陰性(圖1A)。在適當的誘導培養基下,分離的mMSCs表現出向骨細胞、脂肪細胞和軟骨細胞的分化能力(圖1B)。然后,通過標準超離心從條件培養基中分離出外泌體,分別用TEM、納米顆粒跟蹤分析和Western blot方法進行鑒定。如圖1C-E所示,典型的外泌體呈圓形形態,大小為90 ~ 150 nm,陽性表達常見的外泌體標志物CD63、TSG101和CD9。而胞內蛋白GM130在外泌體中缺失。隨后,為了評估來自于mMSCs的外泌體是否被受體細胞吸收,將PKH67標記的mMSCs-exos與小鼠肺泡上皮細胞MLE-12共培養。我們通過共聚焦顯微鏡觀察發現,PKH67信號在MLE-12細胞質中以時間依賴的方式不斷積累,在孵育4小時后達到最大值(圖1F)。
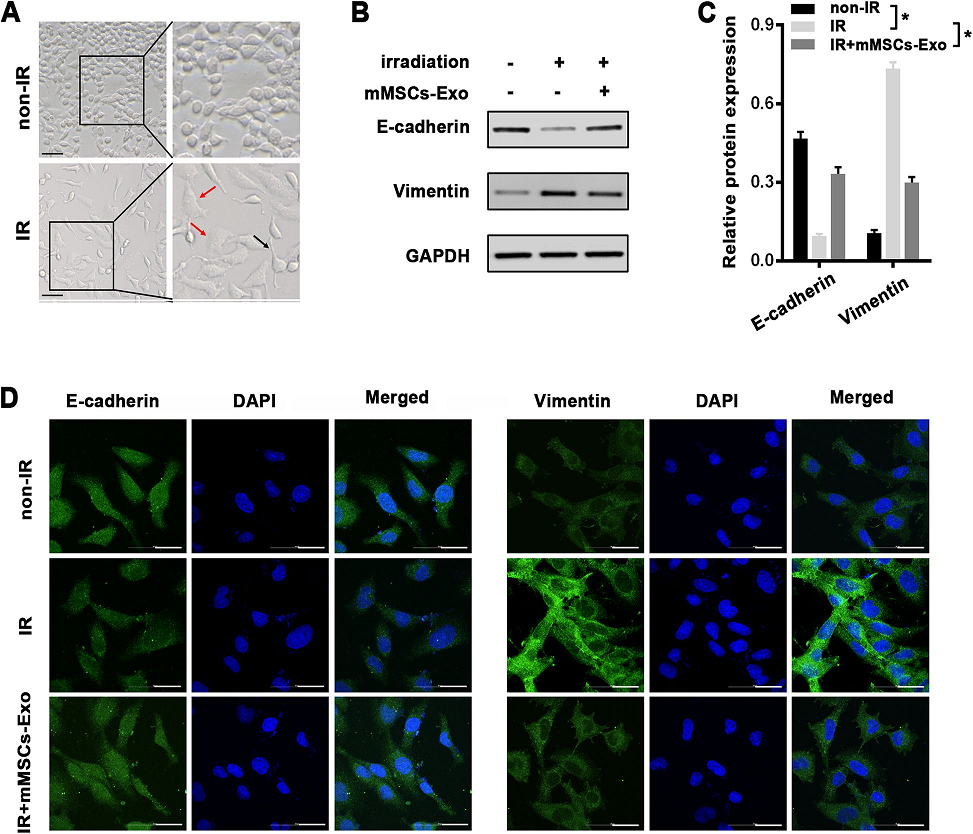
2)mMSCs-Exos可在體外防止放療誘導的肺泡EMT
在放療作用下,肺泡上皮細胞發生了EMT過程,這被認為是RILI發病的重要機制。如預期的那樣,單劑量8 Gy照射的MLE-12細胞出現了明顯的形態變化,照射48 h后,大多數細胞從典型的上皮細胞轉變為具有延伸偽足的細長間充質樣外觀(圖2A)。為了探究mMSCs-Exos在放療誘導的EMT中的作用,我們在MLE-12細胞在放療前用mMSCs-Exos預處理4 h,48 h后用western blot方法分析EMT相關標記物。與放療誘導的形態學變化相一致的是,與對照組細胞相比,放療后的MLE-12細胞上皮標記物(E-cadherin)明顯減少,間充質標記物(Vimentin)表達增強,證實了EMT形態的變化(圖2B, C)。預處理后的mMSCs-Exos明顯逆轉了放療誘導的EMT(圖2B, C)。此外,上述EMT相關蛋白的變化通過免疫熒光進一步鑒定(圖2D)。
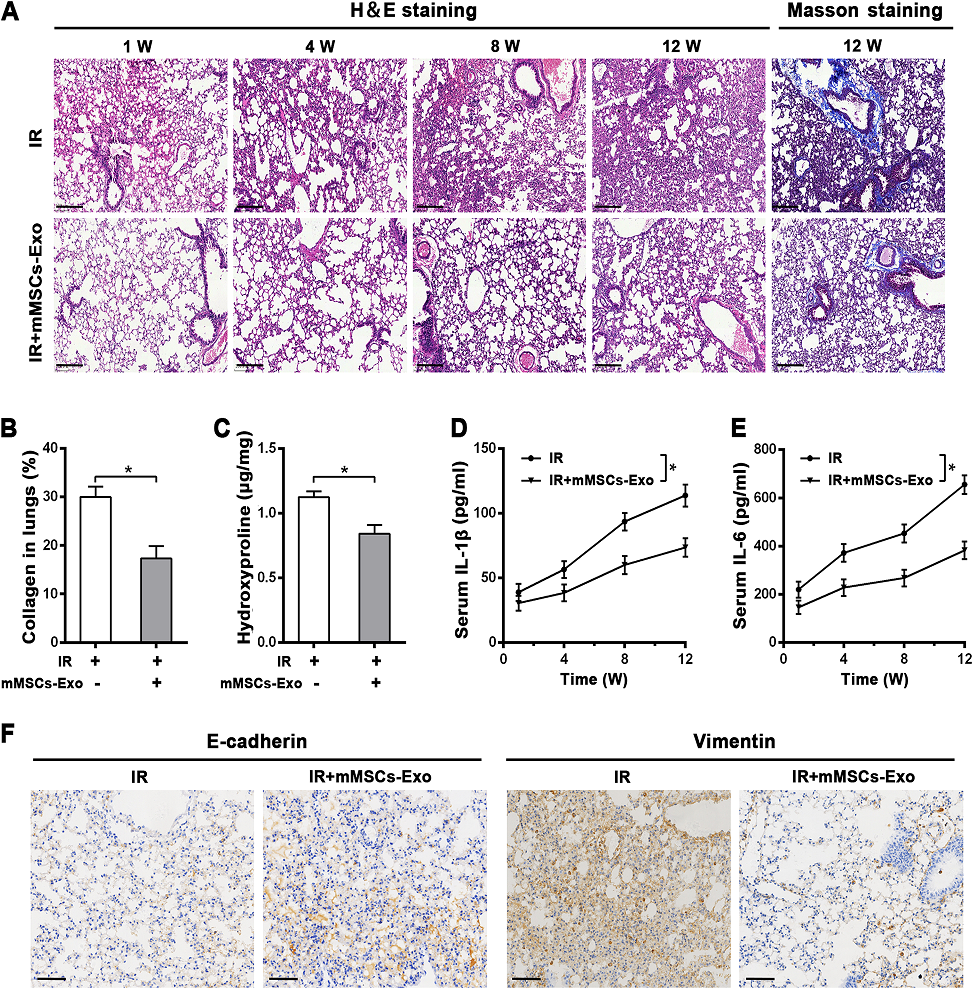
3)mMSCs-exos可在體內防止放療誘導的肺損傷
為了研究其體內細胞保護作用,我們建立了單劑量14 Gy全胸注射的小鼠RILI模型。治療組小鼠在放療前2 h靜脈注射mMSCs-Exos。有趣的是,H&E染色顯示,在1周、4周、8周和12周時,給予mMSCs-Exos明顯減輕了放療所致的肺損傷,其中肺泡間隔增厚、間質水腫、炎癥細胞浸潤等病理損傷明顯減輕。肺泡完整性優于單純放療組(圖3A)。值得注意的是,Masson染色進一步顯示,在放療12周后,膠原蛋白廣泛沉積,尤其是在血管周圍,而mMSCs-Exos降低了沉積(圖3A, B)。與Masson染色一致,在12周時,mMSCs-Exos也減弱了放療誘導的肺組織中羥脯氨酸含量的增加(圖3C)。此外,我們通過ELISA檢測炎癥細胞因子。數據顯示,雖然IL-1β和IL-6的分泌和釋放在放療12周后顯著增加,但與單純放療組相比,使用mMSCs-Exos顯著抑制了它們的水平(圖3D, E)。此外,免疫組化數據顯示,在放療12周后,mMSCs-Exos導致EMT相關蛋白明顯變化,與單純放療組相比,E-cadherin表達增加,Vimentin表達減少(圖3F)。
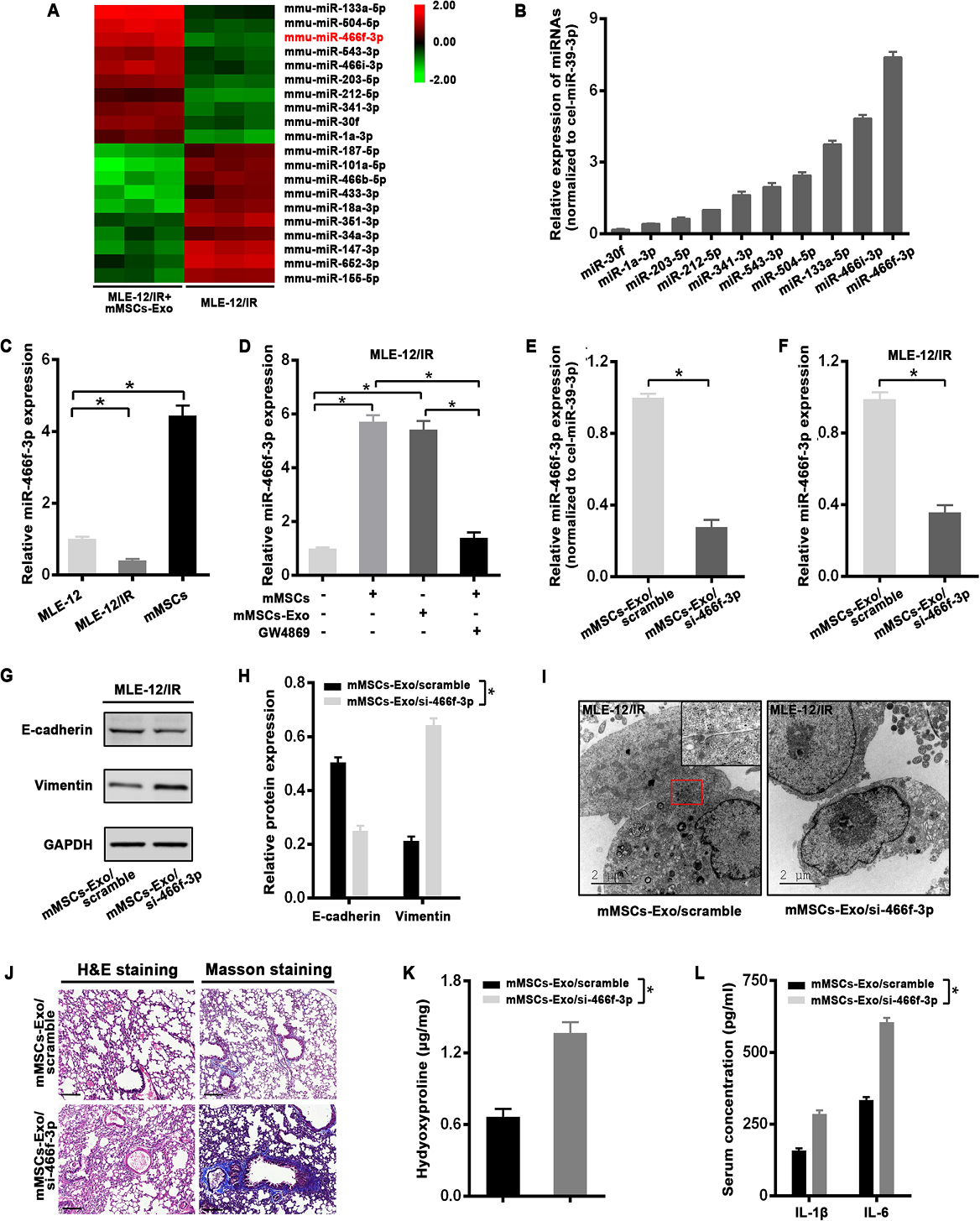
4)來自mMSCs的外泌體mmu-miR-466f-3p可逆轉放療誘導的EMT和肺損傷
鑒于miRNAs的穿梭被認為是外泌體的重要功能,我們進行了miRNA微陣列來篩選對IR的保護作用所需的miRNA。與只接受放療的細胞相比,在與mMSC-Exos共培養的MLE-12細胞中觀察到miRNA顯著增加(圖4A)。在前10個上調的miRNAs中,mmu-miR-466f-3p (miR-466f-3p)在mMSCs-Exos中表達最豐富(圖4B)。mMSCs中miR-466f-3p的水平高于MLE-12細胞,在放療后的MLE-12細胞中miR-466f-3p的水平顯著下調(圖4C)。特別地,用mMSCs或mMSCs- exos處理后,miR-466f-3p在放療的MLE12細胞中的表達顯著增加。然而,這種趨勢被外泌體抑制劑GW4869所削弱(圖4D)。此外,為了闡明外泌體miR-466f-3p在放療誘導的EMT中的作用,將miR-466f-3p抑制劑引入到mMSCs中,與scramble轉染的mMSCs外泌體(mMSCs-exo/scramble)相比,在mMSCs來源的外泌體(mMSCs-exo/ si-466f-3p)中miR-466f-3p的表達下降(圖4E)。正如預期的那樣,miR-466f-3p在scrambled外泌體處理的放療的MLE-12細胞中的水平高于mMSCs-exo/si-466f-3p處理的細胞(圖4F)。有趣的是,與scrambled外泌體處理的放療的MLE-12細胞相比,使用抑制miR-466f-3p的外泌體(mMSCs-exo/si-466f-3p)顯著降低了E-cadherin的表達,并提高了波形蛋白(圖4G, H)。此外,通過透射電鏡(TEM)顯示,與scrambled外泌體共孵育的放療細胞仍保持了一些上皮特性,如黏附連接,而miR-466f-3p抑制外泌體處理使細胞保持分散模式,沒有功能連接(圖4I)。隨后,我們檢測了外泌體miR-466f-3p在RILI小鼠模型中的預防作用。放療8周后,H&E和Masson染色顯示,miR-466f-3p抑制外泌體小鼠的病理性肺損傷更為嚴重,膠原沉積更多(圖4J)。羥脯氨酸評估顯示,在放療8周后,scrambled外泌體誘導肺組織中含量明顯減少,而miR-466f-3p抑制外泌體處理小鼠的肺中含量顯著增加(圖4K)。此外,miR-466f-3p抑制也導致IL-1β和IL-6水平升高(圖4L)。
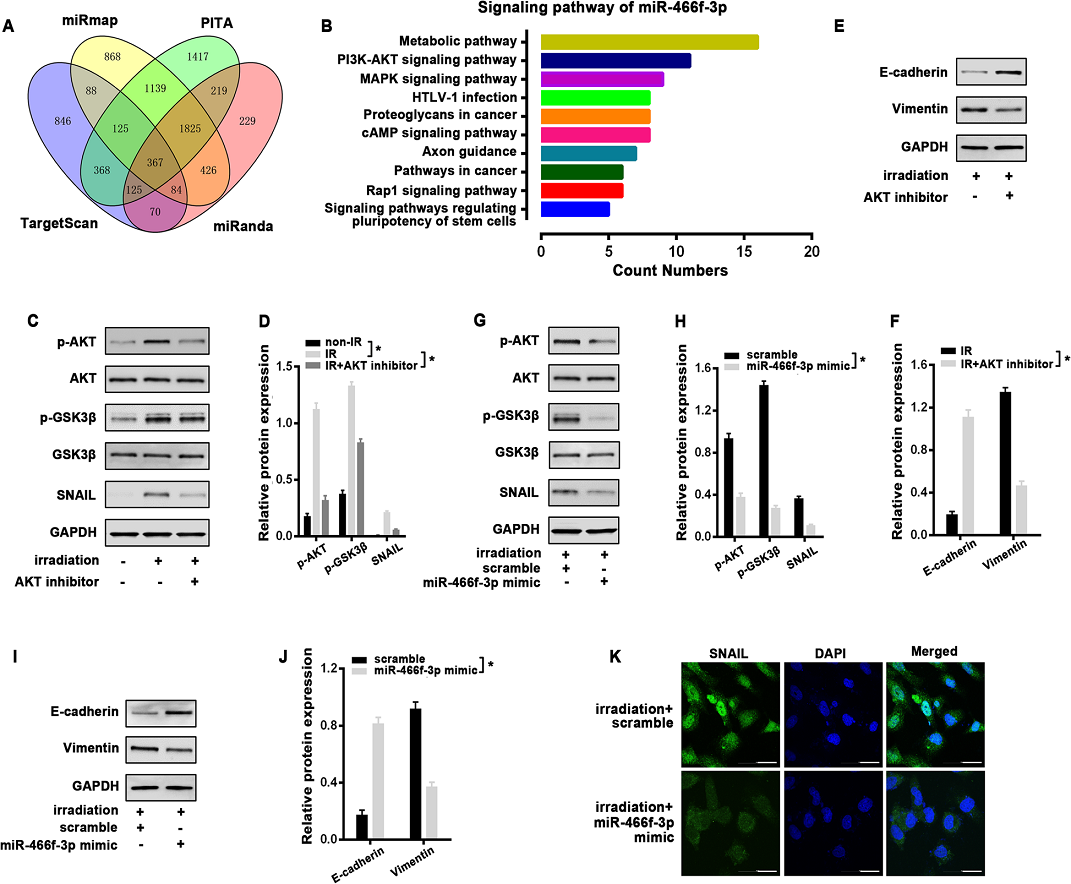
5)miR-466f-3p依賴的AKT/GSK3β通路對放療誘導的EMT至關重要
為了更好地闡明miR-466f-3p調控的EMT的分子機制,我們在Targetscan、miRmap、PITA和miRanda等公開數據庫中預測了miR466f-3p可能的靶點。367個重疊基因隨后被KEGG分析注釋(圖5A)。有趣的是,PI3K/AKT通路(KEGG mmu04151)是前10個富集之一,與EMT的誘導有關(圖5B)。根據之前的文獻,我們首先研究了MLE-12細胞中AKT和GSK3β對放療的響應。Western blot分析顯示,單劑量8 Gy照射1小時后,AKT在絲氨酸473位點明顯磷酸化(p-AKT),同時絲氨酸9位點磷酸化GSK3β (p-GSK3β)增加,SNAIL相應增加(圖5C, D)。我們在放療前用AKT抑制劑LY294002預處理MLE-12細胞2小時。當AKT信號被阻斷時,放療誘導的GSK-3β的抑制被釋放,這與SNAIL的下調有關(圖5 C,D)。AKT抑制劑也可以通過調節放療48 h 后E-cadherin和Vimentin的蛋白水平有效逆轉放療誘導的EMT(圖5 E,F)。根據上述結果,我們檢測了miR-466f-3p和AKT/GSK3β通路之間的潛在關系。與對照組相比,在MLE-12細胞中過表達miR466f-3p顯著降低了放療后p-AKT和p-GSK3β的強信號,同時Snail蛋白減少。而總AKT和GSK3β水平不受影響(圖5G,H)。此外,miR-466f-3p mimic通過恢復E-cadherin的表達明顯減弱放療誘導的MLE-12細胞EMT,而明顯抑制Vimentin的蛋白水平(圖5I,J)。免疫熒光也顯示,與對照相比,miR-466f-3p mimic同時逆轉了放療誘導的Snail核積累(圖5K)。
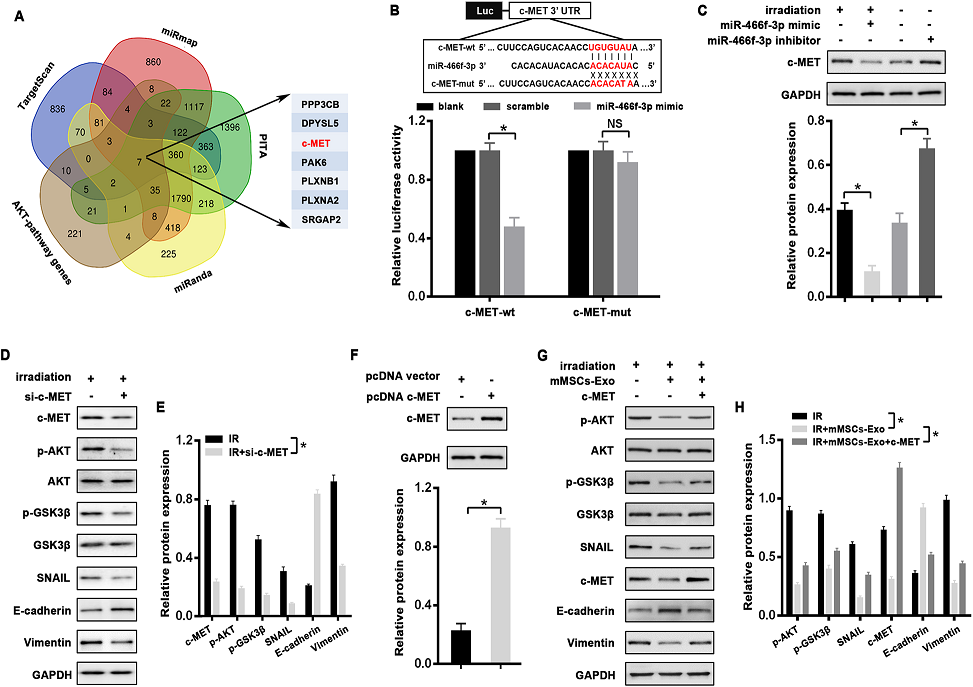
6)C-MET是miR-466f-3p的直接靶點,通過AKT/GSK3β通路消除放療誘導的EMT
為了確定miR-466f-3p的關鍵靶點,上述預測基因與PI3K-AKT通路存在重疊。在候選基因中,我們關注的是c-MET(圖6A),其在肺纖維化中的作用已被證實。首先,通過熒光素酶實驗驗證miR-466f-3p與c-MET之間的直接相互作用。我們發現miR466f-3p模擬物顯著抑制了c-MET野生型3'UTR報告基因的熒光素酶活性,而當載體含有c-MET突變型3'UTR時,這種抑制作用顯著消失(圖6B)。此外,與NC對照相比,轉染miR-466f-3p mimic顯著降低了放療的MLE-12細胞中c-MET蛋白的表達,而抑制miR-466f-3p的MLE-12細胞中c-MET的表達增加(圖6C)。此外,通過siRNA敲除c-MET可以顯著抑制放療誘導的AKT和GSK3β的磷酸化,從而逆轉放療的MLE-12細胞的EMT表型(圖6D,E)。為了進一步支持c-MET在mMSCs-exoos介導的EMT過程中的作用,我們將一個缺乏3’UTR的c-MET表達載體(pcDNA c-MET)轉染到MLE-12細胞中,與對照組相比,鑒定了其異位表達(圖6F)。如預期的那樣,過表達c-MET可減弱mMSCs-Exos處理的MLE-12細胞中放療誘導的變化,包括p-AKT、p-GSK3β、SNAIL和EMT標記物E-cadherin和Vimentin (圖6G,H)。
結論:我們證明了mMSCs-Exos在體內和體外均能減輕放療誘導的肺損傷。特別是,外泌體miR-466f-3p從mMSCs轉移到放療損傷的MLE-12細胞靶向c-MET,從而下調AKT/GSK3β信號通路,從而抑制放療誘導的EMT。對mMSCs-Exos在放療誘導的肺損傷中的作用的了解可能會改善我們開發預防方法的前景。
參考文獻:
Li Y, Shen Z, Jiang X, Wang Y, Yang Z, Mao Y, Wu Z, Li G, Chen H. Mouse mesenchymal stem cell-derived exosomal miR-466f-3p reverses EMT process through inhibiting AKT/GSK3β pathway via c-MET in radiation-induced lung injury. J Exp Clin Cancer Res. 2022 Apr 7;41(1):128. doi: 10.1186/s13046-022-02351-z.






