tRNA m7G修飾通過RPTOR/ULK1/自噬軸促進食管鱗狀細胞癌的發生
食管癌是一種惡性腫瘤,全世界每年有超過40萬人死于食管癌。轉運RNA (Transfer RNAs, tRNAs) 是信使RNA上識別密碼子和連接信使RNA翻譯氨基酸的調節因子。然而,tRNA m7G修飾在ESCC中的具體功能和分子機制尚不清楚。本研究發現tRNA m7G甲基轉移酶復合體蛋白METTL1和WDR4在食管鱗狀細胞癌 (ESCC) 組織中顯著上調,于是作者探索METTL1和WDR4在ESCC中的調控作用。本文于2022年3月發表于《Nature Communications》,IF=14.919。
本文技術路線:

本文主要內容:
1 、METTL1 /WDR4在ESCC中上調,并與ESCC不良預后相關
作者使用ESCC樣本隊列檢測METTL1/WDR4的表達。數據顯示,與相應的對照組相比,在ESCC樣本中METTL1/WDR4表達和m7G tRNA修飾均升高(Fig 1a,b)。此外,免疫組化(IHC)染色顯示,METTL1在ESCC腫瘤組織中的表達高于腫瘤周圍組織(Fig 1c–e),METTL1的表達與腫瘤的高分級和高分期顯著相關(Fig 1f–h),說明METTL1在ESCC進展中的所必需的。進一步研究ESCC患者中METTL1表達與預后的關系。生存分析顯示,METTL1高表達與較差的總生存和無病生存狀態相關(Fig 1i,j)。同樣,WDR4在ESCCs中也上調,并與預后不良相關(Fig 1k,l)。總之, METTL1和WDR4在ESCC中顯著上調,并與ESCC進展和不良預后相關。

Fig1 ESCC患者METTL1升高,是ESCC患者的不良預后因素
2、靶向METTL1表達可抑制ESCC進展
ESCC中METTL1表達的升高,作者推測METTL1在ESCC進展中起重要的致癌作用。為了驗證這一假設,首先使用兩個短發夾RNA(shM1-1和shM1-2)在KYSE150 (K150)和KYSE30 (K30) ESCC細胞中進行METTL1敲低(Fig. 2a),抑制METTL1的增殖(Fig 2b)和集落形成能力(Fig 2c,d)。流式細胞術分析顯示shM1-1和shM1-2可導致ESCC細胞凋亡增加 (Fig. 2e,f)。然后,利用異種移植小鼠模型,探討METTL1在體內ESCC進展中的作用。與注射shGFP ESCC細胞的小鼠相比,注射METTL1敲除細胞的小鼠的腫瘤生長明顯減慢,腫瘤大小和重量明顯降低(Fig 2g–i)。免疫組化染色顯示shM1-1和shM1-2組腫瘤中METTL1表達降低,Ki67染色水平降低,證實下調METTL1可降低ESCC體內增殖活性(Fig 2j,k)。總之,作者的研究揭示了METTL1在體外和體內ESCC進展中的基本功能。

Fig2體外和異種移植模型中,METTL1基因敲低可抑制ESCC進展
3、METTL1調控ESCCs中m7G tRNA修飾、tRNA表達和mRNA翻譯
在作者的TRAC seq數據中,作者在可變環中發現了19個m7G修飾的帶有ABGWY基序序列的tRNAs (Fig 3a)。METTL1的消耗顯著降低了m7G修飾水平(Fig 3b,c),RNA質譜也證實了METTL1中tRNA m7G修飾水平的降低。作者的RNA質譜也證實了METTL1敲除細胞中tRNA m7G修飾水平的降低(Fig 3d)。此外,METTL1的缺失降低了大多數m7G修飾的tRNAs的表達水平,而非m7G修飾的tRNAs,其表達幾乎沒有受到影響(Fig 3e,f)。與測序數據一致,作者的m7G Northern印跡雜交和Northwestern印跡雜交分析證實,在METTL1敲除細胞中,m7G修飾水平降低,m7G修飾的tRNAs表達降低 (Fig 3g)。此外,過表達野生型METTL1,而非其催化死亡突變體,增加了m7G tRNA的整體修飾水平和m7G修飾的tRNA的表達(Fig 3h),證實METTL1通過其tRNA m7G甲基轉移酶活性調控tRNA的修飾和表達。同樣,抑制WDR4導致m7G修飾水平和m7G修飾的tRNA表達下降;WDR4的過表達增加了K150和K30 ESCC細胞中m7G tRNA修飾和m7G修飾的tRNA 的表達(Fig 3i,j)。這些數據支持了METTL1/WDR4在調控tRNA m7G修飾和表達中的基本功能。
鑒于tRNAs在mRNA翻譯中起作用,作者接下來確定METTL1是否對ESCC細胞mRNA翻譯有影響。多聚體分析表明,在METTL1敲低細胞中mRNA翻譯活性降低,反映在多聚核糖體峰減少(Fig 3k)。 此外,嘌呤霉素攝取量測定也證實了這一點。ESCC細胞中METTL1基因的敲除降低了mRNA的翻譯活性(Fig 3L)。在METTL1缺失的細胞中,重新表達野生型METTL1而不是突變型METTL1可以挽救mRNA的翻譯效率(Fig 3l),證明m7G的催化功能對METTL1促進mRNA翻譯至關重要。總的來說,作者的數據表明,METTL1介導的m7G tRNA修飾對ESCC中tRNA的表達和mRNA的翻譯至關重要。
為了研究異常m7G修飾介導的翻譯障礙的影響,作者使用METTL1敲除和控制ESCC細胞進行了多核糖體結合mRNA測序(Fig 3m)。作者的數據顯示,翻譯效率(TEs)降低的mRNA有明顯更多的密碼子被m7G修飾的tRNAs解碼(Fig 3n)。Go和KEGG分析結果表明,下調的mRNA顯著富集在在自噬生物學過程和mTOR信號通路 (Fig 3o,p)。值得注意的是,與其他檢測到的mRNA相比,TEs降低,參與自噬生物學過程或mTOR信號通路的mRNA,有更多的密碼子被m7G修飾的tRNA解碼 (Fig 3q)。
接下來作者探討METTL1在調節自噬負調控和mTOR信號通路基因表達中的作用,結果顯示,METTL1減少了它們的蛋白質表達,但對它們的mRNA幾乎沒有影響(Fig 3r,s)。此外,多核糖體qPCR檢測進一步證實了RPTOR的翻譯效率(Fig 3I)。mTOR信號通路通過pULK1負調控自噬。研究發現,METTL1的消耗降低了pULK1的水平,增加了氯喹(CQ)處理和未處理的K150和K30細胞中LC3-II/LC3-I比例(Fig 3u,v)。總之,METTL1以m7G相關密碼子依賴的方式促進mTOR信號相關基因的翻譯和自噬通路的負調控。

Fig 3 METTL1調控tRNA m7G修飾、tRNA表達和致癌mRNA翻譯
4、 RPTOR是METTL1的重要下游靶點
作者進一步發現,RPTOR的重新表達挽救了METTL1衰竭的增殖和集落形成能力ESCC細胞(Fig. 4a–d)。此外,RPTOR過表達增加了ULK1蛋白的磷酸化水平,降低了METTL1耗竭細胞的LC3-II/LC3-I比值,并消除自噬通量(Fig. 4e–h)。總的來說,這些數據表明RPTOR是METTL1的重要下游靶點,進一步證實METTL1介導的tRNA m7G修飾通過調控RPTOR促進ESCC進展。
鑒于在METTL1敲除的ESCC細胞中,RPTOR可以挽救ULK1的磷酸化水平,減少自噬,作者接下來在METTL1敲除的ESCC細胞中敲除ULK1,以確定METTL1和RPTOR是否通過調節ULK1介導的自噬來促進ESCC進展(Fig. 4i)。數據表明,抑制ULK1可以挽救METTL1枯竭的ESCC細胞的生長(Fig. 4j),進一步證明METTL1和RPTOR通過ULK1調控ESCC的進展。此外,自噬通量檢測表明,敲除ULK1可以消除METTL1缺失的ESCC細胞中增加的自噬通量(Fig. 4k–m)。總的來說, RPTOR/自噬軸在介導METTL1在ESCC進展中的功能中具有重要作用。

Fig4 METTL1/RPTOR/ULK1軸在ESCC進展中起重要作用
5、METTL1的敲除(cKO)可在體內抑制ESCC的腫瘤發生
為了直接探究m7G tRNA修飾在體內ESCC腫瘤發生中的作用,作者構建了上皮組織特異性Mettl1條件敲除)小鼠模型(Keratin14-CreER; Mettl1fl/fl, cKO。用他莫西芬誘導Mettl1敲除后,用DNA烷基化劑二乙基亞硝胺(DEN)和多激酶抑制劑索拉非尼(sorafenib)誘導cKO小鼠和對照組小鼠發生ESCC腫瘤(Fig 5a)。在DEN治療8周,sorafenib治療12周后,作者發現對照小鼠的食道有明顯的病理改變,而metttl1 cKO小鼠的病變面積和ESCC數量明顯減少(Fig 5a–e)。組織學分析顯示,與對照組相比,cKO小鼠腫瘤組織中METTL1和Ki67染色水平降低(Fig 5f,g)。
作者還發現Mettl1 cKO降低了Mettl1 cKO小鼠腫瘤中m7G tRNA修飾,降低了RPTOR蛋白水平(Fig 5h-j),而RPTOR mRNA水平保持不變(Fig 5k)。值得注意的是,cKO組腫瘤中LC3蛋白水平明顯高于對照組(Fig 5l,m),cKO組的LC3蛋白水平明顯高于對照組,說明METTL1基因敲除導致體內自噬增加。

Fig5 敲除METTL1可抑制ESCC體內腫瘤發生
6、METTL1 /WDR4介導的m7G tRNA修飾促進 ESCC進展
為了進一步加強m7G tRNA修飾與ESCC進展之間的功能聯系,作者進行了功能獲得研究(Fig 6a)。數據表明,過表達野生型METTL1而非其催化死亡的突變體可以促進ESCC細胞的生長和集落形成 (Fig 6b–e)。此外,過表達而非突變的METTL1可以上調RPTOR蛋白的表達,減少細胞凋亡和自噬 (Fig 6f–i)。總之,METTL1在調節靶向表達和ESCC進展中,tRNA m7G的催化功能是必不可少的。
然后作者在ESCC細胞中過表達WDR4,進一步證實了作者的結論,m7G tRNA修飾促進了WDR4的表達ESCC進展。作者的數據顯示過表達WDR4穩定了METTL1蛋白的表達,增加了下游靶蛋白RPTOR的表達 (Fig 6j)。功能分析表明,過表達WDR4可促進ESCC細胞生長和集落形成 (Fig 6k–m)。這些數據說明ESCC進展中WDR4是一個重要的致癌基因。總之, MRTTL1 /WDR4介導的m7G tRNA修飾在調節ESCC進展中的重要致癌功能。
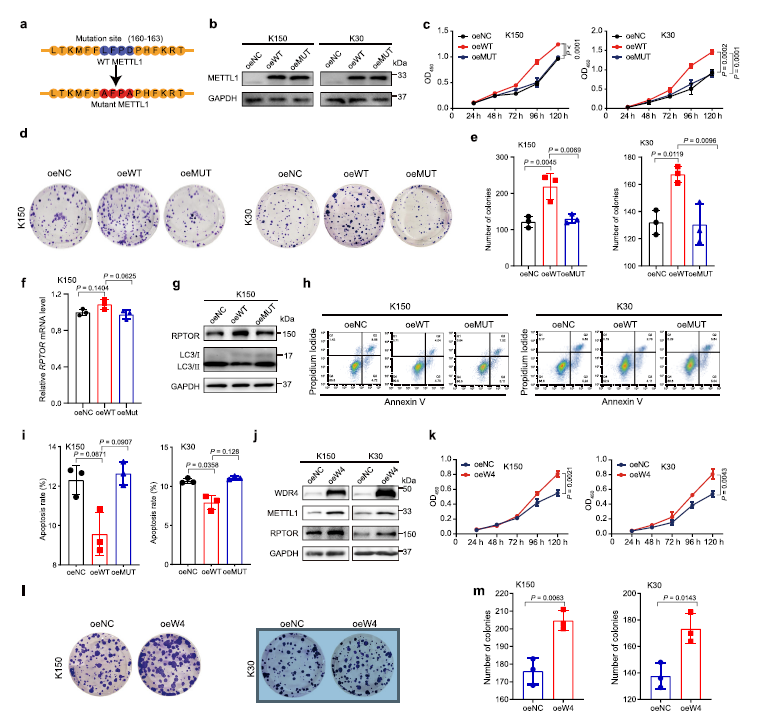
Fig 6 METTL1或WDR4過表達促進ESCC進展
7、METTL1在體內促進ESCC腫瘤的發生
在DEN/sorafenib治療18周后,Mettl1 CKI小鼠的食道出現了巨大的腫瘤負荷,而對照組小鼠的食道只出現了少量和小的病變(Fig 7a-c)。此外,CKI小鼠異常增生和鱗狀細胞癌的數量明顯高于對照組(Fig 7d–f)。組織學分析顯示,cKI小鼠腫瘤中METTL1表達水平和增殖活性均高于對照組(Fig 7g,h)。此外, cKI小鼠腫瘤中m7G tRNA修飾和m7G修飾的tRNA表達水平均高于對照組小鼠(Fig 7i)。此外,在Mettl1 cKI小鼠腫瘤中,RPTOR蛋白水平升高,但其mRNA水平沒有升高(Fig 7j–m)。綜上所述,METTL1和m7G tRNA修飾促進了ESCC體內腫瘤的發生和發展。

Fig7 METTL1過表達促進ESCC體內腫瘤發生
本研究揭示了METTL1介導的ESCC腫瘤發生的機制,發現METTL1/WDR4介導tRNA m7G修飾在選擇性致癌mRNA翻譯和ESCC進展中發揮著重要的生理功能,為建立新的ESCC治療策略提供了分子基礎。
參考文獻:
Han H, Yang C, Ma J, Zhang S, Zheng S, Ling R, Sun K, Guo S, Huang B, Liang Y, Wang L, Chen S, Wang Z, Wei W, Huang Y, Peng H, Jiang YZ, Choe J, Lin S. N7-methylguanosine tRNA modification promotes esophageal squamous cell carcinoma tumorigenesis via the RPTOR/ULK1/autophagy axis. Nat Commun. 2022 Mar 18;13(1):1478. doi: 10.1038/s41467-022-29125-7. PMID: 35304469.






