SUMOylation抑制增強多發性骨髓瘤對地塞米松的敏感性
多發性骨髓瘤(MM)是一種漿細胞惡性腫瘤。地塞米松(Dex)是MM治療中使用最廣泛的治療藥物,但患者會產生Dex耐藥性,從而導致疾病的進展,因此迫切需要研究Dex耐藥的驅動機制,并開發新的試劑來解決這一問題。目前有研究認為SUMO化修飾是調節Dex抗性的潛在機制,而抑制SUMO化修飾可以增強MM對Dex定的敏感性。該研究發表在《Journal of Experimental & Clinical Cancer Research》,IF:11.161。
技術路線:

主要研究結果:
1. 在原發病人樣本和細胞系中,抑制SUMOylation增強Dex抗MM的活性
作者前期通過數據庫和文獻得到MM漿細胞中較高的SUMO E1(UBA2)基因表達與更短的存活時間相關。隨后觀察到UBA2表達水平與Dex IC50s呈顯著正相關,提示UBA2表達與MM細胞Dex耐藥相關(圖1A)。
用TAK-981(一種新型的選擇性SUMO E1酶小分子抑制劑)處理MM1S細胞,檢測SUMOylated蛋白(圖1B)。TAK-981以劑量依賴的方式抑制整體SUMOylation,并誘導凋亡標志物cleaved PARP。然后,測試TAK-981單藥和Dex聯合治療對MM的影響。在從復發骨髓瘤患者分離的原發MM細胞中,TAK-981聯合Dex治療比單藥治療顯著增強了對MM細胞的殺傷力 (圖1C)。進一步的細胞毒性實驗發現TAK-981與Dex在MM1S和MM1R細胞株中均有協同作用(圖1D)。Dex對MM1R細胞的誘導凋亡和抑制增殖作用有限。相比之下,TAK-981在兩種細胞系中誘導細胞凋亡并降低細胞活力,與Dex聯用后效果進一步增強(圖1E)。瞬時敲除SAE2、UBC9可顯著提高MM1R細胞Dex敏感性(圖1F)。穩定敲除SAE2、UBC9的細胞對Dex處理均表現出顯著的反應,MM1R cells的IC50s值均下降(圖1G)。這些數據表明,SUMOylation與Dex抗性有關,抑制SUMOylation增強了Dex敏感性
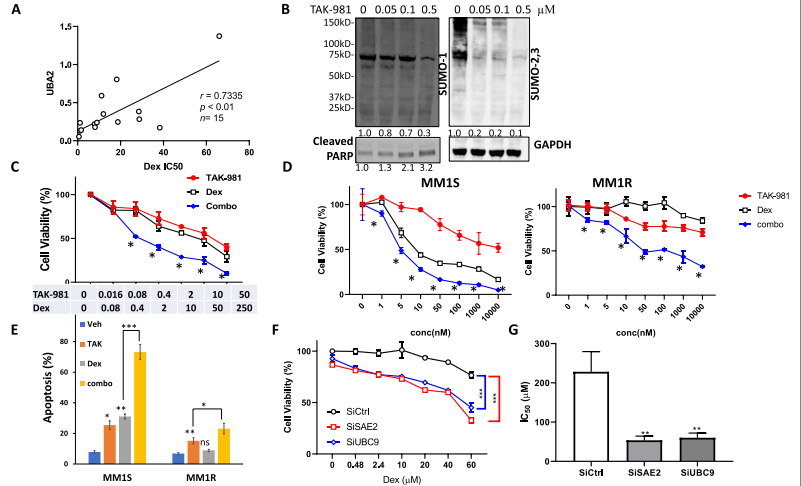
圖1在原發性多發性骨髓瘤細胞和MM細胞系中,抑制SUMOylation與Dex協同降低細胞活力
2. TAK-981在體內顯示出抗MM活性
通過構建小鼠兩種異種移植模型,發現與對照組相比,TAK-981治療組小鼠骨髓瘤負擔顯著降低(圖2A-B)。另外,與體外實驗一致,Dex單獨治療不影響腫瘤生長,而TAK-981與Dex聯合治療時,能顯著抑制腫瘤生長,進一步降低腫瘤負荷(圖3C)。免疫組化染色分析表明Dex單獨處理幾乎沒有誘導細胞凋亡,而TAK-981處理組明顯誘導cleaved PARP表達,Dex聯合處理后cleaved PARP表達水平更高(圖2D)。結果表明,TAK-981具有較強的體內抗MM活性。
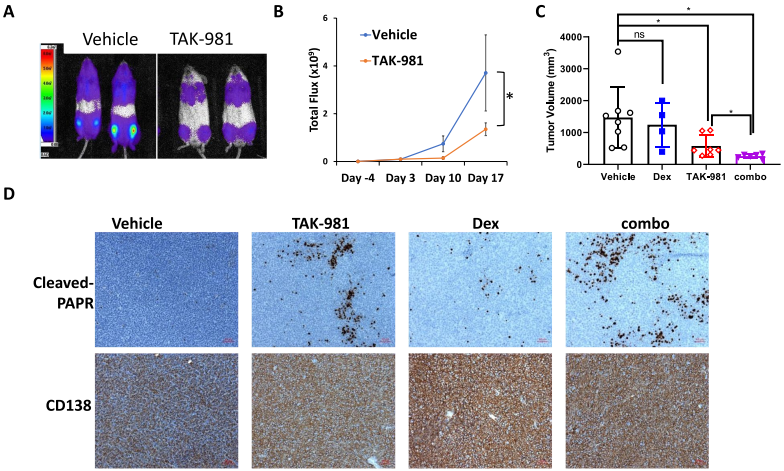
圖2 TAK 981在體內抑制MM腫瘤生長并與Dex協同作用
3. 抑制SUMOylation通過下調miR-130b上調GR來提高Dex的敏感性
有報道稱GR的表達是Dex反應的主要機制,并與MM患者較好的預后有關。研究發現GR表達與原代MM細胞Dex IC50s值呈負相關 (圖3A)。基于SUMOylation抑制增強了Dex的敏感性,進而評估抑制SUMOylation對GR表達的影響:在TAK-981治療48小時后,劑量依賴性GR (NR3C1) mRNA上調(圖3B)。據報道,通過靶向3’-UTR下調GR mRNA水平的miR-130b,在相同的原代MM細胞中,經TAK-981處理后顯示出劑量依賴性降低(圖3C)。在TAK-981處理的原代MM細胞中也誘導了GR蛋白水平(圖3D)。在MM1S和H929細胞系中觀察到類似的GR水平誘導和miR-130b降低(圖3E和F)。TAK-981降低了MM1S和H929細胞中RRM2水平,并進一步協同降低Dex對RRM2的降低。相應的誘導凋亡標志物cleaved PARP(圖3G),表明TAK-981對Dex細胞毒性的增強與GR regulated RRM2的抑制有關。SAE2水平較低(Sumoylization low)的患者GR抑制基因RRM2表達較低,GR激活基因RASD1水平較高。該分析支持了表明SUMO化抑制上調GR途徑。
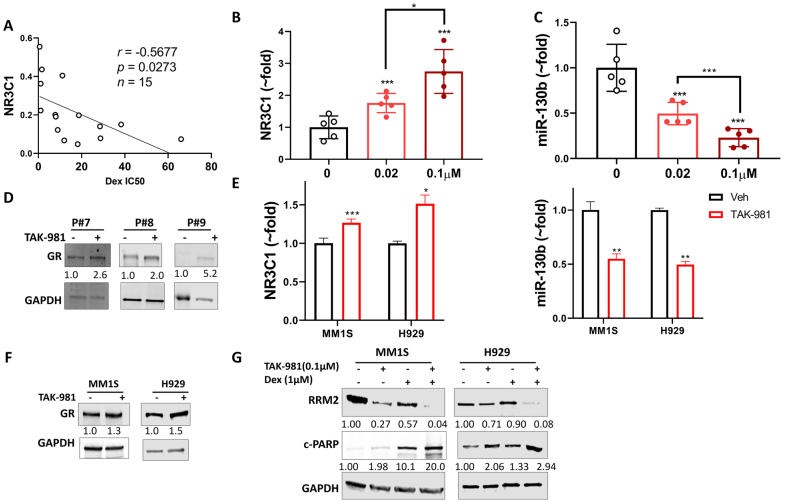
圖3 TAK-981通過下調miR-130b上調原發性多發性骨髓瘤和細胞系中GR的表達
4. 抑制SUMOylation通過調控miR-551b和miR-25提高了MM對Dex的敏感性
miR-mimic轉染后,過表達miR-551b和miR-25可促進MM細胞增殖并降低MM1S細胞的Dex敏感性,IC50s增加約4倍(圖4A-B)。miR抑制劑轉染miR-551b和miR-25后,miR-551b和miR-25的下調抑制了MM1R細胞的生長并增強了Dex敏感性,IC50s從875 μM下降到193和142 μM(圖4C-D)。這些數據表明,miR-551b和miR-25的表達可能與MM對Dex的耐藥有關。
由于PJA1和ZNF280C在MM細胞中沒有大量表達,因此ZFP36成為miR-551b的唯一潛在靶點。ZFP36編碼的tristtrprolin (TTP)是一種RNA結合蛋白,通過破壞Cyclin D1和E2F1 mRNA的穩定性在癌細胞增殖中發揮重要作用。通過轉染miR-551b inhibitor下調miR-551b水平,導致TTP水平升高,Cyclin D1和E2F1水平下降(圖4E)。ZFP36與miR-551b在初次MM樣本中的表達呈負相關(圖4F),進一步表明miR-551b調節ZFP36的水平。miR-25的下調顯著提高了ULK1的水平。敲低miR-25導致p27水平升高,這與MM初發樣本中p27 mRNA水平與miR-25呈負相關的觀察結果一致(圖4G-H)。
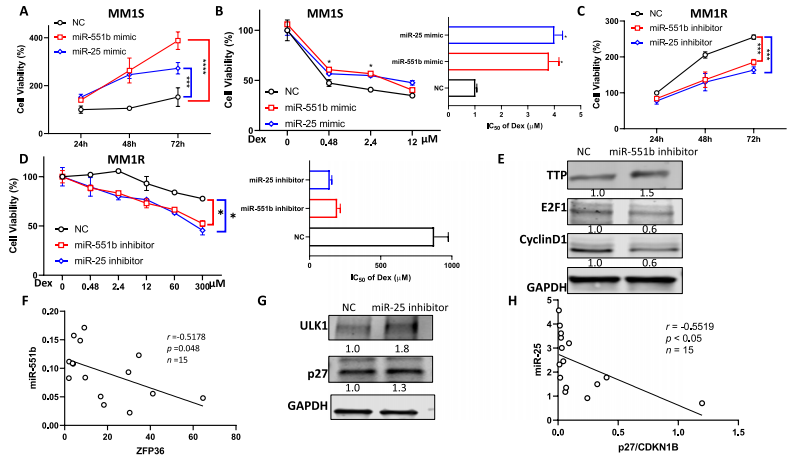
圖4 MiR-551b和MiR-25水平對MM Dex敏感性的影響
MM1R細胞的miR-551b和miR-25水平高于MM1S(圖5A)。Dex處理降低了MM1S中這兩種miRs的水平,但對MM1R沒有影響,而TAK-981處理降低了MM1S和MM1R細胞系中這兩種miRs的水平,并在與Dex聯合時進一步降低(圖5A)。通過siRNA瞬時轉染,SAE2或UBC9的下調降低了MM1R中miR-551b和miR-25的水平(圖5B)。另外,與細胞實驗結果一致,TAK-981治療組miR-551b和miR-25水平降低,并在MM1R異種移植瘤組織中聯合Dex治療后進一步降低(圖5C)。用不同濃度的TAK-981、miR-551b和miR-25處理5個原始MM樣本,其水平均呈劑量依賴性顯著降低,表明SUMOylation對miR-551b和miR-25的調控并不局限于細胞系(圖5D)。并且TAKU-981誘導miR-551b靶基因TTP表達,導致MM1R細胞Cyclin D1和E2F1降低,誘導miR-25靶基因ULK1和p27的表達(圖5E)。RNA-seq的GSEA分析顯示,TAKU-981影響細胞周期、凋亡和自噬基因集(圖5F),提示可能是通過這些基因靶向microRNAs- miR-551b和miR-25水平來達到作用。SAE2水平低的患者(UBA2;UBA2low組)的ZFP36(miR-551b靶基因)和ULK1(miR-25靶基因)水平高于SAE2水平高的患者(UBA2;UBA2high組)(圖5G)。該分析進一步支持了SUMOylation調控miR-551b, miR-25及其靶基因的表達。
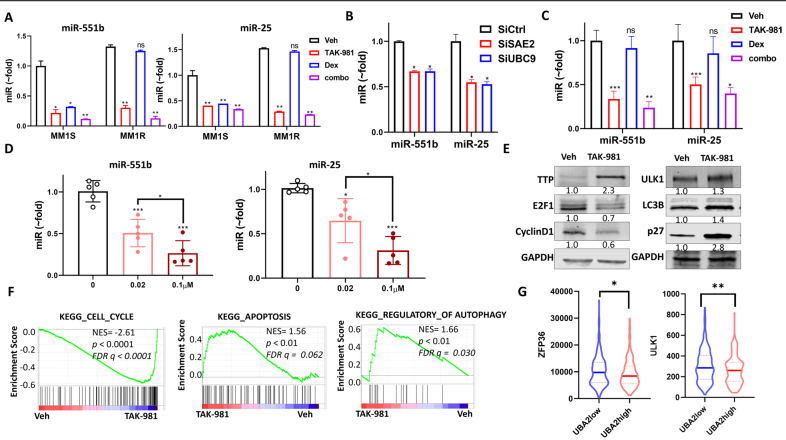
圖5抑制SUMOylation降低miR-551b和miR-25水平
5. 抑制SUMOylation通過c-Myc降低miR-551b、miR-25和miR-130b的表達
在MM1S細胞中,c-Myc誘導的miR-551b、miR-25和miR-130b的pri-miR水平的增加可通過添加TAK-981處理來抑制(圖6A)。在MM1S細胞中siRNA轉染c-Myc (siMyc)導致pri-miRs和成熟miR水平顯著降低(圖6B)。在Dex誘導的c-Myc敲低后,pri-miRs和成熟miRs下降(圖6C)。TAK-981處理顯著降低了MM1S和MM1R細胞中這些miRs啟動子區域c-Myc結合的占用率(圖6D),證明SUMOylation通過c-Myc結合到啟動子區域來調節這些miRs的轉錄。Dex在MM1S細胞中對c-Myc的結合略有降低,而在MM1R細胞中對c-Myc的結合無影響,說明這些miRs參與了MM對Dex的敏感性。通過觀察15例復發患者原發MM細胞中c-Myc和SAE2水平與miR-551b、miR-25和miR-130b的表達之間的顯著正相關,qPCR進一步證實了miR-551b、miR-25和miR-130b對MM細胞c-Myc和SAE2的調控(圖6E-F)。這些都表明,SUMOylation通過介導c-Myc調控miR-551b、miR-25和miR-130b的表達。
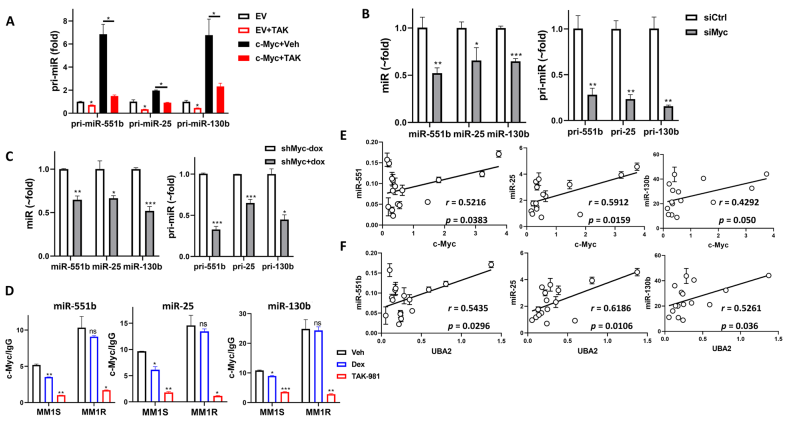
圖6 c-Myc是miR-551b、miR-25和miR-130b的主要轉錄因子
6. 抑制SUMOylation降低了c-Myc水平
Dex降低了Dex敏感的MM1S細胞中的c-Myc蛋白,但對MM1R細胞沒有影響。然而,TAK-981處理顯示MM1S和MM1R細胞系中的c-Myc蛋白均減少,并且與Dex聯合使用時導致進一步減少(圖7A)。GSEA顯示TAK-981處理抑制了MM1S和MM1R細胞中Myc靶基因集,TAK-981和Dex聯合處理比單獨處理Dex更能抑制Myc靶基因集(圖7B)。并且TAK-981處理MM1R細胞后,c-Myc蛋白水平呈時間依賴性下降(圖7C)。與對照相比,TAK-981處理后的骨髓瘤細胞中c-Myc下降更快(圖7D),表明抑制SUMOylation通過增強c-Myc的降解而下調了c-Myc。另外,western blot結果顯示,TAK-981處理后,SUMOylation的c-Myc明顯減少(圖7E)。這些結果證明了c-Myc可通過直接SUMOylation進行調控。
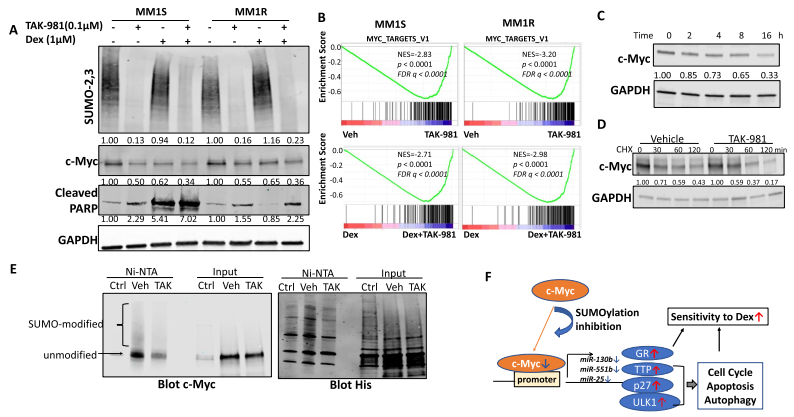
圖7 抑制SUMOylation通過調節蛋白穩定性降低了c-Myc蛋白水平
結論
該研究發現,SUMOylation抑制通過增加GR,降低miR-551b和miR-25,提高了MM對Dex的敏感性。SUMO E1抑制劑TAK-981大大提高了MM細胞系、原代樣本和小鼠異種移植模型對Dex的敏感性。TAK-981與Dex聯用具有明顯的體內外協同抗MM作用。






