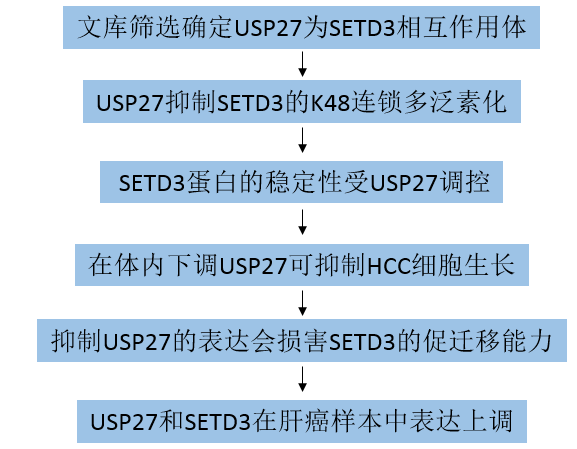
去泛素酶USP27通過穩定SETD3促進細胞增殖和肝細胞癌進展
組蛋白甲基轉移酶SETD3在各種生物事件中發揮著重要作用,其失調常與包括癌癥在內的人類疾病有關。然而,潛在的監管機制仍然難以捉摸。近日,有文獻報道了泛素特異性肽酶27 (USP27)通過與SETD3特異性相互作用,負向調節其泛素化作用,并增強其穩定性,從而促進腫瘤細胞的生長。該研究于2022年1月發表在《Cellular and Molecular Life Sciences》,IF:9.621。
技術路線:
主要研究結果:
為了確定SETD3在肝臟腫瘤發生過程中異常表達的分子機制,利用DUB文庫篩選SETD3相互作用的蛋白,該蛋白可能與SETD3的異常調控有關。通過免疫沉淀和western blot檢測所示,SETD3被USP27拉下,SETD3也可以拉下USP27,說明USP27是真正的SETD3交互伙伴(圖1A和B)。內源性SETD3是否與Hep3B細胞中的USP27相互作用:在anti-USP27中檢測到SETD3,但在正常兔IgG免疫沉淀中未檢測到(圖1C)。此外,體外GST pull-down、PLA兩個實驗均證實了USP27與SETD3相互作用(圖1D-F)。最后,通過突變體確定了USP27與SETD3之間的相互作用區域:USP27的C端UCH域(圖1G-I)。此外,突變分析表明,SETD3與USP27的相互作用需要RSB域(圖1J)。綜上所述,這些數據表明USP27與SETD3相互作用。
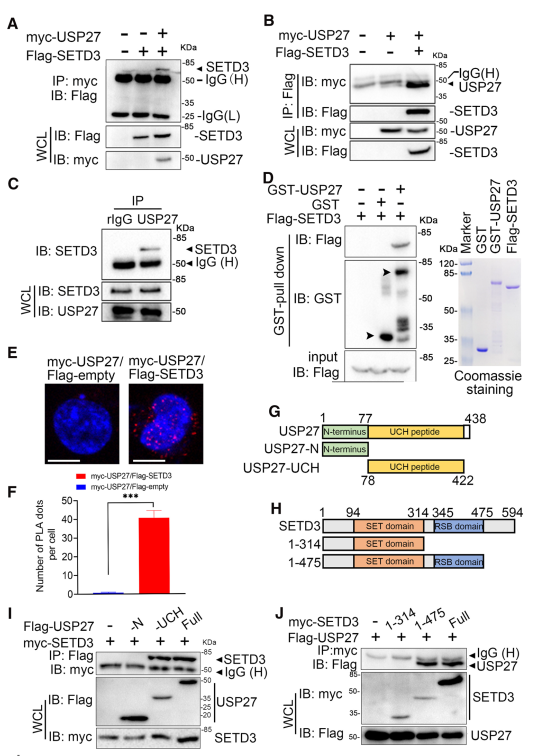
圖1 USP27與SETD3相互作用
由于USP27是一種DUB(去泛素化化酶),可能會保護其底物免受蛋白酶體介導的降解,接下來確定該DUB是否會從SETD3中去除泛素。如圖2A所示,在存在USP27表達的情況下,與SETD3連接的多聚素鏈被完全去除。與野生型(WT) USP27相比,USP27的酶活性突變體(C87A)未能消除SETD3蛋白的泛素化(圖2B和C),這意味著USP27需要DUB活性才能從SETD3中去除泛素。USP27介導的SETD3去泛素化是非常特異性的,因為USP39并沒有顯著影響SETD3去泛素化(圖2D)。此外,與shRNA對照相比,USP27表達的下調導致SETD3泛素化升高(圖2E)。因此,為了確定SETD3上的多聚泛素鏈的哪一種泛素連鎖是受USP27調控的,使用泛素突變體,其中只有位于11 (K11O)、48 (K48O)或63(K63O)位點的一個賴氨酸殘基可被泛素化。如圖2F所示,USP27過表達降低了SETD3的K48-連鎖泛素化,但對SETD3的K11-或K63 -連鎖泛素化無影響。總的來說,這些結果表明USP27是SETD3的一個真正的DUB,并以DUB活性依賴的方式去除SETD3的K48連鎖多泛素化。
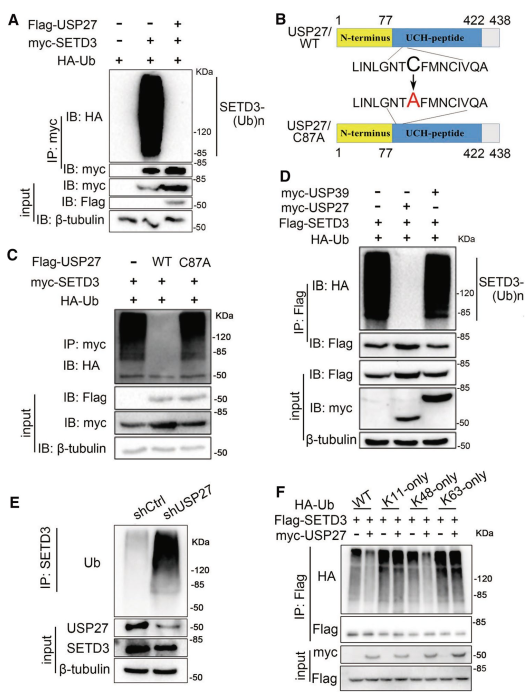
圖2 USP27抑制SETD3的K48連鎖多泛素化
3. SETD3蛋白的穩定性受USP27調控
之前研究發現USP27能夠促進SETD3在K48位點的去泛素化。為了研究這種翻譯后修飾是否促進了SETD3的穩定性,將SETD3表達構建物與空載體(EV)或USP27質粒共轉染293 T細胞,檢測SETD3在不同時間環己亞胺(CHX)作用下的蛋白水平。如圖3A、B所示,USP27共轉染顯著上調SETD3蛋白表達,USP27顯著延長SETD3蛋白的半衰期。此外,USP27的異位表達上調了內源性SETD3蛋白水平(圖3C和D)。USP27/CA突變體的催化活性不能保護SETD3免受降解(圖3E和F)。為了進一步證實USP27調節SETD3穩定性的觀點,在Hep3B細胞中敲除了USP27的表達,發現內源性SETD3蛋白水平比對照組下降得更快(圖3G和H)。此外,蛋白酶體特異性抑制劑MG132可以保護SETD3免受降解(圖3I, J)。說明SETD3蛋白降解是通過蛋白酶體途徑進行的。最后,在USP27過表達的Hep3B細胞中,SETD3 mRNA表達水平沒有明顯變化(圖3K),提示USP27可能在轉錄后水平調控SETD3蛋白降解。綜上所述,以上數據表明USP27可以正向調控SETD3蛋白的穩定性。

圖3 USP27促進SETD3穩定
4. SETD3逆轉USP27基因敲除介導的細胞增殖阻滯
由于USP27具有去泛素化和穩定SETD3的作用,可能通過調節SETD3蛋白水平來促進細胞增殖和遷移。為了驗證這個假設,首先評估了生物USP27在肝癌中的作用 (圖4)。如圖4 A和B所示, 敲除USP27明顯減少Hep3B和MHCC97H細胞的細胞生存能力。將SETD3引入USP27基因敲除細胞,可部分恢復其惡性表型,而這兩種蛋白的敲除均可顯著抑制細胞能力。集落形成實驗進一步證實,USP27在Hep3B或MHCC97H細胞中的穩定敲除顯著抑制了集落形成(圖4C-F)。此外,5-EdU顯示,USP27或SETD3的敲除與EdU標記細胞的顯著下降百分率相關。在USP27或SETD3敲除細胞中加入SETD3的表達可以部分逆轉(圖4G和H)。同樣,Ki67免疫熒光染色也證實了增殖下降,因為在USP27或SETD3敲除細胞中Ki67陽性增殖細胞的比例顯著降低。Ki67陽性細胞的增加也提示更多的G0靜止細胞在SETD3過表達后重新進入細胞周期,因為Ki67只在細胞周期的活動期而不是G0靜止期表達。這些結果也表明,隨著USP27或SETD3基因的下調,G0/G1期細胞部分的總大小增加,從而抑制細胞周期的進展。總的來說,這些發現表明USP27和SETD3對細胞增殖至關重要。
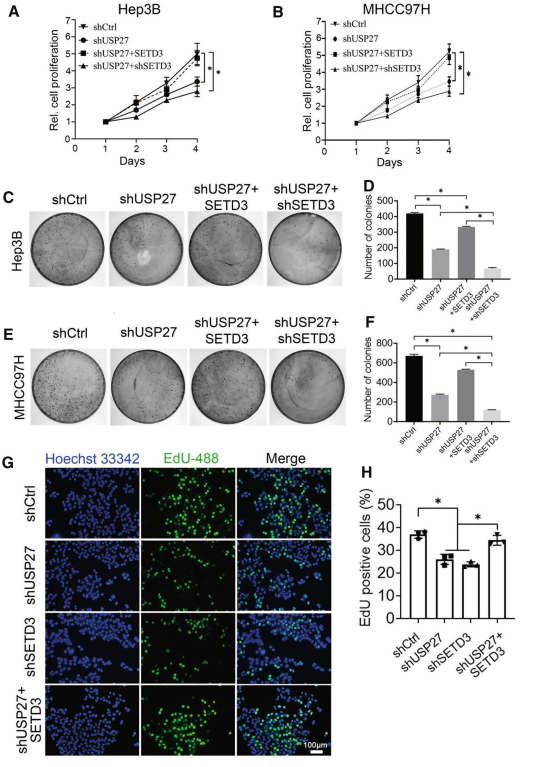
圖4抑制USP27表達可阻斷細胞增殖,延緩細胞生長
5. 在體內下調USP27可抑制HCC細胞生長
為了評價USP27和SETD3在體內對細胞生長的影響,將Hep3B細胞系皮下注射到裸鼠右側側腹建立異種移植模型。在腫瘤發展過程中,從注射后第6天開始每3天測量一次腫瘤體積,結果顯示USP27和SETD3敲除細胞的腫瘤生長均顯著下降(圖5A)。注射后27天,解剖腫瘤,拍照(圖5B)并稱重(圖5C)。USP27或SETD3敲除細胞產生的腫瘤明顯比對照細胞更小、更輕,而在USP27缺失細胞中過表達SETD3可恢復腫瘤生長。此外,通過Ki67染色檢測,USP27基因敲除細胞的腫瘤細胞活力也有所下降(圖5D)。這些結果表明,USP27的缺失也抑制了肝癌細胞的體內生長。

圖5體內下調USP27基因可抑制HCC細胞的生長
6. 抑制USP27的表達會損害SETD3的促遷移能力
由于SETD3的上調可促進肝臟腫瘤發生和腫瘤進展,因此USP27也可能通過穩定SETD3來增強轉移表型。為了探究USP27-SETD3軸在細胞遷移和侵襲中的作用,進行了創傷愈合實驗,結果表明,與對照細胞相比,SETD3或USP27基因的下調顯著抑制了細胞遷移。而將SETD3引入USP27基因敲低的細胞則部分恢復了轉移表型(圖6A-D)。Transwell侵襲實驗一致顯示,USP27和SETD3在Hep3B細胞(圖6E, F)和MHCC97H細胞(圖5G, H)的腫瘤侵襲中的作用類似。綜上所述,這些數據表明,USP27或SETD3的下調可以阻止肝癌細胞的遷移和侵襲。
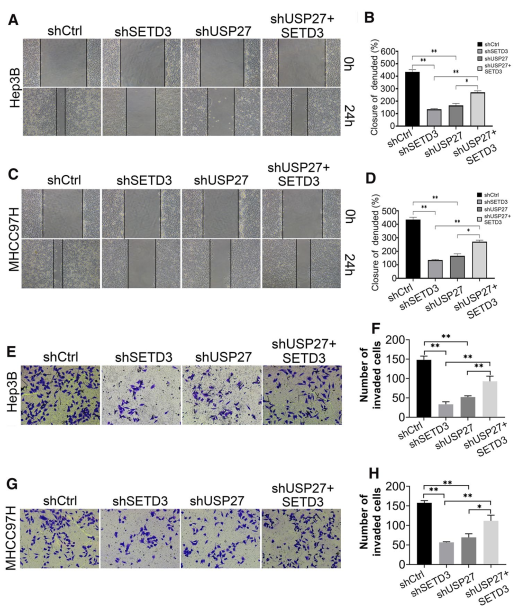
圖6 抑制USP27表達可損害肝細胞癌細胞中SETD3的促遷移能力
7. USP27和SETD3在肝癌樣本中表達上調
USP27-SETD3軸能夠促進細胞增殖和遷移,推測它們可能在肝細胞癌中表達上調。首先,使用western blot檢測了USP27和SETD3在HCC組織(n = 10)和匹配的相鄰正常肝組織(n = 10)中的表達水平(圖7A)。如圖7B所示:USP27與SETD3蛋白水平明顯上調且呈正相關。通過對肝癌組織和正常組織的免疫組化染色進一步檢測兩者之間的關系:與匹配的正常肝組織相比,SETD3和USP27在HCC組織中的表達水平顯著上調(圖7C)。根據患者的mRNA表達水平分為高表達組(高于正常組織平均水平)和低表達組(低于或等于正常組織平均水平),比較兩組患者的生存期:與低表達的患者相比,USP27高表達患者的5年生存率明顯降低(圖7D)。SETD3的分析也得到了類似的結果。基于以上研究結果,作者得出結論,SETD3被USP27去泛素化,其蛋白水平受到USP27表達的正調控,并與USP27表達相關。肝細胞癌患者USP27的上調導致SETD3表達升高,進而促進細胞增殖、侵襲、遷移和腫瘤發生。
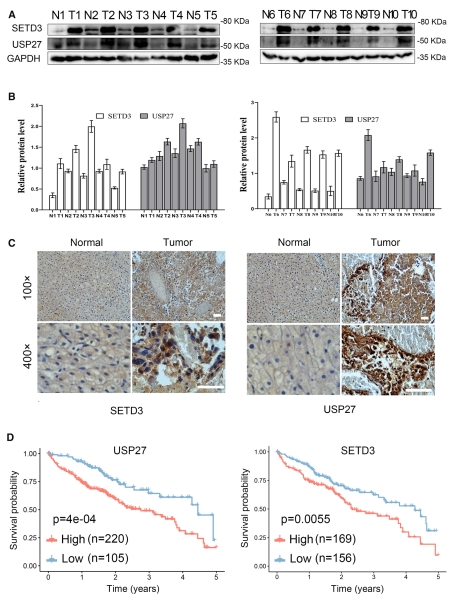
圖7肝細胞癌組織中USP27和SETD3表達上調
主要結論:
在這里,該研究闡明了通過USP27的翻譯后修飾對SETD3的動態調節(圖8)。首先發現USP27是Hep3B細胞中SETD3的相互作用伙伴。USP27能夠去泛素化并穩定SETD3。此外,體內外研究表明,USP27的缺失抑制了HCC細胞的增殖、侵襲、轉移和腫瘤發生,而SETD3的過表達挽救了這種表型。SETD3和USP27水平在HCC中明顯高于相關相鄰組織。利用TCGA和GTEx數據庫的數據,發現USP27和SETD3的表達水平與HCC患者的5年生存率呈負相關。總之,這項研究中的發現可以更好地理解USP27-SETD3軸在癌癥發展中的作用和分子機制,為癌癥治療提供新的策略。

圖8 USP27調節SETD3的模型示意圖
參考文獻:
Zou T, Wang Y, Dong L, Che T, Zhao H, Yan X, Lin Z. Stabilization of SETD3 by deubiquitinase USP27 enhances cell proliferation and hepatocellular carcinoma progression. Cell Mol Life Sci. 2022;79(1):70.






