通過IL6/JAK2/STAT3信號通路靶向小膠質細胞極化表型能減少NSCLC腦轉移
腫瘤相關的巨噬細胞已經成為轉移的關鍵因素。小膠質細胞是腦微環境不可或缺的組成部分,在腦轉移 (brain metastasis, BM) 中發揮著重要作用。然而,活化的小膠質細胞促進非小細胞肺癌(NSCLC)腦轉移的潛在機制尚不清楚。本研究純化了具有腦轉移傾向的細胞系,并利用共培養系統揭示了它們與小膠質細胞的通信。本文于2022年2月發表于《Signal Transduction and Targeted Therapy》,IF=13.493。
本文技術路線:
本文主要內容:
1. 腦轉移微環境下小膠質細胞表型的改變
為了探討小膠質細胞在非小細胞肺癌腦轉移中的作用,我們首先評估了幾種常用的EGFR野生型非小細胞肺癌細胞株(A549、H460、H292和H1299)的轉移能力(Fig 1a,b)。其中,A549細胞的侵襲和遷移能力最強,因此選擇A549細胞進行進一步研究。我們將A549細胞心內接種裸鼠,建立腦轉移模型。將轉移組和未接種對照組小鼠腦組織進行Iba-1染色,分析小膠質細胞的分布情況。與對照組相比,治療組腦轉移灶可見大量形態改變、樹枝狀化增強的小膠質細胞(Fig 1c)。同樣的,人NSCLC-BM標本Iba-1免疫組化染色顯示,活化的小膠質細胞浸潤于BM病灶附近(Fig 1d)。
為了研究NSCLC細胞與小膠質細胞的相互作用,我們進行了體外細胞實驗,用A549細胞(ACM)條件培養液(CM)刺激小膠質細胞,觀察其對不同時間點小膠質細胞形態的影響。24 h和48 h后,植株形態發生明顯變化,分枝形態轉變為叢生形態(Fig. 1e)。
為闡明ACM對特異性小膠質細胞活性的影響,用qRT-PCR分析了促炎M1標志物(iNOS和CD86)和抗炎M2標記物(CD206和ARG1)的表達。NOS和CD86的表達在12 h 上調, CD206、Arg1表達水平在24 h、48 h也上調了(Fig. 1f)。Western blot結果顯示,HMO6細胞在0 h時幾乎檢測不到iNOS和CD206水平,提示小膠質細胞處于靜止狀態(Fig 1g)。所有結果在NSCLC-BM患者樣品中中一致反映為CD206+小膠質細胞明顯多于iNOS+小膠質細胞(Fig 1h)。

Fig1 人NSCLC A549細胞中小膠質細胞表型改變
2. 抗炎小膠質細胞的腦轉移瘤促進非小細胞肺癌細胞定植
免疫熒光分析顯示,TGF-β1降低了E-cadherin在細胞突出連接處的表達,上調了vimentin的表達,而共培養CM (co-HCM和co-CCM)可以逆轉這一過程(Fig. 2a,b)。為了進一步驗證這些觀察結果,我們進行了qRT-PCR和western blot分析。結果表明,CM共培養可誘導間充質樣A549細胞和H292細胞MET(圖2c-f),E-cadherin上調、vimentin下調。這些結果表明,抗炎小膠質細胞足以對癌細胞進行重組,以獲得上皮表型,并促進轉移性定植。

Figure 2.M2 -小膠質細胞CM促進NSCLC細胞定植
3. 單細胞測序顯示A549細胞BM中存在激活的小膠質細胞
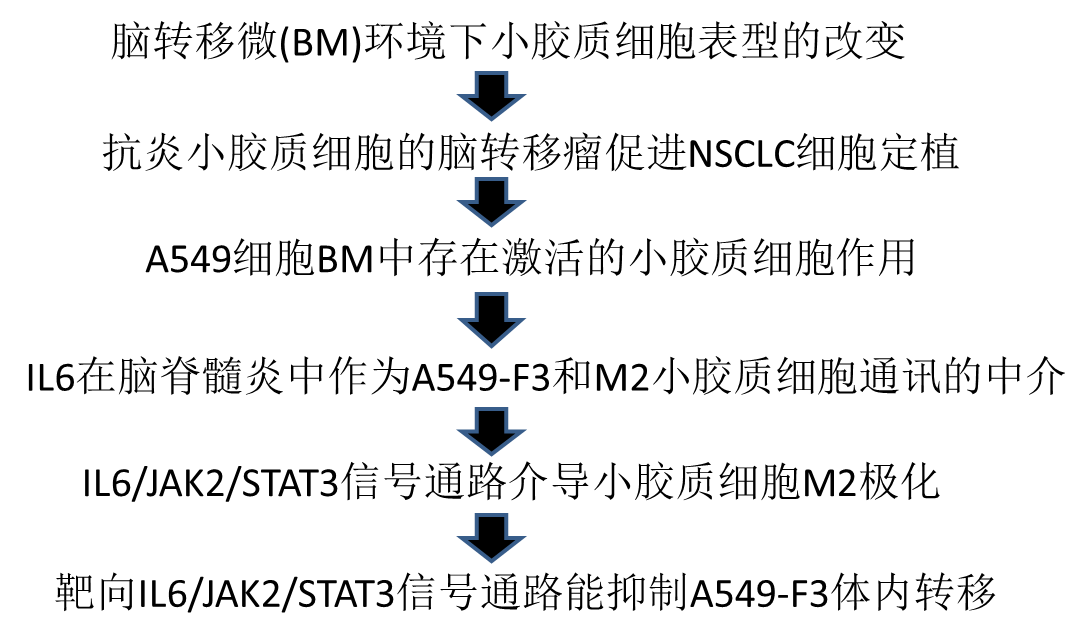
為了進一步闡明非小細胞肺癌BM細胞與激活的小膠質細胞之間的細胞通信的潛在機制,我們首先通過將A549細胞接種到雄性BALB/c nu/nu小鼠左心室中獲得了高腦轉移性NSCLC細胞(Fig 3a)。分別經過第一輪、第二輪和第三輪體內獲得提取的細胞A549-F1、A549-F2和A549-F3。值得注意的是,BM的發生率隨體內選擇數量的增加而增加,A549-F3細胞最終BM的發生率最高(63.6%;7/11)。BM發生率從F0時的10.0%增加到F1時的28.6%,在F0時增加到50.0% (Fig. 3b)。
為了表征激活的小膠質細胞參與腦轉移定植的特征,我們通過單細胞RNA-seq對小膠質細胞進行分類,并使用指數排序策略分析了轉移組和健康組大腦中細胞簇的差異,從而可以回顧性分析每個單個細胞的表面標記組合(Fig 3c)。共鑒定28165個細胞,其中A549-BM有11305個,A549-F3-BM有10459個,來自正常大腦組織的6401個。
接下來,我們分析了20個細胞群(0-19)(Fig. 3d)。絕大多數細胞為小膠質細胞(簇0,1,2,3,5,9,10,16,17,19),大多數細胞簇在A549和A549-f3細胞轉移病灶之間重疊(Fig 3e、f)。我們通過HeatMap隨機選擇100個細胞,分析了每個集群中差異基因的前10個,結果顯示,A549和A549- 3組中以特征性抗炎小膠質細胞為主,而對照組中抗炎和促炎小膠質細胞數量相近,維持平衡狀態(Fig 3g)。KEGG通路分析腦轉移瘤中小膠質細胞重疊簇。結果表明,JAK/STAT通路及其他幾個通路均顯著上調(Fig 3h)。已知JAK/STAT通路的上調與TAM的激活有關。在這些結果的基礎上,我們在體內證實了M2小膠質細胞在NSCLC-BM中的存在。
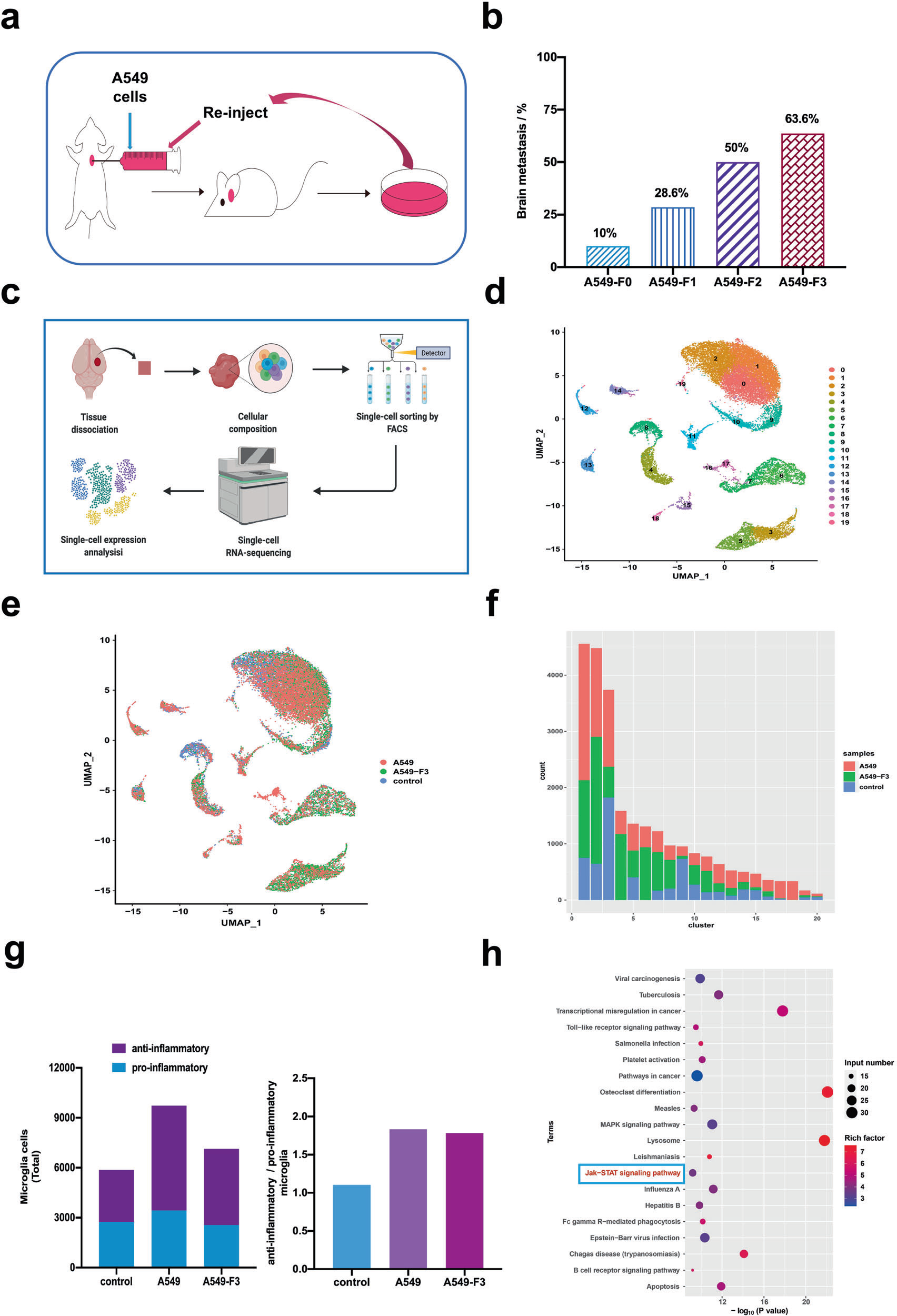
Figure 3 單細胞RNA-Seq揭示轉移性病變中活化的小膠質細胞
4. IL6在腦脊髓炎中作為A549-F3和M2小膠質細胞通訊的中介
比較轉錄組芯片分析被用來比較A549-F3細胞、A549-F0細胞與HMO6小膠質細胞與親本A549細胞共培養時的高轉移性基因的全基因組表達譜。結果顯示,腦脊髓瘤衍生的差異表達基因(DEGs)有4857個A549-f3細胞,共培養的A549細胞中有1769個DEGs (Fig. 4a,b)。為了進一步優選候選基因,我們在標準化數據的基礎上,使用兩組基因芯片進行相關分析,得到維恩圖(Fig 4c)。對前30個DEGs進行進一步分析(Fig.4d)。在A549-F3及共培養細胞中,IL6上調最顯著(Fig 4e)。
qRT-PCR和Western blot結果證實A549-f3和共培養的A549細胞中IL6表達升高(Fig 4f,g)。此外,ELISA檢測顯示與A549細胞培養相比,A549- F3細胞中IL6水平較高(Fig 4h)。為了證實IL6對BM的影響,將A549-F3/mock或IL6/敲除細胞注射到裸鼠體內(Fig 4i)。四周后,利用體內BLI信號檢測轉移活性。il-6的下調降低了BM的發生率,從58.3%(7 / 12)降至38.5%(5 / 13),轉移病灶的光子通量也較弱(Fig. 4j,k)。這些結果提示了IL6在A549-F3 BM中的重要性,并提示了IL6相關信號的參與。

Figure 4 IL6是BM中A549-F3和M2小膠質細胞通訊的中介
5. IL6/JAK2/STAT3信號通路介導小膠質細胞M2極化
在添加F3-CM或iL- 6的培養基中加入不同濃度的托珠單抗后,HMO6和CHME5細胞中CD206和Arg1的表達水平下降(Fig 5a). 接下來分析JAK/STAT通路成員如JAK1、JAK2、STAT3和STAT1的表達水平。發現可以通過添加IL6或F3-CM刺激HMO6或CHME5細胞,而在托珠單抗治療的情況下磷酸化的JAK2和STAT3水平均降低(Fig 5b)。為研究M2極化中的JAK2/STAT3 信號,我們用JAK2抑制劑菲卓替尼治療HMO6或CHME5細胞。不出所料,在IL6或菲卓替尼存在的情況下,JAK2/STAT3活性被抑制(Fig 5c),綜上所述,這些結果表明F3-CM誘導的M2極化需要IL6/JAK2/STAT3信號的激活。隨后,我們研究了STAT3是否可以直接調控ARG1或CD206的表達。使用生信軟件來預測和鑒定ARG1基因含保守的STAT3結合位點的啟動子區域包,我們選擇最保守的結合位點(#1)進行詳細分析(Fig 5d)。STAT3的過表達導致腫瘤的ARG1-promoter-WT報告基因表達增加,但未增加ARG1-promoter-MT報告基因的表達(Fig 5e)。接下來,在CHME5細胞中進行染色質免疫沉淀(ChIP)-PCR分析,以確定ARG1啟動子激活的精確序列。免疫沉淀后,推測的STAT3結合位點(-1108 ~ -1098 bp)顯著富集,而陰性對照IgG抗體則無明顯條帶(Fig 5f)。qRT-PCR結果顯示,在CHME5細胞中,蛋白/ARG1基因復合物被抗STAT3抗體拉下(Fig 5g)。總之,ARG1可能是STAT3的潛在靶基因,介導il6誘導的M2極化。

Fig 5. IL6/JAK2/STAT3信號通路介導小膠質細胞M2極化
6. 靶向IL6/JAK2/STAT3信號通路能抑制A549-F3體內轉移
體外數據表明IL6在M2極化中的關鍵作用,于是作者提出抑制IL6是否可以抑制小膠質細胞中JAK2/STAT3信號通路的活性,從而降低A549-F3腦轉移的問題。將裸鼠分成四組,將A549-F3細胞注入左心室建立骨髓。此后,四組小鼠均給予托珠單抗(5mg /kg)腹腔注射,每周1次,每日給予PLX5622(抑制劑與磷酸鹽緩沖鹽水聯合)12000 mg/kg治療,注射PBS作為對照。實時成像顯示,托珠單抗治療組BM發生率為38.5%(5 / 13),對照組為70.0%(7 / 10),而聯合治療組BM發生率高于托珠單抗治療組(50.0%,5 / 10) (Fig 6a, b)。與此結果一致的是,轉移灶的總BLI信號強度在單抗治療組是最低的(Fig 6c)。在結束時,治療組BM負擔顯著低于對照組(45.5%[5 / 11],而對照組為70% [7 / 10]),并伴有轉移灶較低的發光(Fig 6d-f).
為了進一步證實IL6在NSCLC-BM中的臨床價值,采集了120例非NSCLC患者的外周血標本,并評估了血清IL6水平預測BM的可行性。根據IL-6水平分為兩組(n = 120)。隨訪28個月后,分析兩組腦脊髓炎的差異。結果發現兩組有不同的腦轉移率,iL-6水平較高的組有更高的腦轉移風險 (Fig 6g). 雖然由于隨訪時間有限,無法獲得生存數據,但TCGA數據顯示IL6水平低的NSCLC患者(n = 318,中位生存時間=21.87個月)的總生存期長于il - 6高的患者(n = 314,中位生存時間= 26.33個月;P = 0.0006) (Fig.6h)。
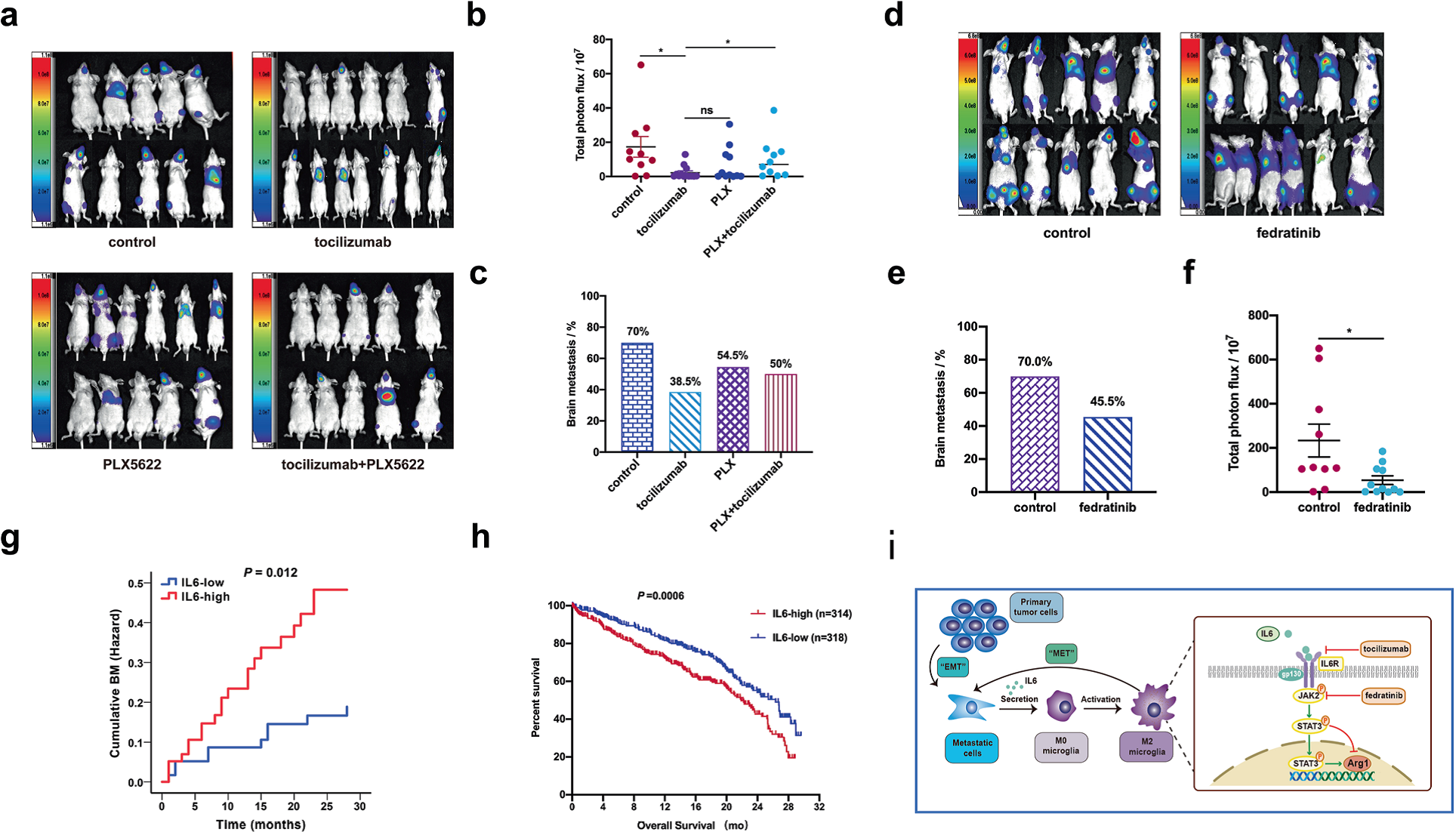
Fig6 靶向IL6/JAK2/STAT3信號通路抑制A549-F3體內轉移
本研究闡明了腦轉移細胞(A549-F3)和活化的M2 -小膠質細胞之間的相互交流機制。強調了NSCLC-BM中IL6是BM發生的一個預后因素,也是一個潛在的預防治療靶點。提出可以通過IL6/JAK2/STAT3信號通路調控小膠質細胞表型,探索了新的潛在的預防和治療方法。
參考文獻:
Jin, Y., et al., Targeting polarized phenotype of microglia via IL6/JAK2/STAT3 signaling to reduce NSCLC brain metastasis. Signal Transduct Target Ther, 2022. 7(1): p. 52.






