“線粒體學—自噬”強強聯手打造高分文章
腎小管上皮細胞(RTECs)是最富線粒體的細胞類型之一,因而容易發生線粒體失調事件,這也被認為是糖尿病腎病(DN)中腎小管損傷的關鍵事件。然而,其潛在機制仍在很大程度上未知。在此,我們研究了腫瘤壞死因子α誘導蛋白8-like 1 (TNFAIP8L1/TIPE1)在高糖(HG)誘導的RTECs和DN進展中的線粒體功能障礙中的作用和機制。本研究于2022年4月發表在《Redox Biology》IF:11.799期刊上。
技術路線:

主要實驗結果:
為了初步評估TIPE1在DN中的潛在作用,作者首先分析了TIPE1在Nephroseq數據庫DN患者中表達,結果顯示,相比于健康組,TIPE1在DN組的表達顯著升高(Fig. 1A),免疫組化進一步確認了該結果(Fig. 1B)。免疫熒光染色顯示TIPE1表達主要在DN患者和小鼠的腎小管上皮細胞中觀察到(Fig. 1C- D)。Western blot和RT-qPCR分析進一步驗證了TIPE1在DN小鼠腎組織中的表達上調,這與腎小管損傷標志物KIM1的水平升高相吻合(Fig. 1E–G)。與此一致,在HK-2細胞中,不同濃度(20 mM、40 mM)葡萄糖和不同時間點(24 h、48 h)誘導后TIPE1表達上調,同時KIM1、N-cadherin、α-SMA表達上調(Fig. 1H–J)。這些結果說明TIPE1在DN患者和小鼠的RTECs中顯著上調并可能參與DN的發病機制。
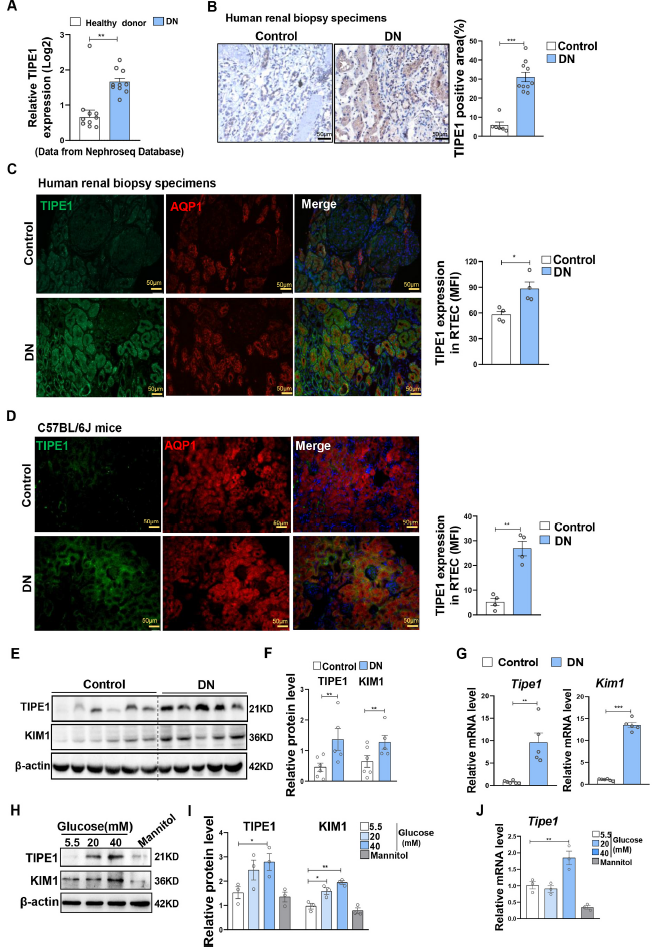
為了進一步評估TIPE1在DN進展中腎小管上皮細胞中的功能,作者構建了腎小管上皮細胞特異性敲除TIPE1的小鼠(T1KO)(Fig. 2A-B)。Tipe1缺失降低了尿蛋白的含量(Fig. 2C)并顯著減輕了STZ誘導的腎小管損傷(Fig. 2D)和腎小管損傷標志蛋白的表達,如KIM1和NGAL(Fig. 2E-G)。腎小管間質中細胞外基質(ECM)蛋白的過度沉積是DN進展的關鍵事件。因此,進一步評估腎小管細胞間質纖維化和EMT的程度。Tipe1缺失導致膠原積累減少,以Sirius染色和α-SMA的表達表征(Fig. 2H-I)。一致的,STZ處理后Tipe1缺失小鼠間充質細胞標志物vimentin、N-cadherin和TFs表達顯著下調,E-cadherin表達升高(Fig. 2J-L)。這些結果表明RTECs中Tipe1缺失可減輕糖尿病腎損傷和纖維化。

圖2 RTECs中缺乏Tipe1可減輕糖尿病腎損傷和纖維化。
作者使用人腎小管上皮細胞HK-2進一步驗證了TIPE1在HG誘導腎小管損傷中的作用。與體內實驗結果一樣,在HG誘導下,相比于Lv-NC,慢病毒攜帶Tipe1 shRNA (Lv-shTipe1)顯著降低了HK-2細胞中KIM1的表達(Fig. 3A and B)。一致地,在HK-2細胞中,沉默Tipe1也下調了間充質細胞標志物和TFs的表達,但上調了上皮標志物的表達,尤其是在HG條件下(Fig. 3C–E)。總之,這些結果強烈支持TIPE1表達促進腎小管細胞損傷、EMT和腎纖維化,從而加速DN進展的觀點。
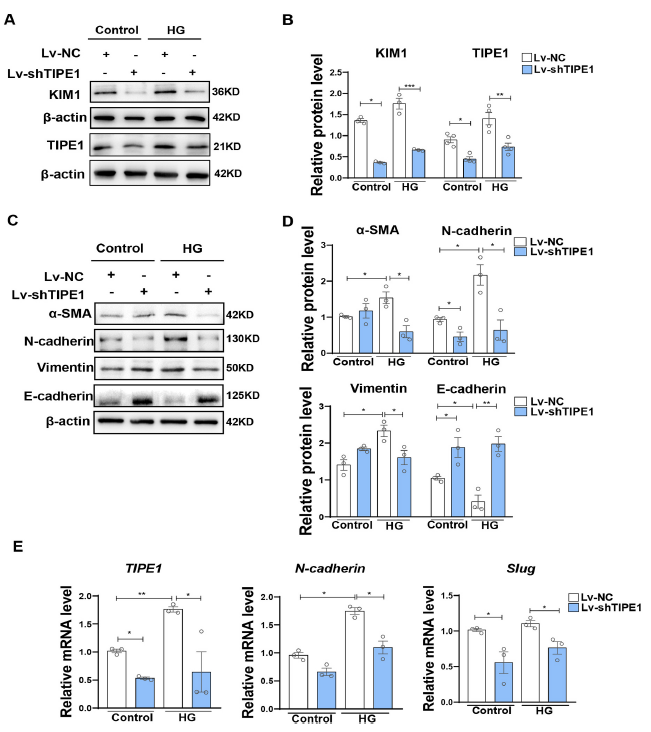
圖3 敲除TIPE1可改善HG環境下HK-2細胞損傷和EMT
3、在HG環境下Tipe1缺乏可改善線粒體穩態并減少RTECs的凋亡
為了探究TIPE1調控HG誘導損傷和EMT進程的分子機制,對野生型和TIKO突變型的STZ誘導的DN鼠的腎皮質進行轉錄組測序,總計篩選到1166個差異表達基因(DEGs)。對這些DEGs進行GSEA分析,與WT小鼠相比,T1KO小鼠的腎皮質組織中與三羧酸(TCA)循環相關的基因正富集(Fig. 4A)。一致地,T1KO小鼠腎組織中的ATP水平高于WT小鼠(Fig. 4B)。透射電鏡顯示,STZ誘導T1KO小鼠RTECs線粒體損傷率(表現為線粒體腫脹,內外膜斷裂,線粒體嵴斷裂)明顯降低(Fig. 4C)。此外,DHE染色顯示T1KO小鼠腎組織中ROS水平降低(圖4D)。與體內數據一致,氧消耗率(OCR)分析表明,在HK-2細胞中沉默Tipe1提高了氧化磷酸化能力和ATP生成(圖4E)。此外,MitoTracker Red和MitoSOX染色顯示,在HG處理的HK-2細胞中,下調Tipe1可上調線粒體膜電位,下調線粒體ROS水平(Fig. 4F and G)。與線粒體控制細胞活力的決定作用一致,RTECs中Tipe1缺失顯著降低了腎組織中TUNEL陽性細胞核的比例(Fig. 4H)。在HG條件下,Lv-shTIPE1感染的HK-2細胞凋亡也減少(Fig. 4I)。綜上所述,這些結果表明TIPE1具有調節管狀細胞線粒體穩態和細胞活力的能力,進而決定DN的進展。

圖4在HG環境下,Tipe1缺乏可改善線粒體穩態并減少RTECs的凋亡
4、通過Tipe1消融增強線粒體自噬,可減輕高糖誘導的RTECs損傷和EMT
接下來,探究TIPE1如何控制RTECs的線粒體穩態。線粒體自噬是清除損傷線粒體維持線粒體穩態的過程。KEGG結果顯示相比于WT小鼠,線粒體自噬相關基因顯著富集于TIPE1敲除鼠的腎組織(Fig. 5A),這些基因與線粒體自噬誘導有關,例如Pink1,Parkin,Atg12,Mfn1/2上調,Sqstm1/p62,Rps27a基因下調(Fig. 5B)。Western blot分析證實,與WT小鼠相比,T1KO小鼠腎組織線粒體中PINK1、Parkin和LC3II蛋白水平上調,p62表達降低(Fig. 5C-D)。TEM也顯示T1KO小鼠腎組織中線粒體自噬小體數量明顯高于WT小鼠(Fig. 5E)。與WT小鼠相比,T1KO小鼠的腎組織中LC3與線粒體自噬的標志基因COX-IV的共定位更為顯著(Fig. 5F and G)。HG條件下Lv-shTIPE1感染的HK-2細胞也有類似的結果(Fig. 5H and I)。這些結果表明,TIPE1在RTECs中是一種潛在的線粒體自噬抑制劑。
積累的數據表明,線粒體自噬是有缺陷線粒體選擇性降解的重要機制,參與腎損傷和修復。為了進一步驗證線粒體自噬失調在TIPE1促進小管細胞損傷中的重要性,我們用線粒體自噬抑制劑Mdivi-1對HK-2細胞進行預處理。觀察到,在Lv-shTIPE1感染的HK-2細胞中,PINK1表達的上調幾乎被消除。更重要的是,Mdivi-1可以減輕HK-2細胞中因TIPE1敲除引起的KIM1下調表達(Fig. 5J and K)。一致地,Mdivi-1處理顯著挽救了HK-2細胞中TIPE1沉默引起的EMT增強促進作用,在Mdivi-1處理的對照細胞或TIPE1敲除的HK-2細胞中顯示相似水平的EMT標記物(α-SMA、波形蛋白、N-cadherin和E-cadherin) (Fig. 5L-M)。綜上所述,這些數據表明,消融Tipe1增強了RTECs中的線粒體自噬,從而減緩了小管細胞損傷和EMT。
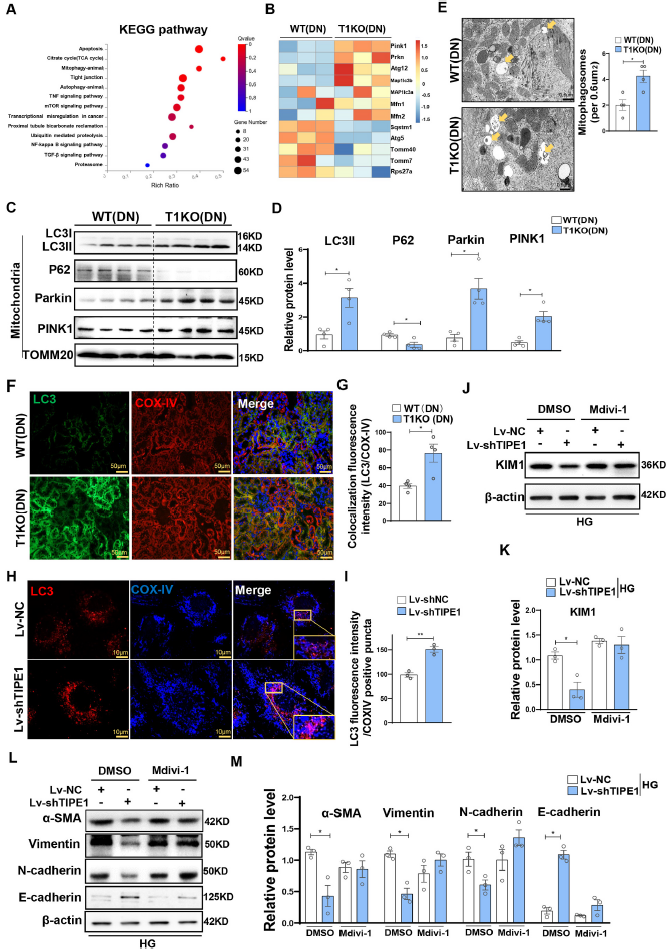
圖5通過Tipe1消融增強線粒體自噬,可減輕高糖誘導的RTECs損傷和EMT
5、TIPE1與PHB2相互作用并促進PHB2的蛋白酶體降解
接下來,研究了TIPE1調控RTECs線粒體自噬的機制。越來越多的證據表明,TIPE1與多種蛋白質相互作用,調節細胞生物學。因此,使用pcTIPE1-HA轉染細胞的免疫沉淀進行LC-MS/MS (Fig. 6A)。有30個潛在相互作用蛋白的蛋白質得分大于200,其中(Fig. 6B),有報道稱,prohibitin 2 (PHB2)是一種線粒體膜內蛋白,在哺乳動物細胞和線蟲中都發揮著重要的線粒體吞噬受體的作用。共免疫沉淀試驗表明,在pcTIPE1-HA轉染的HEK293細胞中,TIPE1和PHB2相互作用(Fig. 6C)。內源性關聯在對照組或HG處理的HK-2細胞中得到進一步驗證(Fig. 6D)。HG條件下,Lv-shTIPE1感染HK-2細胞后,PHB2蛋白主要在線粒體中上調,而PHB2 mRNA與lv - NC感染細胞相當(Fig. 6E–G)。環己酰亞胺(CHX)追蹤實驗進一步發現,敲除TIPE1可增加HK-2細胞中PHB2蛋白的半衰期(Fig. 6H and I)。此外,用蛋白酶體抑制劑(MG132)而不是自噬抑制劑氯喹(CQ)處理可以消除TIPE1沉默引起的HK-2細胞中PHB2的上調(Fig. 6J and K),明TIPE1促進PHB2的蛋白酶體降解。一致地,TIPE1的異位表達導致HEK293細胞中PHB2泛素化的增加(Fig. 6L)。這些結果表明,TIPE1與PHB2相互作用,并通過泛素-蛋白酶體途徑加速PHB2的降解。

圖6 TIPE1與PHB2相互作用并促進PHB2的蛋白酶體降解
6、敲低PHB2消除Tipe1缺失對RTECs線粒體自噬、損傷和EMT的改善作用
為了驗證TIPE1在RTECs細胞線粒體吞噬和損傷中的調控作用,給WT或T1KO小鼠注射編碼PHB2 shRNA的慢病毒(Lv-shPHB2)或陰性對照慢病毒(Lv-NC)。發現敲除PHB2幾乎可以消除Tipe1缺失對RTECs線粒體自噬的作用,表現為Parkin、PINK1、LC3II/I和PHB2水平在WT和T1KO小鼠中相當(Fig. 7A and B)。PHB2的沉默也消除了NGAL、EMT標志物的表達差異(Fig. 7C-F)。HE和免疫組化染色進一步證實,敲除PHB2幾乎消除了腎小管細胞Tipe1缺乏對腎損傷和纖維化的改善作用(Fig. 7G)。總之,這些結果支持管狀細胞TIPE1通過失調PHB2的表達抑制線粒體自噬并促進DN進展的觀點。

圖7敲低PHB2消除Tipe1缺失對RTECs線粒體自噬、損傷和EMT的改善作用
7、TIPE1在RTECs中的表達與DN患者的腎功能、線粒體吞噬和纖維化相關
為了探討TIPE1在人類DN中的臨床意義,進一步分析了TIPE1表達與腎功能的相關性。自Nephroseq數據庫的數據顯示,TIPE1表達與DN患者的腎小球濾過率(GFR)呈負相關(Fig. 8A)。然后在DN患者的腎活檢中檢測TIPE1、PHB2和α-SMA的表達(Fig. 8B)。統計分析顯示,在DN患者中TIPE1表達與UACR呈負相關(Fig. 8C)。此外,TIPE1水平與α-SMA表達呈正相關,與PHB2表達呈負相關(Fig. 8D and E)。些結果進一步支持了TIPE1在DN進展中起促進作用的觀點。

圖8 TIPE1在RTECs中的表達與DN患者的腎功能、線粒體吞噬和纖維化相關
總之,本研究確定了TIPE1在RTECs中調控DN進展的關鍵作用。在HG條件下,TIPE1破壞PINK1/ parkin介導的線粒體自噬,并破壞RTECs的線粒體穩態。TIPE1上調是RTEC損傷和EMT的催化劑,最終促進DN的發展。
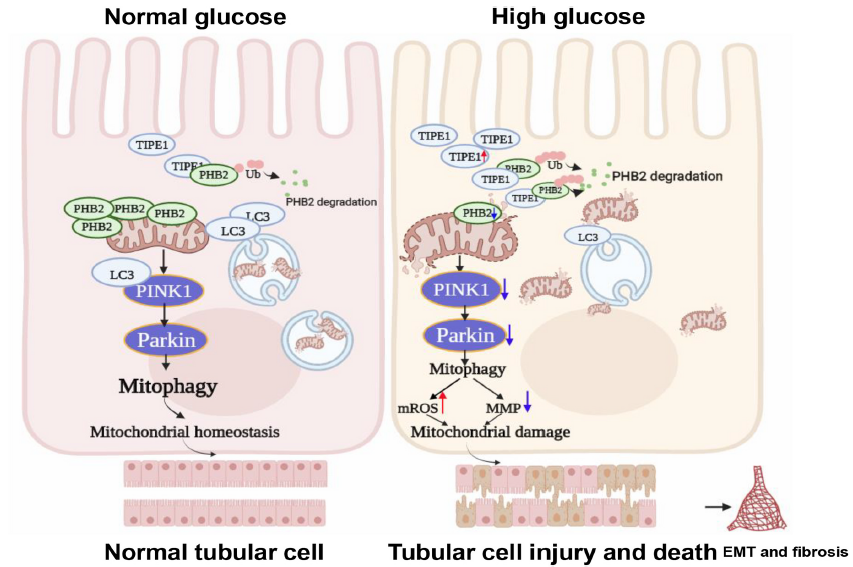
圖9 TIPE1在RTECs中的上調通過干擾PHB2介導的線粒體自噬而加重DN的進展。HG環境下RTECs中TIPE1的上調與PHB2相互作用并觸發其蛋白酶體降解,進而破壞線粒體自噬和線粒體穩態,促進DN的進展。
參考文獻:
Liu Lei., Bai Fang., Song Hui., Xiao Rong., Wang Yuzhen., Yang Huimin., Ren Xiaolei., Li Shuangjie., Gao Lifen., Ma Chunhong., Yang Xiangdong., Liang Xiaohong.(2022). Upregulation of TIPE1 in tubular epithelial cell aggravates diabetic nephropathy by disrupting PHB2 mediated mitophagy. Redox Biol, 50(undefined), 102260. doi:10.1016/j.redox.2022.102260






