lncRNA TINCR促進肝細胞癌進展,抑制對奧沙利鉑的化療敏感性
lncRNA在肝細胞癌(HCC)的進展和化療耐藥性中起重要作用。深入研究其具體的調控機制對于提供潛在的治療靶點具有重要價值。本研究旨在探討lncRNA TINCR在HCC進展和奧沙利鉑反應中的調控作用及機制。我們的發現提示,存在一個TINCR/miR-195-3p/ST6GAL1/NF-κB信號轉導軸調控腫瘤進展和奧沙利鉑耐藥,該信號轉導軸可能用于肝癌的抗腫瘤治療。本文于2022年1月發表于雜志“JOURNAL OF EXPERIMENTAL & CLINICAL CANCER RESEARCH”(IF=11.161)上。
技術路線

結果
1)TINCR在HCC中上調,并與患者不良預后相關
為了識別調控HCC進展的lncRNAs,我們對5例HCC患者的5對腫瘤和正常組織進行了完整的轉錄組序列。共發現49個不同表達的lncRNA (圖1A),其中TINCR是HCC中顯著上調的lncRNA之一。此外,我們通過qRT-PCR再次證實,與50個正常組織相比,50個HCC組織中TINCR的表達顯著升高(圖1B-C)。我們利用qRT-PCR進一步研究了TINCR對139例HCC冷凍HCC組織的預后價值。根據TINCR表達中位數將患者分為高表達組和低表達組。結果顯示,TINCR高組患者的總生存期(圖1D-E)和無復發生存期(圖1F)較差。生存圖顯示三組患者的總體生存率和無復發生存率有顯著的分層(圖1G-H)。

2)TINCR促進肝癌細胞增殖、遷移、侵襲和對奧沙利鉑的耐藥性
我們在HuH7和HepG2細胞中分別轉染了si-TINCR (si-TINCR 1#和si-TINCR 2#)和TINCR過表達質粒(pcDNA3.1TINCR),并采用qRT-PCR檢測轉染效率(圖2A-B)。CCK-8和集落形成實驗顯示,與對照組相比,轉染si-TINCR的HCC細胞的增殖受到顯著抑制(圖2C和E)。同樣,pcDNA3.1-TINCR轉染的肝癌細胞與空載體轉染的肝癌細胞效果相反(圖2D和F)。沉默TINCR可抑制HCC細胞的遷移和侵襲(圖2G),而過表達TINCR可增強這些細胞行為(圖2H)。此外,我們研究了TINCR在奧沙利鉑敏感性調節中的作用。在不同濃度梯度的奧沙利鉑下,CCK-8和凋亡檢測結果顯示,沉默TINCR可顯著提高肝癌細胞對奧沙利鉑的敏感性(圖3A-D)。在過表達的HCC細胞中證實了相反的效果(圖3E-H)。這些結果表明,在HCC中,TINCR作為一種促癌lncRNA促進增殖、侵襲和遷移,并誘導對奧沙利鉑的敏感性。


3)TINCR作為ceRNA,競爭性地吸收miR-195-3p
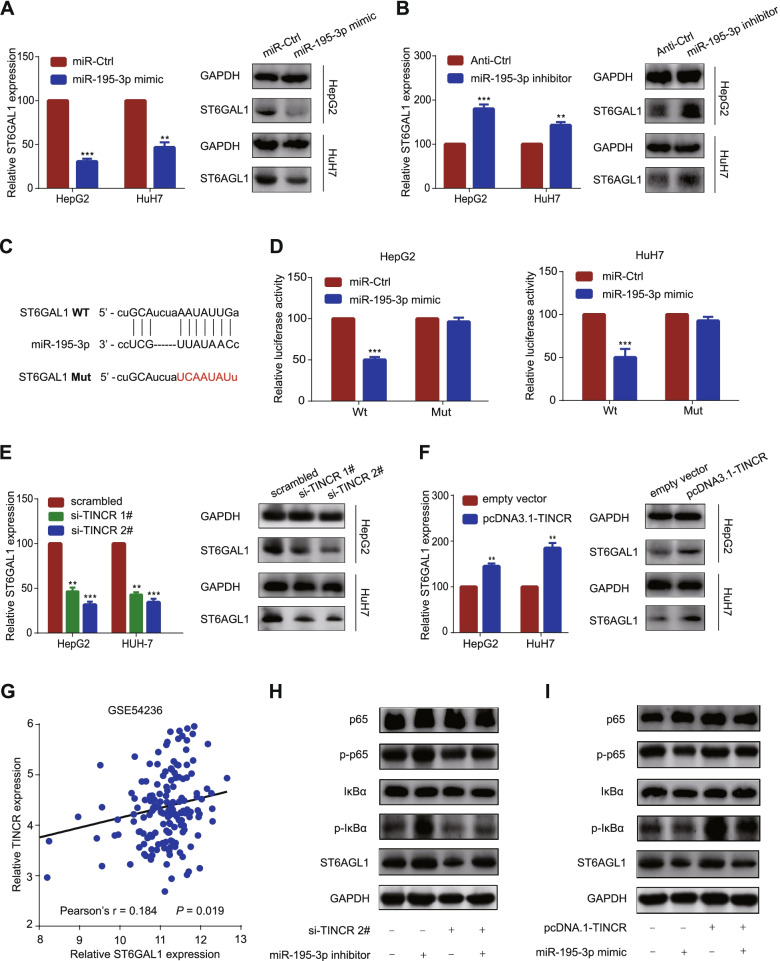
為了揭示TINCR潛在的調控機制,我們首先探索了TINCR在LncLocator中的預測位置。推測TINCR主要位于細胞質中(圖4A)。TINCR在細胞核和細胞質中表達的QRT-PCR分析進一步證實了這一結論(圖4B)。基于這些結果,我們假設TINCR作為一個ceRNA發揮作用。為了找到結合的miRNA,我們對經TINCR敲除后的HepG2的miRNA進行測序,發現miR-195-3p是顯著增加的miRNA之一,其fold change值最大(圖4C)。接下來,雙熒光素酶報告基因檢測顯示,過表達miR-195-3p降低了野生型TINCR基因片段的熒光素酶活性,而不是突變型TINCR載體(圖4D-E)。我們通過qRT-PCR進一步驗證了TINCR和miR-195-3p在HCC細胞中的表達值相反。結果顯示,miR-195-3p在TINCR抑制后上調,在TINCR過表達后下調(圖4F-G)。相比之下,過表達miR-195-3p時,TINCR下調(圖4H)。RNA拉下實驗顯示,與對照組相比,生物素標記的miR195-3p轉染的HCC細胞中,TINCR的表達占總輸入量的比例顯著升高(圖4I)。最后,來自TCGA數據庫和Starbase的調查結果表明,miR-195-3p與TINCR呈負相關,并可能作為一種在臨床病理特征和生存預測方面與TINCR相反趨勢的腫瘤抑制分子(圖4J-K)。以上結果提示,TINCR的致癌作用部分是通過miR-195-3p的負調控介導的。

4)TINCR緩解miR-195-3p對ST6GAL1的抑制,增強NF-κ B通路
為了找到miR-195-3p的下游靶蛋白,我們在TargetScan中篩選了累積加權上下文評分小于?0.1的靶基因。在這些預測目標基因,ST6GAL1是可能的候選基因。我們發現ST6GAL1的表達受miR-195-3p變化的影響(圖5A-B)。為了驗證這種潛在的相互作用,雙熒光素酶報告分析顯示,過表達miR-195-3p會降低野生型ST6GAL1基因片段的熒光素酶活性,但不會降低突變型ST6GAL1載體(圖5C-D)。這些結果表明ST6GAL1是miR-195-3p的靶基因。此外,western blotting結果顯示ST6GAL1的表達與TINCR的表達呈正相關(圖5E-F),我們進一步用GEO數據集(GSE54236,圖5G)驗證了這一點。為了尋找潛在的信號通路,基于TCGA數據集進行GSEA分析。結果顯示,包括NF-κB通路在內的多個經典通路相關基因組均顯著富集了TINCR的高表達。為了驗證這一點,進一步的實驗結果顯示,沉默TINCRs蛋白水平后ST6GAL1降低,IκBα (p-IκBα)和p65 (p-p65)的磷酸化水平降低。抑制miR-195-3p可部分逆轉上述作用(圖5H)。相比之下,TINCR過表達增加了ST6GAL1蛋白水平以及IκBα (p-IκBα)和p65 (p-p65)的磷酸化水平,而過表達miR-195-3p可部分逆轉這一變化(圖5I)。基于這些發現,我們提出TINCR通過吸收miR-195-3p上調ST6GAL1,并激活NF-κB通路。
5)ST6GAL1負責TINCR介導的細胞進展和奧沙利鉑不敏感
為了證實TINCR介導的ST6GAL1的功能,我們在TINCR敲除的基礎上,用ST6GAL1過表達載體或空載體轉染HuH7和HepG2細胞。細胞功能檢測顯示,ST6GAL1表達的恢復在一定程度上挽救了細胞增殖、侵襲和遷移能力的下降(圖6A-E),以及奧沙利鉑耐藥情況(圖6F)。此外,ST6GAL1的恢復還部分彌補了IκBα (p- IκBα)和p65 (p-p65)磷酸化減弱的水平,而ST6GAL1過表達則表現出相反的作用(圖6G-H)。總的來說,這些發現進一步說明了TINCR通過TINCR/miR-195-3p/ST6GAL1/NF-κB信號通路促進了肝癌細胞進展和對奧沙利鉑的耐藥(圖6I)。

6)在體內,沉默TINCR可損害肝細胞癌的腫瘤發生和對奧沙利鉑的耐藥性
為了驗證TINCR在體內的致瘤功能,將TINCR沉默的裸鼠皮下接種穩定轉染的HuH7細胞,建立異種移植小鼠模型。qRT-PCR證實了TINCR基因的下調程度(圖7A)。與scramble對照組相比,sh-TINCR組腫瘤大小和重量的生長均受到強烈抑制。sh-TINCR組腫瘤對奧沙利鉑治療的敏感性明顯高于ctrl-TINCR組(圖7B-D)。同時,ST6GAL1在腫瘤組織中的表達隨著TINCR的沉默而降低(圖7E-F)。這些數據表明,沉默TINCR可以抑制肝癌細胞增殖和體內奧沙利鉑耐藥。

結論:本研究確定了TINCR在HCC中是一種致癌lncRNA,并通過TINCR/miR-195-3p/ ST6GAL1調控軸闡明了其在促進肝癌細胞增殖、遷移、侵襲和奧沙利鉑耐藥中的作用。我們的數據可能有助于更深入地理解與腫瘤進展相關的機制,并有助于開發更有效的肝癌患者化療的治療靶點和生物標志物。
參考文獻:Mei J, Lin W, Li S, Tang Y, Ye Z, Lu L, Wen Y, Kan A, Zou J, Yu C, Wei W, Guo R. Long noncoding RNA TINCR facilitates hepatocellular carcinoma progression and dampens chemosensitivity to oxaliplatin by regulating the miR-195-3p/ST6GAL1/NF-κB pathway. J Exp Clin Cancer Res. 2022 Jan 3;41(1):5. doi: 10.1186/s13046-021-02197-x. PMID: 34980201; PMCID: PMC8722212.






