LncRNA NORAD/miR-224-3p/MTDH軸通過促進β-catenin核積累,參與食管鱗狀細胞癌CDDP耐藥
食管鱗狀細胞癌(ESCC)是我國食管癌的主要亞型,占食管癌患者的90%以上。目前,順鉑(cis-diamminedichloro-platinum,CDDP)是治療ESCC的首選藥物。CDDP耐藥是一種惡性的生物學特性,其調控機制復雜。長鏈非編碼RNA (lncRNAs)的異常調節是CDDP耐藥的關鍵調控因子。然而,本研究探討ESCC中參與CDDP耐藥的LncRNA并闡明其臨床意義和功能機制。本文于2021.12月發表于《Molecular Cancer》, IF=15.302。
技術路線:

主要結果
1.在ESCC中,NORAD高表達與CDDP耐藥相關
基于GEO數據庫,作者首先分析了CDDP敏感和耐藥的食管癌組織中差異表達的基因,并篩選5個在CDDP耐藥的組織中差異表達的LncRNA(Fig. 1a)。這5個LncRNA在CDDP耐藥的ESCC組織中NORAD表達量明顯高于CDDP敏感的ESCC組織(Fig. 1b)。 TCGA數據庫分析發現NORAD在ESCC組織中的表達高于正常組織,提示NORAD可能促進食管鱗癌的發生ESCC進展(Fig. 1c)。熒光原位雜交顯示在CDDP耐藥的ESCC組織中,NORAD的表達量明顯高于CDDP敏感的ESCC組織(Fig. 1d)。 臨床分析發現,NORAD表達量越高患者預后越差(Fig. 1e)。ROC曲線顯示NORAD可能是ESCC患者CDDP耐藥的預測標志物(Fig. 1f)。風險模型顯示發現NORAD表達和腫瘤分期都是ESCC患者無病生存期和總生存期的獨立危險因素(Fig. 1g)。
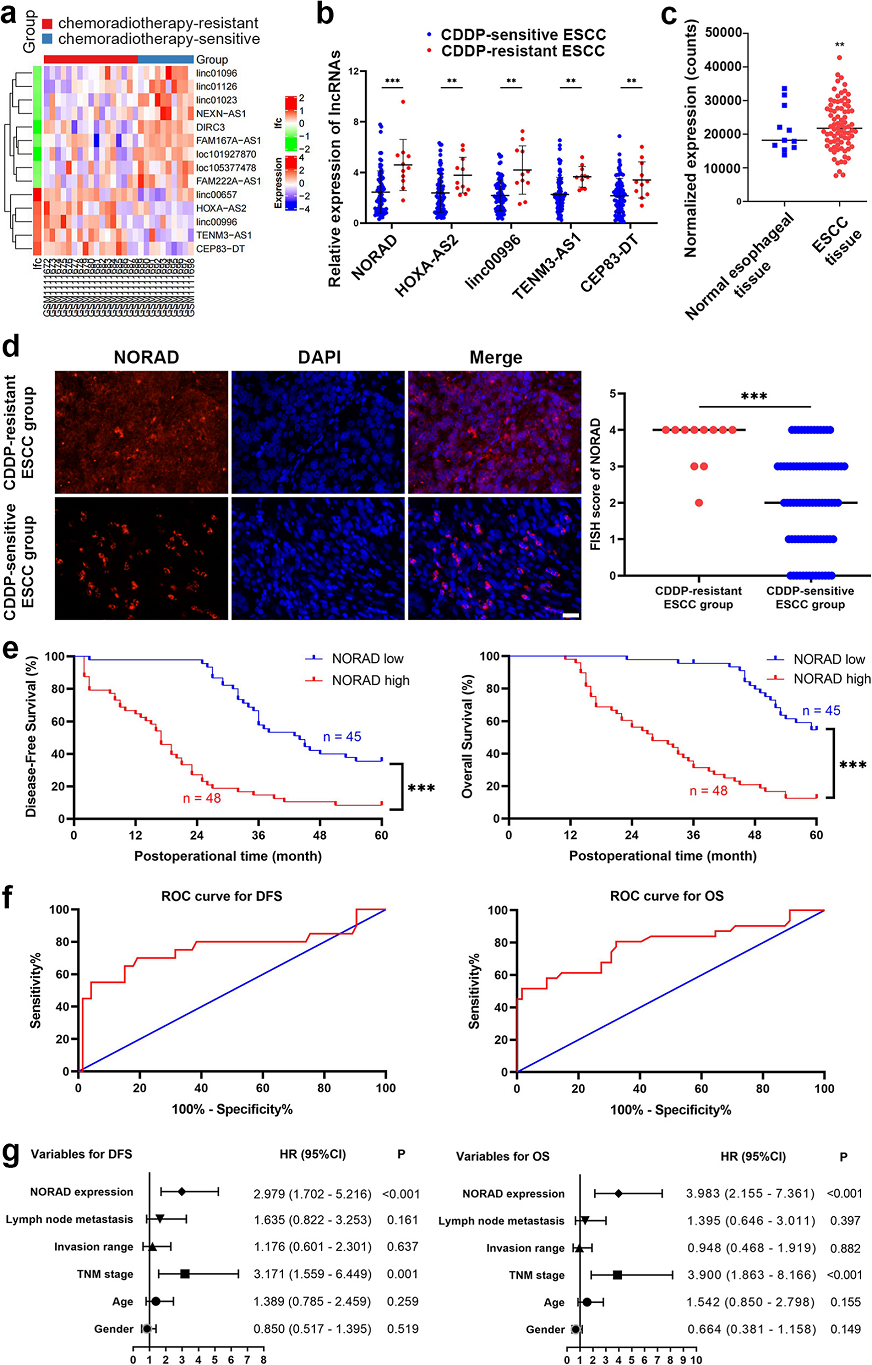
Fig 1 在CDDP耐藥的ESCC組織中,NORAD表達增加,與患者預后不良相關
2.NORAD促進體外ESCC CDDP耐藥
為了進一步研究CDDP耐藥在ESCC中的作用機制,作者采用CDDP敏感的親本ESCC細胞系(KYSE30和TE1)及其等基因耐藥CDDP細胞 (KYSE30/CDDP-R和TE1/CDDP-R)用于后續研究。結果發現KYSE30/CDDP-R和TE1/CDDP-R中,NORAD顯著高于相應的親本細胞(Fig. 2a)。通過熒光原位雜交檢測到NORAD主要位于ESCC細胞的細胞質中(Fig. 2b)。IC50是指在用藥后存活的細胞數量減少一半時所需的藥物濃度,在KYSE30/CDDP-R和TE1/CDDP-R細胞系中敲低NORAD,在KYSE30和TE1細胞系中過表達NORAD,結果表明,下調NORAD表達顯著降低了KYSE30/CDDP-R和TE1/CDDP-R中的IC50值,表明NORAD降低了耐藥細胞的敏感性(Fig. 2c)。此外,過表達NORAD顯著降低了KYSE30和TE1細胞對CDDP的敏感性(Fig. 2d)。此外,NORAD在耐藥細胞中敲低之后抑制了集群形成能力,表明NORAD基因敲除部分恢復了這些細胞對CDDP的敏感性(Fig. 2e);與空載體(EV)組相比,用CDDP處理TE1細胞時,NORAD過表達對TE1細胞的增強作用更為顯著(Fig. 2f)。作者接下來了檢測細胞凋亡率,以進一步確定NORAD對ESCC細胞CDDP耐藥的影響。在CDDP耐藥細胞中,抑制NORAD顯著增加了CDDP誘導的KYSE30/CDDP-R和TE1/CDDP-R細胞凋亡(Fig. 2g);NORAD過表達顯著降低了CDDP誘導了KYSE30和TE1細胞中的細胞凋亡(Fig. 2h)。 在NORAD敲除的耐藥細胞中,加劇了KYSE30/CDDP-R和TE1/CDDP-R細胞中CDDP誘導G1期阻滯的情況。當在KYSE30和TE1細胞中過表達NORAD,CDDP誘導G1期阻滯情況被緩解(Fig. 2i)。γH2AX 是DNA損傷標志物,cleaved – caspase-3是凋亡標志物。在KYSE30和TE1細胞中干擾NORAD后,細胞中γH2AX和cleaved - caspase-3的表達顯著增加(Fig. 2j);CDDP誘導的DNA損傷標志物γH2AX和凋亡標志物cleaved - caspase-3在KYSE30和TE1細胞中的表達水平也被NORAD過表達降低(Fig. 2k)。

Fig 2 NORAD有助于ESCC的CDDP耐藥性
3. NORAD作為miR - 224 - 3p海綿調節ESCC細胞MTDH的表達
為找到參與調控CDDP耐藥的miRNA,作者首先通過數據庫在CDDP敏感和耐藥的組織中找到3個差異表達的miRNAs(Fig. 3a)。其中miR-224-3p可能與NORAD存在結合(Fig. 3b)。在KYSE30/CDDP-R和TE1/CDDP-R細胞中,敲除NORAD之后3個候選差異表達的miRNAs中只有miR-224-3p的表達增加(Fig. 3c)。 在5個片段克隆中敲除NORAD,miR-224-3p在KYSE30/CDDP-R和TE1/CDDP-R細胞中的表達增加均顯著上調(Fig. 3d)。表達量分析發現在ESCC組織中,只有miR-224-3p與NORAD呈負相關(Fig. 3e)。此外,KYSE30/CDDP-R和TE1/CDDP-R細胞中的miR-224-3p表達低于相應的親本細胞(Fig. 3f)。在藥物敏感細胞中過表達NORAD,miR-224-3p表達量降低(Fig. 3f)。亞細胞定位檢測發現NORAD和miR-224-3p都是定位于ESCC細胞細胞質中(Fig. 3h,i)。將攜帶NORAD-WT或NORAD突變型的熒光素酶報告基因轉染到,KYSE30/CDDP-R和TE1/CDDP-R細胞中,再轉染miR-224-3P模擬物。結果表明,在轉染NORAD-WT和第二個NORAD突變型中,miR-224-3p模擬物能降低,KYSE30/CDDP-R和TE1/CDDP-R細胞中NORAD的熒光素酶活性。相比之下,轉染NORAD- mut #1的KYSE30/CDDP-R和TE1/CDDP-R細胞中,NORAD的熒光素酶活性沒有被miR-224-3p模擬物降低(Fig. 3j)。此外,RIP-PCR結果顯示NORAD和miR-224-3p在ESCC細胞中形成RNA誘導的沉默復合體(RISC)(Fig. 3j)

Fig 3 NORAD充當海綿吸附ESCC中的miR-224-3p
4. MTDH是miR-224-3p的直接靶點
生信工具預測了miR-224-3p潛在調控的405靶點,通再過生信靶點預測和耐藥和敏感的ESCC組織之間的差異mRNA的分析,找到1個重疊區,也就是MTDH(Fig.4ab)。免疫組化檢測到MTDH主要位于ESCC細胞的細胞質中(Fig.4c)。接下來檢測了CDDP耐藥和敏感食管癌細胞中MTDH的表達。發現,KYSE30/CDDP-R和TE1/CDDP-R細胞中MTDH表達明顯高于相應的親本細胞(Fig.4 d),生信預測到MTDH的3’-UTR區中有4個位點有可能與miR-224-3p結合,接下來作者構建了MTDH-3′-UTR的4個不同的突變序列(e.g. MTDH-3′-UTR-Mut#1, MTDH-3′-UTR-Mut#2,MTDH-3′-UTR-Mut#3 and MTDH-3′-UTR-Mut#4) (Fig.4 e)。然后將攜帶MTDH-3-UTR-WT或MTDH-3-UTR Mut的報告基因導入耐藥細胞,再共轉染miR-224-3p模擬物(Fig.4 f)。轉染miR-224-3模擬物后顯著降低了MTDH-3-UTR-WT,以及其中3個MTDH-3’--UTR-mut的耐藥細胞中的MTDH的熒光素酶活性。說明miR-224-3p與MTDH-3′-UTR-Mut#1結合。WB得到相同的結果(Fig.4 g)。接下來為了研究NORAD是否通過吸附miR-224-3p上調MTDH的表達,作者在KYSE30/CDDP-R和TE1/CDDP-R細胞中用shRNA敲除NORAD,并轉染miR-224-3p抑制劑。結果顯示, NORAD基因敲除后MTDH的表達明顯降低,而轉染miR-224-3p抑制劑后抑制了這種效果(Fig.4 h)。接下來,在KYSE30和TE1細胞中過表達NORAD顯著增加了MTDH的表達,而轉染miR-224-3p模擬物部分挽救了這種上調(Fig.4 i)。相關性分析發現miR-224-3p與NORAD和MTDH呈負相關, NORAD與MTDH呈正相關(Fig.4i)。
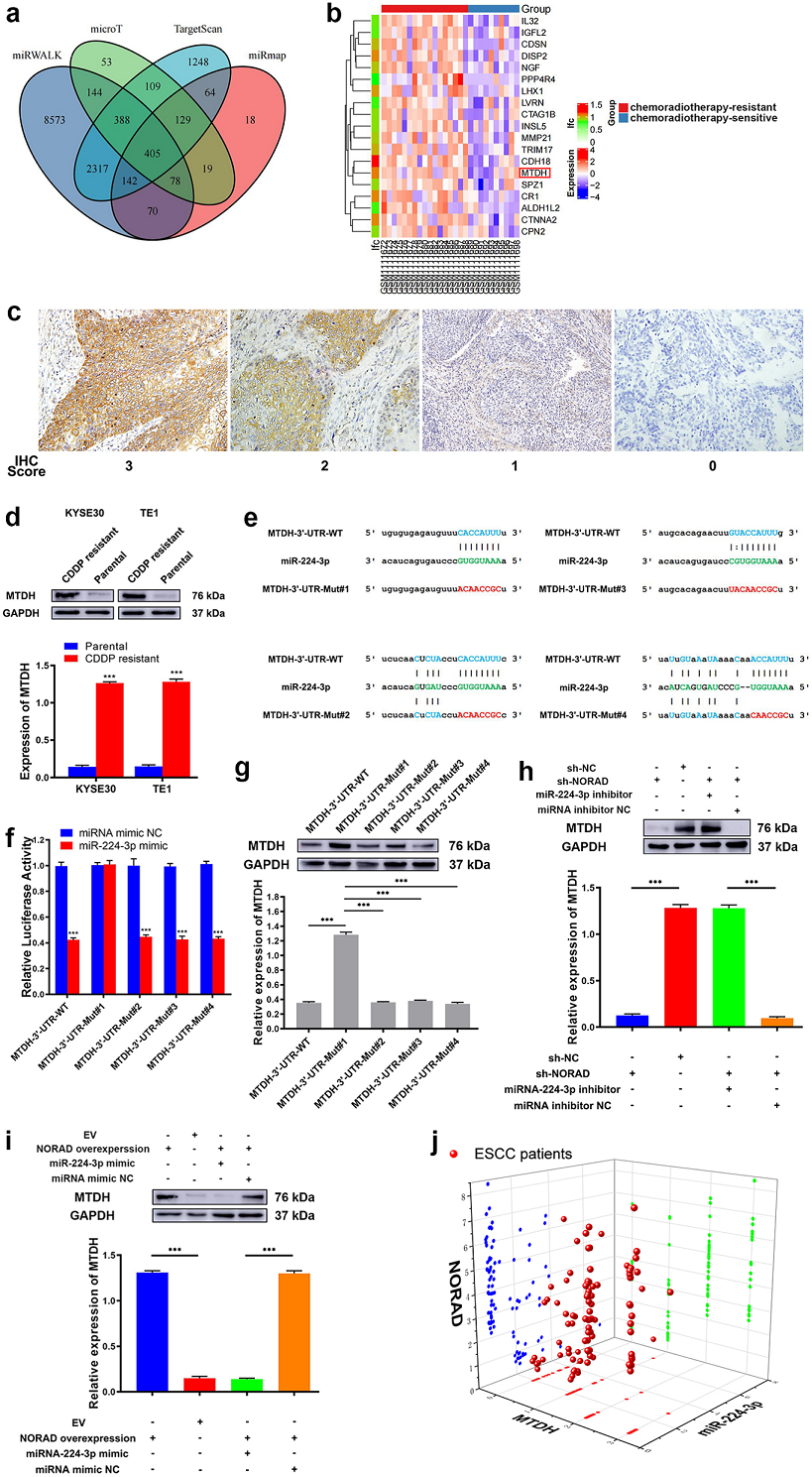
Fig4 MTDH是miR-224-3p的直接靶點
5. NORAD/miR?224?3p/MTDH軸通過調節B-活性進而促進耐藥以及ESCC進展
接下來,作者用CDDP處理KYSE30/CDDP-R和TE1/CDDP-R細胞,以確定NORAD/ miR-224-3p/MTDH軸在ESCC細胞中的作用。敲低NORAD可部分消除KYSE30/CDDP-R和TE1/CDDP-R細胞中的CDDP耐藥性,而miR-224-3p抑制劑則增強了耐藥性。隨著NORAD過表達,KYSE30和TE1細胞中的敏感性下降,而miR-224-3p模擬物中和了這一現象(Fig 5a)。 此外,隨著敲除NORAD,CDDP誘導的KYSE30/CDDP-R和TE1/CDDP-R細胞中的凋亡率增加,這種效果通過共轉染miR-224-3p抑制劑來拯救;同時,過表達NORAD,CDDP誘導的TE1和KYSE30細胞凋亡率降低,這種效果能隨著轉染miR-224-3p模擬物拯救(Fig 5b)。此外,敲低NORAD促進了CDDP誘導的誘導G1期阻滯,而miR-224-3p抑制劑挽救了這種增長;同樣,miR-224-3p模擬物部分中和了在KYSE30和TE1細胞中過表達CDDP誘導的G1期阻滯(Fig 5c-d)。為確定NORAD/ miR-224-3p/MTDH軸可能的下游信號通路。于是通過WB檢測轉染NORAD和miR-224-3p模擬物細胞中不同通路的相關蛋白表達量。發現敲除NORAD下調了磷酸化-β連環蛋白的表達,而且這種下調趨勢能被miR-224-3p抑制劑中和(Fig 5e)。接下來分析了NORAD對β連環蛋白在ESCC細胞中的定位情況。WB結果顯示敲低NORAD基因后,ESCC細胞的細胞核中β連環蛋白降低,細胞質中β連環蛋白升高(Fig 5f)。此外,作者通過免疫熒光染色觀察NORAD/miR-224-3p/MTDH軸對ESCC細胞中β-catenin亞細胞位置的影響。與WB結果一致(Fig 5G)。敲除NORAD或MTDH再共轉染miR-224-3p模擬物可減少耐藥細胞中β連環蛋白的核積累(Fig 5G)。

Fig 5 NORAD/miR-224-3p/MTDH軸通過促進β-catenin的核積累來促進ESCC細胞對CDDP的耐藥性
6. NORAD/miR-224-3p/MTDH軸促進ESCC細胞的進展
通過傷口愈合試驗和Transwell實驗發現敲低NORAD抑制了KYSE30/CDDP-R和TE1/CDDP-R細胞的遷移和侵襲,而miR-224-3p抑制劑減弱了這種抑制(Fig 6A,B)。 敲低NORAD后,檢測遷移和入侵相關因子的表達量,發現E-cadherin表達量增高,N-cadherin和MMP9表達量降低,而miR-224-3p抑制劑則中和了這些改變,在KYSE30和TE1細胞中過表達NORAD則效果相反(Fig 6C)。綜上所述, NORAD/miR-224-3p/MTDH軸促進β-catenin的核積累,激活該蛋白,從而促進了ESCC細胞對CDDP的耐藥和進展。

Fig 6 NORAD/miR-224-3p/MTDH軸促進ESCC細胞的進展
7. NORAD在體內促進CDDP的耐藥和ESCC的生長
將8只雌性ESCC小鼠隨機分成2組注射對CDDP耐藥和敏感細胞(用于注射的CDDP耐藥食管癌細胞之前sh-NORAD或sh-NC處理,CDDP敏感的細胞過表達NORAD),一周后,給小鼠腹腔注射指定濃度的CDDP或PBS。結果發現,耐藥細胞來源的異種移植瘤,經CDDP處理后腫瘤體積明顯小于對照組, MTDH表達降低,但腫瘤依然持續生長。第4周開始,轉染NORAD敲低處理細胞的小鼠中注射CDDP的腫瘤顯著消退,說明NORAD發揮了抑制作用(Fig 7a)。經NORAD過表達載體預處理的KYSE30細胞轉染到小鼠中即使在CDDP處理下也能形成持續生長的腫瘤(Fig 7b)。接下來,作者通過免疫組化法檢測sh-NORAD的KYSE30/CDDP-R細胞中的MTDH的表達量,MTDH的表達明顯低于未處理的KYSE30/CDDP-R細胞。同樣,在過表達NORAD 的KYSE30細胞的異種移植瘤中,MTDH的表達量高于EV細胞(Fig 7c)。在ESCC細胞中β-catenin的核表達與MTDH呈正相關(Fig 7d)。此外,CDDP誘導與γH2AX和cleaved caspase-3表達正相關,與異種移植腫瘤中MTDH呈負相關(Fig 7e-f)。 綜上所述,這些結果表明,NORAD通過促進β-catenin的核積累,促進了ESCC細胞CDDP耐藥性的進展和發展(Fig 7G)。

Fig 7 NORAD/miR-224-3p/MTDH軸有助于ESCC體內CDDP耐藥
本研究中,作者發現NORAD是參與體外和體內ESCC CDDP耐藥的關鍵lncRNA NORAD作為miR-224-3p海綿吸附miR-224-3p,降低miR-224-3p的表達水平,提高MTDH的表達量,促進β-catenin磷酸化,進而促進β-catenin的核積累,提高 ESCC細胞CDDP耐藥性。
參考文獻:
Jia Y.,et al.,Long non-coding RNA NORAD/miR-224-3p/MTDH axis contributes to CDDP resistance of esophageal squamous cell carcinoma by promoting nuclear accumulation of beta-catenin. Mol Cancer,2021. 20(1): p.162.






