腸漿膜損傷修復的第3種巨噬細胞——GATA6 +腹腔巨噬細胞
通過體內血液循環招募骨髓來源單核細胞并隨后轉變為CS3CR1+巨噬細胞以響應腸道損傷的過程是依賴于CCR2,Nr4a1和微生物組的。這個過程對于適當的組織修復非常重要,然而,GATA6+腹腔巨噬細胞可能是受損腸道部位可選擇性的,更容易獲得和有功能性的髓細胞。本文證實了該猜想,并于2021年12月發表在《Nature Communications》IF:14919期刊上。
技術路線:
主要實驗結果:
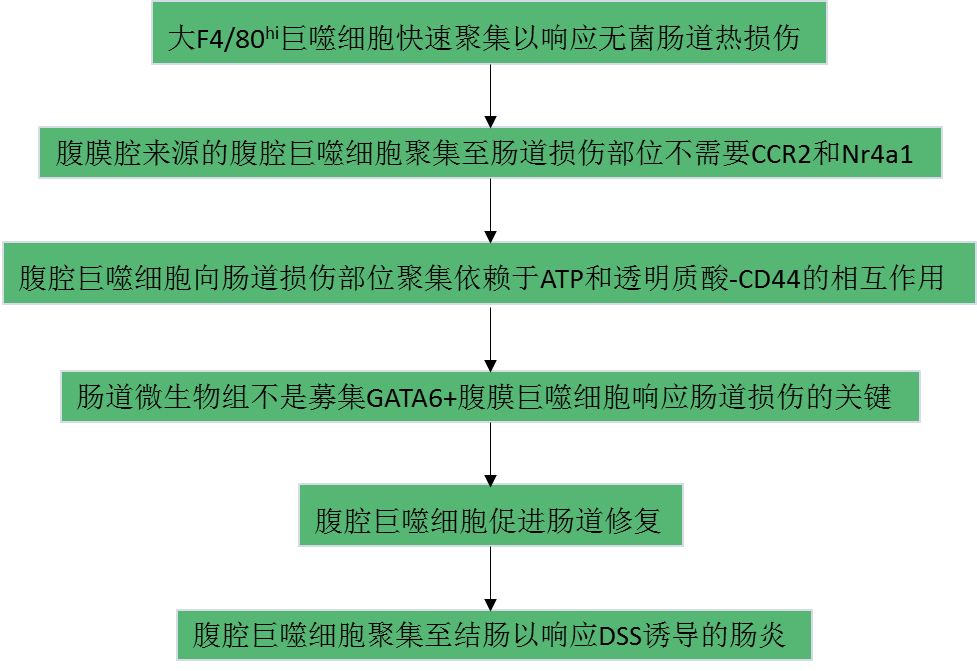
CX3CR1是腸道巨噬細胞特異性表明標志物。利用活體成像和有CX3CR1熒光報告的小鼠,觀察穩態腸道固有層巨噬細胞,結果發現這些巨噬細胞在血管周圍形成一個指間狀的物理鏈(Fig. 1a)。使用Cx3cr1GFP/+Ccr2RFP/+小鼠檢測單核細胞和巨噬細胞的招募對無菌性腸熱損傷的反應。熱探針從結腸漿膜側創建一個500μm的局灶性壞死性病變,延伸到固有層。結果顯示6h內CCR2+單核細胞浸潤,而CX3CR1+單核細胞未浸潤。相鄰損傷部位的CX3CR1+巨噬細胞保持固著,不從原始位置向損傷部位移動(Fig. 1b–d)。盡管F4/80抗體具有固著性,但在損傷部位局部應用F4/80抗體后,C57BL/6小鼠損傷后2h內大F4/80hi巨噬細胞聚集(Fig. 1e)。這些F4/80hi細胞的積累在損傷后24h達到高峰,并持續至48小時(Fig. 1e)。為了證實它們不是來自單核細胞,在損傷后6小時用F4/80抗體對Cx3cr1GFP/+Ccr2RFP/+小鼠進行成像。損傷后24 h,CCR2+單核細胞在損傷部位周圍形成環狀,并通過血管積聚,而大F4/80hi細胞在血管中看不到,其在損傷中心形成大聚集體(Fig. 1f)。重要的是,這些位于腸道損傷部位的大F4/80hi細胞表達GATA6,這是一種大腹腔巨噬細胞特有的轉錄因子,而不是腸道F4/80+巨噬細胞(Fig. 1g,h)。
2、腹膜腔來源的腹腔巨噬細胞聚集至腸道損傷部位不需要CCR2和Nr4a1
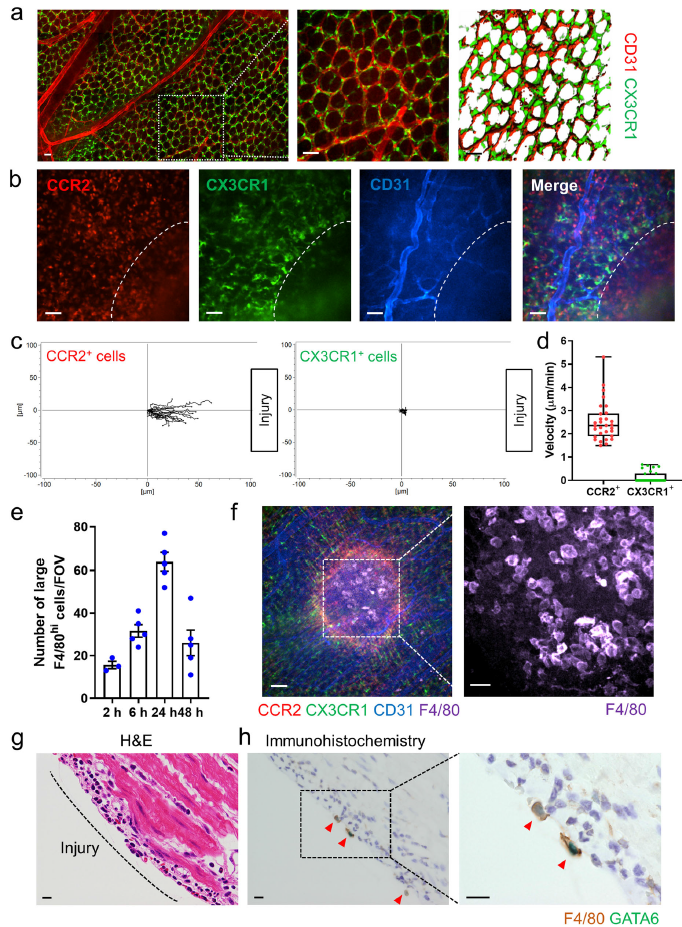
Luminex檢測顯示,損傷后24小時 MCP-1 (CCL2)吸引CCR2+單核細胞的關鍵趨化因子,以及中性粒細胞趨化因子KC在結腸中高表達(Fig. 2a)。然而,CCL2和CCL2受體缺失不影響GATA6+巨噬細胞聚集(Fig. 2b, c),表明1:CCL2與腹膜巨噬細胞的聚集無關;2:CCR2陽性單核細胞對腹膜巨噬細胞招募并不重要。與野生型小鼠相比,損傷后24和48小時,Nr4a1-/-小鼠受損腸內大F4/80hi細胞的招募沒有差異,該鼠損傷部位缺乏Ly6Clo單核細胞(Fig. 2b, c)。表明大F4/80hi細胞的聚集不依賴CCR2和Nr4a1。
為了證實腹膜是大F4/80hiGATA6+巨噬細胞的來源,通過腹腔注射氯磷酸鹽脂質體(CLL)敲除掉腹腔巨噬細胞。腹腔注射CLL不影響腸道內CX3CR1+巨噬細胞分布(Fig. 2d, e)或CCR2+單核細胞在損傷部分的分布,但是顯著降低了大F4/80hi巨噬細胞在腸道部分的數量(Fig. 2f, g)。此外,當腹膜注射LysM-eGFP小鼠(腹膜腔中超過85%的GFP+細胞為GATA6+巨噬細胞)的腹膜細胞至C57BL/6小鼠時發現這些細胞在腸道損傷部位積累,但當靜脈注射時GFP+巨噬細胞則不能進入損傷部位(Fig. 2h–j)。而當用CLL敲除掉GATA6+巨噬細胞后再腹膜注射LysM-eGFP小鼠腹膜細胞時則不能觀察到細胞在損傷部位聚集。以上表明是腹膜腔來源的腹腔巨噬細胞聚集至腸道損傷部位,且該過程不需要CCR2和Nr4a1。
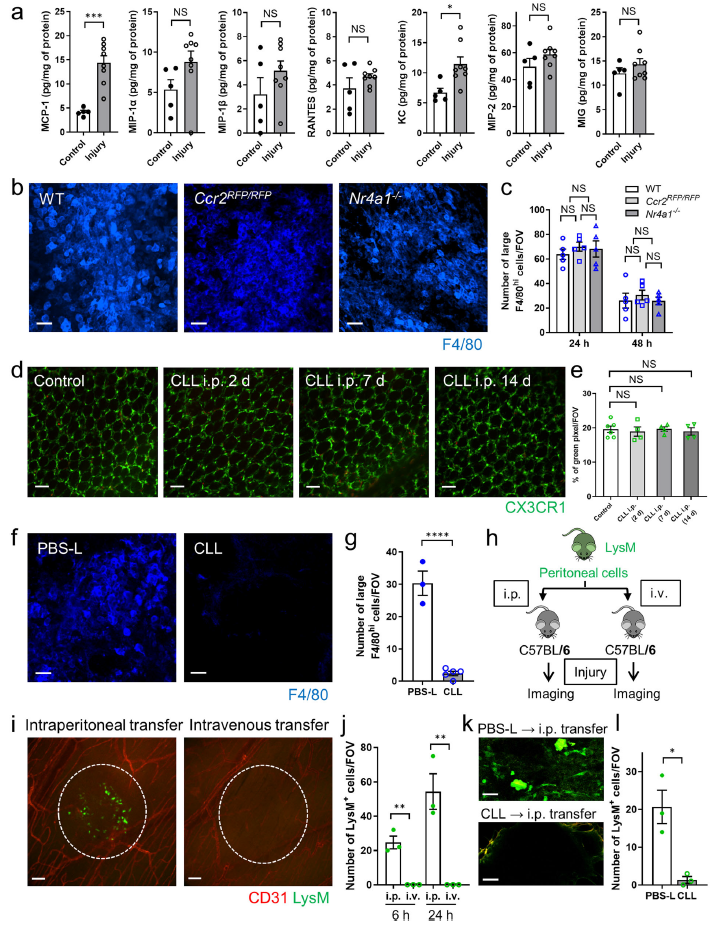
圖2腹腔巨噬細胞聚集至腸道損傷部位直接通過腹腔途徑而不需要CCR2和Nr4a1
3、腹腔巨噬細胞向腸道損傷部位聚集依賴于ATP和透明質酸-CD44的相互作用
ATP是無菌損傷中一個重要的損傷相關分子模式(DAMP),它召集中性粒細胞和巨噬細胞到損傷部位。用apyrase,一種ATPase或ATP受體拮抗劑預處理可抑制大F4/80hi巨噬細胞在腸道損傷部位的積聚(Fig. 3a, b)。為了進一步探討腹腔巨噬細胞動力學在腸道損傷中的機制,阻斷GATA6+腹腔巨噬細胞上高表達的白細胞粘附分子CD44,并對腸道損傷部位進行了成像。Anti-CD44預處理可防止F4/80hi巨噬細胞向腸道損傷部位聚集(Fig. 3c, d)。重要的是,免疫熒光染色顯示,CD44的配體透明質酸暴露在腸道損傷部位,而不是漿膜表面(Fig. 3e)。用透明質酸酶(一種分解透明質酸的酶)也能阻止腹腔巨噬細胞的招募(Fig. 3f)。并且粘膜側的損傷導致漿膜表面F4/80hi巨噬細胞的積累,這表明這些積累機制在嚴重的粘膜損傷中也有部分作用(Fig. 3g, h)。
圖3腹腔巨噬細胞向腸道損傷部位的聚集依賴于ATP和透明質酸-CD44的相互作用
4、腸道微生物組不是募集GATA6+腹膜巨噬細胞響應腸道損傷的關鍵
招募CCR2+巨噬細胞至腸道和轉換CX3CR1+單核/巨噬細胞是依賴于腸道微生物組的無論是在急性修復還是穩態翻轉中。由于燒傷從漿膜一直延伸到固有層,所以作者預測腸道微生物群對GATA6+腹腔巨噬細胞的招募至關重要。從出生前到成年期一直使用廣譜抗生素(Abx)(Fig. 4a),通過SYTOX綠色染色檢測證實了小鼠腸道菌群數量的減少(Fig. 4b)。16S測序也表明了Abx處理小鼠的腸道菌群發生了顯著改變(Fig. 4c),然而,這些改變對CD11bhiF4/80hiGATA6+腹腔巨噬細胞的數量沒有影響,對腸道損傷部位聚集的大F4/80hiGATA6+巨噬細胞也沒有影響(Fig. 4c–f),表明大腹腔巨噬細胞募集表型是不依賴于腸道微生物組的。此外,CD44的表達也沒有明顯受到腸道菌群巨變的影響(Fig. 4c, d)。
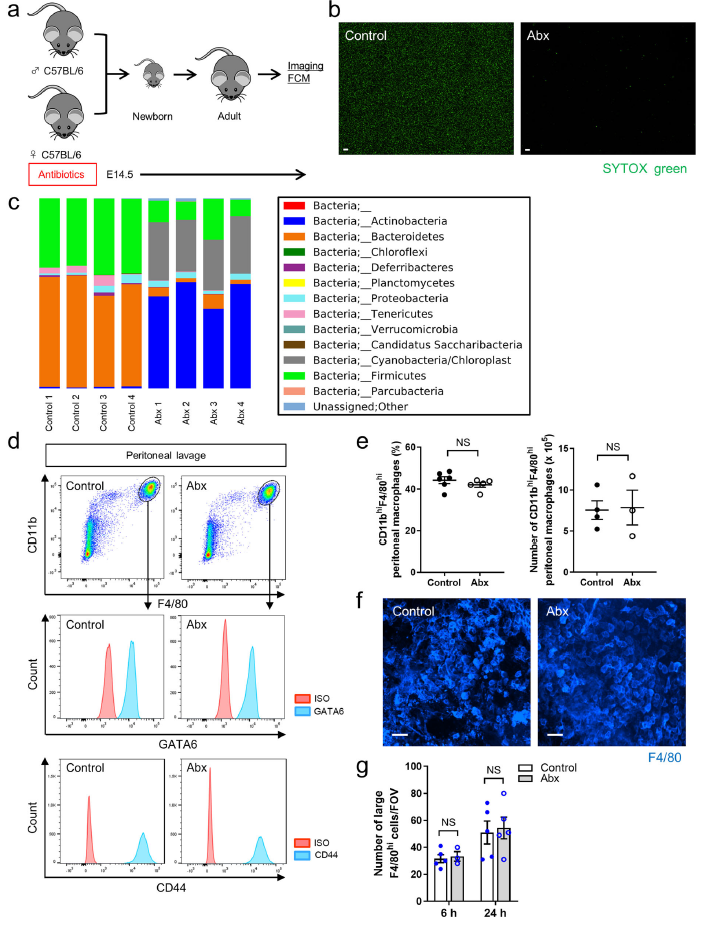
圖4在腸道損傷過程中腸道微生物組不影響腹腔巨噬細胞表現和動態
5、腹腔巨噬細胞促進腸道修復
作者此前研究發現Ccr2RFP/RFP小鼠在傷后48h的愈合延遲。熱損傷后24小時的結腸延時成像顯示,大F4/80hi巨噬細胞已經在附近分解SYTOX+壞死細胞 (Fig. 5a)。接下來,通過腹腔注射CLL來清除腹腔巨噬細胞后,對腸道損傷部位SYTOX綠色陽性細胞進行成像。在損傷后48小時,與PBS -脂質體(PBS-L)處理的小鼠相比,CLL處理的小鼠壞死細胞的清除被延遲 (Fig. 5b, c)。此外,腹腔巨噬細胞敲除與腸損傷部位血管重建和膠原沉積明顯受損有關(Fig. 5d–g)。在腹膜macrophage-depleted Ccr2RFP / RFP小鼠中SYTOX-positive細胞的清除缺乏更加明顯(圖5 b, c),這表明CCR2+單核細胞(可變成CX3CR1 +單核細胞/巨噬細胞)和大GATA6 +腹膜巨噬細胞都可作用于清除壞死細胞,也許發生在小腸的不同層。事實上,受損結腸的成像顯示CCR2+單核細胞主要聚集在固有層,而F4/80hi巨噬細胞主要聚集在肌層。

圖5腹腔巨噬細胞促進腸道修復
6、腹腔巨噬細胞聚集至結腸以響應DSS誘導的腸炎
為了評估腹膜巨噬細胞是否可以對從固有層開始并向漿膜發展的炎癥作出反應,小鼠口服含有 4% DSS 的水5天。F4/80抗體局部應用于漿膜的LyM- eGFP小鼠結腸活體顯像顯示LysM+F4/80hi大巨噬細胞浸潤肌層(Fig. 6a, b)。當將來自LysM-eGFP小鼠的腹膜細胞腹腔內轉移到C57BL/6小鼠,一個類似的積累即腹腔LysM+F4/80hi巨噬細胞被發現在DSS誘導的結腸炎中積累(Fig. 6c–e)。同樣使用DSS誘導Cx3cr1GFP/+Ccr2RFP/+小鼠結腸炎,發現沒有CCR2+或CX3CR1+信號與大F4/80hi巨噬細胞共定位(Fig. 6f),表明這些是不同的細胞譜系。這些結果表明這些大有效性巨噬細胞來源于腹腔,而不是脈管系統。關于這一點,免疫熒光染色顯示,與對照組相比,DSS誘導的結腸炎結腸中透明質酸的表達增加(Fig. 6g, h)。如熱損傷模型所述,Abx治療不影響DSS誘導的結腸炎中F4/80hi腹腔巨噬細胞向結腸的聚集(Fig. 6i, j)。
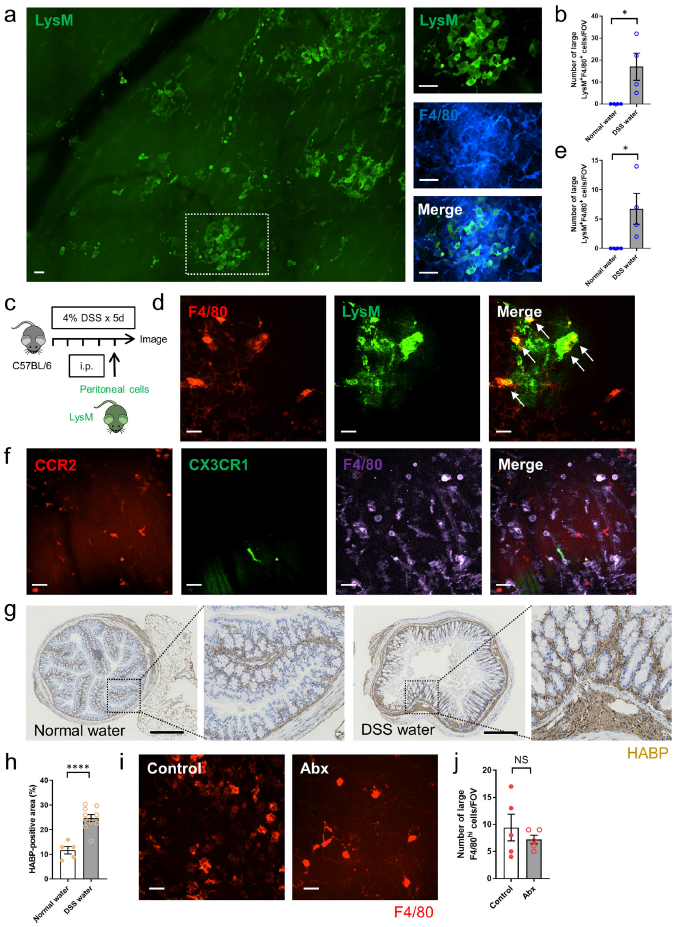
圖6在DSS誘導的腸炎中腹腔巨噬細胞聚集至結腸
為了進一步分析腹腔巨噬細胞在DSS誘導的結腸炎中的作用,通過腹腔注射CLL敲除小鼠的腹腔巨噬細胞然后檢測并與PBS-L處理的DSS小鼠比較小鼠的體重,疾病活性指數,結腸長度和病理發現。發現,CLL小鼠的損傷水平和炎癥水平增加,包括更嚴重的體重丟失和顯著增加的疾病活性指數(Fig. 7a, b)。此外,CLL處理小鼠的結腸長度,這是炎性損傷的標志,明顯短于DSS誘導的小鼠但是和PBS處理的沒有顯著性差異(Fig. 7c)。此外,DSS誘導5天后的結腸組織切片顯示CLL小鼠表現出更嚴重的病理組織損傷,包括炎性細胞浸潤和腸道結構紊亂(Fig. 7d, e)。最后對DSS誘導的結腸炎進行了腹膜細胞移植實驗,以評估其對炎癥和癥狀的影響(Fig. 7f)。與PBS處理對照組相比,腹腔細胞移植組的疾病活動性指數較低,其他參數差異無統計學意義(Fig. 7g–k)。
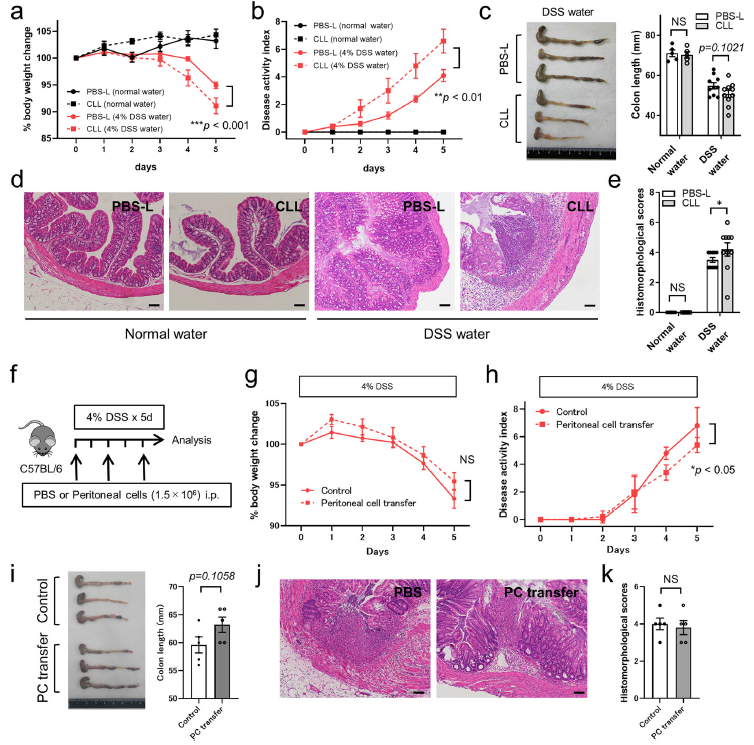
圖7腹腔巨噬細胞在DSS誘導的腸炎中發揮了組織修復功能
總之,在本研究中,作者發現了第三種有助于組織修復的巨噬細胞類型,即GATA6+腹腔巨噬細胞,它們通過腹膜途徑在損傷部位迅速積累,以應對漿膜內的腸道損傷。alarmin ATP和CD44 -透明質酸相互作用是其從腹腔招募到受損腸漿膜的關鍵,這導致GATA6+腹腔巨噬細胞組織修復獨立于CCR2+單核細胞來源的CX3CR1+單核細胞/巨噬細胞(圖8)。令人驚訝的是,當DSS結腸炎引起損傷時,這些細胞也可以在腸道中積累,DSS結腸炎是一種主要開始于固有層的損傷。

圖8機制模式圖:GATA6+腹腔巨噬細胞浸潤損傷的腸道通過直接腹膜途徑作用于組織修復。
參考文獻:
Honda Masaki., Kadohisa Masashi., Yoshii Daiki., Komohara Yoshihiro., Hibi Taizo.(2021). Directly recruited GATA6?+?peritoneal cavity macrophages contribute to the repair of intestinal serosal injury. Nat Commun, 12(1), 7294. doi:10.1038/s41467-021-27614-9






