M6A RNA甲基化介導的RMRP穩定性通過調控TGFBR1/SMAD2/SMAD3通路實現非小細胞肺癌的增殖
非小細胞肺癌(NSCLC)在全球所有惡性腫瘤中死亡率最高。長鏈非編碼 (lncRNAs)在癌癥進展中的作用是當前研究的熱點。鑒于RMRP對致瘤性的潛在調控作用,作者進一步研究RMRP在NSCLC中的的機制究。
技術路線:

主要結果:
1. RMRP可能是NSCLC的一種生物標志物
作者首先對癌癥基因組圖譜進行了綜合分析,TCGA肺腺癌(LUAD)數據庫分析顯示,RMRP在NSCLC組織中的表達高于正常組織(Fig.1A)。RMRP高表達與T分期晚期和較差的生存率相關(Fig.1B,C)。此外,GSE43458數據庫顯示,與正常肺組織相比,RMRP在NSCLC組織中表達上調比較 (Fig.1D)。
共表達研究是探索基因潛在功能的一種途徑。作者研究了TCGA數據庫中與RMRP共同表達的mRNA(cor > 0.4, p < 0.01)。GO結果表明,RMRP在蛋白質異二聚活性、染色質DNA結合、苦味受體活性等方面發揮作用(Fig.1E)。KEGG結果顯示,RMRP在酒精中毒、系統性紅斑狼瘡、病毒致癌、轉錄失調等通路中富集(Fig. 1F)。
然后進行KEGG研究的基因集富集分析(Gene Set Enrichment Analysis, GSEA)。RMRP在細胞周期、結直腸癌、蛋白出口、TGFB通路和泛素介導的蛋白水解通路中富集(Fig. 1G)。這些通路與腫瘤的發生和轉移密切相關,提示RMRP可能在NSCLC中發揮重要作用。研究表明,RMRP不具有蛋白質編碼潛力(Fig. 1H, I)。
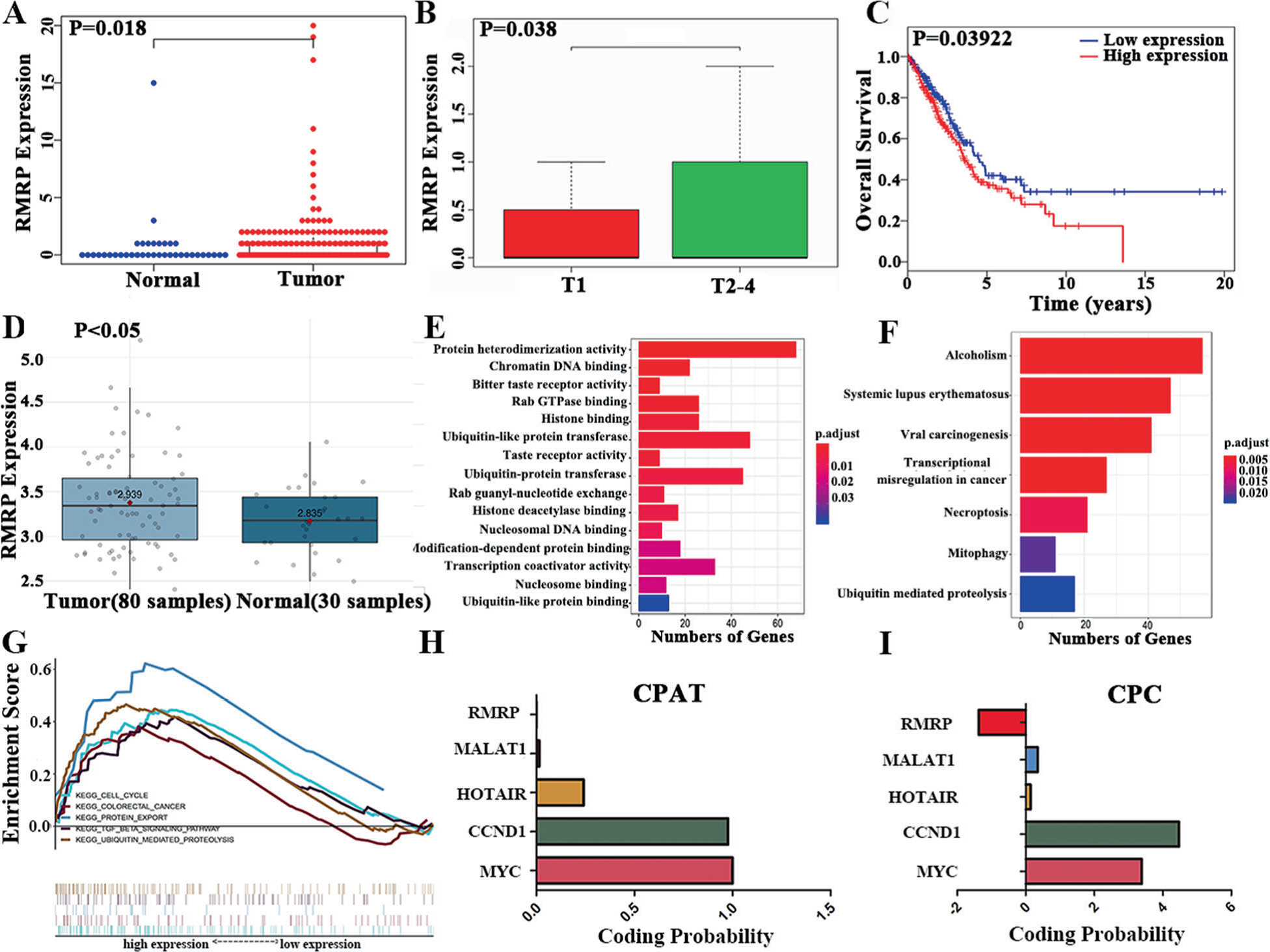
Fig 1:NSCLC的綜合分析表明lncRNA-RMRP是NSCLC患者潛在的分子標記物
2. m6A修飾在RMRP中富集,提高了RMRP轉錄本的穩定性
最近的初步研究報道,m6A的修飾廣泛存在,它調控轉錄組,影響RNA的剪接、翻譯、輸出、定位和穩定性。為了探究RMRP的m6A修飾,首先使用在線生物信息學工具m6Avar (http://m6avar.renlab.org/)預測了位于RMRP中的m6A位點,并確定了兩個RMRP m6A序列基序。
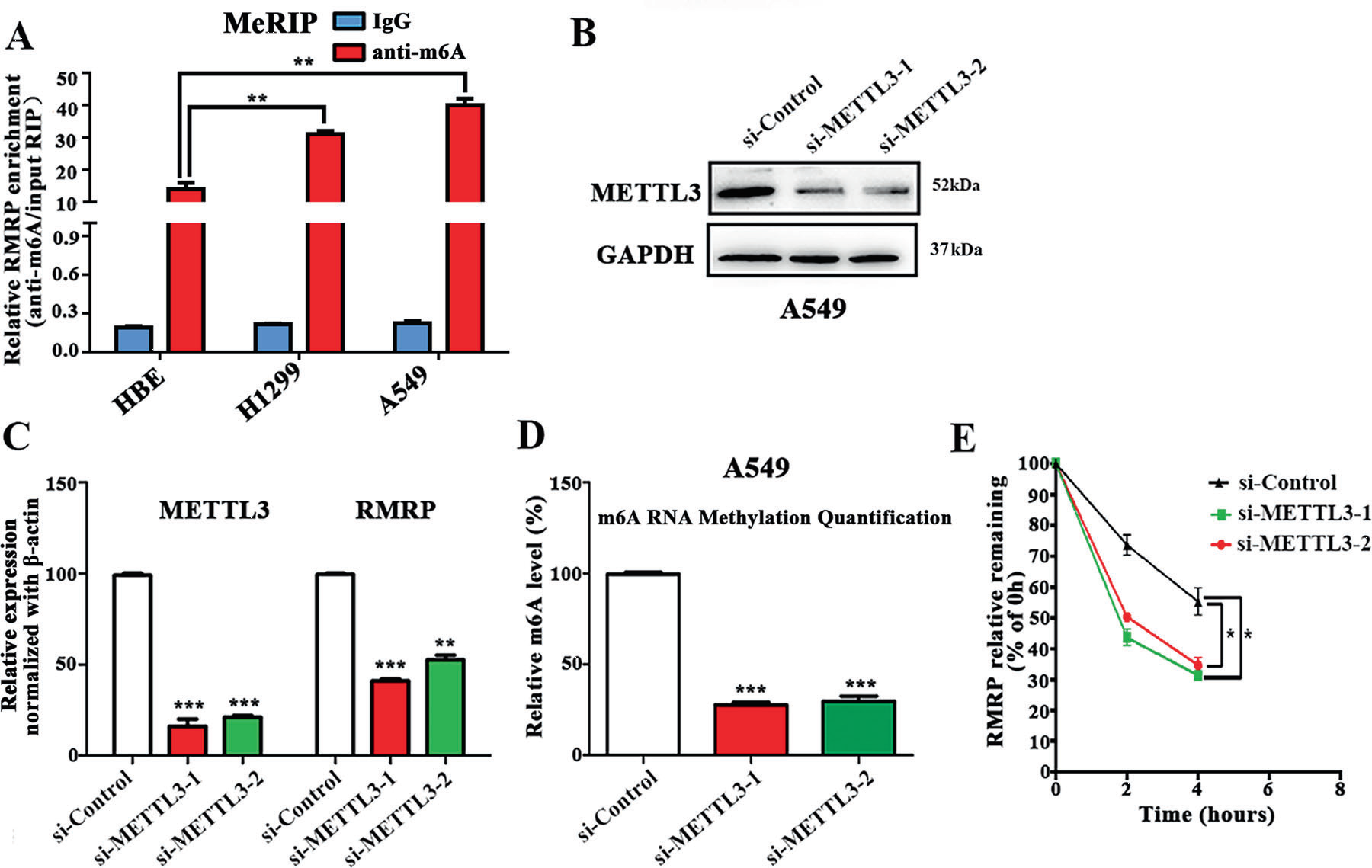
然后,在人正常肺上皮細胞(HBE)和兩種非小細胞肺癌細胞系(A549和H1299)中進行甲基化RNA免疫沉淀(Me-RIP)檢測。MeRIP-qPCR檢測顯示,HBE細胞系列中RMRP m6A甲基化水平低于NSCLC細胞(A549和H1299)(Fig 2A)。隨后我們使用了小RNA干擾m6A甲基化酶復合物的核心組分METTL3,結果發現A549細胞系中m6A水平在總RNA和RMRP中均有降低了 (Fig 2,B, C, D)。在A549細胞中,用放線菌素D (5 μg/mL)阻斷新RNA合成后,檢測RMRP RNA的丟失。結果顯示,下調METT3后,RMRP的RNA穩定性降低(Fig. 2E)。
此外,下調METT3后,miR-122或miR-206的表達增加,在A549細胞中過表達RMRP后,miR-122或miR-206的表達可被挽救。而METTL3過表達降低了H1299細胞中miR-122或miR-206的表達。以上結果提示,與肺正常上皮細胞相比,NSCLC細胞中RMRP的m6A水平上調,m6A的修飾可能提高了RMRP轉錄本的穩定性,這可能是NSCLC中RMRP顯著上調的原因之一。
3. RMRP促進NSCLC細胞增殖
為了進一步探討RMRP的作用,我們采用定量RT-PCR方法檢測了RMRP在NSCLC細胞中的表達。RMRP在A549細胞中的表達明顯高于H1299細胞系(Fig. 3A)。隨后,作者在A549細胞系中通過兩種不同的短發卡結構(shRMRP-1和shRMRP-2)轉染實現RMRP干擾,同時將RMRP過表達質粒轉染H1299細胞。通過定量驗證轉染效率(Fig.3B,C)。CCK-8和菌落形成實驗表明,shRMRP轉染的NSCLC細胞的生長和增殖受到明顯抑制,而轉染RMRP過表達質粒的NSCLC細胞的生長和增殖受到相反的影響(Fig. 3D–G)。

Fig 3 RMRP促進NSCLC細胞增殖
4. TGFBR1是RMRP促進增殖、入侵和遷移的關鍵靶點
TCGA數據庫顯示TGFBR1與RMRP的表達呈正相關(Fig 4A)。因此,作者假設RMRP可能針對TGFBR1。于是在A549或H1299細胞中敲低或過表達RMRP,TGFBR1的表達量隨之變化(Fig. 4B, C)。
此外,在A549細胞系中敲低RMRP,TGFBR1表達降低,BAX/bcl - 2增加,而TGFBR1過表達則相反。在H1299細胞中,RMRP過表達后,TGFBR1的表達增加,BAX/Bcl-2的表達減少,而TGFBR1敲除后則相反(Fig. 4D)。
此外,作者進一步探討TGFBR1參與RMRP促進NSCLC生長和增殖的機制。結果表明, shRMRP對非小細胞肺癌細胞生長和增殖的抑制作用通過TGFBR1過表達得到了緩解,而TGFBR1敲除后則發現相反的作用(Fig. 4E, F, H, J)。
接下來,我作者探討了RMRP對侵襲、遷移和G1細胞周期進展的影響。創傷愈合、transwell和細胞周期檢測表明,與對照組相比,轉染shRMRP的NSCLC細胞的侵襲、遷移和G1細胞周期進展明顯受到抑制,而在RMRP過表達細胞中觀察到相反的作用。此外,shRMRP對NSCLC細胞侵襲、遷移和G1細胞周期進程的抑制在TGFBR1過表達后被挽救,而在TGFBR1敲除后觀察到相反的作用(Fig. 4G, I, K, L, M, N)。這些結果表明,TGFBR1可能是RMRP促進增殖、入侵和遷移的關鍵靶點。
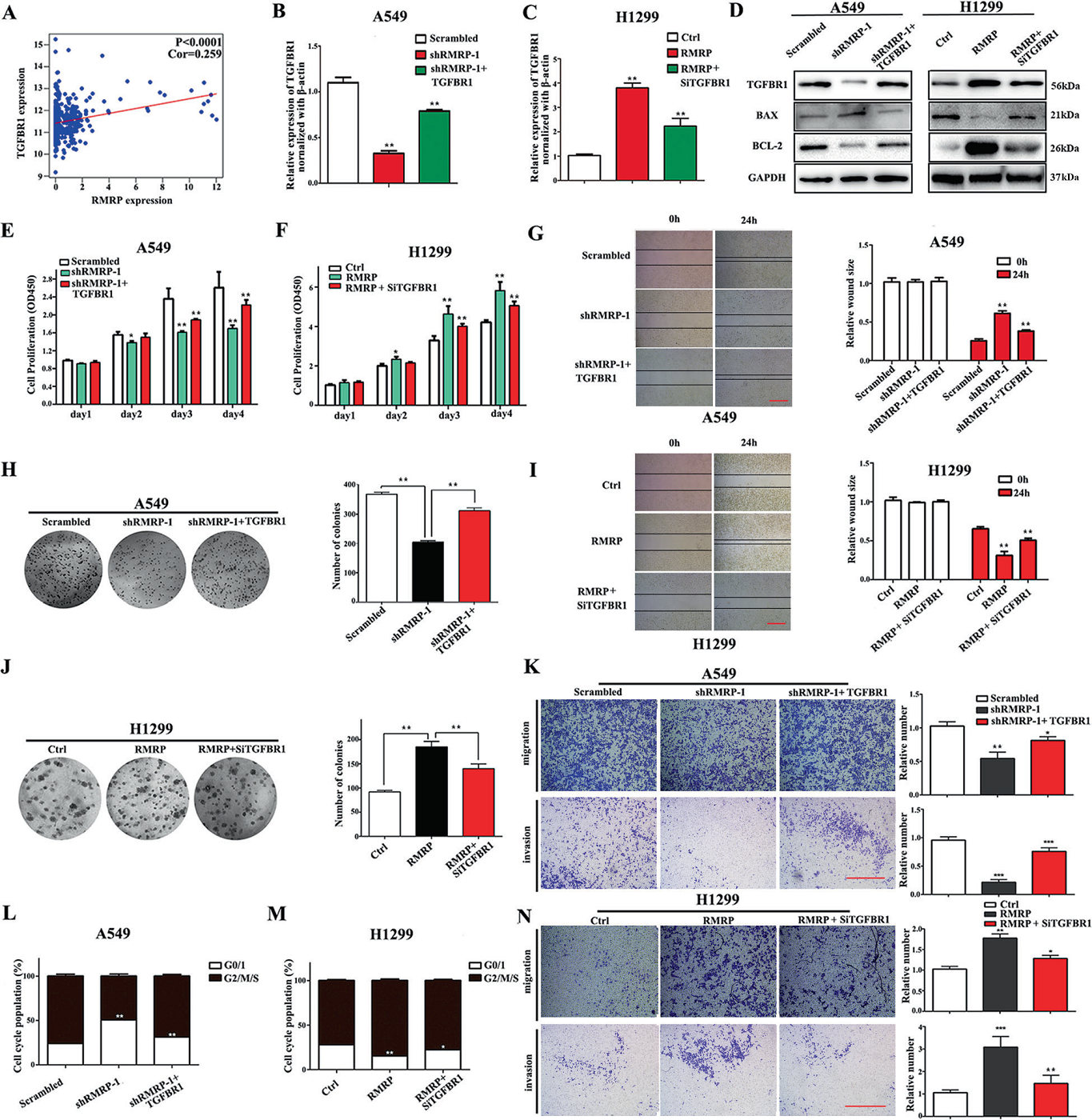
Fig 4 TGFBR1是RMRP促進增殖、入侵和遷移的關鍵靶點
5. RMRP與轉錄因子YBX1相互作用
為了進一步闡明RMRP的機制,作者在NSCLC細胞中進行了核和細胞質RNA的分離和熒光原位雜交(FISH)檢測。結果表明,RMRP主要位于細胞質中(Fig 5A,B)。最近的一些報道發現,許多lncRNAs通過與DNA或蛋白質相互作用而發揮功能。作者使用catRAPID探索RMRP的調控作用。結果表明,YBX1是RMRP潛在的結合蛋白,在NSCLC中起重要作用(Fig 5C)。RIP檢測結果顯示,抗YBX1抗體顯著富集RMRP(Fig 5D,E)。RNA下拉實驗進一步證實了RMRP與YBX1之間的相互作用(Fig. 5F)。總之,YBX1與RMRP之間存在密切的相互作用。
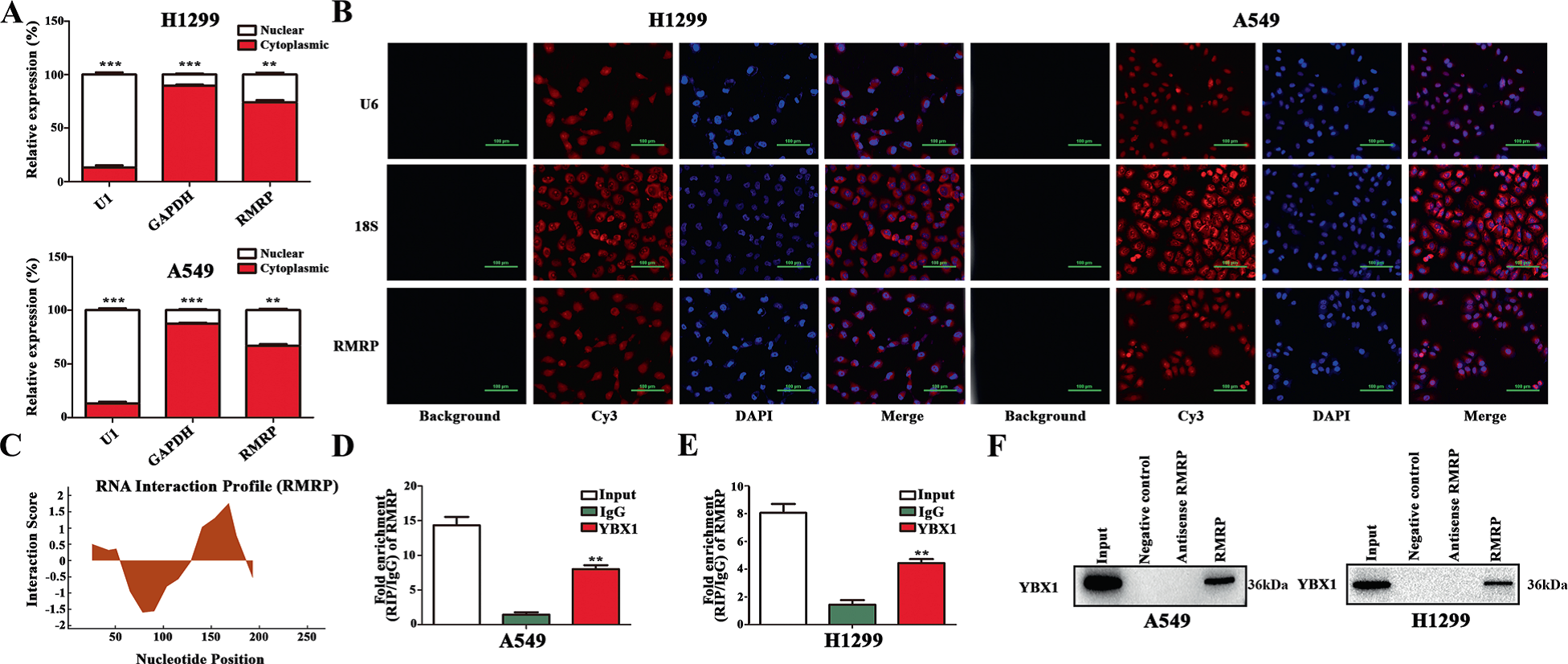
Fig 5 RMRP與轉錄因子YBX1相關
6. RMRP通過將YBX1招募到TGFBR1啟動子來促進TGFBR1的轉錄
接下來,通過研究TCGA-LUAD的ATAC-seq數據來確定TGFBR1可能的轉錄因子。該分析顯示TGFBR1基因啟動子區存在一個YBX1的潛在結合序列。對TCGA-LUAD數據庫進行分析顯示,YBX1的表達與TGFBR1呈正相關,與RMRP1無關(Fig. 6A–C)。因此,作者推測YBX1作為一個轉錄因子,可能被RMRP招募到TGFBR1啟動子中。接下來,分別將SiYBX1、pcDNAYBX1及其對照 SiNC、Ctrl分別轉染到細胞中,發現敲低YBX1會抑制TGFBR1的表達,而過表達YBX1促進了TGFBR1的表達(Fig. 6D)。
YBX1結合復合物顯著富集TGFBR1啟動子(Fig. 6E,F),在野生型TGFBR1 (TGFBR1- wt)的細胞中過表達YBX1增加了熒光素酶活性,而在表達突變型TGFBR1 (TGFBR1- mut)的細胞中沒有增加熒光素酶活性(Fig. 6G,H)。RMRP的敲低降低了YBX1在 TGFBR1啟動子上的富集,而這種作用通過共轉染YBX1的 被逆轉(Fig. 6I)。此外,RMRP還加強了結合能力(Fig. 6J)。熒光素酶實驗進一步揭示了熒光素酶活性的變化是由于抑制或過表達RMRP引起的(Fig.6K.L)。

Fig 6 RMRP通過將YBX1招募到TGFBR1啟動子來促進TGFBR1的轉錄
7. RMRP調控TGFBR1/SMAD2/ SMAD3通路
Western blot和免疫熒光分析顯示,在非小細胞肺癌細胞中,RMRP基因敲除顯著抑制了p-SMAD2/3的核轉運和表達(Fig7A,B)。為進一步探討RMRP是否可以通過調控TGFBR1轉錄外的其他方式影響TGFB信號傳導,作者在NSCLC細胞中TGFBR1進行敲低處理,Western blot結果顯示,RMRP的改變對siTGFBR1組中p-SMAD2和p-SMAD3的表達水平沒有影響,說明TGFBR1在激活SMAD2/SMAD3信號通路中是不可或缺的(Fig. 7C)。TGFB通路通常與CSC特性和EMT相關。因此,作者探討了RMRP是否促進了NSCLC中CSC的性質。通過qRT-PCR檢測CSC相關基因(KLF4,SOX2、NANOG、CD133、ALDH)的表達,發現在A549細胞中,RMRP敲低后這些基因的表達都降低了。而在H1299細胞中過表達RMRP后,這些基因表達上調(Fig. 7D)。
此外,作者還探索了這些細胞中的EMT相關基因。結果顯示,RMRP敲除增加了E-鈣粘蛋白的表達,降低了N-鈣黏蛋白和波形蛋白的表達 (Fig. 7A)。此外,我們還研究了這些細胞的成球能力。結果表明,敲低RMRP的表達降低了成球能力,而過表達RMRP增加了這種能力(Fig. 7E)。
此外,RMRP抑制增加了A549細胞對順鉑和放療的敏感性(Fig. 7F,G)。這些數據表明,RMRP通過增強CSC的自我更新和EMT促進NSCLC的進展。

Fig 7 RMRP調控NSCLC中TGFBR1/SMAD2/ SMAD3通路
8. RMRP的下調限制了體內腫瘤的生長
為了進一步證實RMRP在體內促進腫瘤生長,將A549-shRMRP細胞和a549 - scramble細胞注射到裸鼠體內。30天后,shRMRP組腫瘤明顯變小(Fig. 8A、B),在shRMRP中,腫瘤體積和重量明顯降低(Fig. 8C, D)。此外,A549 -Scrambled組中Ki-67、MMP9和TGFBR1的表達量較高(Fig. 8E)。
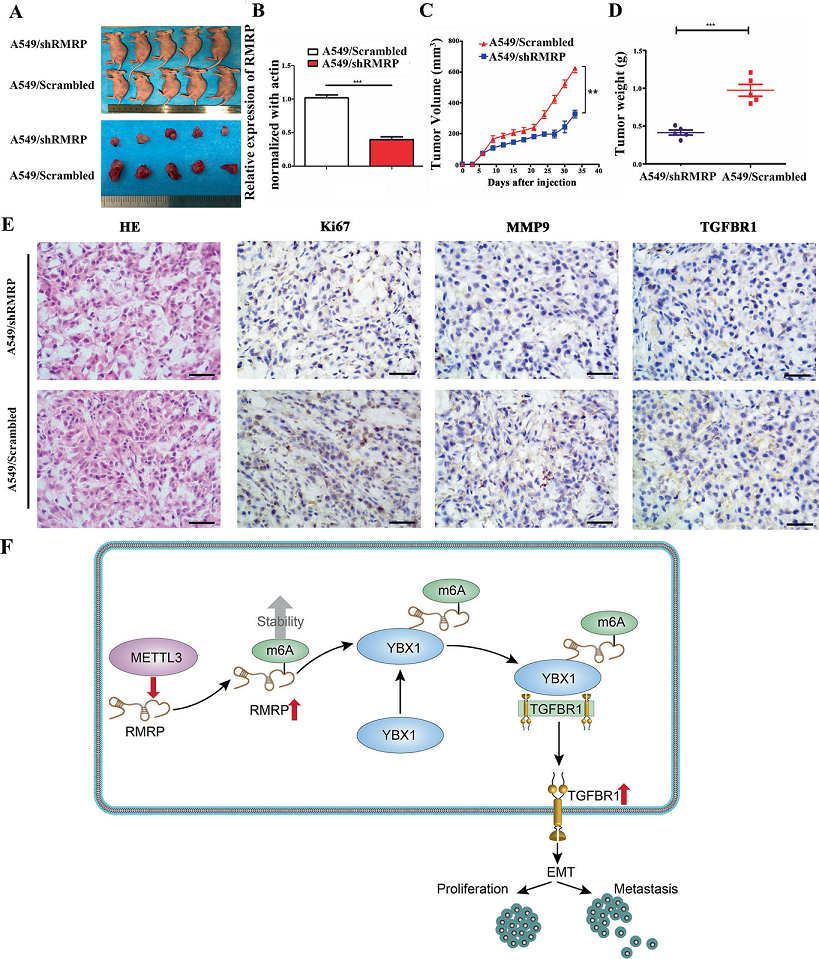
Fig8 RMRP的下調限制了體內腫瘤的生長
本研究中,作者發現研究表明,m6A RNA甲基化介導的RMRP的穩定性通過調控TGFBR1 / SMAD2 / SMAD3通路實現了NSCLC的增殖和進展。
參考文獻:
Yin, H., et al., M6A RNA methylation-mediated RMRP stability renders proliferation and progression of non-small cell lung cancer through regulating TGFBR1/SMAD2/SMAD3 pathway. Cell Death Differ, 2021.






