CircRNA-DOPEY2增強食管癌細胞的化療敏感性
以順鉑為基礎的化療是晚期食管鱗癌(ESCC)的主要系統治療方法,而順鉑耐藥并不少見,是改善患者預后的主要障礙。circRNAs是一種新型非編碼RNA,與癌癥進展有關,但它們在ESCC中調節順鉑反應的作用尚不清楚。我們提供的證據表明,cDOPEY2通過促進CPEB4的泛素化和降解來抑制CPEB4介導的Mcl-1翻譯,從而緩解順鉑耐藥,表明cDOPEY2可能在ESCC中作為有價值的生物標志物和潛在的治療靶點。本文于2021年11月發表在“Journal of Experimental & Clinical Cancer Research”(IF: 11.161)期刊上。
技術路線

結果
1)cDOPEY2在順鉑耐藥ESCC細胞中下調及其特性
為了探索ESCC細胞順鉑耐藥的分子機制,我們首先建立了兩種順鉑耐藥ESCC細胞系(Eca109-CR和TE1-CR)。如圖1A所示,兩種順鉑耐藥細胞株在順鉑處理后的存活率均高于親本細胞。我們分析了來自GEO數據集(GSE131969)的circRNA在ESCC中的表達譜(圖1B)。在5個上調最高和5個下調最高的circRNA中,根據RNase R處理結果顯示7個是真實的circRNA (圖1 C)。我們進一步通過qRTPCR驗證了這些circRNAs在Eca109-CR/Eca109和TE1-CR/TE1細胞中的表達,發現與順鉑耐藥細胞相比,只有來自DOPEY2基因的hsa_circ_0008078在順鉑耐藥細胞中一致且顯著下調(圖1D)。因此,我們進一步研究了hsa_ circ_0008078,命名為cDOPEY2,在ESCC細胞順鉑耐藥中的作用。來自circBase的注釋揭示了cDOPEY2起源于DOPEY2基因在第20 ~ 24外顯子之間的反向剪接(圖1E)。接下來,我們利用幾種方法來描述cDOPEY2的性質。我們首先通過Sanger測序確定了cDOPEY2的反向剪接位點(圖1F),然后使用不同的引物從cDNA中擴增cDOPEY2,而不是從gDNA中擴增(圖1 G)。接下來,進行放線菌素D處理,證實cDOPEY2比其親本宿主基因更穩定(圖1H)。此外,與oligo (dT)引物反轉錄的樣品相比,cDOPEY2在隨機六聚體反轉錄的樣品中顯著富集(圖1I)。亞細胞片段的qPCR和FISH分析顯示cDOPEY2主要位于細胞質中(圖1 J-K)。此外,對ESCC細胞株中cDOPEY2表達的評估顯示,與正常食管鱗狀上皮細胞株HECC和Het-1a相比,cDOPEY2在順鉑耐藥細胞中不僅顯著下調,而且在ESCC細胞株中也顯著降低(圖1 L)。這些結果揭示了一種新的環狀RNA (cDOPEY2)在順鉑耐藥的ESCC細胞中下調,表明cDOPEY2在介導順鉑耐藥中有潛在的抑制作用。

2)cDOPEY2通過增強順鉑誘導的ESCC細胞凋亡來降低順鉑耐藥
我們通過在順鉑耐藥細胞中過表達cDOPEY2,并在順鉑敏感細胞中沉默cDOPEY2,研究了cDOPEY2對ESCC順鉑耐藥的影響。細胞活力和集落形成試驗顯示,cDOPEY2高表達可使順鉑耐藥ESCC細胞對順鉑治療明顯敏感,而cDOPEY2耗盡則對親代ESCC細胞產生相反的影響(圖2 A-B),表明cDOPEY2在緩解順鉑耐藥中發揮重要作用。我們進一步通過Annexin-V/PI染色評估順鉑誘導的凋亡,清楚地顯示cDOPEY2過表達在順鉑耐藥細胞中促進了順鉑介導的凋亡(圖2 C-D)。一致地,cDOPEY2在順鉑處理的細胞中增強了caspase-3活性(圖2E)。由于順鉑通過誘導復制叉停止殺死腫瘤細胞,并隨后引起復制應激,我們下一步通過γ-H2AX染色研究cDOPEY2是否影響腫瘤細胞的DNA損傷。雖然與親代細胞相比,順鉑耐藥細胞的γ-H2AX染色明顯降低,但cDOPEY2并不影響順鉑誘導的DNA損傷(圖2F)。我們通過測定DNA損傷修復(DDR)通路的激活獲得了類似的結果(圖2G)。WB進一步檢測Bcl-2家族抗凋亡調節蛋白的豐度,發現cDOPEY2上調可顯著降低抗凋亡Mc1-1的表達。然而,其他抗凋亡蛋白,Bcl-xL和Bcl-2,在cDOPEY2改變后沒有變化(圖2H)。這些結果表明,cDOPEY2在緩解ESCC對順鉑的耐藥中發揮了重要作用,這種作用可能是通過增加順鉑誘導的凋亡過程而發揮的。接下來,我們通過檢測食管鱗癌患者臨床樣本中cDOPEY2的表達來探索其臨床意義。與鄰近的非腫瘤組織相比,81%的ESCC樣本中cDOPEY2顯著下調(圖2I)。在第二組接受順鉑治療的晚期ESCC患者中,與cDOPEY2腫瘤高表達患者相比,腫瘤樣本中cDOPEY2低表達與較低的緩解率和較差的無進展生存期(PFS)顯著相關(圖2J-K)。這些發現表明cDOPEY2有潛力成為預測ESCC患者順鉑反應性療效的合適標志物。

3)cDOPEY2與RNA結合蛋白CPEB4發生物理作用
我們進一步剖析了cDOPEY2減輕ESCC細胞順鉑耐藥的機制。首先,我們確定cDOPEY2主要定位于細胞質,如圖1 J-K所示。然而,AGO2 RIP顯示cDOPEY2沒有與AGO2共免疫沉淀,這表明它可能不作為競爭性RNA。第二,cDOPEY2未發現潛在的開放閱讀框或內部核糖體進入位點序列。第三,cDOPEY2不能影響其宿主基因DOPEY2的表達。綜上所述,我們假設cDOPEY2在細胞質中起蛋白質支架的作用。為了驗證我們的假設,我們進行RNA下拉實驗和質譜分析(圖3A-B)。我們對cDOPEY2過表達的Eca109-CR細胞提取物進行質譜分析,并與對照細胞比較,共鑒定出39個異常蛋白(圖3D)。GO分析顯示,這些蛋白與藥物響應和凋亡調控顯著相關(圖3C)。在cDOPEY2富集量最高的10個蛋白中,只有CPEB4受到cDOPEY2的顯著調控(圖3E)。cDOPEY2具有CPEB4的結合序列(UUUUA)(圖3 F)。此外,CPEB4在cDOPEY2過表達后表現出最顯著的差異表達(圖3D)。這些結果強烈提示CPEB4不僅與cDOPEY2結合,而且受cDOPEY2調控。因此,我們通過RNA下拉和RIP實驗證實了cDOPEY2和CPEB4之間的相互作用(圖3G-H)。此外,RNA FISH免疫熒光分析顯示cDOPEY2與細胞質中的CPEB4蛋白共定位(圖3I)。CPEB4的RNA識別基序(RRMs)是CPEB4與含有UUUA序列的RNA相互作用所必需的。為了進一步闡明CPEB4和cDOPEY2之間的結合機制,我們構建了一些缺失RRM1、RRM2或兩者都缺失的CPEB4的截短片段(圖3J)。RIP證明CPEB4和cDOPEY2的結合需要兩個RRMs,因為RRM1和RRM2的刪除降低了cDOPEY2和CPEB4的結合水平,同時刪除兩個RRMs完全喪失了它與cDOPEY2的結合能力(圖3K)。為了確認cDOPEY2是否通過其UUUUA序列與CPEB4相互作用,我們將cDOPEY2 UUUUA序列突變為GACCG,這顯著減少了CPEB4與cDOPEY2的相互作用(圖3 L)。這些數據證實了CPEB4與cDOPEY2物理結合。
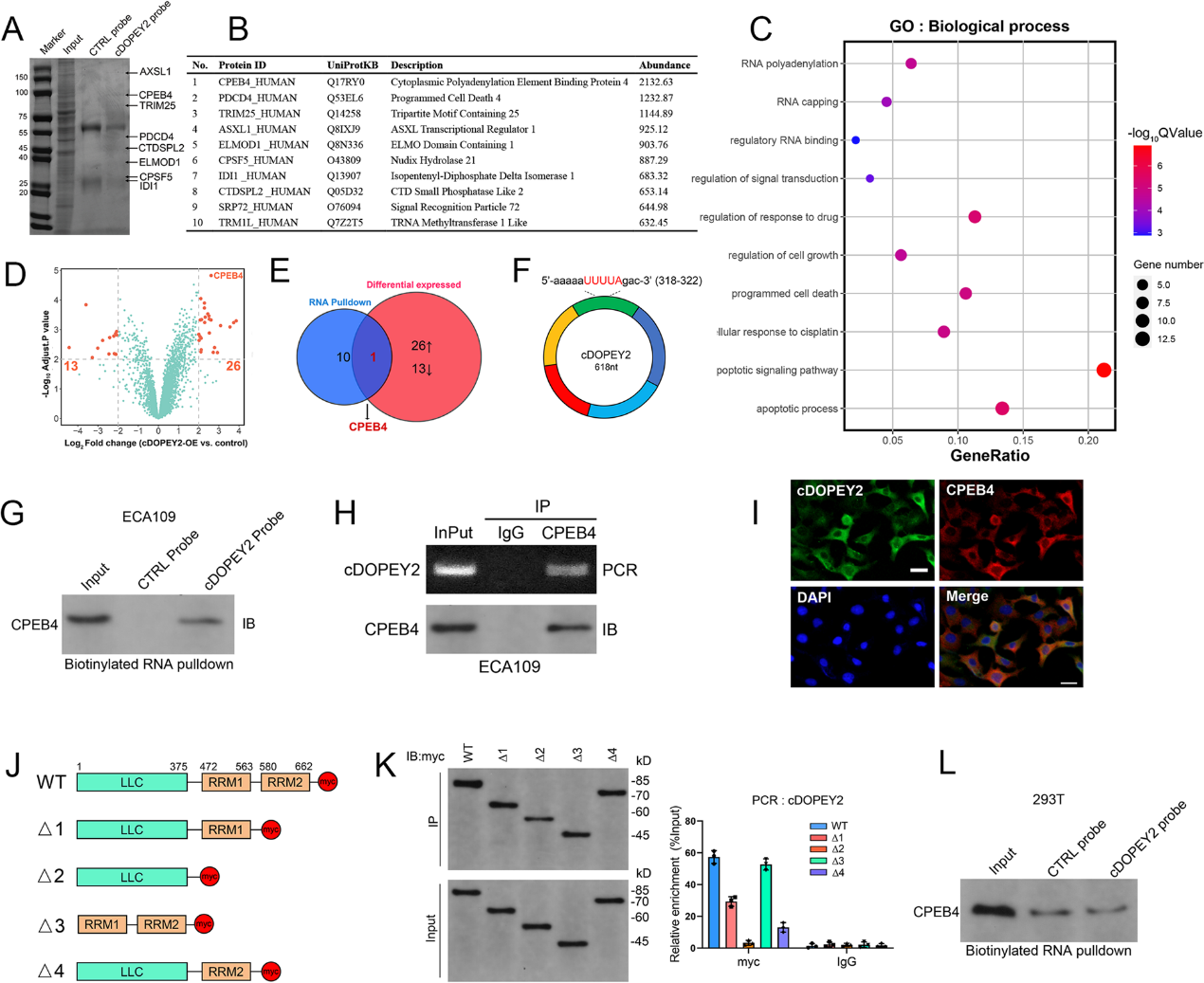
4)CPEB4是一種癌基因,可增強ESCC細胞中的順鉑耐藥,并被cDOPEY2靶向
TCGA數據集的生存分析證實了CPEB4在ESCC中的致癌作用(圖4A)。此外,ESCC樣本中的CEPB4蛋白水平遠高于鄰近的非腫瘤組織(圖4B)。為了確定CPEB4的耗盡是否介導cDOPEY2的化療敏感效應,我們首先檢測了CPEB4在順鉑耐藥細胞中的表達。WB結果顯示,與親代細胞相比,順鉑耐藥細胞中CPEB4的表達顯著增加,而cDOPEY2過表達降低了CPEB4的表達。而cDOPEY2沉默增加了CPEB4的表達(圖4C)。我們進一步在順鉑耐藥的ESCC細胞中過表達CPEB4,并在親代細胞中沉默CPEB4。cDOPEY2在親代Eca109細胞中敲低顯著增加了順鉑治療后的細胞活力和克隆形成能力,而cDOPEY2沉默誘導的化療耐藥性在敲低CPEB4后幾乎受損。相反,TE1-CR細胞過表達cDOPEY2后對順鉑敏感性的增強在很大程度上被CPEB4的過表達所挽救(圖4D-E)。在順鉑誘導的細胞凋亡方面,通過Annexin-V/PI FACS分析和caspase-3活性可以看出,cDOPEY2缺失導致親本ECA109細胞獲得順鉑耐藥,而這些作用在CPEB4敲低后基本被消除。我們在TE1-CR細胞中觀察到類似的結果,過表達CPEB4極大地恢復了過表達cDOPEY2細胞的順鉑耐藥(圖4F-G)。CPEB4敲低后,cDOPEY2耗盡誘導的抗凋亡蛋白Mcl-1的表達明顯被阻斷,而CPEB4過表達則完全逆轉了cDOPEY2抑制的Mcl-1的表達(圖4 H)。這些數據提示cDOPEY2通過抑制CPEB4使ESCC細胞對順鉑致敏。
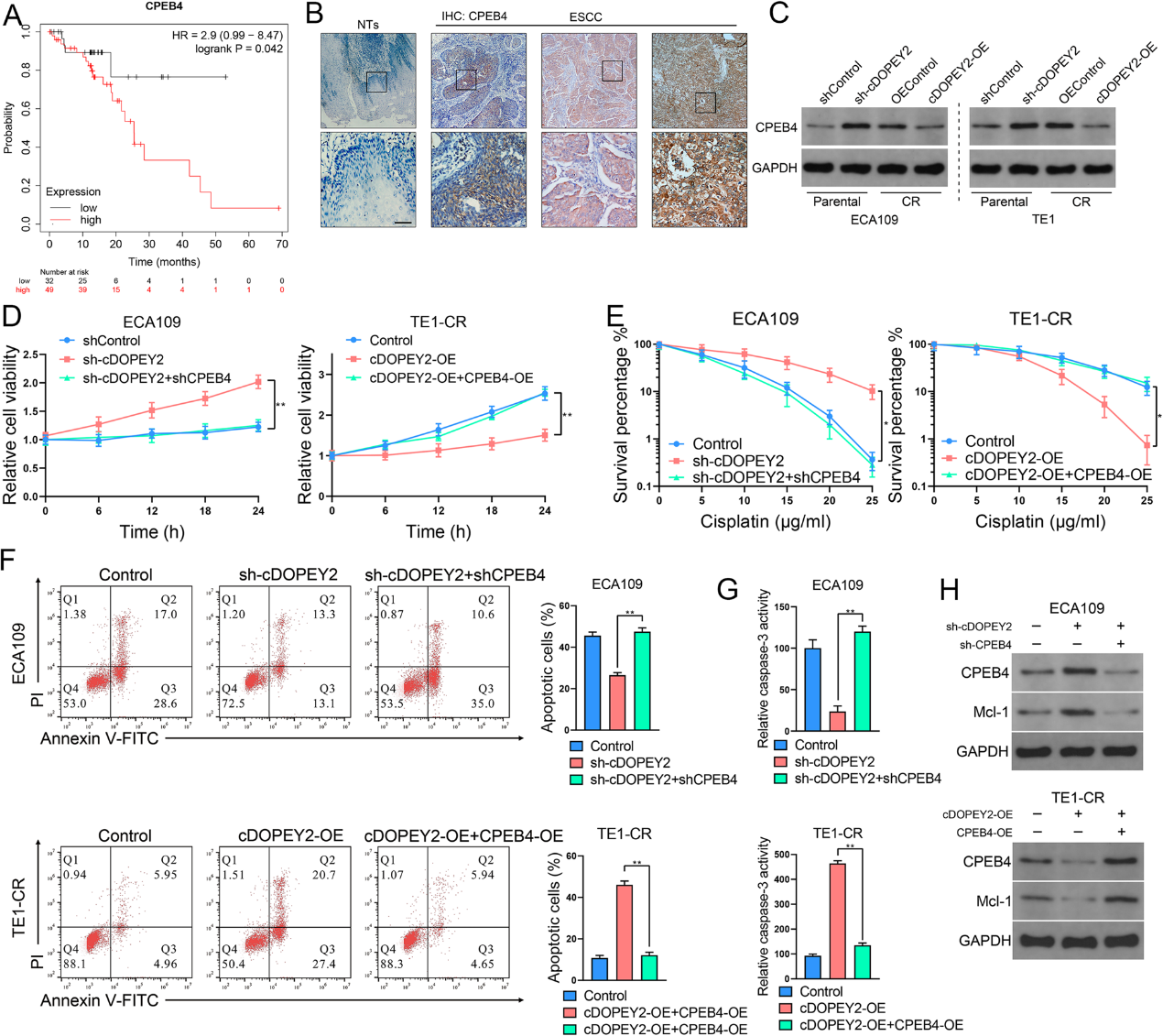
5)cDOPEY2通過增強CPEB4蛋白的泛素化來降低其穩定性
如圖4C所示,雖然cDOPEY2負調控CPEB4的蛋白表達,但cDOPEY2對CPEB4的mRNA表達沒有顯著影響(圖5A)。我們還發現沉默cDOPEY2提高了CPEB4蛋白的穩定性(圖5B)。此外,在過表達cDOPEY2的細胞中,CPEB4蛋白表達的降低被蛋白酶體抑制劑MG132完全逆轉(圖5C)。因此,我們推測cDOPEY2可能通過增強CPEB4泛素/蛋白酶體依賴性的降解而降低CPEB4的穩定性。與我們的假設一致,cDOPEY2過表達強烈促進了CPEB4的泛素化,而cDOPEY2敲低則顯著抑制了這一現象(圖5E)。這些數據表明cDOPEY2通過誘導CPEB4的泛素化而抑制CPEB4。
我們進一步探索了E3連接酶,負責cDOPEY2介導的CPEB4的泛素化。在MS檢測到的與cDOPEY2共沉淀的所有蛋白中,只鑒定到一種E3連接酶TRIM25(圖3 A-B,5D)。此外,TRIM25在蛋白水平上負調控CPEB4的表達,而不在mRNA水平上負調控(圖5F)。據報道,TRIM25的RNA結合活性對其靶向蛋白的有效泛素化至關重要。RNA FISH免疫熒光分析顯示cDOPEY2與TRIM25在細胞質中共定位(圖5G), RIP和RNA下拉實驗證實了cDOPEY2與TRIM25的結合(圖5 H)。cDOPEY2過表達顯著增強了TRIM25對CPEB4降解的影響。而TRIM25的敲除在很大程度上逆轉了cDOPEY2介導的效應(圖5I)。這些結果表明cDOPEY2可能作為支架增強TRIM25與CPEB4之間的相互作用。然后我們探究TRIM25對CPEB4的泛素連接酶活性是否依賴于cDOPEY2。為了實現這一目標,我們構建了一個myc標記的TRIM25片段,其中一部分RBD被刪除(ΔRBD, 470-508 aa刪除,圖5 L)。IP分析證實,RBD的刪除嚴重削弱了TRIM25與CPEB4結合的能力,而RNase A(一種阻斷cDOPEY2與TRIM25相互作用的RNA外切酶)處理和cDOPEY2沉默也削弱了TRIM25與CPEB4之間的相互作用(圖5 K)。值得注意的是,轉染缺乏RBD的TRIM25、RNase A處理和cDOPEY2敲除均削弱了TRIM25對CPEB4降解和泛素化的影響(圖5 J,M)。總的來說,cDOPEY2作為支架增強TRIM25和CPEB4之間的相互作用,從而增強TRIM25依賴的泛素化和蛋白酶體降解。

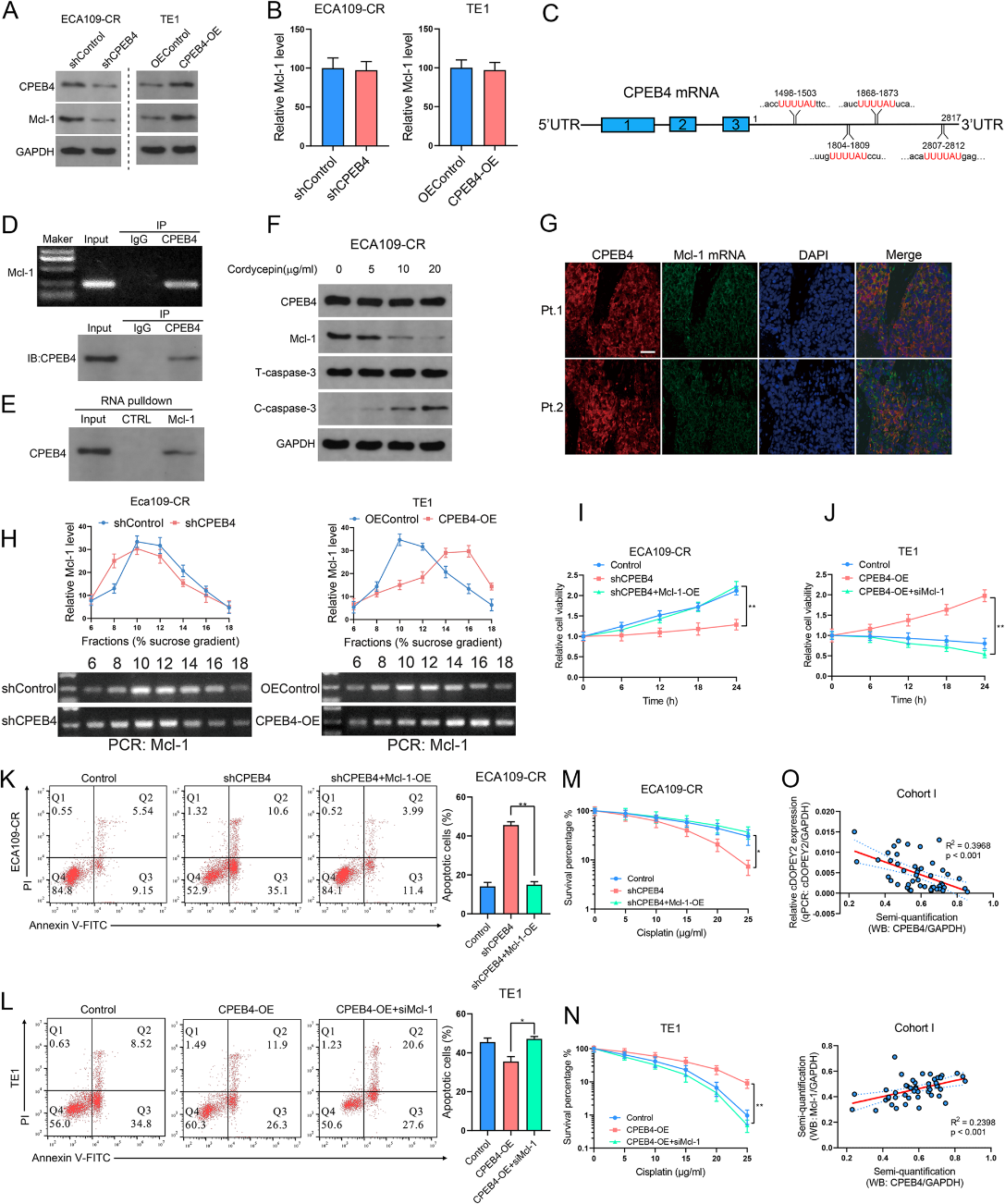
6)CPEB4通過促進抗凋亡蛋白Mcl-1的翻譯上調其表達
如圖2H所示,cDOPEY2降低了抗凋亡蛋白Mcl-1的表達。因此,我們想知道cDOPEY2對Mcl-1的抑制作用是否通過其下游靶基因CPEB4的表達減少來介導。重要的是,CPEB4過表達或沉默后Mcl-1蛋白表達的上調或下調并未在mRNA水平上被證實,這表明CPEB4介導的Mcl-1調控是在轉錄后水平上被調控的(圖6A-B)。CPEB4促進細胞質多聚腺苷酸化和含有細胞質多聚腺苷酸化元件(CPE)的mRNA的翻譯激活。值得注意的是,由于我們在Mcl-1 mRNA的3'UTR中發現了幾個CPE(圖6 C),我們推測CPEB4通過促進Mcl-1的翻譯上調了Mcl-1的表達。為了支持這種可能性,RIP分析證實了CPEB4和Mcl-1 mRNA之間的相互作用(圖6D-E)。此外,蟲草素(一種已知的CPEB4介導的聚腺苷酸化抑制劑)處理降低了Mc1-1的蛋白表達,并伴有cleaved caspase-3的表達增加,這些效應是劑量依賴的(圖6f)。FISH免疫熒光檢測證實CPEB4與ESCC組織中的Mc1-1 mRNA共定位(圖6G)。我們通過核糖體富集實驗驗證CPEB4對Mcl-1翻譯的調控作用。與對照細胞相比,在過表達CPEB4的細胞中,Mcl-1 mRNA的分布從輕聚體轉移到重聚體,而CPEB4沉默將含有Mc1-1 mRNA的部分從輕聚體轉移到單聚體(圖6 H),證實了CPEB4通過促進Mcl-1的翻譯上調了Mcl-1的表達。通過細胞活力、菌落形成和凋亡檢測,Mcl-1過表達顯著挽救了CEPB4沉默對順鉑耐藥的影響(圖6I-K)。此外,消耗Mcl-1完全消除了CPEB4誘導的增強化療耐藥性(圖6 K-M)。我們還分析了臨床樣本中CPEB4、cDOPEY2和Mcl-1的共表達模式,發現在隊列I中,CPEB4蛋白水平與cDOPEY2 RNA水平呈負相關,但與Mcl-1蛋白豐度呈正相關(圖6O)。綜上所述,這些結果表明cDOPEY2通過抑制CPEB4誘導的Mcl-1翻譯而增加了ESCC中的順鉑耐藥。
7)cDOPEY2抑制ESCC異種移植細胞的致瘤性并提高順鉑敏感性
我們驗證了cDOPEY2在體內對ESCC的生物學影響。小鼠每2天腹腔注射順鉑(圖7A)。結果表明,沉默cDOPEY2進一步增強了Eca109-CR細胞的耐藥能力。相反,接種cDOPEY2過表達細胞的裸鼠對順鉑耐藥表現出明顯的敏感性,而在cDOPEY2過表達細胞中重新表達CPEB4則完全消除了cDOPEY2介導的效應(圖7B-C)。與體外結果一致,免疫組化證實與scramble組相比,sh-cDOPEY2組Mcl-1和CPEB4表達增加,過表達cDOPEY2組表達減少(圖7D)。總的來說,我們的結果顯示,cDOPEY2作為支架,以TRIM25依賴的方式促進CPEB4的泛素化和降解,從而通過抑制CPEB4促進Mcl-1翻譯,減輕ESCC細胞中順鉑耐藥從而促進順鉑誘導的凋亡(圖8)。

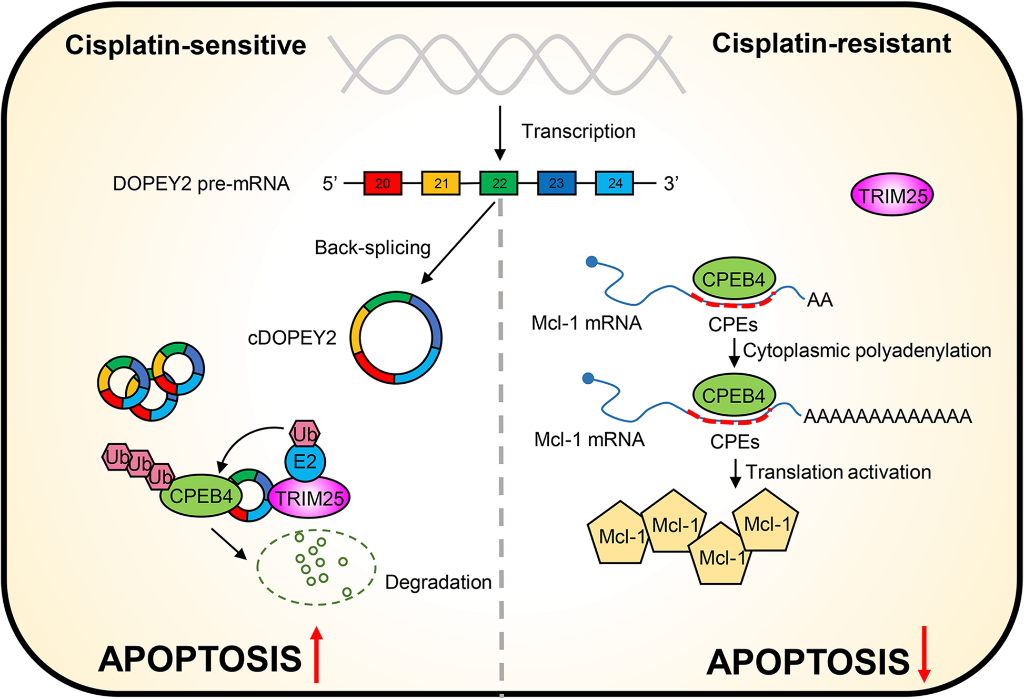
結論:我們提供了第一線綜合證據,證明cDOPEY2是維持順鉑敏感性的關鍵circRNA,也是ESCC的診斷/預后生物標志物。cDOPEY2通過形成CPEB4/cDOPEY2/TRIM25三元復合物,促進CPEB4的泛素化,進而拮抗CPEB4介導的Mcl-1翻譯,從而增強順鉑誘導的細胞凋亡和化療敏感性。我們的研究提供了一個潛在的靶點cDOPEY2,以拓寬管理策略,提高順鉑干預ESCC患者的臨床療效。
參考文獻:
Liu Z, Gu S, Wu K, Li L, Dong C, Wang W, Zhou Y. CircRNA-DOPEY2 enhances the chemosensitivity of esophageal cancer cells by inhibiting CPEB4-mediated Mcl-1 translation. J Exp Clin Cancer Res. 2021 Nov 15;40(1):361. doi: 10.1186/s13046-021-02149-5. PMID: 34781999; PMCID: PMC8591801.






