組蛋白去甲基化酶JMJD1C通過促進M1巨噬細胞極化預防膠質瘤
膠質瘤被認為是一種侵襲性致死的原發性腦腫瘤。JMJD1C是一種H3K9去甲基化酶,參與各種腫瘤的進展,但其在膠質瘤發展中的具體功能和潛在機制尚不明確。2021年9月發表于Clinical and Translational Medicine(IF=11.492)的文章“Histone demethylase JMJD1C promotes the polarization of M1 macrophages to prevent glioma by upregulating miR-302a”對此進行了介紹。在本文中,我們發現JMJD1C在膠質瘤組織中表達較差。此外,JMJD1C通過促進miR-302a啟動子區域的H3K9me1去甲基化而增加了miR-302a的表達。miR-302a可靶向METTL3,METTL3可通過m6A修飾抑制SOCS2表達。在體內和體外,JMJD1C通過miR-302a/ METTTL3 /SOCS2軸促進M1巨噬細胞極化,抑制異種膠質瘤生長。這為JMJD1C在膠質瘤病理生物學中的作用提供了新的視角,可能為靶向治療方法的研究提供了思路。

結果
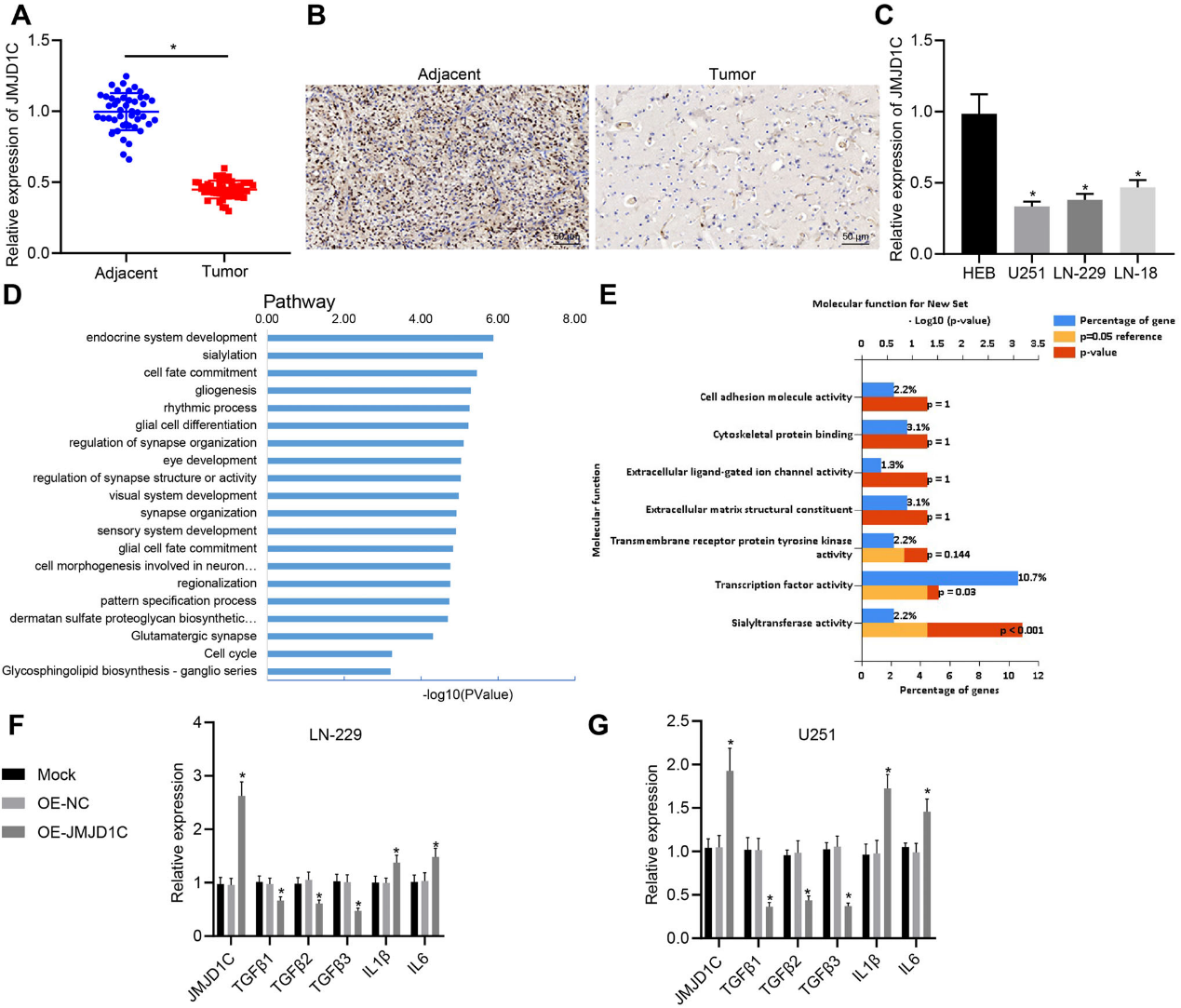
1)JMJD1C在膠質瘤中下調并與免疫反應相關
根據生物信息學分析結果,發現膠質瘤樣本中JMJT1C的表達呈下降趨勢。通過RT-qPCR和IHC檢測,與相鄰正常組織相比,膠質瘤組織中JMJD1C表達較差(圖1A,B)。同時,RT-qPCR顯示U251、LN-229和LN-18細胞中JMJD1C水平較HEB細胞低(圖1C)。我們采用高通量測序技術,在GBM LN-229細胞系中沉默JMJD1C后,研究基因的總體表達模式。JMJD1C的沉默改變了JMJD1C靶基因的表達。KEGG通路富集分析顯示,JMJD1C相關基因在腫瘤壞死因子(TNF)信號通路和免疫應答過程的元件中富集(圖1D,E),提示JMJD1C可能在LN-229細胞的免疫應答中發揮作用。隨后,在LN-229和U251細胞株中檢測免疫和炎癥相關基因水平,發現過表達JMJD1C可導致LN-229細胞中TGFβ 1-3表達降低,IL -1β和IL-6表達升高(圖1F,G)。因此,JMJD1C參與GBM的免疫應答。
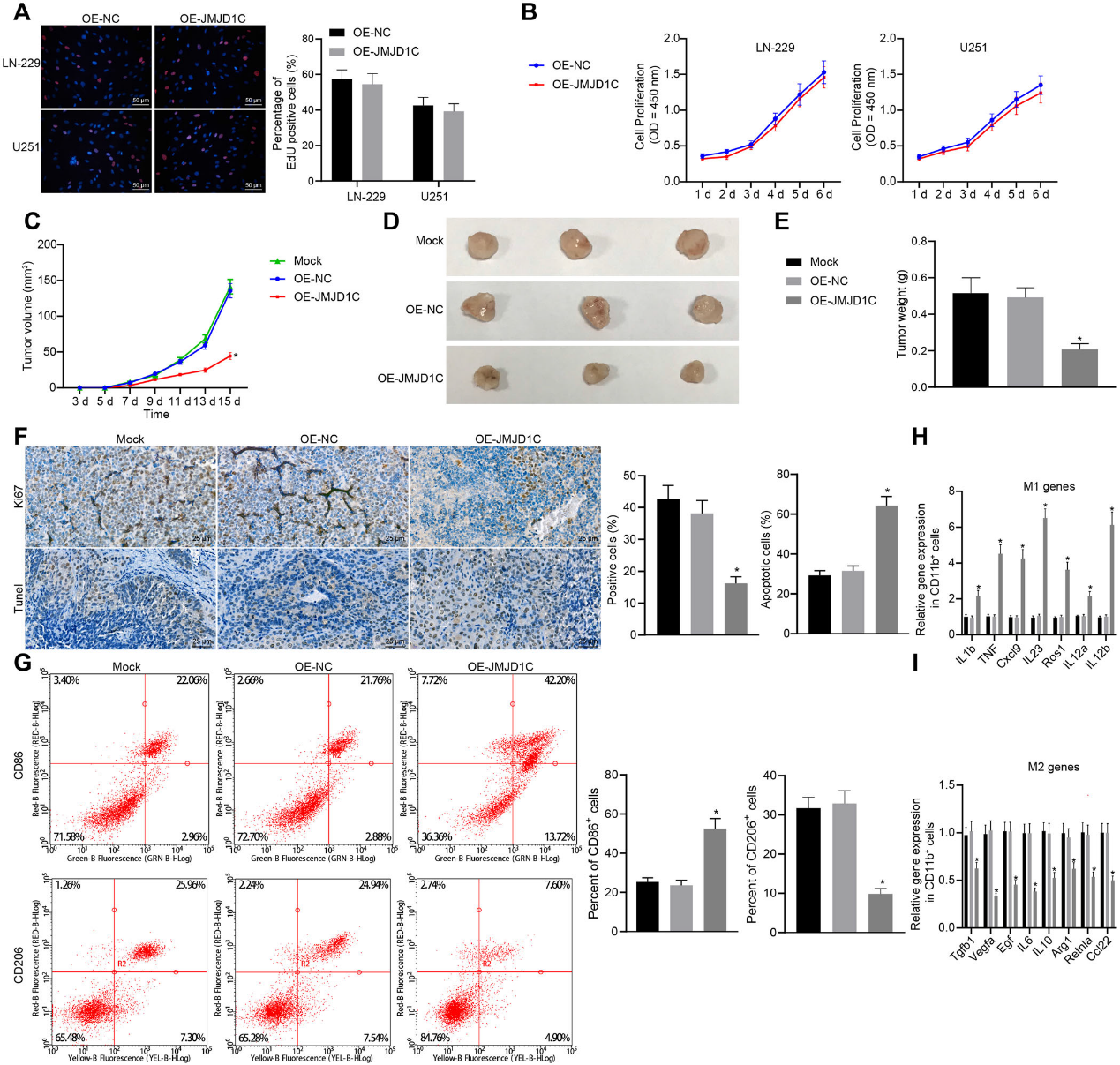
2)JMJD1C在體內促進M1巨噬細胞極化,抑制膠質瘤
通過EdU染色和CCK-8法對穩定過表達JMJD1C的LN-229和U251細胞進行細胞增殖篩選,結果顯示JMJD1C過表達對體外膠質瘤細胞增殖有作用(圖2A,B)。然后,通過皮下注射表達OE-NC或OE-JMJD1C的LN-229細胞構建腫瘤小鼠模型。我們觀察到過表達JMJD1C可抑制腫瘤的生長(圖2C-E)。IHC和TUNEL檢測結果顯示,過表達JMJD1C誘導的TUNEL陽性細胞更多,Ki67陽性細胞更少(圖2F)。采用流式細胞術檢測M1巨噬細胞標記物CD86和M2巨噬細胞標記物CD206,結果顯示JMJD1C過表達導致腫瘤組織中CD206+細胞減少,CD86+細胞增多(圖2G)。RT-qPCR表明,相對于OE-NC,在OEJMJD1C處理的小鼠中M1標記IL-1β,TNF,CXCL9,IL-23,ROS1,IL-12和IL-12b水平增加,而M2標記TGFB1,VEGFA,EGF,IL-6,IL-10,ARG1,RETNLA 和CCL22減少(圖2 h, I)。這些結果提示,JMJD1C本身并不影響膠質瘤細胞增殖,但能抑制膠質瘤細胞在體內的生長,這可能與M1巨噬細胞極化增強、M2巨噬細胞極化減弱有關。
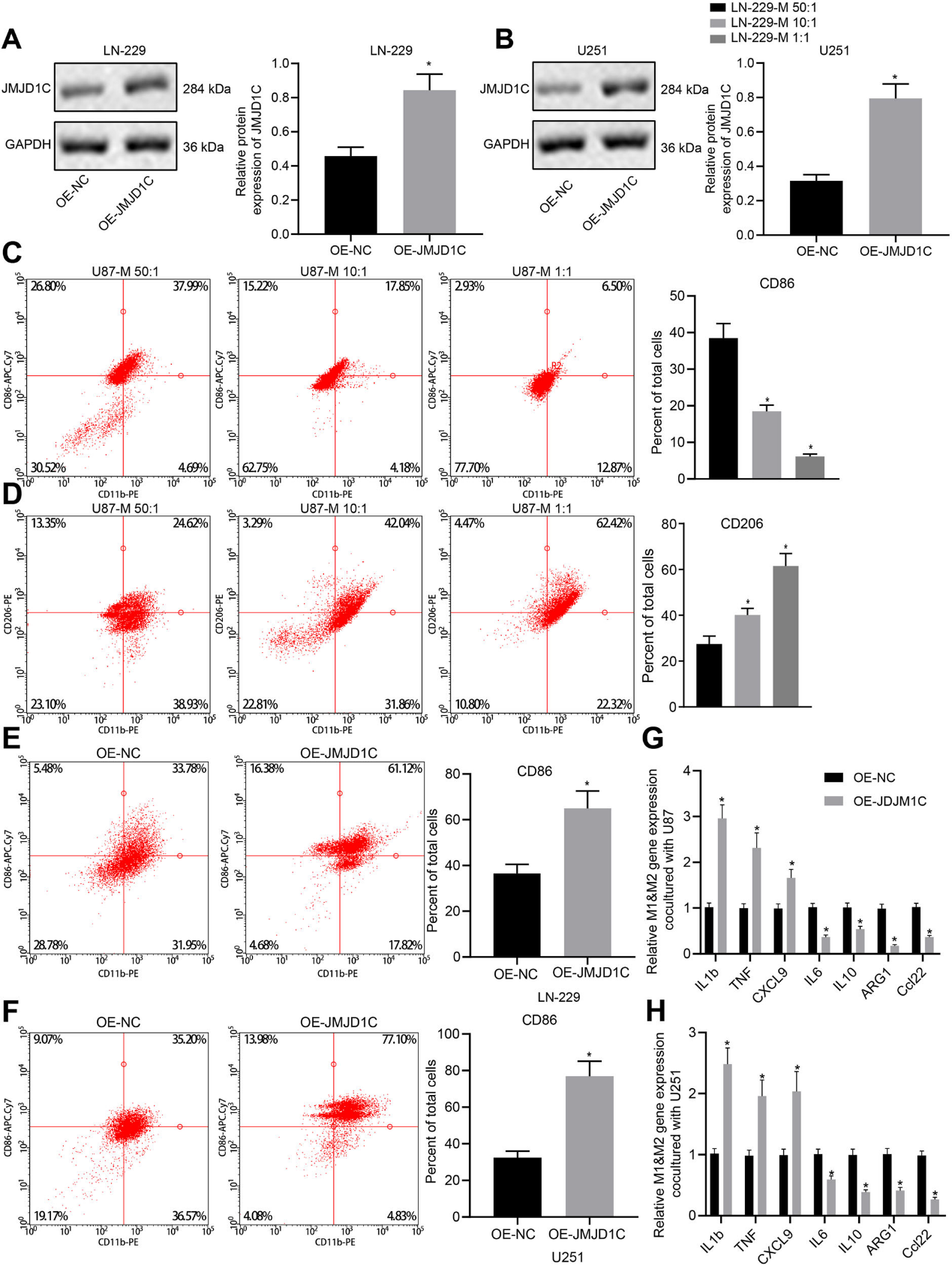
3)特異性表達JMJD1C可加速M1巨噬細胞的極化
免疫印跡法檢測轉染OE-JMJD1C質粒的LN-229和U251細胞系中JMJD1C的表達情況(圖3A,B)。其次,根據效應細胞的E/T比值,CD86+ M1巨噬細胞的誘導與CD14 + PBMCs有區別,E/T比為50:1的共培養誘導效果最佳(圖3C,D)。共培養實驗顯示,JMJD1C升高增加了LN-229和U251細胞中單核細胞分化的CD86+M1巨噬細胞的數量(圖3E,F)。此外,RT-qPCR結果顯示,在CD14+PBMCs中,上調JMJD1C可促進M1標記基因的表達,抑制M2標記基因的表達(圖3G,H)。因此,JMJD1C過表達有可能使巨噬細胞向M1表型極化。
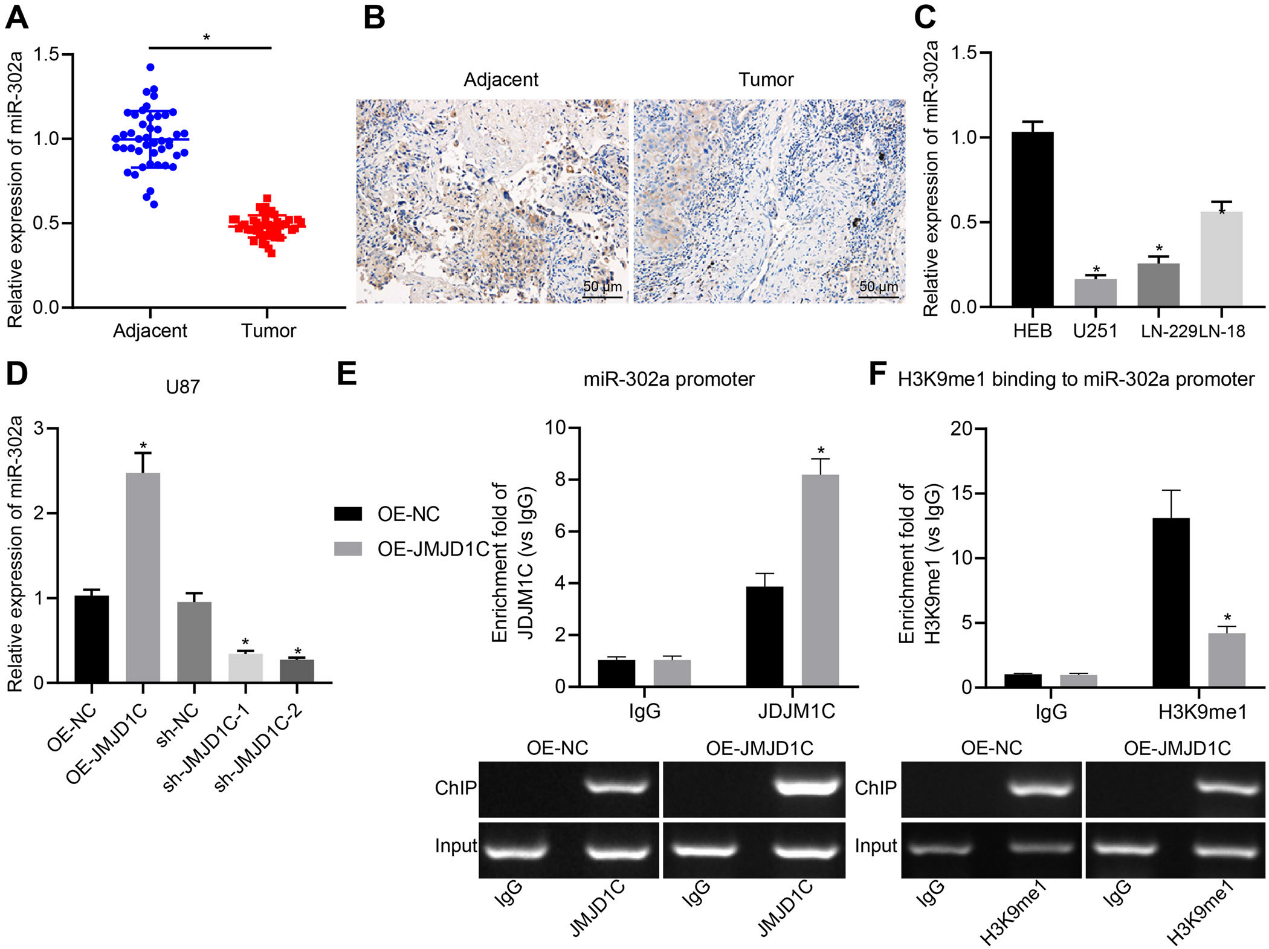
4)JMJD1C通過促進miR-302a啟動子區H3K9去甲基化上調miR-302a
根據既往文獻,我們推測JMJD1C可能通過調節miR-302a影響膠質瘤細胞增殖。正如預期的那樣,RT-qPCR和原位雜交結果表明,miR-302a下調發生在膠質瘤組織中(圖4A,B)。同時,miR-302a在膠質瘤細胞中的表達水平也降低(圖4C)。而在JMJD1C過表達的LN-229細胞中miR-302a水平升高,在JMJD1C沉默的細胞中miR-302a水平顯著降低(圖4D)。然后,我們發現,通過ChIP檢測,在OE-JMJD1C處理的細胞中,JMJD1C的富集程度(圖4E)高于OENC處理的細胞。過表達JMJD1C后H3K9me1水平降低(圖4F),說明JMJD1C可能通過H3K9去甲基化促進miR-302a的表達。
5)miR-302a靶向METTL3
正如生物信息學網站所預測的,miR-302a與METTTL3 3'UTR之間的靶向結合位點被鑒定出來(圖5A)。雙熒光素酶報告基因檢測結果驗證了靶向性(圖5B)。使用生物素標記的miR-302a探針進行RNA下拉實驗,進一步證實了miR-302a和METTL3之間的相互作用(圖5C)。RT-qPCR結合免疫印跡技術檢測LN-229細胞中miR-302a過表達或耗盡后METTTL3的表達變化(圖5E,F)。通過RT-qPCR驗證過表達和耗盡的效率(圖5D)。在miR-302a模擬處理的細胞中,METTL3的表達減少,而在miR-302a抑制物處理的細胞中,METTL3的表達增加。這些結果一致表明miR-302a靶向METTTL3。

6)METTTL3通過降解m6A修飾誘導的SOCS2 mRNA抑制M1巨噬細胞極化
我們還研究了mRNA甲基化酶METTTL3對膠質瘤細胞SOCS2表達的影響。根據GEPIA數據庫,GBM組織中SOCS2相對于正常組織有升高(圖6A)。RT-qPCR檢測的臨床樣本中SOCS2 mRNA水平在膠質瘤組織中呈上升趨勢(圖6B)。SOCS2蛋白在膠質瘤組織中的表達也增加(圖6C)。隨后,在LN-229細胞中過表達或沉默METTL3,發現這抑制了SOCS2 mRNA和蛋白的表達,而沉默METTL3則導致相反的結果(圖6D,E)。考慮到METTTL3是一種甲基轉移酶,采用MeRIP-RTqPCR分析過表達METTTL3的LN-229細胞中SOCS2的m6A水平,發現過表達METTTL3時SOCS2的甲基化水平升高(圖6F)。以上結果表明,METTTL3通過促進SOCS2的m6A甲基化修飾來促進膠質瘤中SOCS2的降解。另外,METTL3過表達導致SOCS2表達受到抑制,而METTL3與SOCS2共轉染促進SOCS2表達(圖6G)。人類CD14+單核細胞和神經膠質瘤細胞的共培養顯示,過表達METTL3減少CD86 + M1巨噬細胞的數量,而同時過表達METTL3和SOCS2使CD86 + M1巨噬細胞的數量增加(圖6 h,I)。此外,過表達METTTL3導致M1標記表達被抑制,M2標記表達升高,而與SOCS2共轉染促進M1標記基因表達,抑制M2標記基因表達(圖6J)。以上數據表明METTTL3可能通過誘導SOCS2 mRNA的降解來促進M1巨噬細胞極化。

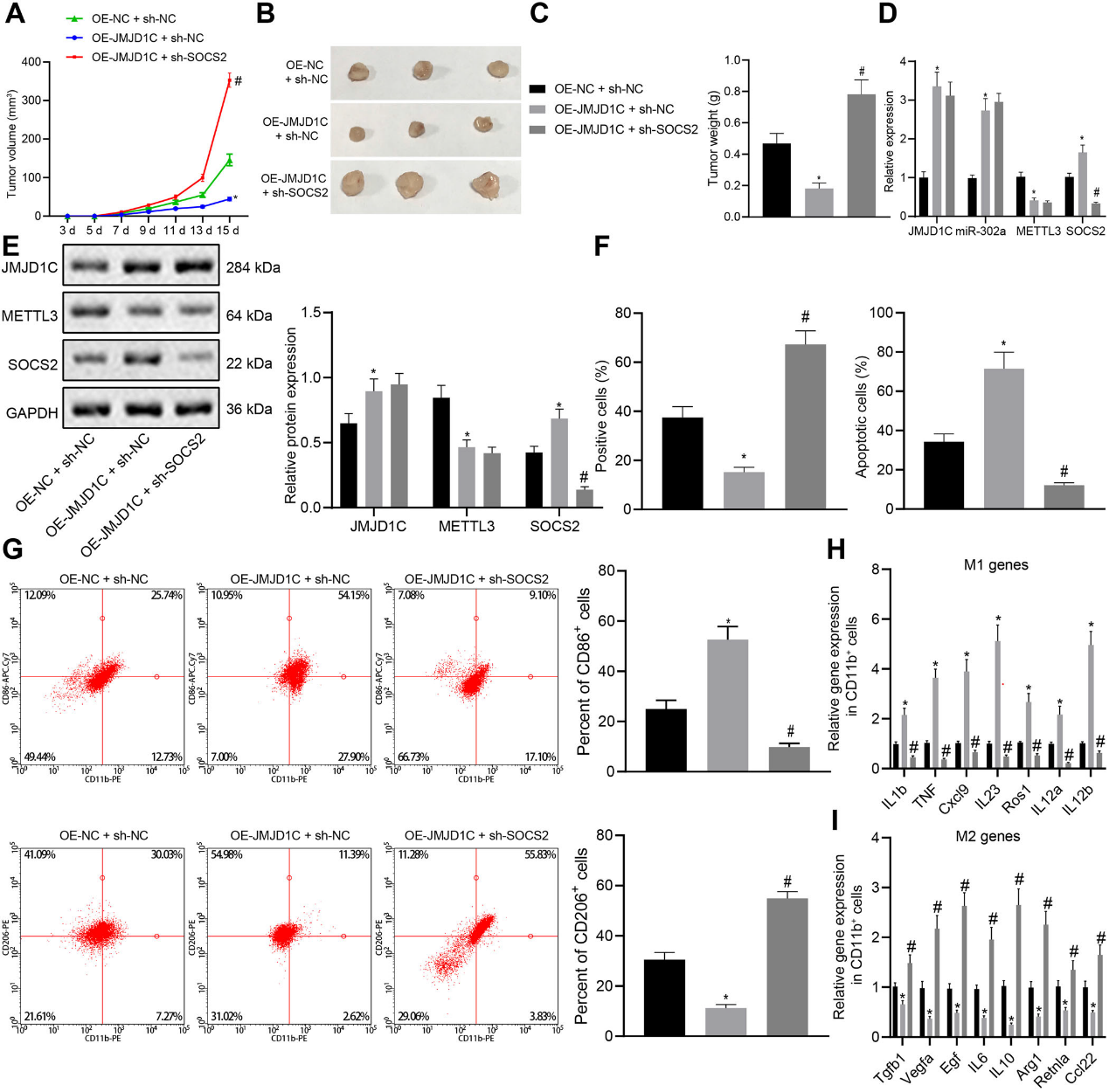
7)JMJD1C通過miR-302a/METTTL3/SOCS2誘導的M1巨噬細胞極化預防膠質瘤
為了驗證JMJD1C是否通過miR-302a/METTTL3/SOCS2軸促進M1巨噬細胞的極化從而抑制膠質瘤的發展,我們獲得了穩定過表達JMJD1C或與SOCS2沉默共同過表達的LN-229細胞,然后接種裸鼠。JMJD1C過表達抑制了腫瘤的生長,但加入sh-SOCS2治療后這種作用被逆轉(圖7A-C)。OE-JMJD1C處理后,JMJD1C、miR-302a和SOCS2表達升高,METTTL3表達降低,而OE-JMJD1C和sh-SOCS2處理后SOCS2水平降低,但JMJD1C、miR-302a和METTTL3表達無統計學變化(圖7D,E)。IHC和TUNEL檢測顯示,OE-JMJD1C處理后,TUNEL陽性細胞增多,ki67陽性細胞減少,而sh-SOCS2進一步處理后,這一趨勢被逆轉(圖7F)。流式細胞術結果顯示OE-JMJD1C中CD206+細胞百分率降低,CD86+細胞百分率增加,而sh-SOCS2進一步處理則相反(圖7G)。同時,OE-JMJD1C中IL-1β、TNF、CXCL9、IL-23、ROS1、IL-12a和IL-12b上調,而TGFB1、VEGFA、EGF、IL-6、IL-10、ARG1、RETNLA和CCL22下調,而sh-SOCS2的進一步處理消除了這一趨勢(圖7H,I)。綜上所述,JMJD1C通過miR-302a/METTTL3/SOCS2軸促進M1巨噬細胞極化,抑制膠質瘤的發展。
結論:JMJD1C通過上調miR-302a,進一步影響M1巨噬細胞METTL3/SOCS2介導的極化,在膠質瘤中發揮抑瘤作用。未來的研究需要進一步探索JMJD1C作為膠質瘤預后和治療的生物標志物的可能性。
參考文獻:Zhong C, Tao B, Yang F, Xia K, Yang X, Chen L, Peng T, Xia X, Li X, Peng L. Histone demethylase JMJD1C promotes the polarization of M1 macrophages to prevent glioma by upregulating miR-302a. Clin Transl Med. 2021 Sep;11(9):e424. doi: 10.1002/ctm2.424. PMID: 34586733; PMCID: PMC8473479.






