FBW7-NRA41-SCD1軸同步調控胰腺癌細胞凋亡和鐵死亡

胰腺癌在美國癌癥死亡原因中排第四名。手術切除是胰腺癌治愈的唯一機會,但由于診斷較晚,大多數患者失去了手術切除的機會,并且,胰腺癌對大多數化療藥物的反應很差。FBW7 (F-box and WD repeat domain-containing 7)是Skp1-Cul1-F-box (SCF)泛素連接酶復合物的底物識別成分,以多種癌蛋白為降解目標,也是人類癌癥中最常見的突變基因之一,參與調節脂質過氧化。鐵死亡是一種依賴鐵的非凋亡細胞死亡形式,其特征是脂質過氧化,在癌癥治療方面表現出巨大的潛力。目前有作者研究了FBW7對胰腺癌患者鐵死亡的影響,該研究發表在《Redox Biology》,IF:9.986。
技術路線:
主要研究結果:
1. FBW7促進胰腺癌細胞脂質過氧化
作者以分析在SW1990轉染pCMV-FBW7或空載體(GEO: accession numbers GSE76443)的高通量基因表達譜陣列研究FBW7在胰腺癌中的作用。以谷胱甘肽代謝和脂肪酸代謝相關的氨基酸為重點,結果顯示,FBW7WT和FBW7T205A下調絲氨酸、蛋氨酸、甘氨酸和胱氨酸,而FBW7R465H對絲氨酸、蛋氨酸、甘氨酸和胱氨酸無影響(圖1A)。這些氨基酸可被催化生成谷胱甘肽(圖1B)。作者檢測了PANC-1和SW1990穩定細胞系異位表達空載體FBW7WT或FBW7T205A的GSH/GSSG比值,結果發現FBW7WT和FBW7T205A導致GSH/GSSG比值增加(圖1C)。接著采用BODIPY 581/591C11探針檢測氧化性脂質,并通過流式細胞術和共聚焦顯微鏡進一步分析發現當脂質過氧化發生時,熒光由紅色變為綠色,顯示FBW7WT和FBW7T205A導致脂質過氧化水平升高(圖1D和E)。這些結果表明FBW7WT和FBW7T205A促進胰腺癌細胞的ROS和脂質過氧化。
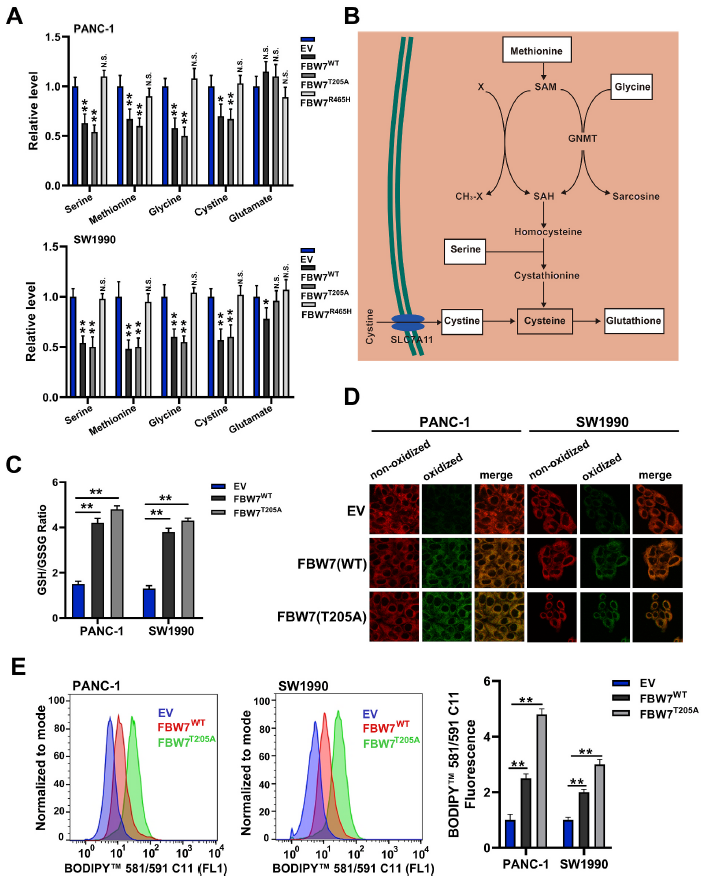
圖1 FBW7促進胰腺癌細胞脂質過氧化
作者檢測了鐵死亡誘導物(RSL3、FIN56、erastin)對pan -1和SW1990穩定細胞系異位表達FBW7WT、FBW7T205A或空載體的殺傷作用。結果發現FBW7WT和FBW7T205A均增強了鐵死亡誘導物對pan -1和SW1990細胞的殺傷作用,尤其是RSL3細胞(圖2A和2B)。此外,鐵死亡抑制劑ferrostatin-1(fer)可以逆轉FBW7過表達引起的脂質過氧化(圖2C和D),也部分挽救了被FBW7抑制的細胞活力(圖2E)。這表明FBW7增強了胰腺癌細胞的鐵死亡。
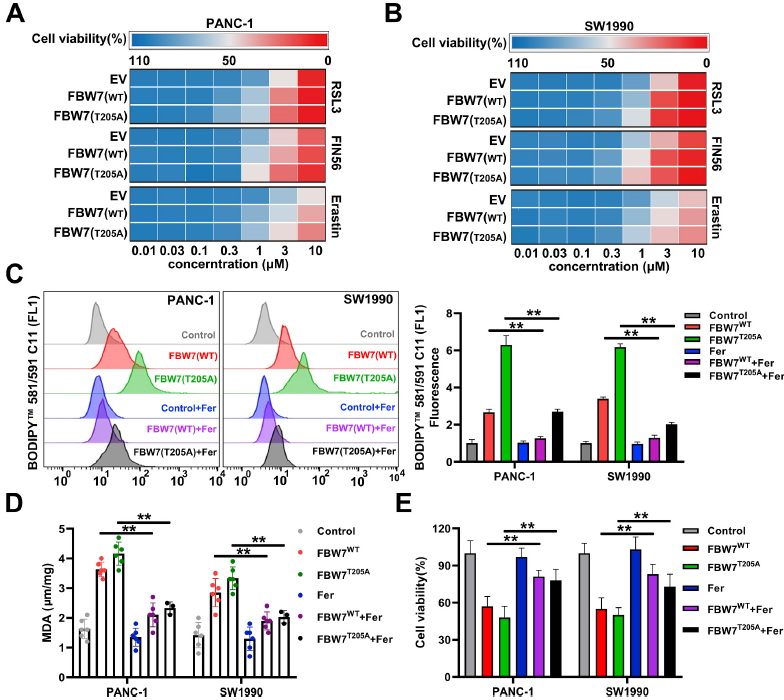
圖2 FBW7可增強胰腺癌細胞的鐵死亡
結合高通量基因表達譜陣列與SCD1有抑制鐵死亡和凋亡的報道,作者推測FBW7可能通過抑制SCD1的表達來促進鐵死亡。通過qRT-PCR和western blot驗證了FBW7降低SCD1的mRNA和蛋白水平(圖3A)。接著作者構建了pCMV-SCD1質粒,在PANC-1和SW1990穩定細胞系異位表達T205A突變體FBW7中過表達SCD1(圖3B)。然后發現SCD1過表達主要可以逆轉FBW7T205A引起的脂質過氧化(圖3C和D)。此外, FBW7沉默能導致SCD1蛋白水平升高(圖3E),也可以部分逆轉RSL3或SCD1抑制劑降低的細胞活力(CAY 10566)(圖3F)。SCD1過表達主要能減少FBW7T205A過表達引起的細胞凋亡(圖3G)。電鏡觀察中發現FBW7T205A過表達導致細胞萎縮、線粒體萎縮、脂滴形成,其結構與RSL3與CAY 10566結合引起的結構相似(圖3H)。這表明FBW7通過下調SCD1促進鐵死亡和細胞凋亡。
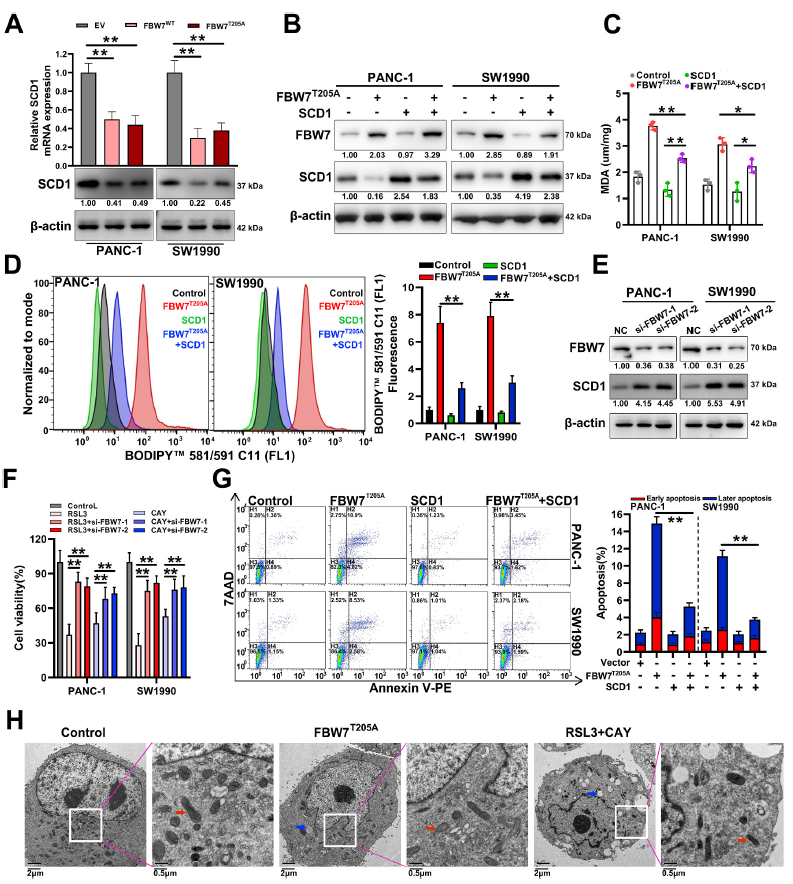
圖3 FBW7通過下調SCD1促進鐵死亡和細胞凋亡。
4. FBW7通過NR4A1抑制SCD1的轉錄
作者在基因表達譜中發現了NR4A家族的核受體(NR4A1, NR4A2)是FBW7下調的基因。作者因此采用qRT-PCR和western blot檢測了FBW7T205A過表達的PANC-1和SW1990細胞中NR4A1和NR4A2的水平。結果發現FBW7T205A降低了NR4A1和NR4A2的mRNA和蛋白水平。此外,與FBW7T205A相比,FBW7R465H(顯性陰性FBW7突變體)僅略微降低了NR4A1、NR4A2和SCD1的表達(圖4A和B)。同時NR4A1沉默降低了SCD1的表達(圖4C和D) ,并且啟動子實驗發現NR4A1與SCD1啟動子結合,促進了SCD1的轉錄(圖4E和4F)。CHIP檢測顯示FBW7T205A過表達減少了NR4A1與SCD1啟動子的結合,但過表達FBW7R465H無顯著差異(圖4G)。在熒光素酶檢測中也有相同的趨勢,MUT pGL3-SCD1啟動子組沒有顯著差異(圖4H)。此外, NR4A1過表達可抵消FBW7 T205A對SCD1的影響(圖4I)。綜上所述,FBW7通過降低NR4A1與SCD1啟動子的結合來抑制SCD1的轉錄。
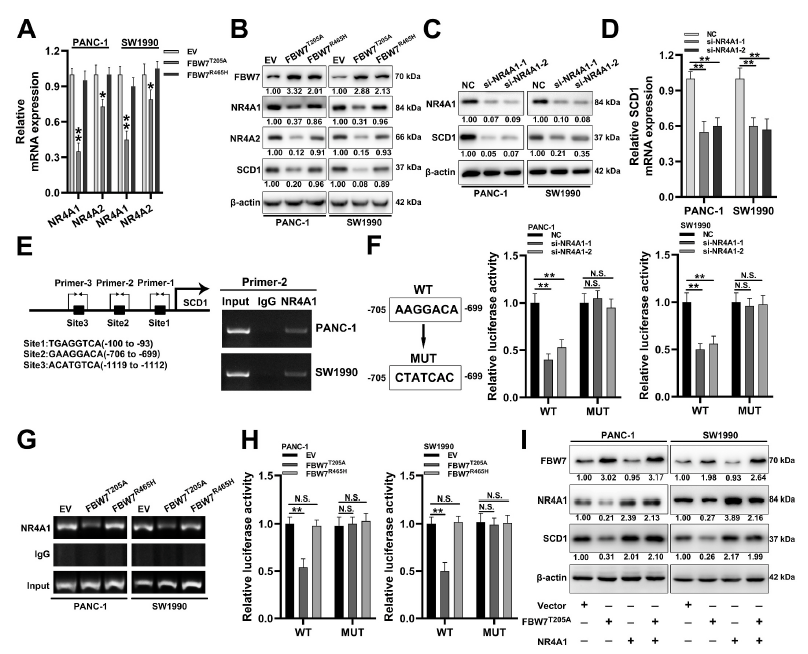
圖4 FBW7通過NR4A1抑制SCD1的轉錄
此前文獻報道NR4A1拮抗劑DIM-C-pPhOH通過抑制NR4A1的反式激活活性而誘導細胞凋亡。在本實驗中,熒光報告基因檢測顯示,DIM-C-pPhOH降低了熒光素酶活性,但在NR4A1結合位點(MUT)突變組,熒光素酶活性無明顯差異(圖5A),這表明DIM-C-pPhOH通過NR4A1抑制SCD1的轉錄。此外,DIM-C-pPhOH還能降低pan -1和SW1990細胞中的SCD1蛋白(圖5B)。同時DIM-C-pPhOH顯著降低了RSL3在PANC-1和SW1990細胞中的IC50(半最大抑制濃度)(圖5C)。DIM-C-pPhOH也可增加脂質過氧化水平,而鐵死亡抑制劑Fer-1可在很大程度上逆轉DIM-C-pPhOH引起的脂質過氧化(圖5D和E)。此外, Fer-1、凋亡抑制劑 (zVAD)或SCD1活性的終產物(POA, OA)可以部分挽救DIM-C-pPhOH引起的細胞毒性效應(圖5F)。同時在NR4A1沉默細胞中也得到了同樣的趨勢(圖5G)。
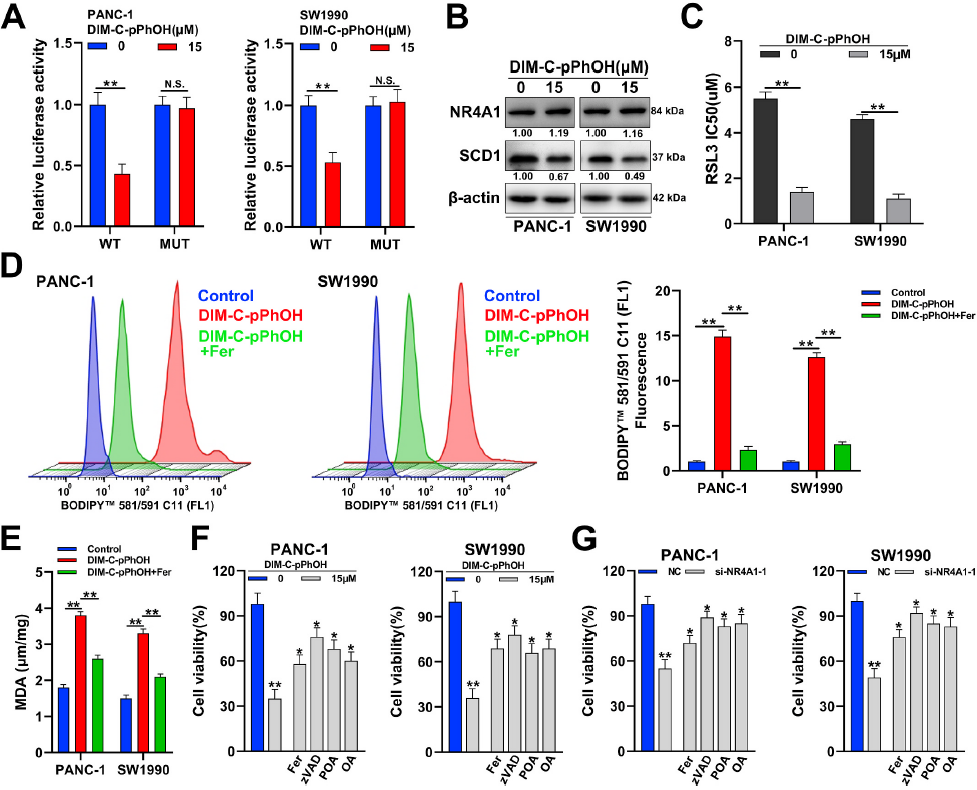
圖5藥物抑制NR4A1可促進胰腺癌細胞的鐵死亡
6. FBW7通過鐵死亡和細胞凋亡增強吉西他濱的細胞毒性作用
鐵死亡誘導劑RSL3也可以增加吉西他濱對胰腺癌細胞的致死率,而鐵死亡抑制劑Fer-1則具有相反的作用(圖6A和B)。這表明激活鐵死亡可以減輕胰腺癌患者對吉西他濱的耐藥性。然后測試了FBW7對吉西他濱敏感性的影響。過表達FBW7T205A可明顯增強吉西他濱的細胞毒作用,而過表達FBW7R465H則無明顯變化(圖6C和D)。用Fer-1或zVAD或兩者同時預處理FBW7T205A過表達細胞。結果顯示,Fer-1和zVAD均能部分挽救過表達FBW7T205A引起的細胞活力,而與Fer-1和zVAD聯合使用則能完全回避FBW7T205A引起的細胞活力(圖6E和F)。這些表明了FBW7通過鐵死亡和凋亡增強吉西他濱的細胞毒性作用。
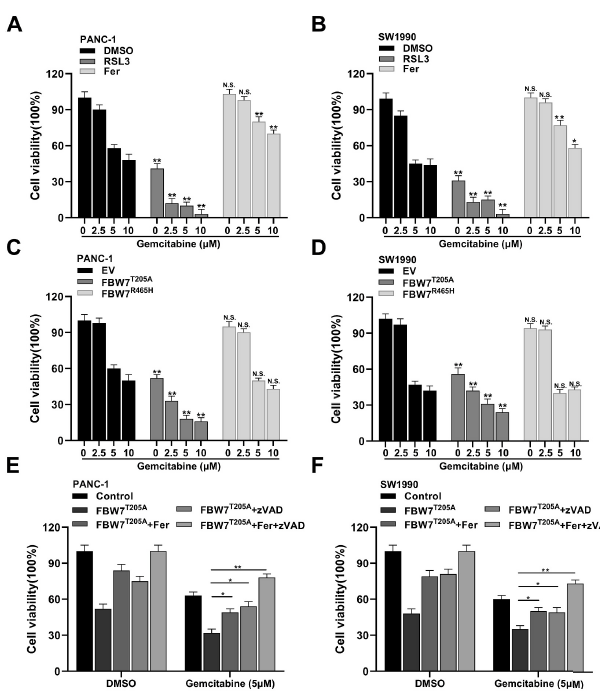
圖6 FBW7通過鐵死亡和細胞凋亡增強吉西他濱的細胞毒性作用
7. 胰腺癌組織中FBW7與NR4A1、SCD1相關
作者檢測了在PADC患者組織中FBW7、NR4A1和SCD1表達之間的關系。對FBW7、NR4A1、SCD1進行組織免疫熒光檢測,分別標記不同的熒光信號。結果顯示,FBW7低表達時,NR4A1和SCD1高表達。FBW7高表達時則發現了相反的現象(圖7A)。免疫組化染色進一步證實了上述結果(圖7B),表明了FBW7與NR4A1、SCD1呈負相關(圖7C)。IHC評分顯示胰腺癌組織中NR4A1與SCD1呈正相關(圖7D)。相應的TCGA和GTEx數據也顯示相同結果(圖7E和F)。Kaplan-Meier生存曲線和log rank檢驗顯示,PDAC中NR4A1高表達與較差的總生存(OS)顯著相關(圖7G)。而在PDAC中,高水平的SCD1也與更大的腫瘤大小、較差的腫瘤分化和較差的總生存率相關(圖7H)。

圖7胰腺癌組織中FBW7與NR4A1、SCD1相關
主要結論:
作者證實FBW7-NR4A1-SCD1顯著增強吉西他濱的細胞毒作用,為化療干預提供了新的靶點。此外,還證明激活鐵死亡和細胞凋亡極大地提高了吉西他濱的敏感性,這可能為胰腺癌的聯合治療提供策略。






