SIRT1與CRL4B復合物協同調控胰腺癌干細胞特性促進腫瘤發生
胰腺癌是一種常見的惡性腫瘤,預后較差。最近,腫瘤干細胞(CSCs)被發現存在于包括胰腺癌在內的幾種實體腫瘤中。盡管越來越多的證據表明sirtuin 1 (SIRT1)在各種癌癥中發揮著生物學功能,但它是如何參與胰腺癌的發生和轉移,以及它在CSCs中的作用仍不明確。2021年6月發表于“Cell Death & Differentiation”(IF=15.828)的文章“SIRT1 coordinates with the CRL4B complex to regulate pancreatic cancer stem cells to promote tumorigenesis”對此展開了研究。研究發現SIRT1與CRL4B復合物相互作用,該復合物負責H2AK119泛素化。SIRT1/CUL4B靶點的全基因組分析確定了一組基因,包括GRHL3和FOXO3,它們在細胞分化、生長和遷移中起關鍵作用。此外,我們發現SIRT1和CUL4B共同促進胰腺癌細胞的增殖、自噬和侵襲。值得注意的是,我們發現SIRT1/CUL4B促進CSC樣特性。體內實驗表明,SIRT1促進了已建立的腫瘤異種移植瘤的生長,增加了NOD/SCID小鼠的腫瘤起始能力,增加了CSC頻率。值得注意的是,SIRT1和CUL4B的表達在包括胰腺癌在內的多種人類癌癥中顯著上調。

技術路線
結果:
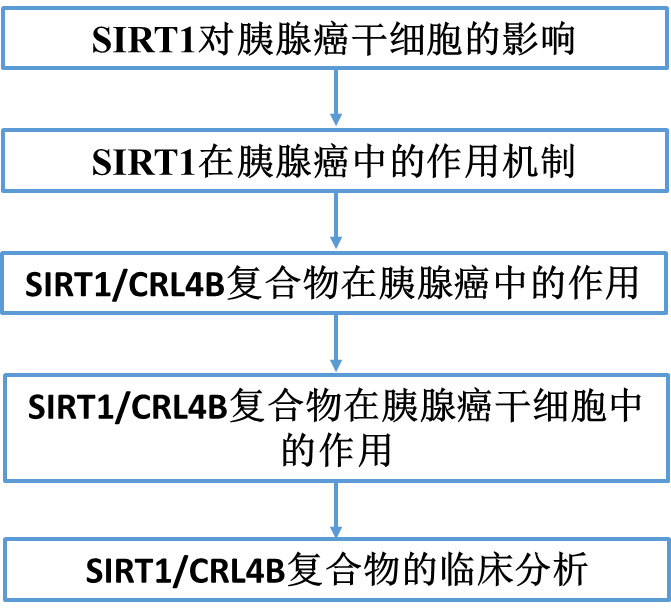
1)sirtuin對胰腺癌細胞干細胞樣表型影響的系統分析
7個人類sirtuin成員(SIRT1-7)共享一個保守的NAD+依賴的去乙酰化酶結構域(圖1A)。為了研究sirtuins是否影響胰腺癌細胞的干細胞樣表型,flag標記的SIRT1-7在PANC-1細胞中穩定表達。過表達SIRT1的細胞中CD133+細胞含量增加(圖1B),其他細胞無明顯變化。過表達SIRT1的PANC-1和AsPC-1細胞中干細胞標記物上調,而過表達其他sirtuin家族成員只改變了部分CSC標記物的表達(圖1C和D)。SIRT1敲低后,這些因素的表達下降。此外,敲低SIRT2-7并沒有引起這些CSC標記物表達的統一變化(圖1E和F)。綜上所述,這些結果表明SIRT1似乎與CSC相關的特性有關,如CD133表達和干性基因水平。
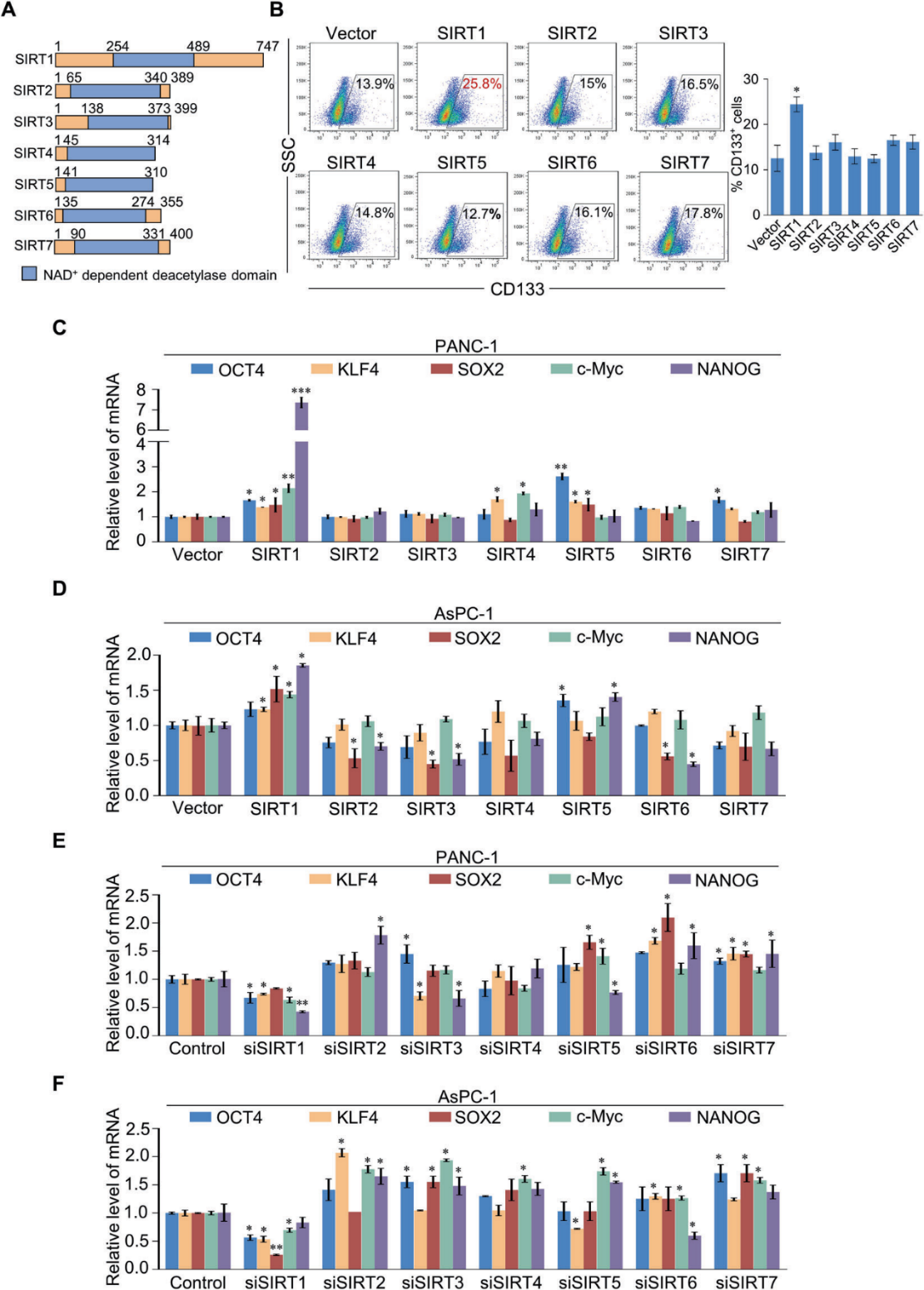
2)SIRT1與CRL4B復合體相關
為了更好地理解SIRT1在胰腺癌中的作用機制,我們使用親和純化和質譜分析,結果顯示SIRT1與各種表觀遺傳因子共純化(圖2A)。在列出的蛋白中,SIRT1與MTA1、HDAC1/2、EED和SAP30的關聯已有報道。western blot進一步證實了SIRT1相關復合物中存在這些蛋白(圖2B)。除了先前報道的與SIRT1相互作用的蛋白外,新發現的SIRT1相關蛋白DDB1表明,SIRT1可能與CRL4B復合物的組成部分CUL4B和ROC1在物理上相互作用(圖2B)。為了進一步證實SIRT1和CRL4B復合物在體外的相互作用,我們在四種胰腺癌細胞株中進行了co-IP檢測,結果顯示SIRT1與CRL4B復合物共免疫沉淀(圖2C)。為了確定SIRT1/CRL4B復合物的存在,我們使用FPLC對核蛋白進行了蛋白分離實驗。Western blotting顯示,SIRT1的洗脫模式與CRL4B組分的洗脫模式大部分重疊(圖2D),支持了SIRT1和CRL4B復合物可能在體內有功能合作的論點。接下來,GST下拉分析結果顯示SIRT1直接與CUL4B和DDB1相互作用(圖2E)。此外,SIRT1的N-terminal負責CUL4B的結合,而C-terminal是DDB1的結合所必需的(圖2F(a))。結果還表明,CUL4B NEDD8結構域直接參與與SIRT1相互作用(圖2F(b))。CUL4B類泛素化位點先前已報道在氨基酸836-843上。結果顯示,具有泛素化位點缺失的CUL4B NEDD8結構域仍然直接與SIRT1相互作用(圖2F(c)),表明SIRT1與CUL4B的相互作用不依賴于類泛素化修飾。GST下拉分析表明,DDB1 BPC結構域與SIRT1相互作用(圖2F(d))。這些結果不僅進一步支持了SIRT1與CRL4B復合物之間的特異性相互作用,而且揭示了SIRT1/CRL4B復合物形成的分子機制(圖2G)。
為了進一步探索SIRT1和CUL4B之間的功能關系,我們研究了SIRT1或CUL4B是否會改變H3K9ac、H3K14ac、H4K16ac和H2AK119ub1的整體水平。Western blot結果顯示,過表達SIRT1降低了H3K9ac、H3K14ac、H4K16ac,而顯著增加了H2AK119ub1(圖2H)。在PAN1細胞中敲除SIRT1,這些組蛋白位點表現出相反的趨勢。CUL4B過表達顯著增加H2AK119ub1,降低H4K16ac;CUL4B下調后,H2AK119ub1顯著降低,H3K9ac、H3K14ac和H4K16ac略有升高(圖2H)。這些結果提供了支持SIRT1和CRL4B復合物相互作用的特定機制的證據;從而確定SIRT1和CUL4B的功能連通性。

3)SIRT1/CRL4B復合物轉錄靶點的全基因組識別
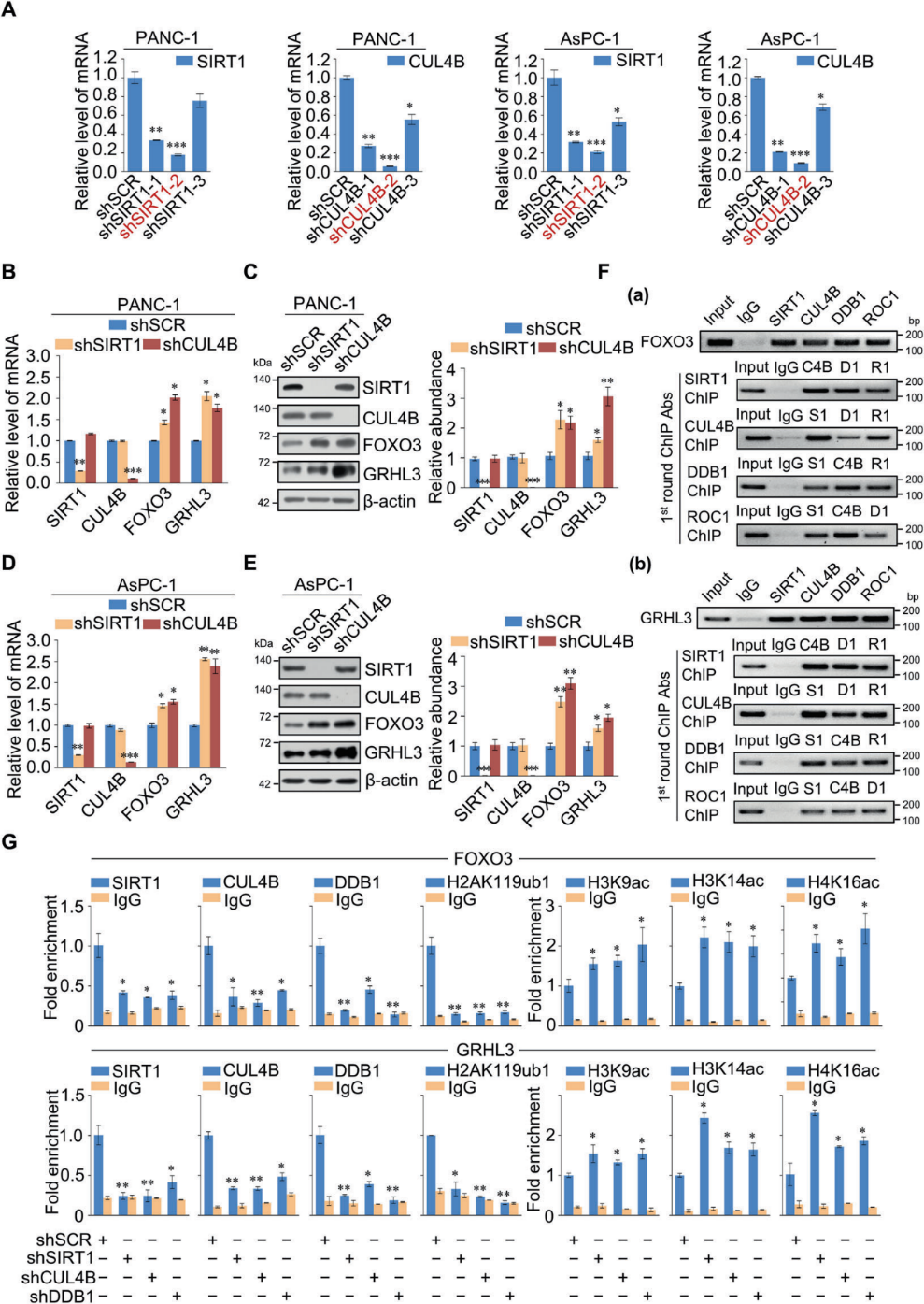
接下來,我們使用ChIP-seq分析全基因組SIRT1/CRL4B復合物轉錄靶點。我們發現SIRT1和CUL4B特異性結合峰分別為10455和12591(圖3A)。此外,我們發現SIRT1和CUL4B具有相似的結合基元(圖3B),這支持了它們在物理上相互作用并在功能上相互連接的觀點。然后,對SIRT1(1560個基因)和CUL4B(2369個基因)的DNA啟動子序列進行重疊分析;這些啟動子代表了SIRT1/CRL4B復合物的共同靶點(圖3C)。我們鑒定了288個SIRT1和CUL4B特異性啟動子,并將它們分為不同的細胞信號通路,包括Rap1、AMPK、FoxO、Hippo、細胞周期、黏附、以及調控干細胞的多能性,這在腫瘤的形成和發展中起著至關重要的作用(圖3D)。qChIP分析顯示,SIRT1和CUL4B對FOXO3、GRHL3、NAV3、AF6、PRDM2、MOB1A、DLG1、CTNNA1和CTNNA3等經典通路基因的啟動子具有強富集作用(圖3E)。RT-qPCR進一步顯示,SIRT1或CUL4B敲低后,PANC-1細胞中靶基因的轉錄水平部分升高(圖3F)。ChIP實驗表明,SIRT1或CUL4B缺失的PANC-1細胞中,SIRT1和CUL4B向其靶啟動子的募集均減少(圖3G和H)。因此,SIRT1和CRL4B可能相互促進對方在靶啟動子上的募集或穩定,形成抑制靶基因表達的轉錄抑制復合物。

4)通過SIRT1/CRL4B復合物調控FOXO3和GRHL3
我們評估了靶向SIRT1和CUL4B mRNA的慢病毒shRNA(圖4A),選擇最有效的進行接下來的實驗。FOXO3是一個成熟的腫瘤抑制基因,參與多種細胞過程;GRHL3是分化所必需的,并具有抑制腫瘤的作用。因此,我們研究了SIRT1/CRL4B復合物對FOXO3和GRHL3的轉錄調控。SIRT1或CUL4B敲低導致PANC-1(圖4B和C)和AsPC-1(圖4D和E)細胞中FOXO3和GRHL3的表達增加。在PANC-1細胞中,通過ChIP或ChIP/Re-ChIP實驗進一步研究了SIRT1/CRL4B復合物介導的FOXO3和GRHL3的調控(圖4F)。這些結果支持了SIRT1和CRL4B復合物作為一個蛋白復合物占據FOXO3和GRHL3啟動子。此外,qChIP分析表明,敲除SIRT1、CUL4B或DDB1的表達導致FOXO3和GRHL3啟動子相應蛋白的募集顯著減少(圖4 G)。SIRT1下調不僅導致FOXO3和GRHL3啟動子H3K9ac、H3K14ac、H4K16ac升高,還顯著降低了H2AK119ub1水平。CUL4B或DDB1基因敲低也得到類似的結果,表明SIRT1/CRL4B復合物作為一個整體與FOXO3和GRHL3啟動子結合,催化組蛋白的泛素化和去乙酰化(圖4G)。這進一步證實了SIRT1和CRL4B復合物通過一組靶基因(如FOXO3和GRHL3)的轉錄抑制在功能上存在關聯。
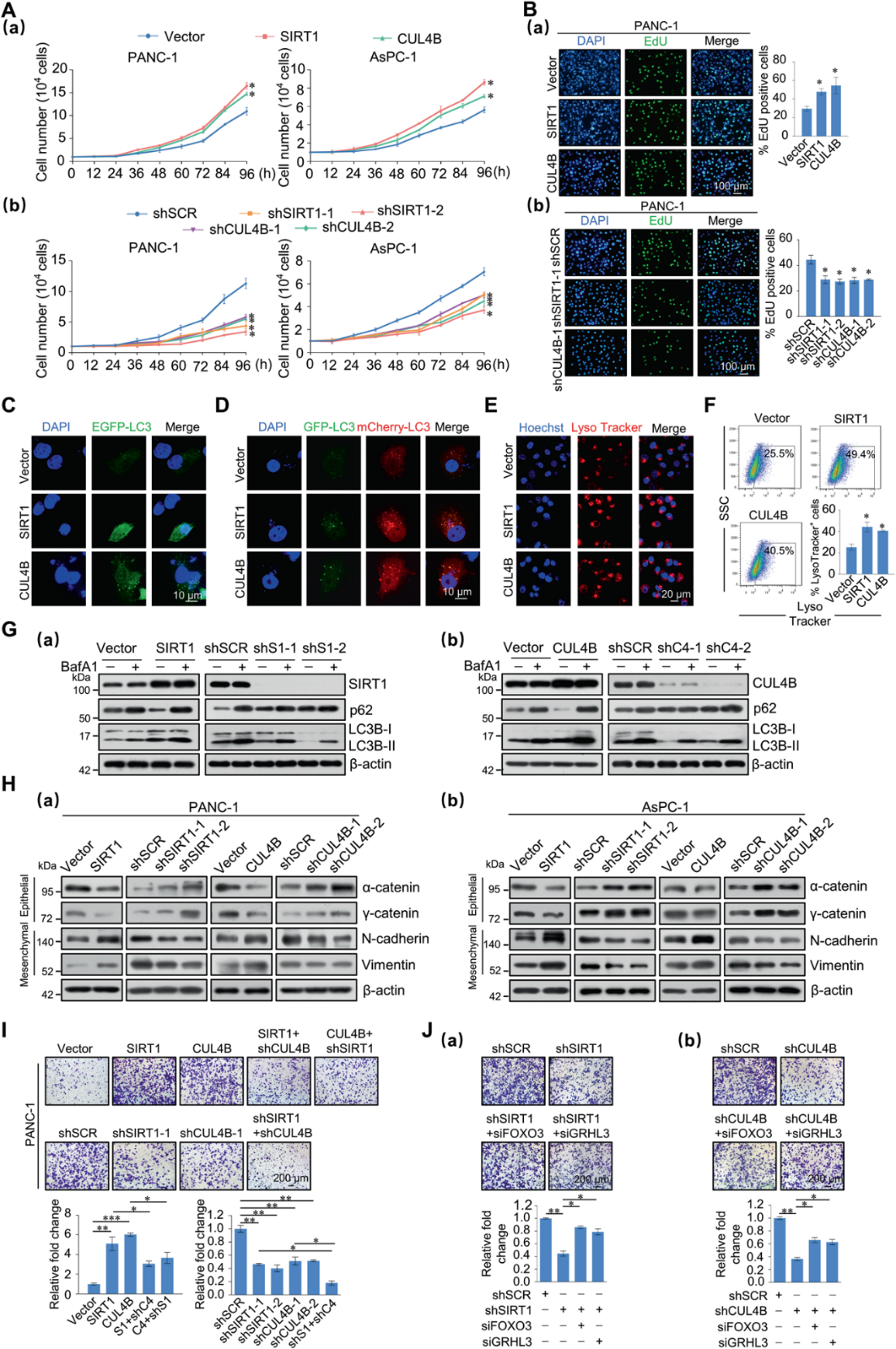
5)SIRT1和CUL4B共同促進胰腺癌細胞的增殖、自噬和轉移
我們研究了SIRT1/CRL4B復合物在胰腺癌細胞增殖、自噬和轉移中的作用。生長曲線分析顯示,SIRT1和CUL4B促進細胞增殖(圖5A)。EdU結果顯示,在EdU標記的細胞中,SIRT1或CUL4B過表達與明顯的百分比增加相關,而SIRT1或CUL4B敲低的細胞顯示這些細胞的百分比要低得多(圖5B)。這表明SIRT1/CRL4B復合物在體外促進了胰腺細胞的增殖。
有報道稱自噬阻斷降低了胰腺CSC活性。因此,我們接下來研究了SIRT1和CUL4B在自噬中的作用。在EGFP-LC3 PANC-1細胞中,SIRT1或CUL4B過表達增加LC3斑點(圖5C)。在mCherryGFP-LC3 PANC-1細胞中,SIRT1或CUL4B過表達顯示GFP-/mCherry+(紅色斑點)自噬溶酶體增加,在較小程度上,GFP+/mCherry+(黃色斑點)吞噬體/自溶噬體增加(圖5D)。接下來,用LysoTracker Red對溶酶體隔室進行染色,顯示過表達SIRT1或CUL4B的PANC-1細胞中溶酶體區域擴大(圖5E)。此外,流式細胞術顯示過表達SIRT1或CUL4B的細胞中LysoTracker+細胞含量增加(圖5F)。我們使用自噬體和溶酶體融合抑制劑巴菲霉素A1 (BafA1)進行自噬通量分析。經過BafA1處理后,SIRT1和CUL4B的增加與LC3-II的積累相關。western blot分析也證實了SIRT1和CUL4B基因下調導致的自噬通量缺陷(圖5G和圖S3C)。這些結果表明,SIRT1或CUL4B過表達不僅增強了自噬通量,還增強了溶酶體功能。
接下來,western blot顯示上皮標記物,如α-和γ-catenin表達減少,而間質標記物,包括N-cadherin和Vimentin,在SIRT1或CUL4B過表達時增加(圖5H)。在PANC-1和AsPC-1細胞中單個敲除SIRT1或CUL4B時,這些EMT標記物表現出相反的趨勢。此外,在PANC-1和AsPC-1細胞中進行transwell侵襲檢測結果顯示,過表達SIRT1或CUL4B導致細胞侵襲能力增加超過兩倍,而敲除SIRT1或CUL4B則導致細胞侵襲能力明顯降低(圖5I)。下調CUL4B或SIRT1后,過表達SIRT1或CUL4B的作用減弱,同時下調SIRT1和CUL4B后,細胞侵襲能力明顯減弱(圖5I)。在PANC-1細胞中敲低SIRT1或CUL4B降低了細胞侵襲潛能,這部分可通過共同敲低FOXO3或GRHL3來挽救,表明SIRT1/CRL4B復合物可通過抑制FOXO3和GRHL3來促進胰腺癌侵襲(圖5J)。這些結果表明,SIRT1/CRL4B復合物促進胰腺癌細胞的遷移和侵襲潛能,部分通過抑制FOXO3和GRHL3。
6)SIRT1和CUL4B促進胰腺癌干細胞特性
我們研究了SIRT1和CUL4B是否影響胰腺癌細胞的干細胞樣表型。在穩定表達SIRT1或CUL4B的PANC-1和AsPC-1細胞中,干細胞標記物均增加(圖6A)。為了進一步闡明SIRT1和CUL4B是否促進胰腺癌細胞向CSCs的發展,我們分析了SIRT1和CUL4B對球體形成的影響。在穩定表達SIRT1或CUL4B的PANC-1和AsPC-1細胞中,球的數量和大小增加,而下調SIRT1或CUL4B后,球的數量和大小減少(圖6B)。接下來,流式細胞術顯示過表達SIRT1和CUL4B后CD133+細胞數量增加,這一效應在抑制CUL4B和SIRT1后部分被挽救(圖6C)。這些結果表明SIRT1/CRL4B復合物促進胰腺CSC特性。為了進一步證實SIRT1在體內靶向胰腺CSC群體,我們建立了小鼠異種移植模型。注射4周后,通過生物發光觀察移植細胞的生長情況(圖6D)。穩定表達SIRT1的細胞顯著增加了腫瘤起始能力(圖6E)。SIRT1過表達組與對照組相比CSC頻率顯著增加(圖6F)。此外,SIRT1顯著促進胰腺腫瘤的生長(圖6G)。這表明SIRT1可以顯著誘導胰腺癌細胞的干細胞性,從而促進腫瘤移植瘤的生長。與腫瘤生長加速一致,SIRT1過表達組Ki67陽性細胞比例明顯高于對照組(圖6H)。我們利用RNA-seq研究了SIRT1過表達的全基因組效應。與對照組相比,我們在SIRT1過表達的腫瘤樣本中共發現了2506個上調基因和2229個下調基因(圖6I)。KEGG富集分析結果顯示,這些差異表達的基因不僅參與病灶黏附、Wnt、Hippo、細胞周期等與腫瘤生長和干性密切相關的途徑,而且在與自噬相關的吞噬小體和溶酶體途徑中富集(圖6J)。接下來,我們選擇了12個已知的腫瘤抑制因子與癌癥發展有關的基因,包括GRHL3、NAV3、AXIN2、FOXP1、WISP3、SPDEF、RASSF1、PTPRG、IGFBP4、FHL1、FEZ1和DUSP4,并通過RT-qPCR驗證了它們在SIRT1過表達的腫瘤樣本中的表達降低(圖6K)。這些結果表明,SIRT1參與調節與腫瘤生長、自噬和干細胞形成密切相關的各種通路,并促進胰腺CSC的發展
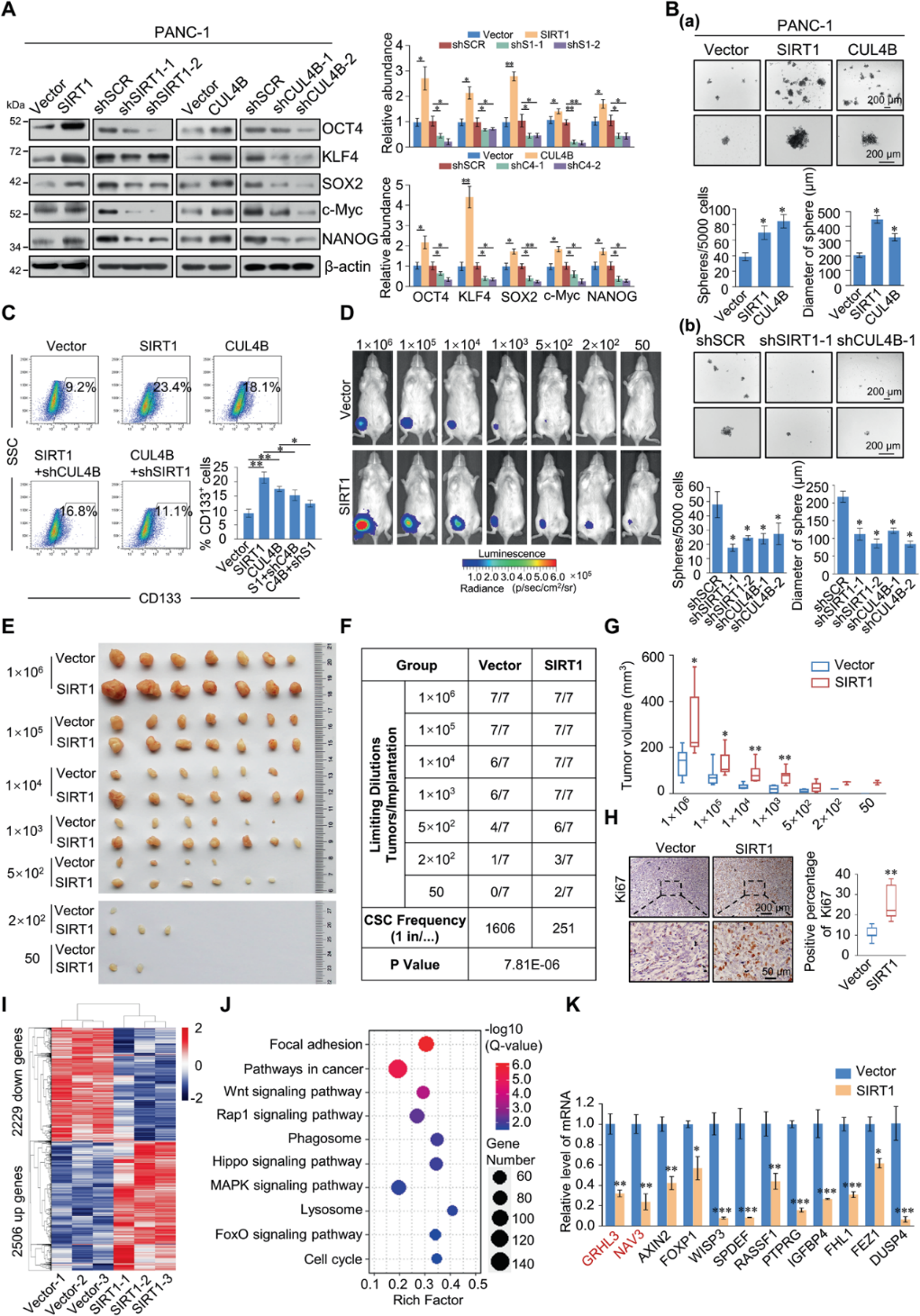
7)SIRT1和CUL4B在多種癌癥中表達上調,是一種潛在的癌癥生物標志物
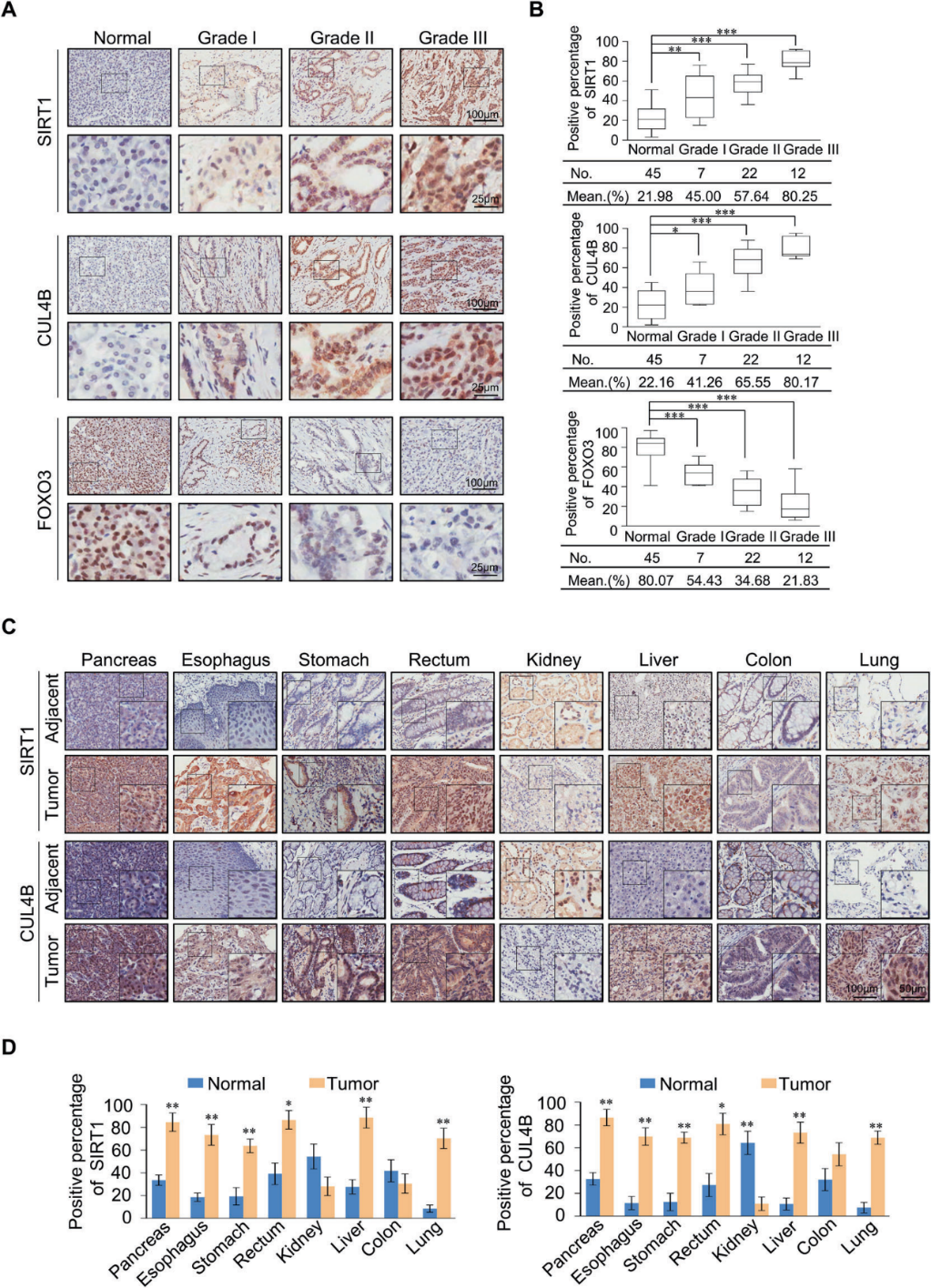
我們收集了86例胰腺癌患者的樣本,通過免疫組化染色進行組織微陣列,檢測SIRT1、CUL4B和FOXO3的表達情況(圖7A)。SIRT1和CUL4B在腫瘤中顯著上調,其表達水平與腫瘤組織學分級呈正相關,FOXO3表達水平與腫瘤組織學分級呈負相關(圖7B)。為了研究SIRT1和CUL4B的影響是否可以擴展到更廣泛的癌癥范圍,我們收集了幾個癌癥樣本,對其進行組織微陣列和免疫組化染色來檢測SIRT1和CUL4B的表達(圖7C)。結果顯示,除胰腺癌外,SIRT1和CUL4B在食管癌、胃癌、直腸癌、肝癌、肺癌中與癌旁正常組織相比也顯著上調(圖7D)。總之,我們的分析表明SIRT1和CUL4B在多種癌癥中上調,是潛在的癌癥生物標志物。
結論: SIRT1和CRL4B作為一個功能單元相互作用和合作,提供了一種新的轉錄調控模式,同時也為染色質重構中組蛋白去乙酰化和泛素化提供了新的分子基礎。此外,SIRT1/CRL4B復合物有助于腫瘤抑制的表觀遺傳學沉默,也在胰腺癌的腫瘤發生和調節CSCs的特性中發揮重要作用。因此,SIRT1和CUL4B是潛在的致癌基因和生物標志物,可能作為腫瘤治療的靶點。






